不同营养条件对野生蝉花人工固体栽培的影响
谢春芹,凡军民,许俊齐,陈庶,曹正
不同营养条件对野生蝉花人工固体栽培的影响
谢春芹,凡军民,许俊齐,陈庶,曹正*
江苏农林职业技术学院生物工程系, 江苏 句容 212400
为了加快蝉花的产业化开发,在过去的3年里,主要研究了野生蝉花人工固体培养基栽培,将液体菌种接种到不同主料和不同氮源的培养基上,在相同的管理条件下进行培养,通过测定蝉花孢梗束的长速、鲜重、生物转化率,比较蝉花在不同培养基上的生长状况。结果表明,野生蝉花人工固体栽培的最适培养基为小麦40 g、氮源为蛋清2 g、营养液60 mL。
营养条件; 蝉花; 固体栽培; 生长影响
蝉花((Miq.) Massee)又称蝉菌、胡蝉、金蝉花、蝉蛹草、蚕茸,分类地位隶属于子囊菌亚门、球腔菌目、麦角菌科、虫草属(Fr. 1818),无性世代为蝉拟青霉((Miq.) Samson)[1-5],是一种具有保健功能的大型药食两用真菌,亦是我国传统的名贵中药,富含核苷、多糖、甘露醇、麦角甾醇等多种活性物质[6-10];具有镇痛、抗高血压、双向免疫调节、抑制肿瘤生长及抗炎、改善肾功能等作用[8,11,12]。核苷类物质特别是腺苷为虫草的主要功效成分之一,在我国药典中就以腺苷含量的高低作为虫草制品的质控指标。据报道腺苷主要具有舒张血管、降低血压、减慢心率、抑制血小板聚焦、松弛血管平滑肌、改善心脑血液循环、防止心律失常、抑制神经递质的释放和调节腺苷酸活化酶活性等的重要药理作用,且该物质广泛存在于虫草真菌的代谢与生物合成中[4,5,13-23]。
自然条件下,针阔叶混交林带中的森林覆盖率达65%,海拔在700~950 m,地势相对平缓,湿度大的林中最适蝉花生长。在自然条件下,蝉花的出产率非常的低[24],资源稀少,同时又以蝉花为原料的药用保健品在不断的开发,再加上长期采挖,自然产量逐年减少,资源日趋枯竭,野生蝉花的数量已经远远不能满足国内外市场的需求[25]。张红霞[26]等人研究了人工培育蝉花与天然蝉花中化学成分的比较,结果表明人工培育蝉花子实体中粗纤维的含量为17%,比天然蝉花高约7%,粗蛋白、粗脂肪和灰分的含量则显著低于天然蝉花。多糖和虫草酸、尿苷的含量显著高于天然蝉花,鸟苷含量与天然蝉花比较接近;氨基酸种类和天然蝉花一致,氨基酸总量和人体必需氨基酸总量均低于天然蝉花,但必需氨基酸占总氨基酸的比例稍高于天然蝉花。因此推出人工培养的蝉花产品来替代日益枯竭的自然资源。
目前人工栽培蝉花的产业刚刚起步,尚处于发展时期[3],尤其是对人工固体栽培蝉花培养基中的最适碳源、氮源的研究相对较少,而在实践生产中,这是提高野生蝉花产量的关键。为此,本研究开展野生蝉花人工固体栽培最适营养条件的试验研究,以期为野生蝉花的产业化、规模化、高效化人工栽培提供技术基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种 及来源野生蝉花菌种:由本课题组从句容地区野生蝉花子实体分离、纯化获得。
1.1.2 试验材料 鸡蛋、杂交米、玉米、小麦、荞麦均由当地农户生产;溶性淀粉由天津市科密欧试剂有限公司生产;葡萄糖由国药集团化学试剂有限公司生产;硫酸镁和磷酸二氢钾由上海统亚化工科技发展有限公司生产;蛋白胨由北京奥博星生物技术有限责任公司生产;柠檬酸由西陇化工股份有限公司生产;B族维生素由华中药业股份有限公司生产。
1.2 试验方法
1.2.1 蝉花液体菌种的制备(1)液体培养基的配方试验液体培养基配方:可溶性淀粉60 g,脱脂奶粉30 g,磷酸二氢钾1.5 g,硫酸镁3 g,VB1230片,蒸馏水3000 mL,pH6.5。
(2)液体培养基的制备按常规液体培养基配制方法,将已配制好的液体培养基分装于500 mL三角瓶内、灭菌备用。
1.2.2 蝉花接种与培养按无菌操作的要求,每瓶接入直径0.5 cm的菌饼块2块,接种后三角瓶立即放入恒温19 ℃的培养箱中静置培养24 h,然后放入120 r/min 在摇床振荡培养3~4 d,出现大量菌丝球即可使用。
1.2.3 蝉花人工栽培固体栽培培养基的制备(1)栽培营养液的配方营养液的配方:葡萄糖36 g,蛋白胨25 g,磷酸二氢钾3 g,硫酸镁3 g,柠檬酸3 g,VB1 30片,蒸馏水3000 mL,pH自然。
(2)固体栽培培养基的配方固体培养基配方:杂交米40 g、蚕蛹粉2 g、营养液60 mL,用脱脂奶粉、蛋清、鸡蛋代替蚕蛹粉,用玉米、小麦、荞麦来代替杂交米,每个培养基配方做3个重复。
(3)固体栽培培养基的配制① 栽培料的准备选用新鲜无霉变的杂交米、玉米、小麦和荞麦及蚕蛹粉、脱脂奶粉、鸡蛋等辅料,按照配方进行准备。玉米应提前浸泡12 h,若还是坚硬,可以加水煮沸保持20 min直至变软然后将水沥干备用。
② 称量分别准确称取杂交米、玉米、小麦、荞麦各40 g;蚕蛹粉、脱脂奶粉、蛋清、蛋清与蛋黄混匀的鸡蛋各2 g。
③ 装瓶装瓶时直接将杂交米、玉米、小麦、荞麦分别装入瓶内,然后加入适当的营养液,用聚丙烯塑料薄膜封口、扎紧。
④ 灭菌与接种将装好培养料瓶放入121 ℃的高压蒸汽灭菌锅内灭菌40 min,待冷却至室温即可接种。按无菌操作要求,每瓶的接入蝉花液体菌种3 mL。
1.2.4 发菌管理将接种好的培养料瓶放入专用培养室内培养。蝉花菌丝萌发阶段保持黑暗,培养箱温度为19 ℃+1 ℃,待料面布满菌丝时再将培养箱内的温度调到22 ℃,约10~12 d菌丝长满培养料的2/3。直到菌丝完全渗入瓶底,才可增加光照。
1.2.5 出草管理当菌丝表面出现一些小隆起时,每天给予10~14 h的散射光照射,刺激原基形成。3~5 d原基即可形成。
原基出现后,温度控制在18 ℃~22 ℃,空气相对湿度为85%~90%,保持恒温培养箱内空气清新,待蝉花现蕾并长到2 mm时,经过40~50 d左右,可见瓶中满布紧密的乳白色鹿角状孢梗束,当孢梗束长到6 cm左右,尚未散孢子时即可采收。
1.2.6 观察并记录接种后观察液体菌种萌发吃料情况、菌丝长势、长满料的时间,同时观察并记录蝉花孢梗束长速、孢梗束的产量等。
1.2.7 生物转化率的计算方法生物学转化率=(子实体鲜重/培养料干重)×100%
2 结果与分析
2.1 4种主料的培养基对蝉花生长的影响
培养基中不同主料对蝉花孢梗束的生长和后期产量存在明显差异;不同主料的营养成分不同,直接影响蝉花孢梗束产量。蝉花在不同主料的培养基中均可生长,但在不同主料中,蝉花的生长存在着明显差异,由2次采收的孢梗束鲜重可见小麦主料的产量最高,鲜重达到29.95 g,其次是乔麦,为24.19 g,玉米最低的,总鲜重为2.15 g(见表1)。
主料培养基的生物转化率小麦最高,为73.31%;其次是荞麦,为57.6%,再最低是玉米,为5.12%(见图1)。

表1 4种主料的培养基对蝉花花孢梗生长的影响
注:数据后不同小写字母表示显著水平(<0.01),下同。
Note: the same data after the different small letters mean significant level (< 0.01), the same below.

图 1 不同主料培养基中蝉花孢梗束的生物转化率
注:图中数据后不同小写字母表示显著水平<0.01,下同。
Note: data in figure after the different small letters mean significant level (< 0.01), the same below.
2.2 杂交米为主料的培养基中添加不同氮源对蝉花生长的影响
蝉花能利用的含氮物质以有机氮为主,如蚕蛹粉、豆饼粉、脱脂奶粉、酵母膏、鸡蛋等,培养基中添加不同氮源对蝉花孢梗束生长有一定的影响,在以杂交米为主料的培养基中添加不同氮源对蝉花孢梗束生长速度有差异。由2次采收的孢梗束鲜重可见,培养基中添加蚕蛹粉的孢梗束总鲜重最高,为39.47 g;鸡蛋最低,为31.56 g,但从子座长速来看,蚕蛹粉>鸡蛋>蛋清>脱脂奶粉(表2)。杂交米主料中添加4种不同氮源的培养基,其蝉花孢梗束的生物转化率存在一定的差异性。蚕蛹粉是杂交米培养基中生物转化率最高的,为49.34%;其次是脱脂奶粉的生物转化率为47.09%,再次是蛋清,为41.34%,最低是鸡蛋,生物转化率为39.45%(图2)。

表2 杂交米主料中添加不同氮源对蝉花生长的影响

图 2 杂交米培养基中添加不同氮源的蝉花生物转化率
Fig.2Biological transformation efficiencies ofin hybrid rice medium with different nitrogen source
2.3 玉米主料培养基中不同氮源对蝉花生长的影响
在玉米主料培养基上添加不同的氮源,其蝉花孢梗束生长存在一定的差异。4种氮源的孢梗束产量均集中在第一次。其中,脱脂奶粉孢梗束的鲜重为7.22 g,显著地高于鸡蛋、蚕蛹粉、蛋清,而产量最低的是蚕蛹粉,鲜重是0.84 g。但孢梗束长速最快的是鸡蛋(表3)。
玉米主料中添加4种不同氮源,其蝉花孢梗束的生物转化率存在一定的差异性(图3),
整体长势欠佳。脱脂奶粉最高,达到9.03%,其次是鸡蛋,为7.64%;蛋清的生物转化率为3.80%;最低的是蚕蛹粉,为1.05%。
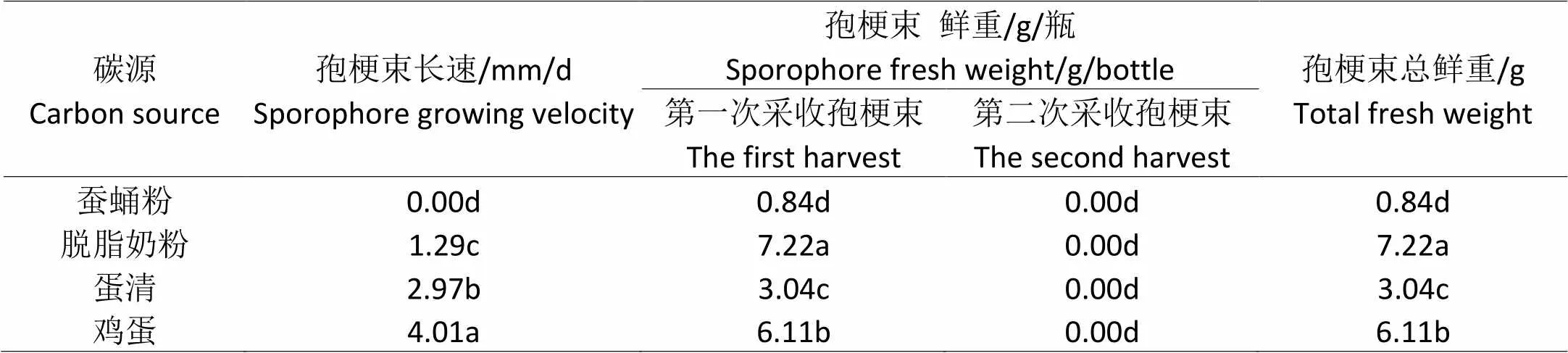
表3 玉米主料培养基中不同氮源对蝉花生长的影响

图 3 玉米培养基中添加不同氮源的蝉花生物转化率
2.4 小麦主料培养基中不同氮源对蝉花生长的影响
在小麦主料中添加不同的氮源,其蝉花孢梗束生长存在一定的差异,在培养基中,添加蚕蛹粉、脱脂奶粉、蛋清、鸡蛋的4种氮源的蝉花产量均较好。其中,蛋清的第一次孢梗束为39.47 g,其次的是脱脂奶粉。而孢梗束的长速是蛋清>鸡蛋>脱脂奶粉>蚕蛹粉(表4)。对蝉花孢梗束的生物转化率存在一定的差异性(图4),小麦培养基中添加蛋清的生物转化率最高,为158.14%;最低的是蚕蛹粉,其生物转化率为131.86%。

表4 小麦主料培养基中不同氮源对蝉花生长的影响

图 4 小麦培养基中添加不同氮源的蝉花生物转化率
2.5 荞麦主料培养基中不同氮源对蝉花生长的影响
荞麦主料添加不同的氮源培养基,其蝉花孢梗束生长存在一定的差异(表5),培养基中添加蚕蛹粉的总鲜重达到54.53 g、孢梗束长速是3.95 mm/d;其次是鸡蛋,其鲜重为48.92 g、孢梗束长速是3.46 mm/d;最低的是蛋清,为42.14 g,但其孢梗束长速是最快的,为4.23 mm/d。
同时,蝉花孢梗束的生物转化率存在一定的差异性,荞麦主料中添加蚕蛹粉的蝉花孢梗束的生物转化率最高,为129.83%;次是鸡蛋,为116.48%;再次是脱脂奶粉,为114.07%;最低的是蛋清,为100.33%(图5)。

表5 荞麦主料培养基中不同氮源对蝉花生长的影响

图 5 荞麦培养基中添加不同氮源的蝉花生物转化率
Fig.5 Biological transformation efficiencies ofin buckwheatmedium with different nitrogen sources
2.6 在小麦与荞麦混合培养基中不同氮源对蝉花生长的影响
在上述试验的基础上得出小麦、荞麦均适合蝉花的生长,将两种主料混合后,添加不同的氮源作为蝉花栽培的培养基,其蝉花孢梗束生长存在一定的差异(表6)。蝉花在不同氮源的混合培养料中生长均较好,其中以鸡蛋为氮源的孢梗束长速最快为3.81mm/d,且第一次采收的孢梗束鲜重、两次采收的孢梗束总鲜重均达到最大值,为47.63g、68.95g;明显的高于蛋清、蚕蛹粉、脱脂奶粉氮源培养基的蝉花。
小麦和荞麦主料中添加4种不同氮源的培养基,其蝉花孢梗束的生物转化率也存在一定的差异性(图6)。其中,脱脂奶粉的生物转化率最低,为104.74%,蚕蛹粉高于脱脂奶粉,却明显低于蛋清与鸡蛋的生物转化率,为137.43%;蛋清与鸡蛋相差无几,但鸡蛋的生物转化率最高,为164.17%,比蛋清提高4.45%。

表6 混合培养料中不同氮源对蝉花生长的影响

图 6 小麦与荞麦混合培养基中添加不同氮源的蝉花孢梗束的生物转化率
Fig.6 Biological transformation efficiencies ofsporophore in mixed medium of wheat and buckwheat with different nitrogen sources
3 结论
3.1 蝉花固体栽培最适宜培养基是小麦主料培养基
在蝉花固体栽培过程中加入杂交米、玉米、小麦、荞麦等四种主料,其中小麦主料培养基两潮孢梗束的总鲜重达到最高,为29.95 g;其生物转化率也达到了最大,为37.44 g。因此,以小麦为主料的培养基,更适合蝉花子实体的生长。
3.2 小麦栽培蝉花最适宜氮源是蛋清
添加蚕蛹粉、脱脂奶粉、蛋清、鸡蛋4种氮源在小麦培养基中,含蛋清的小麦培养基中两潮孢梗束的总鲜重达到最高,为66.42 g;生物转化率为83.03%。因此,在小麦培养基中,蛋清是最适宜的氮源。
在不同主料的培养基中,添加不同氮源,蝉花孢梗束的生长差异显著。如小麦主料培养基中最适宜的氮源是蛋清,玉米主料培养基中最适宜的氮源是脱脂奶粉,荞麦和杂交米主料培养基中最适宜的氮源是蚕蛹粉,但荞麦栽培蝉花孢梗束的产量显著高于杂交米培养基,同时小麦与荞麦混合的主料中最适宜的氮源是鸡蛋。因此,在实践生产中,要获得产量高、品质好、商品性状好的蝉花孢梗束,需根据其栽培主料来选择适宜的氮源。
近年来蝉花的人工培养受到越来越多的关注,随着人工栽培蝉花技术的不断进步,以大米、小麦等材料作为培养基质培养蝉花子实体获得了初步成功[26]。同时经过多年的栽培实践,已经积累了丰富的市场经验,形成一套并非寄生于虫体的蝉花栽培技术体系,特点是栽培原料广泛、操作简单、生产周期短、管理方便、成本低、产量高,很适合大规模、工业化生产,为解决野生蝉花资源短缺问题提供了新途径,也适合在农户中推广应用。未来生产培养基中以含有蚕蛹粉、鸡蛋等动物源成分效果较佳,可能提供了真菌寄生体内类似的激素等促进因子[27],但人工栽培的蝉花尽管只有子座(孢梗束)而无虫体,外观上与虫菌复虫的野生蝉花有较大区别,但其子实体的药理成分和含量与野生蝉花相近[5]。同样可作为有关药品或保健品的加工原料。国内外市场对蝉花及其深加工产品的需求量很大,蝉花人工栽培具有广阔的前景。
[1] Samson RA. Paecilomyces and someallied Hyphomycetes[J]. Stud. Mycol, 1974,6:52-54
[2] 梁宗琦,刘作易,韩燕峰,等.中国虫草图谱[M].贵阳:贵州科学出版社,2009:118-119
[3] 董彩虹,李文佳,李增智,等.我国虫草产业发展现状、问题及展望[J].菌物学报,2016,35(1):1-15
[4] 陈安徽,陈宏伟,徐洋,等.蝉花虫草中核苷类成分的分离纯化和鉴定[J].食品科学,2013(1):131-134
[5] 徐红娟,毛先兵,朱华李,等.中药蝉花的研究概况[J].重庆中草药研究,2007(2):43-46
[6] 贺亮,马素云,程俊文,等.药用真菌蝉拟青霉生物活性物质的研究进展[J].食品与生物技术学报,2012,31(1):8-16
[7] 幸兴球.大蝉草和小蝉草的分类[J].微生物学报,1975(1):21-26
[8] 于士军,纪伟,董建飞等.不同蝉花产品蛋白质营养价值分析[J].氨基酸和生物资源,2014(4):35-39
[9] 王琪,刘作易.药用真菌蝉花的研究进展[J].中草药,2004,34(4):469-471
[10] 葛飞,夏成润,李春如,等.蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J].菌物学报,2007,6(1):68-75
[11] 许洪义,朱燕,程东庆.中药蝉花的研究进展[J].中医药信息,2008(5):27-29
[12] 罗靖,宋捷民.中药蝉花的本草学考证[J].江西中医学院学报,2007(6):14-15
[13] 郭海平,杨智敏.冬虫夏草药理作用研究进展[J].中草药,1999,30(3):231-233
[14] 马定远,李萍,季晖,等.冬虫夏草及其菌丝的药理学研究进展[J].中药材,2001,24(6):455-458
[15] Toda N, Okunishi H, Taniyama K,. Responses to adenine nucleotides and related compounds of isolated dog cerebral, coronay and mesenteric arteries[J]. Blood Vessels, 1982,19(5): 226
[16] Pelleg A, Porter RS. The pharmacology of adenosine[J]. Pharmacotherapy, 1990,10(1):157
[17] Li SP, Li P, Lai CM,. Simultaneous determination of ergosterol, nucleosides and their bases from natural and culturedby pressurised liquid extraction and high-performance liquid chromatography[J]. J Chromatography A, 2004,1036(2):239-243
[18] Li YX, Li SX, Li P,. Simultaneous determination of six main nucleosides and bases in natural and culturedby capillary electrophoresis[J]. J Chromatography A, 2004,10(5):215-221
[19] Gu YX, Wang ZS, Li SX,. Effect of multiple factors on accumulation of nucleosides and bases in Cordyceps militaris[J]. Food Chem, 2007,102(4):1304-1309
[20] Toda N, Okunishi H, Taniyama K,. Responses to adenine nucleotides and related compounds of isolated dog cerebral, coronary and mesenteric arteries[J]. Blood Vessels, 1982,19(5):226-236
[21] 米莉莉,王智华,洪筱坤.冬虫夏草及人工菌丝体的核苷类成分的HPLC研究[J].中草药,2003,34(6):573-574
[22] 王春雷,芦柏震,侯桂兰.中国蝉花的研究进展[J].中国药学杂志,2006(4):244-247
[23] 陈成,许佳伟,孙细涓,等.茅山地区蝉花菌株的分离及其多糖生物活性的研究[J].江苏农业科学,2015(4):347-352
[24] 滕晔,宋玉良,官宗华.蝉花人工培养的研究进展[J].内蒙古中医药,2012(12):111-112
[25] 贺亮,马素云,程俊文,等.药用真菌蝉拟青霉生物活性物质的研究进展[J].食品与生物技术学报,2012(1):8-16
[26] 程东庆,丁志山,林美爱,等.蝉花真菌的分离及液体发酵培养[J].中药材,2006,29(2):99-101
[27] 宋金俤,刘超,华秀红,等.蛹虫草产业化栽培瓶颈及其对策[J].中国食用菌,2009(1):62-64
Effects of Different Nutritional Conditions on Artificial Solid Cultivation of Wild
XIE Chun-qin, FAN Jun-min, XU Jun-qi, CHEN Shu, CAO Zheng*
212400,
In order to accelerate the industrialization development ofthe cultivation of wildin artificial solid medium was studied in the past three years. The liquid strains were inoculated on different culture medium with different main materials and different nitrogen sources, under the same management conditions, the growth status of cicada flower on different media was compared by measuring the growth speeds, fresh weight and biological transformation efficiencies of the flower sporophore growth. The results showed the optimum medium for artificial solid cultivation of wild cicada flower was wheat 40 g, nitrogen source 2 g, nutrient solution 60 mL.
Nutritional conditions;, solid cultivation, influence on growth
S646.9
A
1000-2324(2018)03-0477-07
2016-10-03
2017-01-20
2015年江苏省“六大人才高峰”资助项目(2015-NY-024);江苏农林职业技术学院项目(2017KJ238 );镇江市“1+1+N”新型农业技术项目(ZJNJ[2017]06)
谢春芹(1976-),女,硕士,副教授,主要从事食药用真菌教学与研究. E-mail:xiechunqin@163.com
Author for correspondence. E-mail:963243057@qq.com

