基于二维相关红外光谱强酸性电解水对三种食源性致病菌的灭菌机制
林艳宁,陶宁萍,卢瑛,赵勇*,许长华*
基于二维相关红外光谱强酸性电解水对三种食源性致病菌的灭菌机制
林艳宁1,2,3,陶宁萍1,2,3,卢瑛1,2,3,赵勇1,2,3*,许长华1,2,3*
1. 上海海洋大学食品学院, 上海 201306 2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306 3. 农业部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
本研究旨在利用二维相关红外光谱结合红外光谱差减法探究强酸性电解水(Acidic electrolyzed water,AEW)杀灭食源性致病菌的分子作用机制。经AEW处理后的三种常见食源性致病菌(副溶血性弧菌、沙门氏杆菌、单增李斯特菌),以其和电解水接触时间为微扰条件,分析其和电解水接触过程中光谱动态变化过程,获取电解水处理对其相应化学基团的干扰信息。结果显示,AEW使致病菌蛋白质二级结构发生改变,使折叠含量逐渐增高,转角含量逐渐降低。本研究为以后利用光谱技术揭示电解水灭菌分子机制奠定了基础。
强酸性电解水; 食源性致病菌; 二维相关红外光谱; 灭菌机制
近年来由食源性致病菌引起的食品安全问题已经成为全世界所面临的一个巨大威胁和挑战。存在于水产品中的副溶血性弧菌、单增李斯特菌、沙门氏杆菌等致病菌是引起世界包括中国在内的食源性疾病的主要致病菌[1,2]。为了给消费者生产高质量、微生物安全的食物,很多灭菌方法被应用于食品工业的器械、原材料中来保持商业无菌。在众多灭菌方法中,以低pH(2~3)、高氧化还原电位(900~1200 mV)、高活性氧(10~160 mg/L)为特征的AEW[3]正好满足了食品工业中的灭菌需求。AEW对食品中不同的致病菌都具有良好的灭菌效果,具有广谱灭菌,操作简便,环境友好等优点。目前,AEW已被广泛地应用于研究和生产当中。然而,有关于AEW的灭菌机制仍然未被完整揭示。揭示AEW的灭菌机制对于将其更好的应用到食品工业,甚至是其它工业的灭菌中具有重要作用。
研究证明,影响AEW杀菌能力的因素有很多:AEW中过低的pH环境严重扰乱细菌表面的两性物质,增加细胞膜渗透性,并且妨碍新陈代谢过程[4];过高的氧化还原电位改变细菌细胞内电子流,影响细胞内能量代谢和ATP合成[4,5];AEW中含有活性氧的成分能引起细胞内关键蛋白质折叠,从而影响细胞对电解水的耐受性[6]。然而,很少有研究从揭示AEW和细菌作用时细菌大分子物质化学结构变化的角度来阐述AEW灭菌机制。这些结构变化对于揭示AEW灭菌机制起着至关重要的作用。二维相关红外光谱分析方法,通过对光谱变化分析,可得到分子内官能团间相互作用和分子间相互作用信息。差谱方法利用混合样品光谱减去基准物质光谱,可得到目标物质光谱,降低了光谱中由其它物质带入的干扰[7]。
本研究利用二维相关红外光谱结合红外光谱差减方法,从生物大分子结构改变的角度揭示AEW对食源性致病菌的灭菌机制,为AEW灭菌机制研究开辟一种新思路。
1 材料方法
1.1 致病菌样品制备
实验所用三种食源性致病菌标准菌株,副溶血性弧菌(ATCC17802),单增李斯特菌(ATCC19115),沙门氏杆菌(CMCC50041)。标准菌株用25%的甘油保存管保存于-80 °C冰箱备用。用TSB培养基(TSB,北京市陆桥科技有限公司,中国)在37 °C下培养致病菌18~20 h,使菌株活化后,按1%接菌量将100 µL致病菌接种到10 mL TSB液体培养基中,在37 °C下培养10 h,使致病菌生长到对数期。在3000 g,25 °C条件下用离心机(Centrifuge 5417R,Eppendorf,德国)离心10 min,将液体培养基中的菌体富集。富集到的菌体沉淀分别用超纯水清洗3次,留下菌体沉淀备用。
1.2 电解水制备
参照之前的研究制备AEW[8]。AEW在电解水生成装置(FW-200,AMANO,日本)中生成,利用电解池的阳极电解0.15%的氯化钠溶液15 min产生AEW。制备出的AEW的pH和氧化还原电位(ORP)用pH/ORP测量仪(Mettler-Toledo, Zurich,瑞士)进行测量。有效氯浓度(ACC)通过比色法,用数字氯检测试剂盒(RC-2Z,笠原化工仪器有限公司,日本)来测定。所有操作做三组平行。最终制备的AEW pH值为2.15,ORP为1171.9,ACC为0.0074%。
1.3 实验仪器设备以及实验条件
红外光谱仪为美国Thermo Scientific Nicolet公司生产的iS5光谱仪,采用DTGS检测器。扫描次数为16次,分辨率为4 cm-1,扫描范围为4000~400 cm-1。H2O和CO2的干扰在扫描中被扣除。用电解水与细菌混合后的样品光谱减去纯电解水的光谱,以3400 cm-1[9]为参照峰,差减因子为0.9932,获取细菌样品和电解水接触后的动态光谱。采用Perkin-Elmer公司spectrum v3 02操作软件获取样品二阶导数图谱。
二维相关红外光谱(2DCOS-IR)的获取:将上述处理好的AEW加入ATR(Attenuated Total Reflection)附件中,先采集AEW的红外光谱,随后再分别采集三种食源性致病菌的红外光谱记录为0 s时的光谱。将三种食源性致病菌沉淀与电解水混合,并开始计时,每隔30 s采集一次红外光谱,直到3.5 min后停止采集。二维红外相关光谱通过二维红外光谱分析软件(Nicolet iN10 SpectraCorr)分析获得。
2 结果和讨论
2.1 AEW处理过程中三种致病菌的红外光谱分析
三种食源性致病菌(单增李斯特菌,沙门氏杆菌,副溶血性弧菌)的红外光谱差谱如图1所示,其特征峰总结列于表1[10-13]。
1800~1100 cm-1包含了红外光谱的特征区域和指纹区域,可以用来鉴别检测AEW杀灭食源性致病菌过程中化学分子发生的动态变化。由图1可知,随着与AEW接触时间增加,三株菌在1800~1100 cm-1范围内表现出差异。特别是以1237 cm-1做归一化后,三株菌在特征峰1085 cm-1(Cellular proteins)、1398 cm-1(s(CH3))、1455 cm-1(s(C-O-H))处信号强度在从0~210 s过程中逐渐降低。这反映出,致病菌在AEW处理过程中,蛋白质结构逐渐发生改变,细胞壁脂类结构也逐渐发生变化。
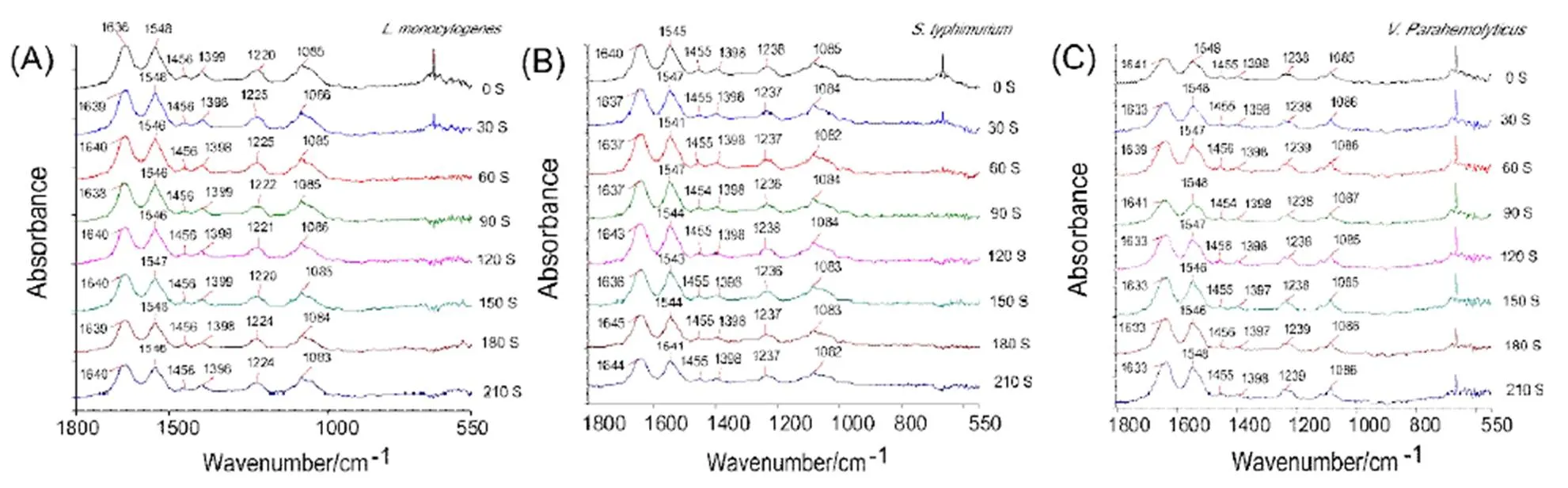
图 1 三种食源性致病菌经AEW处理3.5 min之内的傅里叶红外光谱
(A)丹增李斯特菌;(B)沙门氏杆菌;(C)副溶血性弧菌
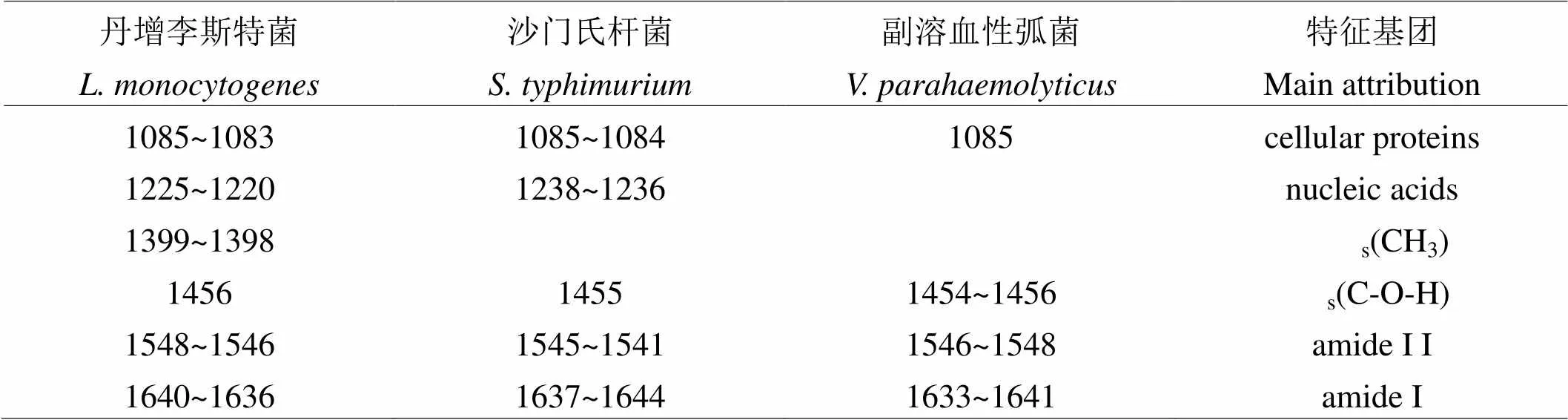
表1 三种食源性致病菌红外谱特征谱带指认
2.2 AEW处理过程中三种致病菌的红外光谱二阶导数分析
红外光谱二阶导数图谱可以分开原始图谱中重叠的吸收峰和宽峰,增加光谱分辨率,放大原始图谱中的细微差别[14,15]。如图2所示,随着食源性致病菌和AEW接触时间增加,蛋白质中β折叠的特征峰(1694 cm-1)[13]吸收强度逐渐增强。β转角的特征峰(1687 cm-1)[13]信号强度逐渐降低。副溶血性弧菌和沙门氏杆菌蛋白质中苯基C-C振动(1589 cm-1)[16]逐渐降低,单增李斯特菌中逐渐升高。这证明在电解水和食源性致病菌相接触过程中,电解水使细菌蛋白质二级结构发生变化。
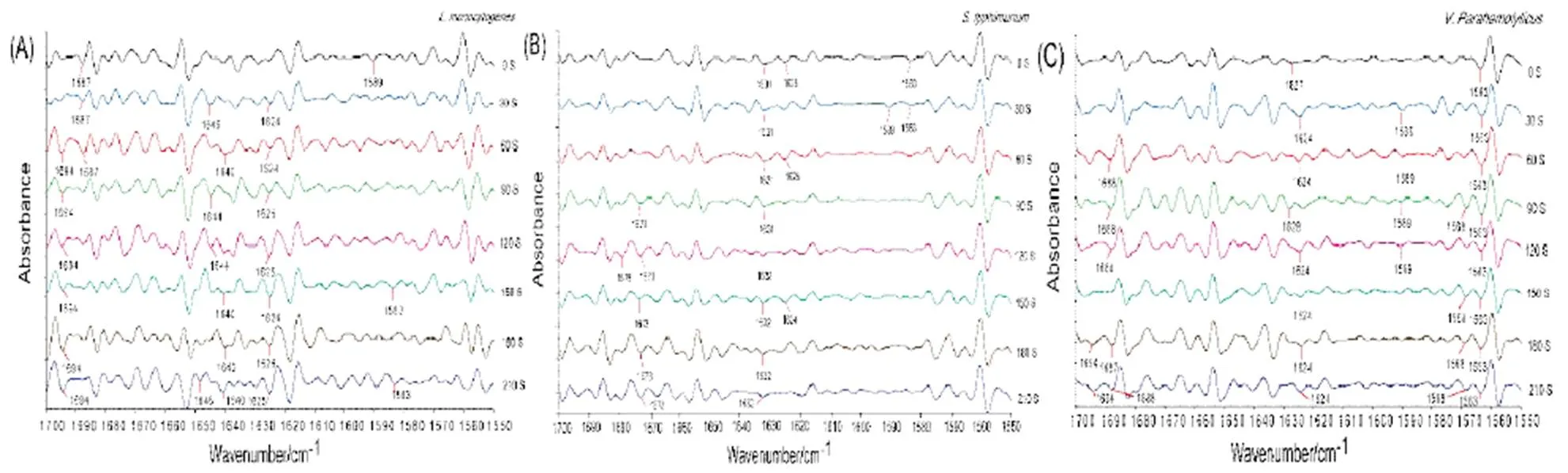
图 2 三种食源性致病菌经AEW处理3.5 min之内的红外光谱(1700~1550 cm-1)二阶导数图谱
(A)丹增李斯特菌;(B)沙门氏杆菌;(C)副溶血性弧菌
对AEW处理0~210 s对应致病菌的酰胺I带(1600~1700 cm-1)光谱进行曲线拟合分析,获取在此过程中,致病菌蛋白质二级结构的动态变化量[13]。丹增李斯特菌与AEW接触时间从0 s到210 s这一过程中蛋白质二级结构的曲线拟合结果如图3所示。随着和AEW接触时间的增加,蛋白质折叠的含量从45.79%逐渐增加到54.33%,转角的含量从16.51%逐渐减小到12.1%(表2)。沙门氏杆菌与副溶血性弧菌也呈现出同样的变化规律,这证明,在致病菌和AEW接触过程中AEW逐渐破坏致病菌蛋白质二级结构中的折叠和转角。
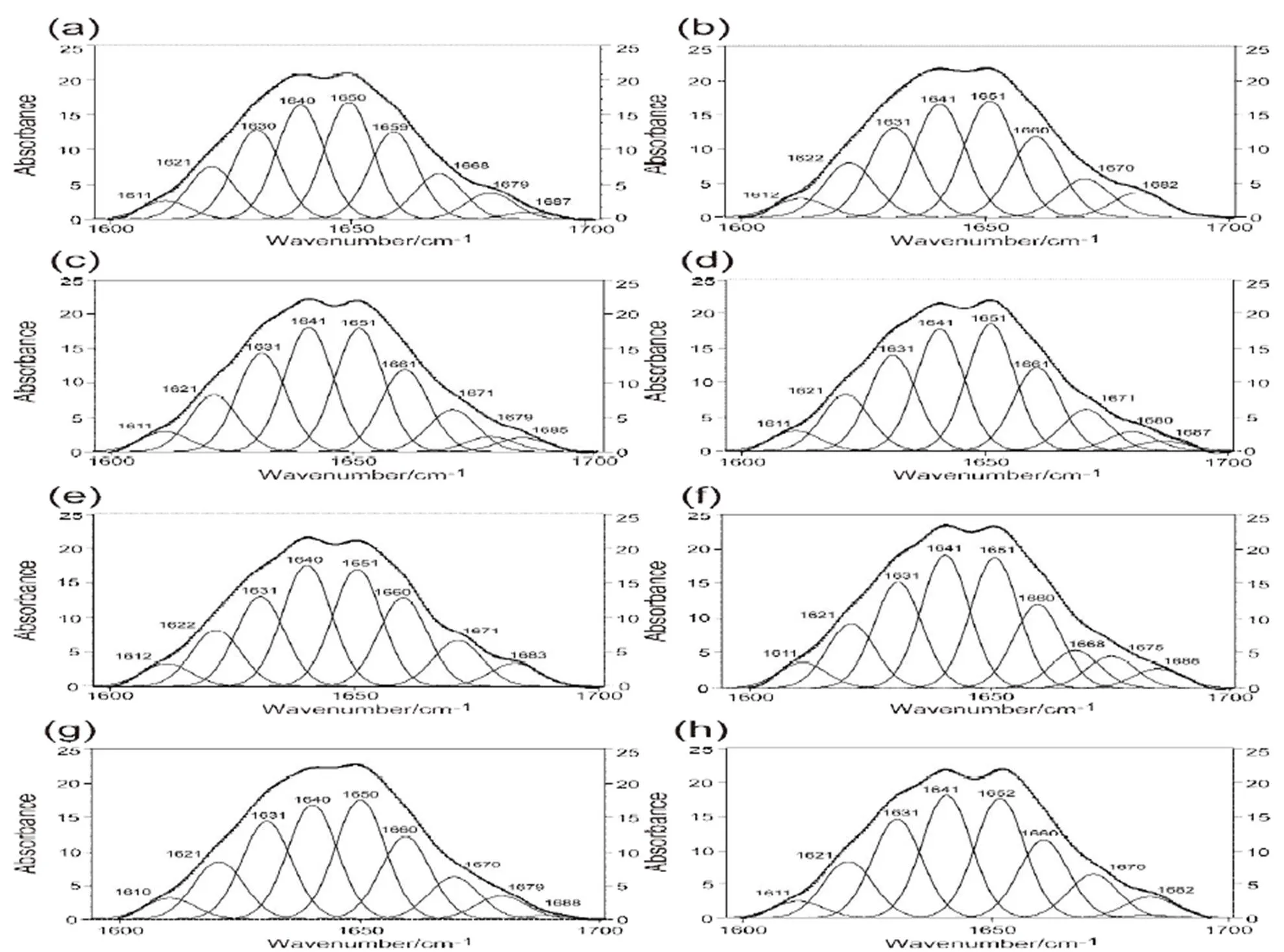
图 3 单增李斯特菌经AEW处理3.5 min之内酰胺I带(1700~1600 cm-1)处的红外光谱曲线拟合图
(a) 0 s,(b) 30 s,(c) 60 s,(d) 90 s,(e) 120 s,(f) 150 s,(g) 180 s,(h) 210 s
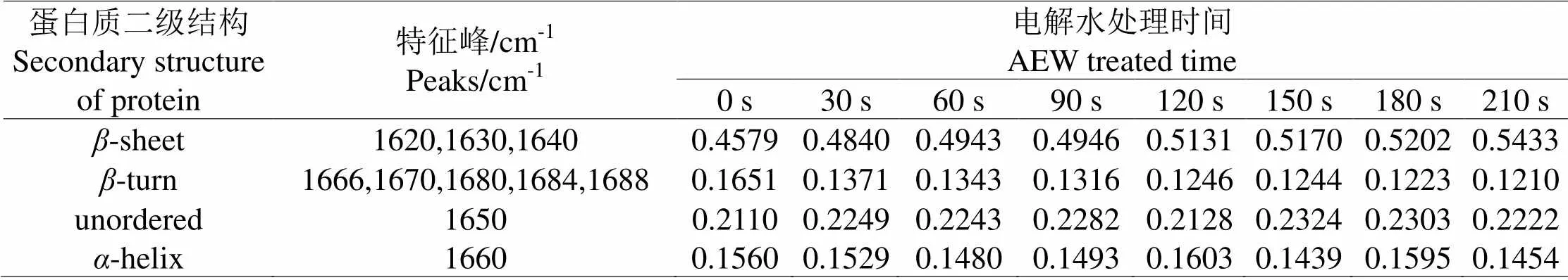
表 2 单增李斯特菌经AEW处理3.5 min之内的蛋白质二级结构含量
2.3 AEW处理过程中三种致病菌的二维相关红外光谱分析
图 4 三种食源性致病菌经AEW处理3.5 min之内在1400~1600 cm-1范围内的二维相关红外光谱
Fig.4 Two-dimensional correlation infrared spectroscopy of three food-borne pathogenic bacteria with AEW treatment within 3.5 min in the region of 1400~1600 cm-1
(A)丹增李斯特菌;(B)沙门氏杆菌;(C)副溶血性弧菌
使用二维相关红外光谱可以观察到食源性致病菌对AEW扰动的响应,获得比普通红外光谱更多的信息,增强谱图分辨率。由图3中可见,在从0~210 s的逐渐增时过程中,三种致病菌在1600~1400 cm-1内的二维相关红外光谱在1560 cm-1(ring base)、1636 cm-1(sheet)[10]处有强自动峰,在1419 cm-1(Vs(COO-))、1406 cm-1(as(CH3))[11]处有比较弱的自动峰(图3 A)。在1489 cm-1(V(CH))、1480 cm-1(AmideⅡ)、1472 cm-1(CH2)[13]处有强自动峰,1456 cm-1(δas(CH3))、1435 cm-1(δ(CH2))、1418 cm-1(Vs(COO-))[11]处有弱的自动峰(图3 B)。在1571 cm-1(AmideⅡ)、1550 cm-1(AmideⅡ)、1540 cm-1(AmideⅡ)[13]处有强的自动峰,在1565 cm-1(ring base)[13](图3 C)处有弱的自动峰。在和AEW接触的过程中蛋白质受到的扰动最大,尤其是苯基的响应最大,这证明蛋白质结构受到的破坏最显著。除此之外,脂类亚甲基,多糖类等也出现相应的自动峰,即致病菌中的脂类和多糖类也遭到破坏。
3 结论
随着三种食源性致病菌与AEW接触时间增加,利用红外光谱差谱结合二维相关红外光谱方法,可以检测到致病菌从存活到死亡过程中对应的光谱变化。从原始图谱到二阶导数图谱,再到二维相关红外光谱,样品图谱的分辨率逐级提高。原始图谱与二阶导数图谱均得出致病菌在和电解水作用过程中其蛋白质二级结构发生变化,即β折叠含量逐渐增高,转角含量逐渐降低。二维相关红外光谱证明,其蛋白质的苯基等官能团对电解水的响应最大,蛋白质的结构受到电解水的扰动最大,其次脂类,多糖类也出现响应,即AEW还破坏脂类和多糖类。本研究初步证明红外光谱差谱结合二维相关红外光谱方法可以用于研究电解水灭菌机制,同时这种方法有望以后用于研究生物体与外界环境的动态变化作用机制中。
[1] Sun JL, Zhang SK, Chen JY,. Efficacy of acidic and basic electrolyzed water in eradicating Staphylococcus aureus biofilm[J]. Canadian Journal of Microbiology, 2012,58(4):448-54
[2] Wang M, Wang JJ, Sun XH,. Preliminary mechanism of acidic electrolyzed water ice on improving the quality and safety of shrimp [J]. Food Chemistry, 2015,176:333-41
[3] 高新昊,刘兆辉,李晓琳,等.强酸性电解水的杀菌机理与应用[J].生态农业科学,2008,24:393-399
[4] Ding T, Xuan XT, Li J,. Disinfection efficacy and mechanism of slightly acidic electrolyzed water on Staphylococcus aureus in pure culture [J]. Food Control, 2016,60:505-510
[5] Al-Qadiri HM, Lin M, Al-Holy,. Detection of sublethal thermal injury in Salmonella enterica serotype typhimurium and Listeria monocytogenes using Fourier transform infrared (FT-IR) spectroscopy (4000 to 600 cm-1)[J]. Food Microbiology and Safety, 2008,73(2):54-61
[6] Winter J, Ilbert M, Graf PCF,. Bleach Activates a Redox-Regulated Chaperone by Oxidative Protein Unfolding [J]. Cell, 2008,135:691-701
[7] 孙素琴,周群,陈建波.ATC 009 红外光谱分析技术[M].北京:中国质检出版社,2013:160-164
[8] Wang JJ, Sun WS, Jin MT,. Fate of Vibrio parahaemolyticus on shrimp after acidic electrolyzed water treatment[J]. International Journal of Food Microbiology, 2014,179:50-56
[9] 时有明,刘刚,孙艳琳.八种鹅膏菌的傅里叶变换红外光谱的差谱鉴别研究[J].光散射学报,2012,24:211-216
[10] Filip Z, Hermann S. An attempt to differentiate Pseudomonas spp. and other soil bacteria[J]. European Journal of Soil Biology, 2001,37:137-143
[11] Mengshi L, Murad A, Hamzah A,Discrimination of Intact and Injured Listeria monocytogenes by Fourier Transform Infrared Spectrosco[J]. Journal of Agricultural and Food Chemistry, 2004,52:5769-5772
[12] Guo XX, Hu W, Liu Y,. Rapid determination and chemical change tracking of benzoyl peroxide in wheat flour by multi-step IR macro-fingerprinting[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2016,154:123-129
[13] Yang HY, Yang SN, Kong JL,. Obtaining information about protein secondary structures in aqueous solution using Fourier transform IR spectroscopy[J]. Protocol, 2015,10(3):382-96
[14] Xu BL, Zhang GJ, Sun SQ,. Rapid discrimination of three kinds of Radix Puerariae and their extracts by Fourier transform infrared spectroscopy and two-dimensional correlation infrared spectroscopy[J]. Journal of Molecular Structure, 2012,1018:88-95
[15] Chong YK, Xu CH, Lan J,. Identification of geographical origin of Lignosus samples using Fourier transform infrared and two-dimensional infrared correlation spectroscopy[J]. Journal of Molecular Structure, 2014,1069:188-195
[16] Rasha AEK, Safaa K, Ragab M. Dielectric and FT-Raman spectroscopic approach to molecular identification of breast tumor tissues[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015,151:208-12
Sterilization Mechanism of AEW on Three Kinds of Food Borne Pathogenic Bacteria by Using Two Dimensional Infrared Correlation Spectroscopy
LIN Yan-ning1,2,3, TAO Ning-ping1,2,3, LU Ying1,2,3,ZHAO Yong1,2,3*, XU Chang-hua1,2,3*
1.201306,2.201306,3.201306,
The purpose of this study was to explore the molecular mechanism of killing foodborne pathogenic bacteria (AEW) in strongly acidic electrolytic water (Acidic electrolyzed water) by two dimensional correlation infrared spectroscopy (IR) and infrared spectral subtraction (IR). Three common foodborne pathogenic bacteria (and) treated with AEW were used as perturbation conditions to analyze the dynamic changes of spectrum during contact with electrolytic water. The interference information of electrolytic water treatment on the corresponding chemical groups was obtained. The results shown that AEW changed the secondary structure of protein, increased the content of β -fold and decreased the content of β -corner. This study laid a foundation for revealing the molecular mechanism of electrolytic water sterilization by spectral technique.
Acidic electrolyzed water (AEW); food-borne pathogenic bacteria; two dimensional correlation infrared spectroscopy; sterilization mechanism
Q93-334
A
1000-2324(2018)03-0424-05
2016-11-07
2016-12-22
中国国家自然科学基金(31401571); 上海市科技兴农重点攻关项目(沪农科攻字(2016)第4-4号); 上海市科学技术委员会部分地方院校能力建设项目(15320502100); “十二五”国家科技支撑计划重大项目(2015BAD17B01,2015BAD17B02)
林艳宁(1990),女,硕士研究生,主要从事红外光谱拉曼光谱检测研究. E-mail:yanninglinlin@163.com
Author for correspondence.E-mail:yzhao@shou.edu.cn; chxu@shou.edu.cn

