辣椒疫霉效应因子RxLR115890不同侵染时期的差异性表达
张丽,王俪颖,梁涛,丁鹏,朱彤彤,张修国,李壮
辣椒疫霉效应因子RxLR115890不同侵染时期的差异性表达
张丽,王俪颖,梁涛,丁鹏,朱彤彤,张修国,李壮*
山东农业大学植物保护学院, 山东省蔬菜病虫生物学省级重点实验室, 山东 泰安 271018
辣椒疫霉菌()能够产生370多个RxLR效应分子,绝大多数效应分子的特性都是未知的。为了对辣椒疫霉RxLR效应因子开展深入的功能研究,本研究以辣椒疫霉SD33菌株的DNA为模板,设计辣椒疫霉菌以及RxLR115890的特异性引物。采用实时荧光定量PCR检测RxLR115890在辣椒疫霉游动孢子侵染条件下,不同时间的表达量。结果显示,RxLR115890的表达量在侵染前期有明显的上调表达,伴随着侵染时间的加长表达量迅速下降,又在12 h处再次轻微上调。由此得出结论,RxLR115890对辣椒疫霉菌的前期侵染具有至关重要的作用。为RxLR115890后续的研奠定了基础。
辣椒疫霉; RxLR115890; 实时荧光定量PCR; 表达量
辣椒疫霉()是农业生产上一类重要的植物病原卵菌,具有重要的经济学与生态学的意义[1]。其寄主范围广,引起的作物疫病是作物生产上的毁灭性病害,造成巨大的经济损失,同时还能侵染模式植物拟南芥和本氏烟,是卵菌研究的重要模式材料[2]。疫霉菌分泌大量的效应分子,一类为胞间效应分子,一类为胞内效应分子[3],其中RxLR效应分子是一类胞内效应分子,其能干扰寄主植物细胞的正常生理代谢和功能。由于卵菌多为二倍体,其遗传学研究进展较慢,直至2004年,Avr1b作为第一个克隆的卵菌效应基因被报道[4]。目前已有十几个卵菌效应基因克隆和鉴定,均归类于RxLR效应蛋白家族序列比对分析发现,RxLR效应蛋白结构上分为3部分:信号肽、N-端RxLR-dEER基序和C-端功能结构域[5],其中约为20个氨基酸长短的信号肽可引导效应蛋白进入真核细胞,RxLR-dEER基序辅助成熟蛋白跨过寄主细胞膜进入寄主细胞[5],而C-端功能结构域将效应蛋白定位于胞内靶标位点而发挥其生物学功能[6]。
1999年,首次被应用于植物病理学研究的实时荧光定量PCR技术是基于普通PCR,并将核酸扩增、杂交、光谱分析和实时检测等多项技术融合在一起的一项创造性技术,与常规PCR相比,其操作更简便,更快速,敏感性更强,重复性且特异性更好[7]。传统的RT-PCR方法常被用于mRNA转录的检测,但此方法是非定量的[8,9]。实时荧光定量PCR(real-time quantitative PCR)技术实现了PCR从定性到定量的飞跃,实时荧光定量PCR就是通过实时检测PCR扩增反应中每一个循环产物的荧光信号从而完成对起始模板定量及定性的分析[10]。其原理是在RT-PCR反应中,引入一种化学荧光物质[11],随着PCR反应的进行,其反应产物不断累积,相应的荧光信号强度也等比例增加,即荧光强度与监测的产物量呈线性关系,最终得到一条荧光扩增曲线图,以此实现对样品数量的检测[12]。
在侵染条件下,辣椒疫霉通过提高或者降低自身分泌的效应分子的表达量,来促进对寄主的破坏作用[13,14]。本研究以辣椒疫霉效应分子RxLR115890为研究对象,以实验室自交系辣椒以及辣椒疫霉为供试材料,采用实时荧光定量PCR技术检测在侵染状态下115890在不同时间的表达量进行分析,进而研究RxLR115890在辣椒疫霉侵染时期的作用。研究结果为RxLR115890效应分子的后续功能研究奠定了基础。
1 材料与方法
1.1 供试作物及菌株
供试作物:辣椒,品种为‘自交系’,实验室杂交预留。
供试菌株:所用菌株为辣椒疫霉菌株LT1534。是辣椒疫霉属标准菌株,为本实验室保存。
1.2 菌株培养与DNA的提取
供试疫霉菌采用燕麦培养基进行活化,3 d后挑取适当大小的菌块于液体V8培养基中,28 ℃震荡培养3~5 d,直至有菌丝球出现,三层纱布过滤收集菌丝,并液氮冷冻研磨,采用CTAB法提取菌丝的DNA,通过凝胶电泳验证,并保存于-20 ℃备用。
1.3 材料准备与RNA的提取
供试疫霉菌采用燕麦培养基进行活化,培养7 d后去除培养基中部3~5块0.5 cm见方的菌丝块,用灭菌的山泉水每隔0.5~1.0 h清洗1次,共清洗7~8次。将处理后的培养皿置于14 ℃培养箱中静置培养12~14 h,收集产出的游动孢子悬浮液。辣椒种子经表面消毒于25 ℃下催芽5 d,播种于装有灭菌土壤的花盆中,置于22 ℃,相对湿度为90%条件下进行光照培养,待辣椒植株长到6叶期时进行辣椒疫酶菌胁迫处理。采用离体孢子悬浮液接种,接种孢子悬浮液浓度为2×104个/mL。接种前将辣椒叶片进行表面消毒,用接种针在叶片中间位置扎孔,并于接种前取辣椒疫霉菌丝(立即放入液氮速冻后,置-80 ℃超低温冰箱保存)为对照材料,诱导材料每个叶片滴约10 μL孢子悬浮液,28 ℃培养箱中保湿培养,于接种后1.5、3、6、12、24、48、72 h分别取样,液氮冷冻,并保存于-80 ℃备用。
将上述保存的辣椒样品进行液氮研磨,采用OMEGA植物RNA提取试剂盒进行RNA提取,参照试剂盒说明书进行操作提取RNA,通过凝胶电泳验证RNA的完整性,并保存于-80 ℃备用。
1.4 cDNA合成与纯度、浓度检测
以RNA为模板,参照诺唯赞反转录试剂盒说明书,在冰上进行反转录实验,反应体系如下:4×g DNA wiper Mix 4 µL,模板RNA1 µg,RNase free ddH2O to 16 µL,42 ℃ 2 min;在第一步反应管中直接加入5×HiScriptⅡqRT Super MixⅡ4 µL,第一步反应液16 µL;50 ℃ 15 min,85 ℃5 s。用分光光度计检测样品的浓度与纯度,并将cDNA的浓度稀释到0.4 μg·µl-1,-20 ℃保存。
1.5 引物设计
NCBI(http://www.ncbi.nlm.nih.gov)中下载LT1534肌动蛋白()序列,登录号为PPTG15376。应用Primier Quest Tool(http://sg.idtdna.com/Primer Quest/Home/Index)软件对其设计特异性荧光定量PCR引物。通过Blast program(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对所设计的引物序列与其它生物种属之间的同源性及其引物二聚体的有无。引物由上海博尚基因公司合成后对特异性进行筛选与评价。
应用Primier Quest Tool(http://sg.idtdna.com/Primer Quest/Home/Index)软件对RxLR115890特异位点设计特异性荧光定量PCR引物。通过Blast program(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对所设计的引物序列与其它生物种属之间的同源性及其同源二聚体的有无。引物由上海博尚基因公司合成后对特异性进行筛选与评价。
1.6 普通PCR检测引物特异性
以辣椒疫霉菌基因组DNA为模板进行PCR扩增。总体系为25 μL,其中2×Taq PCR Master Mix 12.5 μL,上下游引物各1.0 μL,DNA模板2.0 μL,ddH2O补足至25 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共32个循环;72 ℃补充延伸10 min。1.0%琼脂糖凝胶电泳检测扩增结果。
1.7 荧光定量PCR筛选模板浓度
以辣椒疫霉菌基因组DNA为模板进行荧光定量PCR扩增。测得基因组初始浓度为1.0 μg·µL-1,将样品以十倍浓度进行稀释,获得总浓度为1.0 μg·µL-1~1.0×10-6μg·µL-1,总体系为20 μL,其中2*Super Real Pre Mix Plus 10 μL,上下游引物各0.4 μL,DNA模板4 μL,50*ROX Reference Dye 0.4μL,ddH2O补足至20 μL。反应程序:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火32 s,共40个循环。在升温时收集荧光信号,筛选cDNA的反应浓度。
1.8 荧光定量PCR标准曲线的建立
以稀释后的cDNA为模板,构建实时荧光定量PCR标准曲线,每个反应3次重复。反应体系为2*Super Real Pre Mix Plus 10 μL,上下游引物各0.4 L,DNA模板4 μL,50*ROX Reference Dye 0.4μL,ddH2O补足至20 μL。以模板DNA浓度对数值为横坐标,反应循环数(Ct)值为纵坐标绘制标准曲线。
2 结果与分析
2.1 总RNA提取
提取高质量的总RNA是进行荧光定量PCR的关键。提取总RNA经紫外分光光度计检测,OD260/OD280值均在1.9~2.0之间,说明所提取的总RNA纯度较高,OD260/OD230值均在大于2.0,说明提取的RNA没有盐离子污染。1.0%琼脂糖凝胶电泳检测,总RNA的28S rRNA、18S rRNA两条带清晰锐利(图1),表明RNA未出现降解,完整性较好,并且没有基因组DNA污染,符合进一步实验的要求。

图 1 电泳检测辣椒疫霉不同时期总RNA
2.2 普通PCR检测引物特异性
以辣椒疫霉LT1534的cDNA为模板进行PCR扩增,凝胶电泳结果显示,仅在辣椒疫霉菌的245 bp处有特异性条带,无非特异性引物二聚体出现,说明引物特异性良(2)。
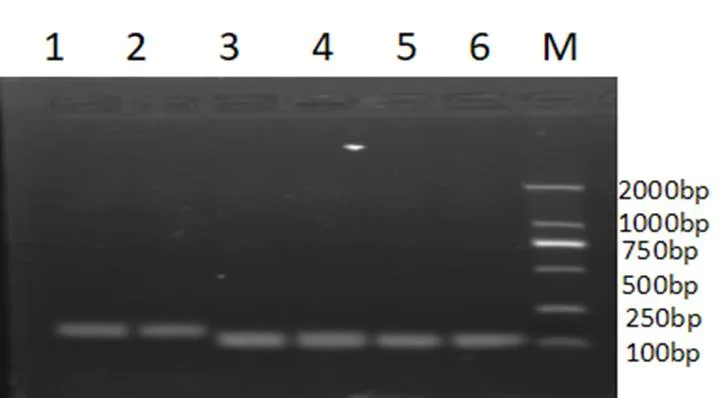
图 2 电泳检测引物特异性
2.3 荧光定量PCR检测引物特异性
荧光定量PCR检测结果表明:此引物对辣椒疫霉菌(编号为PPTG15376)模板DNA扩增良好,溶解曲线有单一峰值,无非特异性扩增及引物二聚体现象(如图3-1,3-2)。
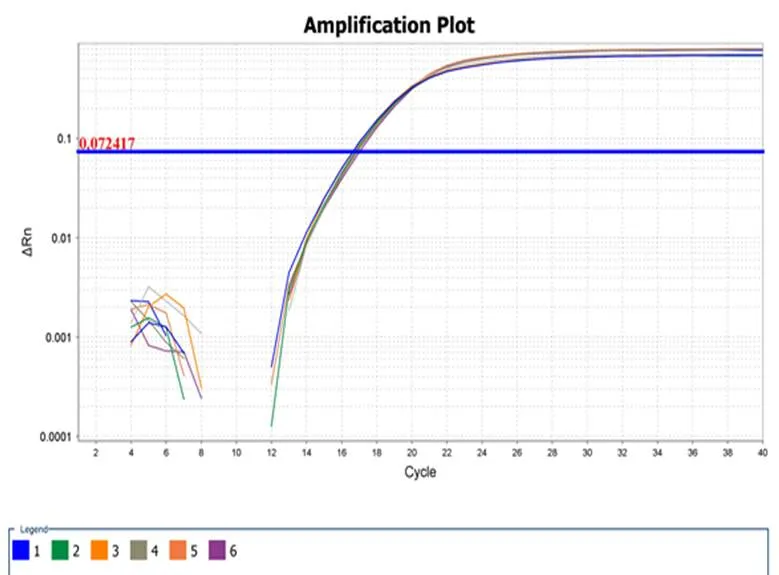
图 3-1 RT-PCR检测引物特异性-扩增曲线
Fig.3-1 Detection of primer-specific by RT-PCR - amplification curve
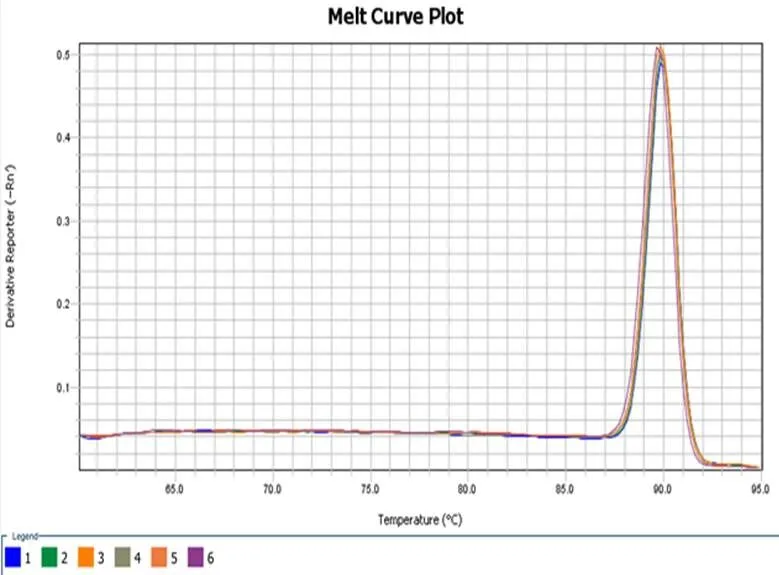
图 3-2 RT-PCR检测引物特异性-溶解曲线
Fig.3-2 Detection of primer-specific by RT-PCR - Dissolution curve
2.4 荧光定量PCR筛选模板浓度
荧光定量PCR检测结果表明:此引物对辣椒疫霉菌(编号PPTG15376)模板DNA扩增良好,且浓度为1 μg·µL-1~0.001 μg·µL-1时标准方差最小,因此cDNA浓度在此区间下最适宜。(如图4-1,4-2)。
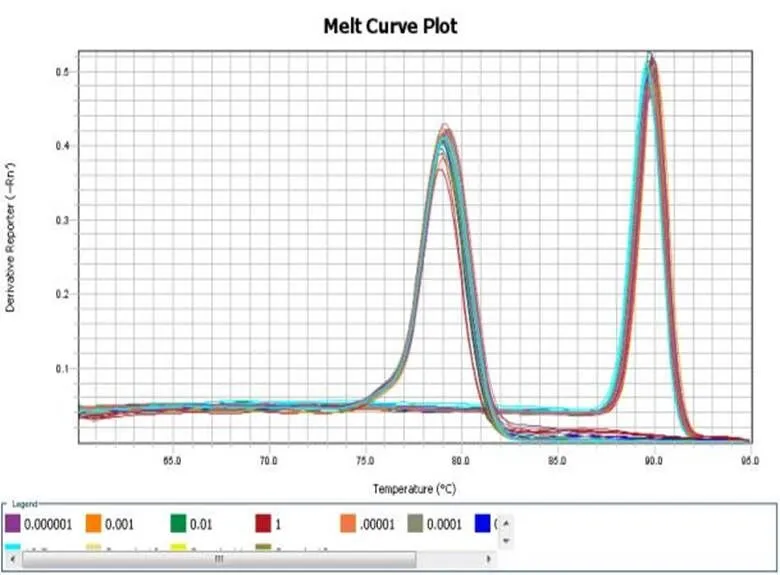
图 4-1 RT-PCR筛选模板浓度-溶解曲线图
Fig.4-1 RT-PCR screening template concentration-dissolution profile

图 4-2 RT-PCR筛选模板浓度-表达量
Fig.4-2 RT-PCR screening template concentration -expression level
2.5 RxLR115890在不同辣椒疫霉菌侵染时期的荧光定量PCR标准曲线的建立
RxLR115890在辣椒疫霉中的表达量是相对于辣椒疫霉中actin的表达量而确定的。以辣椒疫霉菌未侵染时期的RxLR115890作为对照,检测不同侵染时期的辣椒疫霉菌的表达量。结果显示,与对照相比,RxLR115890在侵染时期的表达量明显高于未侵染时期的,且在侵染前期表达量最高(如图5-1,5-2)。
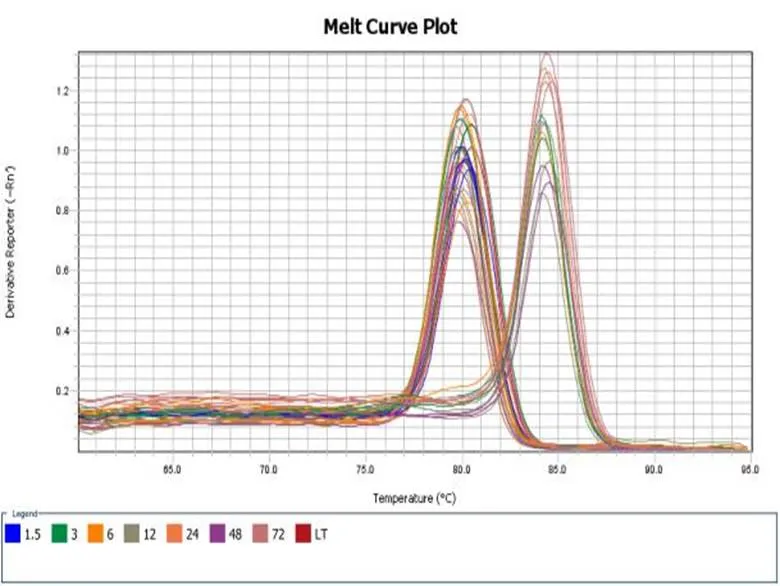
图 5-1 RxLR115890荧光定量PCR扩增曲线
Fig.5-1 Real-time fluorescence quantitative standard curve of RxLR115890
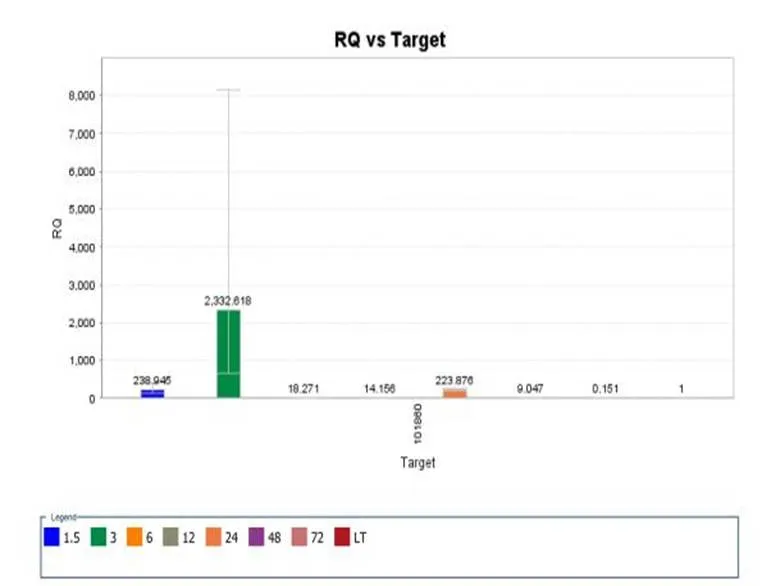
图 5-2 RxLR115890荧光定量PCR表达模式分析
Fig.5-2 Real-time fluorescence expression patterns of RxLR115890
3 讨论
辣椒疫霉菌是一种重要的土传病害病原菌,其寄主范围较广,可引起辣椒、番茄、黄瓜、南瓜等多种重要蔬菜作物的疫病。考虑到该病害的易爆发性,病原菌侵入植株后迅速蔓延,短时间内即可暴发成灾,且其症状与传统镰刀菌引起的病害症状相似,在生产防治中难度较大,易给蔬菜生产造成毁灭性的灾害。
本研究基于辣椒疫霉菌在侵染条件下,菌丝体活跃程度的差异,在不同侵染时间检测RxLR115890的差异性表达。设计辣椒疫霉actin以及RxLR115890特异性引物,以未侵染时期的辣椒疫霉未阴性对照,检测RxLR115890在侵染时期的差异性表达。结果显示,RxLR115890的表达量会在侵染时期明显上调,且在3 h表达量达到顶峰,然后骤然下调,继而再次轻微上调,最后平稳下降。此实验结果表明,在辣椒疫霉菌侵染辣椒寄主时,RxLR115890会调动自身活性积极响应,且在3 h时表达量最高,说明RxLR115890在3 h时开始对寄主起破坏作用,从而确定了RxLR115890的最佳研究时期,为互作的体内验证时间选择提供了数据支持,为RxLR115890功能研究奠定了理论基础。本研究在生产实践方面为分子检测病害以及实时减药防治辣椒病害技术提供了技术支持,同时在RNA水平确定了RxLR115890的表达趋势,为致病分子遗传机理与侵染时期的功能特性的研究提供了理论基础。
[1] Lamour KH, Stam R, Jupe J,The oomycete broad-host-range pathogen[J]. Moleclar Plant Pathology, 2012,13(4):329-337
[2] 蒋玥.辣椒疫霉中3个RxLR效应子的功能研究[C]//中国植物病理学会.中国植物病理学会2017年学术年会论文 集,2017:1
[3] Wang Y, Bouwmeester K, Van de Mortel JE,. A novelpathosystem: differential interactions withreveal a role for camalexin,indole glucosinolates and salicylic acid in defence[J]. Plant Cell and Environment, 2013,36(6):1192-1203
[4] Birch PR, Boevink PC, Gilroy EM,.Oomycete RxLR effectors: delivery, functional redundancy and durable disease resistance[J]. Current Opinion in Plant Biology, 2008,11(4):373-379
[5] Shen DY, Li QL, Sun P,. Intrinsic disorder is a common structural characteristic of RxLR effectors inOomycetepathogens[J]. Fungal Biology, 2017,121(11):911-919
[6] Kamoun S. A catalogue of the effector secretome of plant pathogenic Oomycetes[J], 2005,44(1):41-60
[7] Ginzinger DG. Gene quantification using real-time quantitative PCR. An emerging technology hits the mainstream[J]. Experimental Hematology, 2002,30(6):503-512
[8] Schmittgen TD, Zakrajsek BA, Mills AG,. Quantitative reverse transcription-polymerase chain reaction to study mRNA decay: comparison of endpoint and real-time methods[J]. Analytical Biochemistry, 2000,285:194-204
[9] 付春华,陈孝平,余龙江.实时荧光定量PCR的应用和进展[J].激光生物学报,2005,14(6):466-471
[10] Whelan JA, Russell NB, Whelan MA. A method for the absolute quantification of cDNA using real-time PCR[J]. Journal of Immunological Methods, 2003,278(1-2):261-269
[11] 张慧琴,谢鸣,肖金平,等.猕猴桃实时荧光定量PCR分析中内参基因的筛选[J].浙江农业学报,2015,27(4):567-573
[12] 李毛毛,赵伟,汪涛,等.以1基因序列为靶标的辣椒疫病菌快速分子检测[J].植物病理学报,2014,44(5):546-551
[13] Liu T, Jiao BB, Song SY,. Detection ofby PCR and real-time PCR[J]. Acta Phytopathologica Sinica, 2016,46(6):730-73
[14] Roberts CA, Dietzgen RG, Heelan LA,. Real-time RT-PCR fluorescent detection oftomato spotted wilt virus[J]. Journal of Virological Methods, 2000,88(1):1-8
Differential Expression ofEffector RxLR115890 at Different Stages of Infection
ZHANG Li, WANG Li-ying, LIANG Tao, DING Peng, ZHU Tong-tong, ZHANG Xiu-guo, LI Zhuang*
271018,
can secret more than 370 RxLR effectors, and the characteristic of most effectors are unknown. In order to conduct deep functional studies on the RxLR effectors of, the specific primers forand RxLR115890, were designed using the DNA of thestrain SD33 as a template. Real-time fluorescent quantitative PCR was used to detect the expression level of RxLR115890 under the zoospores infection condition ofin different stages. The results showed that the expression level of RxLR115890 was significantly up-regulated at the early stage of infection, and the length of expression was decreased rapidly along with the infestation time, and slightly increased again at 12 hours. It was concluded that RxLR115890 has a crucial role in the early infection of. Furthermore, it established the foundation for the following research of RxLR115890.
; RxLR115890; real-time quantitative PCR; expression
S436.418.1+2
A
1000-2324(2018)03-0388-05
2017-11-12
2018-02-20
国家大宗蔬菜产业技术体系(CARS-25-03B)
张丽(1991-),女,在读硕士研究生,研究方向:植物病原卵菌分子遗传学. E-mail:1300194196@qq.com
Author for correspondence. E-mail:liz552@126.com

