植物microRNA响应非生物胁迫研究进展
吴美婷,杨晓玉,2,罗淋淋,莫蓓莘,刘 琳
(1. 深圳大学生命与海洋科学学院/广东省植物表观遗传学重点实验室,广东 深圳 518060;2. 深圳大学光电工程学院/光电子器件与系统(教育部/广东省)重点实验室,广东 深圳 518060)
microRNA (miRNA)是一类长度约为20~24 nt的非编码小RNA (small non-coding RNA),广泛分布于各类动植物中,在动植物基因表达的调控中发挥关键作用。成熟miRNA是由RNA聚合酶Ⅱ(Pol-Ⅱ)转录产生初级转录本(primary-miRNA,pri-miRNA)、经过核糖核酸酶DCL1 (DICER-LIKE 1)加工后形成的miRNA/miRNA*双链聚合体而来,并且该过程可受一系列转录因子的调控[1]。成熟miRNA进一步与Argonaute (AGO)蛋白等结合形成RISC复合体(RNA-induced silencing complex),通过直接切割靶基因mRNA或抑制靶基因翻译,以及通过切割来源于PHAS位点的转录本产生的大量phasiRNA而间接作用于靶基因mRNA,实现对靶基因表达的抑制,进而调控动植物的生长发育进程以及逆境响应[2-3]。
1993年,研究人员从秀丽隐杆线虫(Caenorhabditis elegans)中发现了第一个miRNAlin-4,它是线虫发育早期必需的调控因子。随后,人们陆续在其他物种中发现了数以千计的miRNA。其中,在模式植物拟南芥(Arabidopsis thaliana)基因组中发现了325个miRNA基因,在重要的农作物水稻(Oryza sativa)、玉米(Zea mays)以及园艺作物番茄(Solanum lycopersicum)中则分别发现了592、172、77个miRNA基因[4]。这些在植物中报道的miRNA多数具有高度的保守性,但同时呈现出一定的物种间差异性以及时空表达特异性,在植物根、茎、叶、花器官和果实的生长发育及生物和非生物逆境响应中发挥着重要的调控作用。本文综述了近年来植物miRNA的生物学特性及其参与非生物胁迫响应调控方面的研究进展,并探讨了今后该领域研究的主要发展方向。
1 miRNA的生物合成、降解及作用方式
1.1 miRNA的生物合成
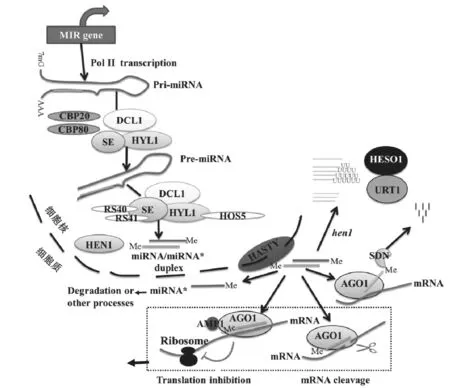
图1 miRNA的生物合成、降解及作用机制
植物miRNA的生物合成是一个精确而复杂的过程(图1)。经典的miRNA生物合成是以Pol-Ⅱ作用下miRNA基因转录形成primiRNA开始,随后pri-miRNA 折叠成一个特定的二级茎环(stem-loop)发夹结构,该发夹结构可被具有核糖核酸酶活性的DCL1家族成员等形成的蛋白切割复合体(dicing body)识别并裂解形成70~350 nt的茎环状前体(precusor miRNA,pre-miRNA),并在HYL1 (Hyponastic Leaves1)和SE (Serrate)的作用下被进一步加工成miRNA/miRNA*复合体,该二聚体随后经HEN1 (Hua Enhancer1)甲基转移酶甲基化修饰并在HST (HASTY)蛋白作用下出核,成熟miRNA与AGO蛋白可结合形成RISC复合体调控靶基因的表达[3-6]。进一步研究发现,CBP20 (Cap-binding Protein20)和CBP80 (Capbinding Protein80)在miRNA合成过程中发挥着与SE和HYL1类似的功能,同时剪接因子RS40和RS41以及RNA结合蛋白HOS5也直接参与miRNA的合成,并且RNA结合蛋白SE和HYL1与DCL之间的互作是调控pri-miRNA加工的重要机制[3,7-8]。
1.2 miRNA的降解
成熟miRNA的稳定性对于其功能的正常发挥具有重要意义。植物在长期进化过程中形成了多种机制以维持体内miRNA水平的稳定。HEN1介导的miRNA 3′末端核糖2′-O-甲基化修饰是维持成熟miRNA稳定性的重要机制之一。HEN1是一个Mg2+依赖型的甲基转移酶,可与DCL1/HYL1/miRNA复合物结合,将甲基从辅因子S-腺苷-L-甲硫氨酸转移到双链miRNA分子3′末端核苷酸的2′-OH基团上,避免其尿苷酸化和降解。SDN (SMALL RNA DEGRADING NUCLEASE)蛋白具有3′→5′核酸外切酶的活性,可介导2′-O-甲基化miRNA由3′→5′的降解,限制miRNA在拟南芥中的积累;SDN蛋白的失活可导致miRNA丰度增加和植物发育异常,离体实验表明,AGO10结合的miR165/166对SDN1的作用敏感,AGO10可通过促进SDN1和SDN2介导的miR165/166的降解来减少miR165/166在体内积累[3]。核苷酸转移酶HESO1 (Hen1 Suppressor1)和URT1 (UTP:RNA Uridylyltransferase1)介导的miRNA的尿苷化降解也是植物体内避免成熟miRNA过量积累的重要机制,HESO1和URT1通过参与miRNA 3′端的加尾影响miRNA的降解和活性;HESO1和URT1均可向未被甲基化修饰miRNA的3′端添加寡聚尿苷酸尾使其降解,但二者对miRNA 3′端核苷酸具有不同的偏好,HESO1优先催化3′端以U结尾的miRNA加尾,而URT1则优先催化3′端以A结尾的miRNA 加尾[8]。
1.3 miRNA的作用方式
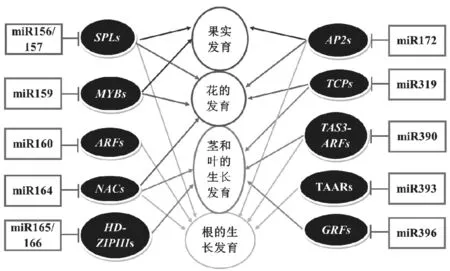
图2 miRNA参与植物生长发育的调控
miRNA可通过剪切或者翻译抑制的方式对靶基因的表达进行调控,进而影响植物的生长发育过程,包括根的形成、茎叶的发育、花器官的形成、果实的发育等(图2)。miRNA可能调控一类靶基因家族的多个靶基因成员,同一类靶基因也可能参与植物的多种生长发育调控过程。靶基因mRNA上与miRNA互补的区域通常被称作miRNA响应元件(miRNA response element,MRE),植物中的MRE大多分布在靶基因的编码区以及5′和3′非翻译区(untranslated region,UTR)。当miRNA与靶基因mRNA上的MRE完全互补或几乎完全互补时,RISC复合体中的AGO可使靶基因的上MRE与miRNA 序列配对区域第10~11位核苷酸之间的磷酸二酯键发生裂解,裂解产物随后进一步被核酸外切酶降解。miRNA介导的转录产物裂解属于转录后水平的调节,是植物中miRNA调控靶基因表达的主要途径。此外,当miRNA与靶基因的MRE序列不完全互补时,它可通过与靶基因MRE的不完全互补配对进而阻抑靶基因mRNA的翻译过程,该途径对mRNA的稳定性无影响,属于翻译水平的基因调节,可由靶基因的mRNA与蛋白丰度的不一致所反映,该过程主要发生在植物细胞的内质网结构,需要AMP1 (Altered Meristem Program1)蛋白参与介导实现[9]。
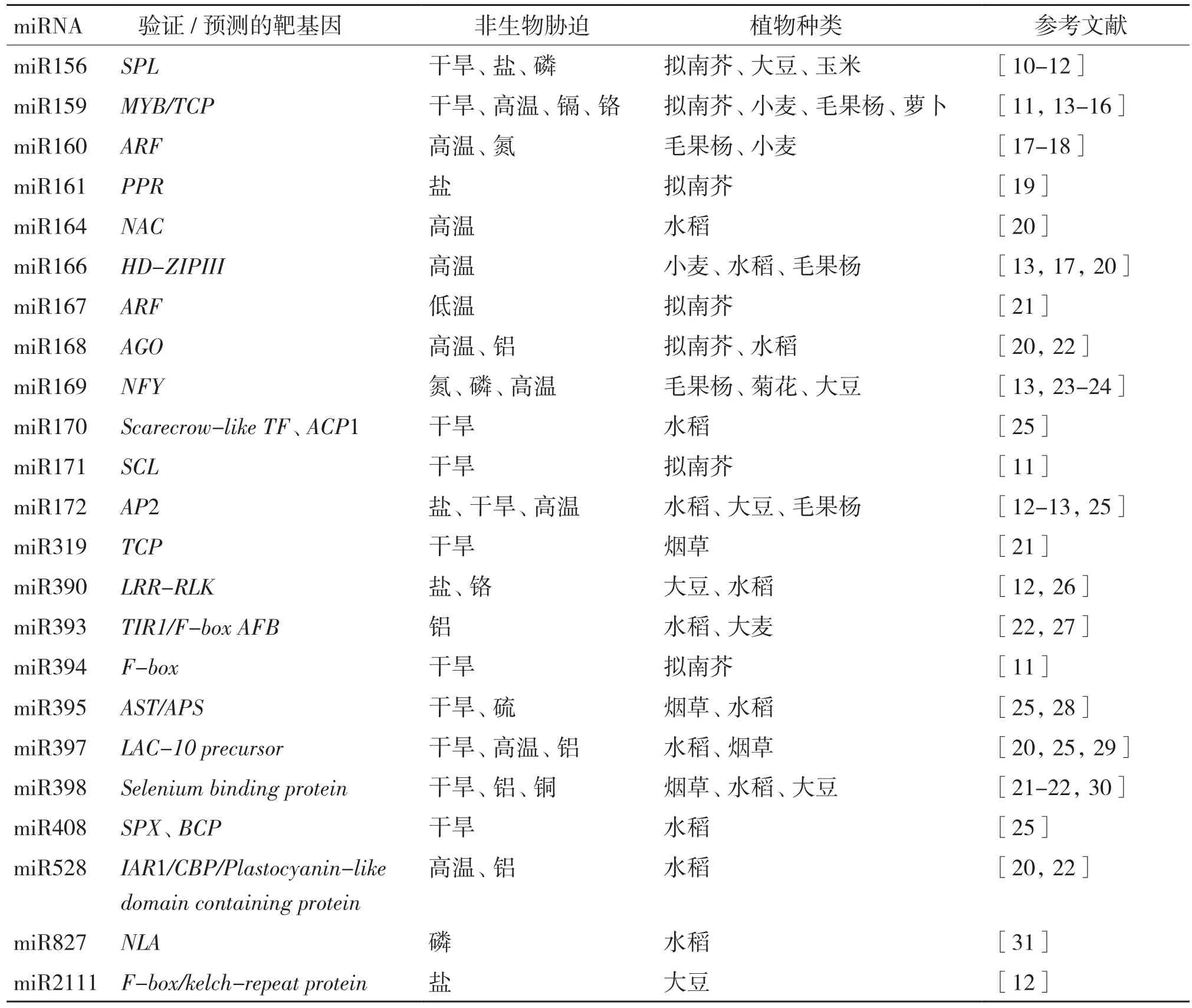
表1 miRNA对植物非生物胁迫的响应
2 miRNA参与植物的非生物胁迫应答调控
温度、光照、水分和矿质元素等是植物生长发育所必需的环境因子。由于外部环境因子的多变性,植物常常会面临一种或多种不利环境因子的胁迫,影响正常的生长发育过程。环境胁迫分为生物和非生物胁迫,其中非生物胁迫主要是指干旱胁迫、盐胁迫、高低温胁迫、养分胁迫以及重金属胁迫等。在长期的进化过程中,植物形成了一系列响应各种非生物胁迫的机制,其中miRNA介导的非生物胁迫响应网络是植物应答各种非生物胁迫的重要机制之一。表1总结了近年报道的参与植物非生物胁迫响应的主要miRNA。非生物胁迫下,植物可通过调节某些miRNA的表达或者产生一些新的miRNA来调节自身对胁迫的耐受性,以便在逆境下得以生存。与动物相比,尽管植物中miRNA调控的靶基因在全部基因中所占比重较低,但由于这些靶基因大多为转录因子,因此miRNA参与的植物逆境响应机制更为复杂。
2.1 干旱胁迫
干旱是世界性的生态危机,也是制约农业生产的主要胁迫之一,阐明植物的耐旱机制、培育耐旱品种、提高水资源的利用率是今后农业科研中亟需解决的问题。在拟南芥中,miR156、miR159、miR160、miR165、miR169、miR171、miR319、miR394和miR395等均可响应干旱胁迫,且干旱胁迫程度不同,miRNA的响应趋势亦存在差异[11]。干旱胁迫下,胁迫敏感水稻的旗叶中 miR159f、miR397、miR398b、miR408-3p、miR528-5p、amiR1871和 miR2878-5p的表达量显著下调,而胁迫钝感水稻的上述7类miRNA的表达量显著上调,表明这些miRNA可能在水稻耐旱性的调控中发挥着至关重要的作用[32]。植物的miRNA对干旱胁迫的响应可通过调控ABA (Abscisic Acid)依赖型靶基因的表达来实现[18]。植物体内部分miRNA基因如拟南芥miR167和miR393等的启动子区域含有ABA信号途径的响应元件(ABA-response elements,ABREs),可直接响应干旱胁迫下ABA信号途径的变化,进而影响下游靶基因如生长素受体基因TIR1/AFB2 (Transport Inhibitor Response/Auxin Signaling F-Box2)和生长素响应因子ARF8 (auxin response factor8)等的表达,调控植物的生理生化过程及生长发育进程来适应外部环境中的水分供应不足[33]。ABA亦可通过miR159介导的转录因子如MYB101和MYB33的降解来调控植物对干旱胁迫的适应[33]。miRNA介导的ABA非依赖型靶基因表达的调控也是植物干旱胁迫响应的重要机制。干旱胁胁迫下,植物体可产生大量的乙烯,继而激活乙烯信号通路蛋白基因EIN2 (Ethylene Insensitive2),抑制miR164的表达并促进其下游靶基因NAC1 (Nucleus Accumbens-Associated1)和ORE1 (Oresara1)等的表达,加速叶片衰老,降低植株的蒸腾作用,提高植物的保水及耐旱性[33]。此外,miR408还可通过调控质蓝素等铜结合蛋白基因的表达,进而引起DREB(Dehydration Responsive Element Binding)和其他干旱响应基因的差异表达,提高植物的耐旱性[32]。
综上,多种miRNA可参与植物对干旱胁迫响应的调控,进而影响其耐旱性,然而与目前所鉴定出的大量响应干旱胁迫的miRNA相比,进行功能验证的miRNA数量仍相对较少,对其进行深入研究将有助于我们更好地理解干旱胁迫下miRNA参与响应的具体分子机制。
2.2 盐胁迫
植物体内多个miRNA介导的调控途径均可响应盐胁迫。盐胁迫下拟南芥中miR156、miR158、miR159、miR161、miR165、miR167、miR168、miR169、miR171、miR173、miR319、miR393、miR394、miR396和 miR397的表达上调,而miR398的表达则显著降低[21]。Sun等[12]研究了大豆根尖分生组织中miRNA对盐胁迫的响应,发现miR156g、miR156j、miR172f、miR390e、miR399a、miR1511、miR2111b、miR2111c和miR2111f参与了大豆根系耐盐性的调控。水稻miRNA对盐胁迫的响应具有明显的品种间差异,在抗盐水稻品种中miR156j、miR390和miR5817等的表达受到显著抑制,而miR168a和miR535-5p等的表达则显著升高;然而在盐敏感品种中上述miRNA的表达则呈现截然相反的趋势[34]。盐胁迫下桑树(Morus alba)有12个miRNA的表达与正常生长条件下相比具有显著差异,其中表达量显著上升的有novel-19*、novel-68、miR398a和 miR408,而 novel-6ae、novel-50、novel-65、miR394*、miR395、miR395*、miR827和miR2111的表达则显著下降[35]。除了转录水平上的响应,miRNA转录后的加工过程亦可对盐胁迫发生响应,从而影响成熟miRNA在植物体内的积累。研究表明,盐胁迫下尽管成熟miR161和miR173的丰度显著上升,但是其初级转录本的水平却呈现下调的趋势[36],这种不一致性可能是由盐胁迫下AGO1对两个miRNA在胞质及核内的差异调控所致,首先在胞质内AGO1可与miRNA形成RISC复合体,提高miRNA的稳定性,而在细胞核内,AGO1则可结合于基因组中miRNA基因茎环结构的编码区域,抑制miRNA基因的转录,导致miRNA初级转录本丰度的下降[37]。此外,miRNA还可通过影响生长素信号途径参与植物对盐胁迫响应的调控。研究发现,盐胁迫可诱导拟南芥miR393的表达,进而抑制TIR1和AFB2的表达,激发体内的盐胁迫响应途径,提高拟南芥的耐盐性,这与拟南芥tir1/afb2 双突变体的耐盐性显著提高的研究结果一致[19]。
尽管目前已鉴定出多种植物的大量miRNA均可响应盐胁迫,但除少量miRNA调控机制的研究较为透彻以外,多数miRNA参与介导的盐胁迫响应调控机制仍不清楚,有必要在今后工作中进一步研究。
2.3 高温与低温胁迫
由于地理条件的差异以及季节的变化,植物在生长发育过程中常常面临各种极端的温度条件,这对植物的生长发育和产量形成极为不利。Li等[38]利用高通量测序技术研究了褪黑素缓解冷胁迫对西瓜(Citrullus lanatus)伤害过程中miRNA的变化,发现有50个miRNA的表达响应褪黑素处理呈显著上调或下调趋势,其中部分下调miRNA的靶基因可参与逆境信号转导或者对植物具有保护和解毒功能,mRNA-seq结果显示这些靶基因在褪黑素处理下表达量均显著提高,表明miRNA介导的调控网络可能参与了褪黑素对西瓜耐寒性的调控。水稻的miRNA可通过CBF(C-repeat binding transcription factor)依赖的途径来调节其耐寒性,其中miR319的表达下调可诱导其靶基因PCF5 (Proliferating Cell Factor5)、PCF6、PCF8和TCP21的表达,继而激活冷应激基因DREB1A/1B/1C和DREB2A,增加渗透调节物质的含量,增强水稻的耐寒性;而miR394和miR397则是水稻耐寒性的正调控因子[20]。
miRNA可参与植物对高温胁迫的响应,但表现出明显的种间差异。例如在高温胁迫下小麦(Triticum aestivum)的miR160、miR166和 miR167表达量显著上升[17],而毛白杨(Populus tomentosa) miR160的表达则显著下降[13]。Liu 等[17]检测了不同品种水稻 miRNA对高温胁迫的响应,发现miR159a.1、miR159b和miR528-3p的表达在高温耐受型品种中受到抑制,但在敏感品种中被诱导;然而miR396e-5p和miR396f-5p的表达在高温耐受型品种中显著上调,但在高温敏感品种中表达则显著下调;此外,miR164d、miR166i-3p、miR168a-3p和miR397b在高温胁迫处理后,无论是耐受型还是敏感型品种其表达量均呈显著降低的趋势。与野生型相比,过表达小麦miR159的转基因水稻对高温处理更敏感[14],表明高温处理小麦中miR159的下调可能参与高温响应相关的信号通路,从而提高了小麦的耐热性。miR173-TAS1-HTT(heat-induced TAS1target)-HSF(heat stress transcription factors)和miR398-CSD(Copper/Zinc Superoxide Dismutase1) /CCS(Copper Chaperone For Sod1)-HSF途径是目前研究较为清楚的植物参与热应激反应的重要途径。其中,miR173-TAS1可在热胁迫下被抑制,继而其下游热胁迫响应基因HTT1和HTT2高度表达,促进HSF基因的表达及积累,提高植物的耐热性;不同于miR173,miR398是通过HSP (heat shock protein)的积累来感应热胁迫,进而调节其下游靶基因CSD1、CSD2和CCS的表达,影响植物体内ROS (Roactive Oxygen Species)的积累和耐热性[39]。
尽管越来越多的证据表明miRNA在植物响应极端温度胁迫时发挥着重要的调控作用,但目前对其具体的调控机制仍有许多不明之处,需要在今后研究中逐步解析,并应用于农作物的遗传改良中。
2.4 养分胁迫
矿物元素如氮、磷和硫等是植物生长、发育和产量形成所必需的营养元素。Ren等[18]利用小RNA测序分析了低氮胁迫下毛果杨(Populus trichocarpa)中miRNA表达的变化,鉴定出7个保守miRNA家族(miR159a/b、miR160e-3p、miR166a-m、miR169a/b-5p/c、miR172a/b-3p/c/f、miR396c/d/e-5p和 miR475a-3p/b-3p)和 1个毛果杨特有miRNA (miR6427-3p)的表达显著降低,而3个miRNA家族(miR395b-k、miR396a/b和miR396e-3p)的表达则显著上升,表明miRNA在植物氮响应中发挥着重要的调控作用。与正常供氮条件下的植株相比,低氮胁迫处理的菊花(Chrysanthemum morifolium)根系中有28个miRNA上调,53个下调;而在叶片中则有40和61个miRNA 分别呈现上调和下调的趋势,其中低氮胁迫下miR169a的下调可促进NFYA(Nuclear Transcription Factor-Y Alpha) 基因的表达,以调节氮的转运,促进菊花对低氮环境的适应[24],这与拟南芥中的研究结果一致[40],暗示miR169a-NFYA参与的低氮适应机制在高等植物中可能具有一定的保守性。miRNA对植物氮信号途径成员的调控可能是其响应氮胁迫的重要机制之一。在氮信号途径中,生长素受体AFB3受到氮信号和miR393的双重调控,其中氮信号表现为正调控,而miR393则负调控AFB3的表达,当氮元素供应异常时,AFB的表达呈现为氮信号及miR393共调控的结果,随后经生长素信号途径中的Aux/IAA以及ARF等的传递,最终影响植物的NAC4和OBP4基因表达,调控植物对氮胁迫的适应性[41]。
无机态磷是一种十分重要的矿质元素,是植物能量供给、遗传物质构成所必须的,缺磷可导致植物根系形态建成的异常,影响植物的正常生长发育[54]。植物的miR399是最早发现的与体内磷代谢相关的miRNA,可靶向磷转运蛋白和泛素连接酶基因,在维持磷的平衡上起着重要作用。低磷胁迫下玉米幼苗根系中12个miRNA的表达量发生显著变化,其中2个属于保守的miRNA家族(miR156和miR399b),其余10个为禾本科特有的miRNA,其中miR399b和玉米特有的miR3具有共同的靶基因磷转运蛋白基因PT1 (Phosphate Transporter1)和PT2[10],暗示miR399b和miR3可能直接参与玉米磷酸盐代谢调节。水稻miR399在低磷胁迫下表达量下调,从而抑制LTN1 (Leaf Tip Necrosis1)的表达,激活多种营养吸收相关基因如PTs(phosphate transporters)和磷饥饿诱导基因PSIGs(phosphate starvation-inducible genes)的表达,提高水稻对低磷胁迫的耐受性[42]。缺磷胁迫下,拟南芥的miR399表达上调并促进编码泛素E2结合酶的PHO2 (PHOSPHATE2)mRNA的切割;时空表达分析结果显示芽中miR399对缺磷胁迫的响应早于根[43],这可能与miR399可作为信号分子进行长距离运输有关,但具体的转运机制目前仍不清楚。磷饥饿下大豆根系和叶片中的miR169f、miR399a、miR399b、miR399c和miR399d等25个miRNA受到诱导,且叶中的表达水平显著高于根中;而miR169c和miR169r等11个miRNA的表达则被抑制[23]。miR156-SPL3 (Squamosa-Promoter Binding Protein-Like3)-Pht1.5/PLDZ2(phospholipase DZ2)/miR399f和MYB2-miR399f通路是植物低磷胁迫响应调控机制的重要组成部分。首先,低磷条件下拟南芥PHR1可促进miR156的表达,从而抑制其下游靶基因SPL3的表达,而SPL3则能通过结合启动子中的GATC元件对PLDZ2、Pht1.5和miR399f进行调控,调节拟南芥的低磷耐受性[44],此外,拟南芥中转录因子MYB2和miR399f可在相同组织中表达,MYB2可直接结合到miR399f 启动子中的MYB结合位点并正向调节miR399f的表达,磷饥饿处理可诱导MYB2的表达,进而促进miR399f的表达以维持体内磷代谢的稳定;过表达MYB2可导致拟南芥转基因植株的根系形态建成异常[45]。Lin 等[31]通过 Northern blot和原位杂交实验分析了低磷胁迫下水稻miR827的表达,发现磷饥饿处理可显著提高miR827在水稻叶肉、表皮和根中的表达,同时其靶基因SPX(SYG1/PHO8/XPR1)-MFS1 (Major Facility Superfamily1)的表达显著减少;而其靶基因SPX-MFS2 mRNA的积累在磷饥饿下则显著增强,反映了水稻miR827与其两个靶基因参与磷代谢调节的复杂性。
植物可吸收环境中的无机硫元素并进一步同化为有机态硫,并以甲硫氨酸和半胱氨酸的形式参与一系列的生物及化学过程,因此在全球硫循环中发挥着极为重要的桥梁作用。研究发现拟南芥中miR156、miR160、miR164、miR167、miR168、miR394和 miR395的表达在低硫胁迫下均发生了变化[46]。低硫环境可通过促进拟南芥硫同化途径关键转录因子SLIM1(Sulfur Limitation1)的表达,促进根和叶中的miR395的表达,与此同时,APS1 (ATP Sulfurylse1)、APS4和芽中SULTR2.1 (Sulfate Transporter2.1)的表达均发生了下调,而APS3和根系中SULTR2.1的表达却呈现明显的上调趋势,组织特异性表达分析结果显示,miR395主要在韧皮部伴胞中表达,而SULTR2.1主要在木质部的薄壁细胞中表达[46],这种表达的空间异位可能有利于硫元素通过木质部从根系向芽中的转运。Yuan等[28]克隆了一个来自水稻的miR395基因并研究了其对植物营养胁迫的响应,结果表明硫缺乏可诱导水稻miR395的表达及两个靶基因表达的下调;过表达水稻miR395h的转基因烟草中,硫酸转运蛋白基因SULTR2的表达受到抑制,打破了硫酸盐代谢的平衡,并对不同时期叶片中硫酸盐的分配产生了影响。
随着研究的逐步深入,越来越多营养胁迫响应相关miRNA不断被发现,由其介导的响应调控机制也开始逐步被解析,这为作物营养特性的遗传改良工作提供了更多的思路,并可促进减肥增效工作的开展以及绿色生态农业的发展。
2.5 金属离子胁迫
miRNA在植物响应重金属胁迫中发挥着重要作用。镉毒害严重影响植物正常的生长发育,危害农业生产的可持续发展。Qiu等[16]研究了镉胁迫下小麦miRNA表达的变化,发现根系和叶片中miR159、miR408以及根系中miR398与其对应的靶基因MYB3、CLP(Cardiac Lineage Protein)和CSD(N-Chlorosulfonyl Dicyclohexylamine)的表达水平呈显著负相关,表明miRNA可能参与小麦对镉胁迫响应的调控。镉胁迫下水稻成熟miR390的丰度显著降低,而其靶基因SRK(Serine/Threonine-Protein Kinase)的表达则明显升高;与野生型相比,过表达miR390的转基因水稻SRK的表达被显著抑制,对镉胁迫的耐受性降低[26],暗示miR390可能是水稻耐镉性的负调控因子之一。与野生型油菜(Brassica napus)相比,过表达miR395可抑制镉由根系向到芽的转运,同时金属耐受型基因如PCS1 (Phytochelatin Synthases1)、HO1(Heme Oxygenase1)和SULTR1.1的表达上调,显著提高了对镉胁迫的耐受性,从而使产量增加[47]。
miRNA在植物对铝胁迫的响应中起着关键的调控作用。Lima等[22]检测了铝胁迫下粳稻和籼稻根系miRNA表达量的变化,鉴定出粳稻根中有19个miRNA响应铝胁迫,而在籼稻根中仅有8个,其中miR393b、miR395a、miR398a、miR398b和miR408在粳籼稻中均表现为下调,miR168a、miR399和miR528均为上调,暗示miRNA介导的铝胁迫响应调控机制在水稻中具有一定的保守性。Burklew等[29]研究发现烟草中miR395、miR397、miR398和miR399的表达在铝胁迫下显著增加;Zeng等[48]以铝胁迫处理的大豆幼苗根系为试材构建了小RNA和降解组文库并利用高通量测序技术进行了分析,鉴定出30个响应铝胁迫的miRNA及其下游调控的靶基因68个。植物的miR393-TIR1/AFB途径是铝毒害下调控根系生长的重要机制之一。首先,铝胁迫可导致大麦中miR393的表达下调,继而提高了其靶基因TIR1/AFB的表达,促进了根尖中的生长素信号传导,抑制根的伸长;其次,铝胁迫也可能促进局部生长素的生物合成或极性运输,有助于提高根尖对生长素变化的响应以及胁迫环境的适应[27]。
铜元素既是植物的必需营养元素,也是一类重要的重金属污染物。菜豆(Phaseolus vulgaris)的miR398b和靶基因CSD1和Nod19(Nodulation19) 在根、根瘤及叶片中表达,并可响应铜亏缺与毒害两种逆境,表明miR398b对维持菜豆体内铜元素的稳态具有重要的调控作用;过表达miR398的转基因菜豆和烟草中CSD1和Nod19的表达受到抑制,铜毒害等胁迫条件下ROS大量产生,植物抗性降低[30]。然而,目前关于miR398其他家族成员在响应铜胁迫中的功能尚不清楚,miR398在其他植物中是否参与对铜胁迫的响应还有待验证。Liu等[15]利用高通量测序技术分析了铜胁迫下萝卜中miRNA的表达变化,发现与对照植株相比,有54个已知和16个新型miRNA在铜胁迫下的表达差异显著,其靶基因多为转录因子如SPLs、MYBs、ERFs(Ethylene-Responsive Transcription Factors)和bZIPs(Basic Leucine Zippers)等,可进一步调控铜转运蛋白HMAs(Heavy Metal ATPases)、YSLs(Yellow Stripe-like1Transporter)和ABCs(ATP-Binding Cassette-Transporters)的表达,影响铜的吸收和体内的平衡。转录因子SPL7在miRNA对铜胁迫的响应中发挥着重要的桥梁作用。首先铜缺乏可促进SPL7的表达,继而通过结合于铜胁迫响应miRNA基因如miR397a、miR398b/c和miR857以及铜转运蛋白基因COPT1 (copper transporter1)、COPT2和COPT6启动子的GATC顺式作用元件上,诱导其表达并抑制miRNA靶基因的转录,提高植物对铜离子的吸收及转运;相反,铜毒害会导致SPL7失活,受SPL7转录激活的miRNA以及铜转运蛋白基因等的表达下调,降低铜的吸收,提高植物对铜毒害的耐受性[49]。此外,锰胁迫可诱导大豆菌根中miR172的表达显著升高,进而抑制其靶基因AP2的表达,暗示miRNA 亦可参与植物对锰胁迫响应的调控[50]。
目前土壤的重金属污染问题呈逐渐加重的趋势,miRNA作为一类重要的调控因子,在植物的重金属胁迫响应中发挥着重要作用,随着其调控机制的逐步阐明、基因操控技术的革新,对miRNA及其调控途径进行操控可能成为改善植物对重金属胁迫耐受性的重要途径,服务于重金属污染土壤的利用。
2.6 其他非生物胁迫
miRNA介导的调控网络也可响应机械伤害、氧化及缺氧等其他形式的非生物胁迫。例如,机械胁迫下毛果杨22个miRNA的表达发生了显著变化,其靶基因多为发育和胁迫相关的基因,这与毛果杨在机械胁迫下的适应性生长具有高度地一致性[48]。在水稻中,miR169、miR397、miR827和miR1425 的表达水平在高H2O2条件下显著升高,而miR172则显著降低[52];过表达OsmiR529的水稻可通过抑制其靶基因OsSPL2/OsSPL14的表达,激活下游活性氧清除酶类如SOD(Superoxide Dismutase)、POD(Peroxidase)等的表达,提高植物对氧化胁迫的耐受性[53],表明miRNA的调控网络与氧化胁迫具有一定的关联性。
3 展望
3.1 植物miRNA的代谢
自20世纪90年代被发现,经过20多年的发展,植物miRNA领域的研究取得了长足进步,大量有关植物miRNA生物合成、降解以及作用机制的研究揭示了miRNA在植物体内主要的代谢途径,对该途径中更多关键因子的克隆和功能鉴定将使得人们对miRNA代谢通路的认识更加完整和清晰。但有关miRNA代谢过程发生的具体亚细胞定位还有待进一步探讨,如AGO1蛋白如何在细胞核、细胞质以及内质网上进行分配和执行功能?蛋白切割复合体如何在细胞核内形成和行使切割功能?miRNA介导的靶基因切割发生在细胞内的什么位置?同时,目前对于植物miRNA在翻译水平调控的靶基因的鉴定及分子机制研究仍相对匮乏,有待进一步深入探讨揭示其具体过程和发生机理。以上这些问题的阐明将有助于我们深入理解miRNA在植物体内的作用机制。
3.2 植物miRNA的生物学功能
目前植物miRNA的研究主要集中在以拟南芥和水稻等为代表的模式植物上,对于其他重要农作物的研究仍相对匮乏,特别是物种特异的miRNA有待被进一步发现。其次,多数miRNA功能的研究仍以过表达或者基因沉默技术为主,缺乏相关的突变体证据,CRISPR/Cas9基因组编辑技术的出现将有效解决这一问题,帮助获得大量定点定向突变体,丰富实验资源。此外,多项研究发现除了成熟的miRNA,miRNA*在特定胁迫中也发生了明显的表达量变化,表明其参与非生物胁迫响应并发挥一定的作用,今后对于miRNA*的研究工作也将很有意义。miRNA在加工过程中会发生碱基替换、缺失或增加等修饰,这些修饰广泛存在于多种作物中并可能参与调控作物的生长发育和逆境应答,研究miRNA的修饰将为理解miRNA的作用机制和功能提供新的思路。
3.3 植物miRNA参与逆境胁迫应答的分子机制
尽管很多研究揭示了miRNA与逆境胁迫的相关性,但关于miRNA对逆境胁迫调控的分子机理尚不清晰,且仍有大量与逆境相关的miRNA及其靶基因尚未被发现,同时一种miRNA可能具有多重作用,在多种非生物胁迫调控途径中发挥作用,因此有必要深入发掘逆境相关 miRNA,揭示其靶基因,解析miRNA介导的逆境胁迫响应调控网络,这些研究可丰富植物逆境生物学的理论知识,并为农作物的遗传改良提供技术支撑,促进农业生产的可持续发展。
参考文献
[1] Fang X,Cui Y,Li Y,et al. Transcription and processing of primary microRNAs are coupled by Elongator complex inArabidopsis[J]. Nature Plants,2015,1:15075.
[2] Li S,Le B,Ma X,et al. Biogenesis of phased siRNAs on membrane-bound polysomes inArabidopsis[J]. Elife,2016,5:e22750.
[3] Yu Y,Jia T,Chen X. The‘how’and‘where’of plant microRNAs[J]. New Phytol,2017,216(4):1002-1017.
[4] 杨静,宋江华. 植物花粉发育miRNAs研究进展[J]. 中国细胞生物学学报,2014(9):1317-1322.
[5] 张世华,上官明珠,盛亮,等. 植物miRNA在非生物逆境下调控机制的研究进展[J]. 安徽农业大学学报,2013,40(4):673-677.
[6] 沈亚欧,林海建,张志明,等. 植物逆境miRNA研究进展[J]. 遗传,2009,31(3):227-235.
[7] Chen T,Cui P,Xiong L. The RNA-binding protein HOS5 and serine/arginine-rich proteins RS40 and RS41 participate in miRNA biogenesis inArabidopsis[J]. Nucleic Acids Res,2015,43(17):8283-8298.
[8] Tu B,Liu L,Xu C,et al. Distinct and cooperative activities of HESO1 and URT1 nucleotidyl transferases in microRNA turnover inArabidopsis[J]. PLoS Genet,2015,11(4):e1005119.
[9] Li S,Liu L,Zhuang X,et al. MicroRNAs inhibit the translation of target mRNAs on the endoplasmic reticulum inArabidopsis[J]. Cell,2013,153(3):562-574.
[10] Zhang Z,Lin H,Shen Y,et al. Cloning and characterization of miRNAs from maize seedling roots under low phosphorus stress[J]. Mol Biol Rep,2012,39(8):8137-8146.
[11] Barciszewska-Pacak M,Milanowska K,Knop K,et al. Arabidopsis microRNA expression regulation in a wide range of abiotic stress responses[J]. Front Plant Sci,2015,6:410.
[12] Sun Z,Wang Y,Mou F,et al. Genome-wide small RNA analysis of soybean reveals auxinresponsive microRNAs that are differentially expressed in response to salt stress in root apex[J]. Front Plant Sci,2016,6:1273.
[13] Chen L,Ren Y,Zhang Y,et al. Genome-wide identification and expression analysis of heatresponsive and novel microRNAs inPopulus tomentosa[J]. Gene,2012,504(2):160-165.
[14] Wang Y,Sun F,Cao H,et al. TamiR159 directed wheat TaGAMYB cleavage and its involvement in anther development and heat response[J]. PLoS ONE,2012,7(11):e48445.
[15] Liu W,Xu L,Wang Y,et al. Transcriptomewide analysis of chromium-stress responsive microRNAs to explore miRNA-mediated regulatory networks in radish(Raphanus sativusL.)[J]. Sci Rep,2015,5:14024.
[16] Qiu Z,Hai B,Guo J,et al. Characterization of wheat miRNAs and their target genes responsive to cadmium stress[J]. Plant Physiol Biochem,2016,101:60-67.
[17] Xin M,Wang Y,Yao Y,et al. Diverse set of microRNAs are responsive to powdery mildew infection and heat stress in wheat(Triticum aestivumL.)[J]. BMC Plant Biol,2010,10:123.
[18] Ren Y,Sun F,Hou J,et al. Differential profiling analysis of miRNAs reveals a regulatory role in low N stress response ofPopulus[J]. Funct Integ Genomics,2015,15(1):93-105.
[19] Liu H,Tian X,Li Y,et al. Microarray-based analysis of stress-regulated microRNAs inArabidopsis thaliana[J]. RNA,2008,14(5):836-843.
[20] Liu Q,Yang T,Yu T,et al. Integrating small RNA sequencing with QTL mapping for identification of miRNAs and their target genes associated with heat tolerance at the flowering stage in rice[J].Front Plant Sci,2017,8:43.
[21] Chen Q,Li M,Zhang Z,et al. Integrated mRNA and microRNA analysis identifies genes and small miRNA molecules associated with transcriptional and post-transcriptional-level responses to both drought stress and re-watering treatment in tobacco[J]. BMC Genomics,2017,18(1):62.
[22] Lima J C,Arenhart R A,Margis-Pinheiro M,et al. Aluminum triggers broad changes in microRNA expression in rice roots[J]. Genet Mol Res,2011,10(4):2817-2832.
[23] Xu F,Liu Q,Chen L,et al. Genome-wide identification of soybean microRNAs and their targets reveals their organ specificity and responses to phosphate starvation[J]. BMC Genomics,2013,14:66.
[24] Song A,Wang L,Chen S,et al. Identification of nitrogen starvation-responsive microRNAs inChrysanthemum nankingense[J]. Plant Physiol Biochem,2015,91:41-48.
[25] Zhou L,Liu Y,Liu Z,et al. Genome-wide identification and analysis of drought-responsive microRNAs inOryza sativa[J]. J Exp Bot,2010,61(15):4157-4168.
[26] Ding Y,Ye Y,Jiang Z,et al. microRNA390 is involved in cadmium tolerance and accumulation in rice[J]. Front Plant Sci,2016,7:235.
[27] Bai B,Bian H,Zeng Z,et al. miR393-mediated auxin signaling regulation is involved in root elongation inhibition in response to toxic aluminum stress in barley[J]. Plant Cell Physiol,2017,58(3):426439.
[28] Yuan N,Yuan S,Li Z,et al. Heterologous expression of a rice miR395 gene inNicotiana tabacumimpairs sulfate homeostasis[J]. Sci Rep,2016,6:28791.
[29] Burklew C E,Ashlock J,Winfrey W B,et al.Effects of aluminum oxide nanoparticles on the growth,development,and microRNA expression of tobacco(Nicotiana tabacum)[J]. PLoS ONE,2012,7(5):e34783.
[30] Naya L,Paul S,ValdëS-LȯPez O,et al.Regulation of copper homeostasis and biotic interactions by microRNA398b in common bean[J]. PLoS ONE,2014,9(1):e84416.
[31] Lin S,Santi C,Jobet E,et al. Complex regulation of two target genes encoding SPX-MFS proteins by rice miR827 in response to phosphate starvation[J]. Plant Cell Physiol,2010,51(12):2119-2131.
[32] Balyan S,Kumar M,Mutum R D,et al. Identification of miRNA-mediated drought responsive multi-tiered regulatory network in drought tolerant rice,Nagina 22[J]. Sci Rep,2017,7:15446.
[33] Ferdous J,Hussain S S,Shi B. Role of microRNAs in plant drought tolerance[J]. Plant Biotechnol J,2015,13(3):293-305.
[34] Goswami K,Tripathi A,Sanan-Mishra N.Comparative miRomics of salt-tolerant and saltsensitive rice[J]. J Integr Bioinform,2017,14(1):1-15.
[35] Wu P,Han S,Zhao W,et al. Genome-wide identification of abiotic stress-regulated and novel microRNAs in mulberry leaf[J]. Plant Physiol Biochem,2015,95:75-82.
[36] Iglesias M J,Terril M C,Windels D,et al.miR393 regulation of auxin signaling and redoxrelated components during acclimation to salinity inArabidopsis[J]. PLoS ONE,2014,9(9):e107678.
[37] Dolata J,Bajczyk M,Bielewicz D,et al. Salt stress reveals a new role for ARGONAUTE 1 in miRNA biogenesis at the transcriptional and post-transcriptional levels[J]. Plant Physiol,2016,172 (1):297-312.
[38] Li H,Dong Y,Chang J,et al. High-throughput microRNA and mRNA sequencing reveals that microRNAs may be involved in melatoninmediated cold tolerance inCitrullus lanatusL.[J]. Front Plant Sci,2016,7:1231.
[39] Zhao J,He Q,Chen G,et al. Regulation of noncoding RNAs in heat stress responses of plants[J]. Front Plant Sci,2016,7:1213.
[40] Zhao M,Ding H,Zhu J,et al. Involvement of miR169 in the nitrogen-starvation responses inArabidopsis[J]. New Phytol,2011,190(4):906-915.
[41] O'Brien J A,Vega A,Bouguyon E,et al. Nitrate transport,sensing,and responses in plants. Mol Plant,2016,9(6):837-856.
[42] Hu B,Wang W,Deng K,et al. microRNA399 is involved in multiple nutrient starvation responses in rice[J]. Front Plant Sci,2015,6:188.
[43] Lin W,Huang T,Leong S,et al. Long-distance call from phosphate:systemic regulation of phosphate starvation responses[J]. J Exp Bot,2013,65(7):1817-1827.
[44] Lei K,Lin Y,Ren J,et al. Modulation of the phosphate-deficient responses by microRNA156 and its targeted Squamosa promoterbinding protein-like3 inArabidopsis[J]. Plant Cell Physiol,2015,57(1):192-203.
[45] Baek D,Park H C,Kim M C,et al. The role ofArabidopsisMYB2 in miR399f mediated phosphate-starvation response[J]. Plant Signal Behav,2013,8(3):e23488.
[46] Kawashima C G,Matthewman C A,Huang S,et al. Interplay of SLIM1 and miR395 in the regulation of sulfate assimilation inArabidopsis[J]. Plant J,2011,66(5):863-876.
[47] Zhang L,Song J,Shu X,et al. miR395 is involved in detoxification of cadmium inBrassica napus[J]. J Hazard Mater,2013,250-251:204-211.
[48] Zeng Q,Yang C,Ma Q,et al. Identification of wild soybean miRNAs and their target genes responsive to aluminum stress[J]. BMC Plant Biol,2012,12:182.
[49] Gielen H,Remans T,Vangronsveld J,et al.Toxicity responses of Cu and Cd:the involvement of miRNAs and the transcription factor SPL7[J].BMC Plant Biol,2016,16(1):145.
[50] ValdëS-LȯPez O,Yang S,Aparicio-Fabre R,et al. MicroRNA expression profile in common bean(Phaseolus vulgaris)under nutrient deficiency stresses and manganese toxicity[J]. New Phytol,2010,187(3):805-818.
[51] Lu S,Sun Y,Shi R,et al. Novel and mechanical stress-responsive microRNAs inPopulus trichocarpathat are absent fromArabidopsis[J].Plant Cell,2005,17(8):2186-2203.
[52] Li T,Li H,Zhang Y,et al. Identification and analysis of seven H2O2-responsive miRNAs and 32 new miRNAs in the seedlings of rice(Oryza sativaL. ssp.indica)[J]. Nucleic Acids Res,39(7):2821-2833.
[53] Yue E,Liu Z,Li C,et al. Overexpression of miR529a confers enhanced resistance to oxidative stress in rice(Oryza sativaL.)[J]. Plant Cell Rep,2017,36(7):1171-1182.
[54] 文晓鹏,杨鵾. 植物miRNA在应答非生物胁迫上的调控作用[J]. 山地农业生物学报,2014,33(6):1-13.

