干旱胁迫对火龙果植株形态及生理指标的影响
齐 钊,闫 臻,徐 敏,曾灿彬,骆 娟,韦双双,阮云泽,汤 华
(海南大学热带农林学院/热带生物资源可持续利用国家重点实验室,海南 海口 570228)
干旱已成为世界性的问题,据报道全球干旱半干旱地区占陆地总面积的48%,是农业生产面临的最为严重的问题[1]。因此干旱是影响作物产量的主要原因之一,在非生物胁迫造成的损失因素中排首位[2]。目前对于干旱胁迫的研究主要集中在干旱胁迫的响应机制,通过测定相关生理生化指标以及观察植物形态结构变化的方法进行,最近几年,在高速发展的基因组学的影响下,对干旱胁迫相关基因以及调控机制的研究更加广泛。大多数植物在短期或轻度土壤缺水下叶片水势下降,引起气孔关闭,限制了CO2摄取及光合作用速率;长期而严重的干旱胁迫可限制植物生长,引起形态结构及生物量分配格局发生变化,甚至会导致植物死亡[3-5]。干旱胁迫下,植物形态和生理生化特征上对干旱的响应主要包括生长发育、形态适应特征、光合作用、氧化酶活性、丙二醛、渗透调节物质及干旱诱导蛋白等。因此植物抗旱性研究,是探讨植物对干旱胁迫的响应机制的研究,能够为植物健康的生长发育提供基础理论,为培育新品种、提高植物抗旱能力和改良植物抗旱调控措施提供理论依据,对促进我国农业和林业的进步具有积极的意义[6-7]。
火龙果(Hylocereus undatus)是一种热带水果,属仙人掌科(Cactaceae)量天尺属(Hylocereus Britton et Rose)植物,果实呈椭圆形或圆形,果肉白色或红色两种[8]。火龙果耐干旱和粗放管理,病虫害少,在环境恶劣的沙漠也能够生存,具有作为绿色食品开发的基础条件,发展前景广阔[9]。但投入农业生产后,为了追求产量和经济效益最大化,研究火龙果最适管理条件显得尤为重要。本试验通过研究干旱胁迫下火龙果植株的形态及生理生化特征变化,探讨火龙果的干旱胁迫应答机制,为制定良好的火龙果田间管理方案及作物抗旱改良提供理论支持。
1 材料与方法
1.1 试验材料
火龙果品种大红最开始是从台湾引进,因其果实果重较大、果型圆润、甜度高等优点被广大农民认可,在海南省大面积种植。试验材料采自海南省万钟实业有限公司,取苗高20~30 cm、长势良好、大小均匀的的台湾大红火龙果植株,移栽到相同大小的花盆中恢复生长2周,每盘栽1株。
1.2 试验方法
试验于海南大学海甸校区内大棚基地进行,大棚内设有水泥平台。干旱胁迫处理试验开始后停止浇水,对照则正常浇水。试验始于2017年3月1日,干旱胁迫后40 d即4月9日开始取样并进行分析,每隔1周取样1次,每次取1株,共取样3次,分别命名为干旱早期(40 d)、干旱中期(47 d)、干旱后期(54 d),每个时期均设置3个生物学重复。
1.3 测定项目及方法
分别测定样品的生理生化指标,包括可溶性蛋白含量(考马斯亮蓝G-250染色法)[10]、可溶性糖含量(蒽酮比色法)[10]、游离脯氨酸含量(茚三酮显色法)[10]、丙二醛含量(硫代巴比妥酸比色法)[10]、超氧化物歧化酶活性(氮蓝四唑光还原法)[10]、过氧化物酶活性(愈创木酚法)[10]、过氧化氢酶活性(紫外吸收法)[11]。每个指标测定3次,取平均值。
试验数据采用SPSS 21.0统计软件进行方差分析,运用Duncan's检验法进行差异显著性比较。
2 结果与分析
2.1 干旱胁迫下火龙果植株形态的变化
植物在干旱状态下,植株生长缓慢,叶质量比降低。火龙果为耐旱植物,在预实验中,火龙果形态在干旱胁迫30 d以内并没有明显变化,抽取样品测定生理生化指标也无明显变化。由图1(封三)可知,在干旱胁迫处理54 d后,火龙果茎和根都出现了明显的变化:主根的长度变短,侧根变少,须根基本消失;茎的颜色变深,表面出现褶皱,从茎横切面看出,茎的厚度明显变薄,茎肉变少。
2.2 干旱胁迫对火龙果茎表面气孔变化的影响
植物气孔一般由一对保卫细胞围成,呈“新月形”,靠近气孔一边的壁较厚,其余部分较薄,在干旱胁迫下植物以关闭气孔的方式减少水分的蒸发[1]。由图2A(封三)可知,取样时间为20:00~22:00,分别取干旱后期火龙果茎及正常浇水火龙果茎进行表皮气孔形态观察(光照、温度等因子为环境中的实际情况),可见干旱后期火龙果茎表皮气孔呈现关闭状态,气孔的关闭会使火龙果的光合作用能力下降,从而减轻胁迫对光合器官的伤害以适应干旱环境,而正常浇水火龙果茎表皮则观察到了开放的气孔(图2B,封三)。
2.3 干旱胁迫对火龙果茎游离脯氨酸和可溶性糖含量的影响
游离脯氨酸和可溶性糖都是植物的渗透调节物质。从图3可以看出,对照组的可溶性糖含量的变化趋势与游离脯氨酸含量的变化相类似,都呈不断升高趋势。火龙果植株遭受干旱胁迫时,脯氨酸含量变化如图3A所示,随着干旱的加深,相较于对照,干旱胁迫处理的脯氨酸含量明显升高,其中干旱40 d和54 d时脯氨酸含量呈极显著升高,干旱47 d时呈显著升高。干旱胁迫下,火龙果茎可溶性糖含量也发生了变化,如图3B所示,相较于对照,干旱胁迫处理的可溶性糖含量随干旱程度的加深而呈升高趋势,在干旱胁迫47 d和54 d时,可溶性糖含量显著升高。

图3 干旱胁迫下火龙果游离脯氨酸含量和可溶性糖含量的变化
2.4 干旱胁迫下火龙果茎可溶性蛋白和MDA含量的变化
可溶性蛋白是植物重要的渗透调节物质和营养物质,其增加和积累可以提高细胞的保水能力,在干旱胁迫中起到保护生物膜的作用。干旱胁迫下火龙果茎可溶性蛋白质含量整体上呈先降低后显著性升高的趋势。如图4A所示,相较于对照,在干旱胁迫40 d时火龙果茎的可溶性蛋白含量呈显著升高,在干旱胁迫47 d时可溶性蛋白含量又有所下降、但仍高于对照,干旱胁迫54 d时,可溶性蛋白含量又显著高于对照。
在干旱胁迫处理的不同时期,MDA的含量也有所不同,整体上呈先降低后升高的趋势,且均高于对照。如图4B所示,各干旱胁迫处理的火龙果茎MDA含量均高于对照,在干旱胁迫47 d时稍有降低,至干旱胁迫54 d时又有所升高,而对照的MDA含量表现出相对稳定的状态。
2.5 干旱胁迫下火龙果茎POD活性的变化
如图5所示,火龙果茎的POD活性随干旱胁迫的加深,从整体上呈其显著升高后又极显著降低的趋势。在干旱胁迫处理47 d时火龙果茎的POD活性与对照相比呈极显著升高,在干旱胁迫处理54 d时则极显著下降,而对照的POD活性相对一致,趋势平缓;POD活性除了干旱胁迫47 d时极显著升高,在干旱胁迫40 d和54 d时均低于对照。
2.6 干旱胁迫下火龙果茎SOD和CAT活性的变化
如图6A所示,随着干旱胁迫的加深,火龙果茎SOD活性均有所下降,从整体上呈持续降低的趋势,且在极显著降低后,降低的程度变缓。干旱胁迫47 d时,火龙果茎SOD活性相较于对照呈极显著下降;在干旱胁迫40 d时SOD活性高于对照,而在干旱胁迫47 d和54 d时均小于对照。SOD活性的降低说明随着干旱胁迫的加深,植株的抗氧化性能力下降,这可能导致植株损伤。
如图6B所示,随着干旱胁迫的加深,火龙果茎的CAT活性相较于对照都有所升高,其整体变化趋势是先升后降。在干旱胁迫47 d时火龙果茎的CAT活性达到最大值,在干旱胁迫54 d时虽有所下降,但其CAT活性仍大于对照,说明植株仍然具有响应干旱胁迫的调节机制,干旱胁迫没有造成永久性伤害。
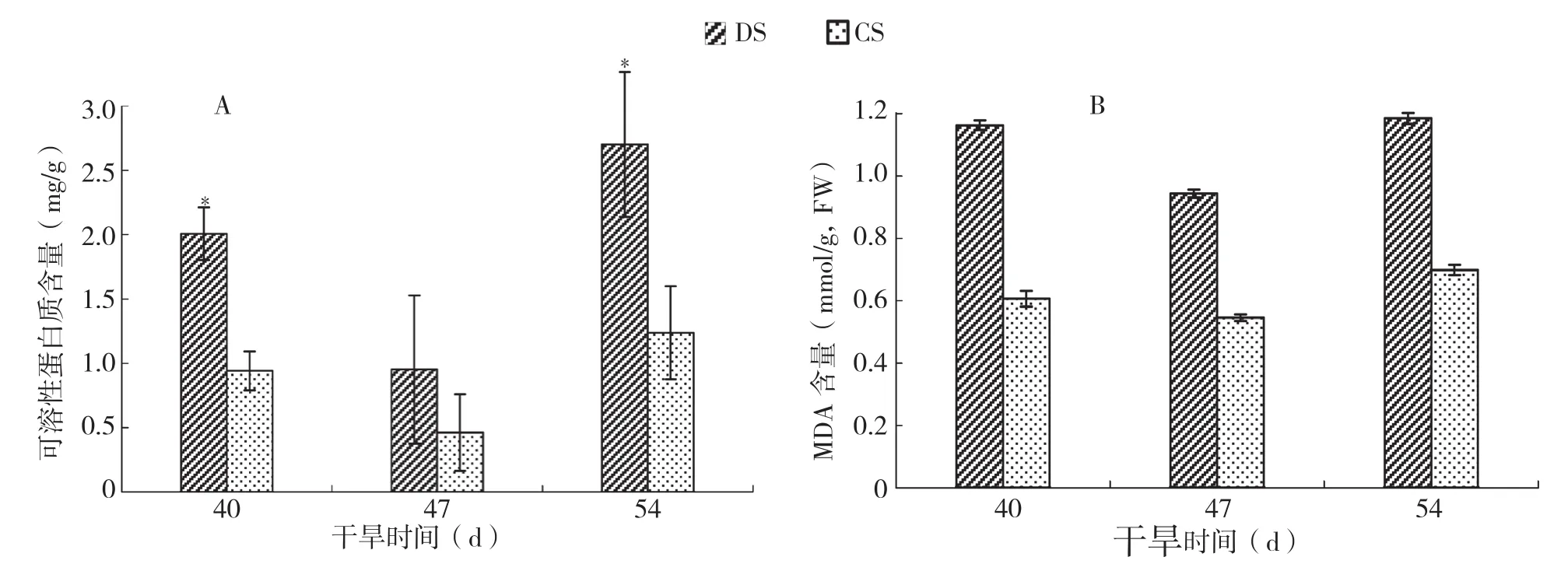
图4 干旱胁迫下火龙果可溶性蛋白质和MDA含量的变化
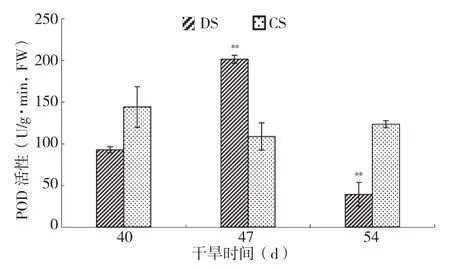
图5 干旱胁迫下火龙果POD活性的变化
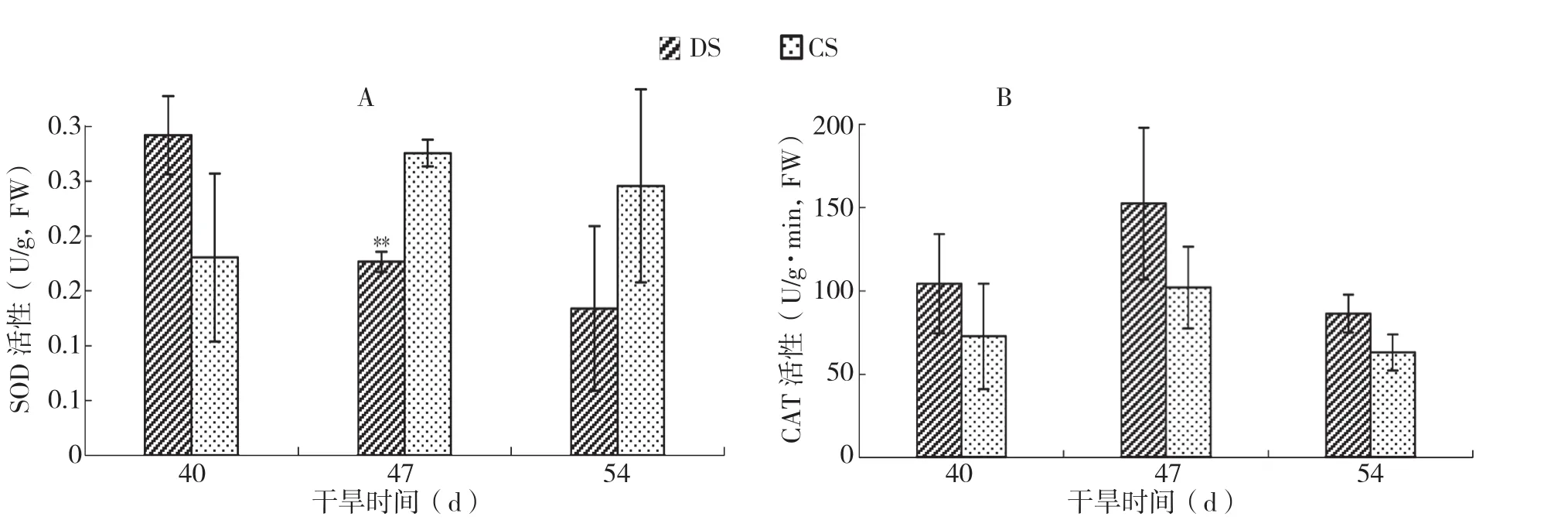
图6 干旱胁迫下火龙果SOD活性和CAT活性的变化
3 结论与讨论
火龙果茎表皮气孔在白天关闭,减少蒸腾作用,夜晚气孔开放,消耗CO2,合成有机物,释放氧气;叶片则退化成了体积最小的针刺状;表皮外还有较厚的角质层,能够限制蒸腾作用;肉质茎中富含胶质的海绵组织,储存水分和营养物质,这些特征表明火龙果具有在干旱条件下生存的潜质。干旱胁迫可通过影响光化学过程来直接影响光合作用,导致气孔的关闭,从而减少与外界的交流,降低植物的生物量,抑制植物的生长发育[12]。本研究结果表明,虽然火龙果在干旱条件下不会立刻死亡,但是干旱胁迫显著影响火龙果的生长。一方面,在干旱后期,火龙果储存的营养大量被消耗,光合作用的积累不能及时补充,导致火龙果茎明显变薄,茎表面出现褶皱;另一方面,干旱胁迫下火龙果茎的渗透调节相关指标以及与消除氧自由基相关的酶活都呈现不同的变化。由此可知,干旱胁迫下火龙果植株的形态和生理生化指标都会发生变化,以适应和帮助植株度过干旱期。
植物对干旱的响应机制是复杂的[13]。植物细胞内游离脯氨酸(Pro)是水溶性最大的氨基酸[14],起着渗透调节以及维持细胞膨压和正常生理功能的作用[15]。可溶性糖是植物重要的能源和碳源,参与植株生命代谢的多个途径。植物细胞内可溶性糖的累积,可增加细胞内渗透势,以此维持植株正常生长所需水分,提高抗逆性[16-17]。因此,可溶性糖和脯氨酸作为重要渗透调节物质,是植物渗透调节能力的重要指示指标[18]。本研究结果表明,在干旱胁迫下,火龙果植株游离脯氨酸含量不断增加,与对照比,在干旱初期和后期都呈极显著升高,这与王丹等[19]和刘三梅等[20]研究结果相符;在干旱胁迫下,与对照相比,火龙果可溶性糖含量一直在升高,且在干旱中期和后期呈显著升高,这与赵超等[21]和尹智宇等[22]研究结果保持一致。本试验结果还表明,火龙果对干旱胁迫具有一定的响应机制,在干旱胁迫下通过提高游离脯氨酸以及可溶性糖的含量来维持植株正常的渗透压,游离脯氨酸和可溶性糖变化规律的相似性也说明在干旱胁迫下两者协同作用。
丙二醛(MDA)是膜脂过氧化最重要的产物之一,植物在逆境下遭受伤害与活性氧积累诱发的膜脂过氧化作用密切相关。本试验火龙果干旱胁迫进程中,MDA含量比对照都有所升高,这与李雪凝等[23]的研究和魏杰等[24]关于高温胁迫中MDA含量变化趋势一致。在干旱胁迫的3个时期中,MDA含量差异不显著,干旱中期还有所下降,说明随着干旱胁迫的加深,火龙果膜系统有一定程度的损伤,但这种损伤并没有一直加深,没有造成不可逆的伤害,且干旱中期是POD和CAT活性达到峰值的时期,极有可能是活性氧(ROS)爆发的时期,而此时MDA含量却有所降低,进一步说明了火龙果植株对干旱胁迫具有良好的调节机制。
相较于对照,火龙果茎的可溶性蛋白含量在干旱初期和后期都有显著升高,在干旱中期有所下降但仍高于对照。在胁迫初期,合成蛋白受阻导致可溶性蛋白含量下降,随着植物体对逆境的机制响应,在干旱条件下,植物体内可能产生更多的蛋白质或者细胞内一些不溶性蛋白转变为可溶性蛋白[25-27]。有报道称,干旱胁迫下的青稞幼苗可溶性蛋白含量随胁迫程度加深呈现出先降后升的趋势[28],这与本研究结果一致;董娜等[29]研究则显示对大豆进行干旱胁迫时,可溶性蛋白含量随干旱程度增加呈降低趋势,与本研究结果有所不同,这可能是由于火龙果和青稞幼苗本身具有一定的抗旱性,而大豆抗旱性较差所致。
逆境胁迫一般都会伴随活性氧自由基爆发[30],活性氧的清除依靠保护酶系统(POD、SOD、CAT)的反应,活性氧的清除能力是衡量植物抗逆性的关键性指标之一。本研究结果表明,随着干旱胁迫的加深,POD和CAT活性都是先升后降,其中POD活性在干旱初期和后期都小于对照,在干旱中期,POD活性极显著升高;POD活性极显著增强的阶段即干旱中期,很有可能是伴随ROS大量产生,POD在干旱胁迫下参与清除H2O2,保护植物不被损伤,响应植物的抗逆境机制。而干旱后期,POD活性又极显著下降,光合系统受损,表现出酶调节的限制性。POD含量先升后降的趋势与邵惠芳等[31]研究结果保持一致。CAT活性在干旱胁迫中期出现峰值,而后有所下降,但CAT活性在干旱胁迫的3个时期均高于对照,说明CAT在干旱胁迫过程中一直发挥着作用,这与尹智宇等[22]的研究结果一致。
在干旱胁迫前期,各处理SOD活性比对照高,而在干旱中期和后期SOD活性则呈下降趋势且低于对照组活性。这与宋学华[32]和蒋明义等[33]研究结果相一致。值得一提的是,SOD活性的变化趋势和POD、CAT活性的变化趋势并不同步,这可能是由于SOD是植物响应胁迫的第一道防线,其先于其他酶开始积累,因此表现出了一定的时差性和不一致性。
植物对胁迫的响应机制是复杂且多变的,本研究通过对火龙果植株进行干旱胁迫处理,分析了干旱胁迫下火龙果植株的形态特征变化,分别测定了可溶性糖、可溶性蛋白、游离脯氨酸、MDA、POD、CAT、SOD等生理生化指标的含量及活性且分析了它们在干旱胁迫中的变化,找出它们在响应干旱胁迫机制中变化的可能原因。火龙果植株具有刺状叶、肉质茎、角质层、内陷气孔等对干旱胁迫具有一定适应能力的结构,能够主动适应一定条件下的胁迫环境,但当干旱胁迫加深时,为了适应更恶劣的干旱条件,火龙果植株通过自身的活性氧消除系统及渗透调节等方式维持细胞代谢平衡。研究表明,短期的干旱对火龙果植株影响不大,长期干旱会对火龙果植株产生不良影响;CAT、POD、SOD这3种酶在火龙果抗干旱胁迫的不同时期中起到关键的调节作用;MDA、游离脯氨酸、可溶性糖和可溶性蛋白含量均可作为胁迫程度的衡量指标。而关于这些指标对干旱胁迫的应答通路,则需要在此基础上作进一步的研究和探讨。
参考文献:
[1] 魏志刚,王玉成. 植物干旱胁迫响应机制[M].北京:科学出版社,2015.
[2] 彭立新,李德全,束怀瑞. 园艺植物水分胁迫生理及耐旱机制研究进展[J]. 西北植物学报,2002,22(5):1275-1281.
[3] Ogbonnaya C I,Nwalozie M C,Roymacauley H,et al. Growth and water relations of Kenaf(Hibiscus cannabinusL.) under water deficit on a sandy soil[J]. Industrial Crops & Products,1998,8(1):65-76.
[4] Wei L,Zhang X,Hou Z,et al. Effects of water stress on photosynthesis and carbon allocation inCunninghamia lanceolataseedlings[J]. Acta Phytoecologica Sinica,2005,29(3):394-402.
[5] Dias P C,Araujo W L,Moraes G A,et al.Morphological and physiological responses of two coffee progenies to soil water availability[J].Journal of Plant Physiology,2007,164(12):1639-1647.
[6] 李燕,薛立,吴敏. 树木抗旱机理研究进展[J]. 生态学杂志,2007,26(11):1857-1866.
[7] 沈少炎,吴玉香,郑郁善. 植物干旱胁迫响应机制研究进展—— 从表型到分子[J]. 生物技术进展,2017,7(3):169-176.
[8] 郑伟,王彬,蔡永强,等. 不同火龙果品种及不同生长调节剂对扦插育苗的影响[J]. 贵州农业科学,2010,38(1):146-148.
[9] 蔡永强,向青云,陈家龙,等. 火龙果的营养成分分析[J]. 经济林研究,2008,26(4):53-56.
[10] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:261-263.
[11] 彭志英,蒋黎. 紫外速率直接法测定过氧化氢酶活性[J]. 华西医学,1995(1):4-7.
[12] 陈彪,李继伟,王小东,等. 外源硒对干旱胁迫下烤烟生长和生理特性的影响[J]. 植物生理学报,2018,54(1):165-172.
[13] Yao X,Chu J,Wang G. Effects of drought stress and selenium supply on growth and physiological characteristics of wheat seedlings[J]. Acta Physiologiae Plantarum,2009,31(5):1031-1036.
[14] 武勇,陈存及,刘宝,等. 干旱胁迫下柚木叶片生理指标的变化[J]. 福建林学院学报,2006,26(2):103-106.
[15] Vanaja M,Maheswari M,Sathish P,et al.Genotypic variability in physiological,biomass and yield response to drought stress in pigeonpea[J]. Physiology & Molecular Biology of Plants,2015,21(4):541-549.
[16] 朱维琴,吴良欢,陶勤南. 干旱逆境对不同品种水稻生长、渗透调节物质含量及保护酶活性的影响[J]. 科技通报,2006,22(2):176-181.
[17] 王蕊,李新国,李绍鹏,等. 干旱胁迫下2种香蕉幼苗叶片和根的主要渗透调节物质的变化[J]. 基因组学与应用生物学,2010 ,29(3):518-522.
[18] 马新,姜继元,董鹏,等. 干旱胁迫对文冠果幼苗的生理反应及生长的影响[J]. 西南农业学报,2017(3):553- 558.
[19] 王丹,龚荣高,荣毅. 干旱胁迫对枇杷生理特性及生长的影响[J]. 西北植物学报,2016,36(7):1399-1407.
[20] 刘三梅,杨清辉,李秀年,等. 不同生育时期干旱胁迫对甘蔗形态指标及生理特性的影响[J]. 南方农业学报,2016,47(8):1273-1278.
[21] 赵超,王海燕,刘美珍,等. 干旱胁迫下木薯茎杆可溶性糖、淀粉及相关酶的代谢规律[J].植物生理学报,2017(5):795-806.
[22] 尹智宇,肖关丽. 干旱胁迫对冬马铃薯苗期生理指标及光合特性的影响[J/OL]. 云南农业大学学报(自然科学):1-6[2018-03-24].https://doi. org/10. 16211/j. issn. 1004-390X(n). 2017. 06. 005.
[23] 李雪凝,董守坤,刘丽君,等. 干旱胁迫对春大豆超氧化物歧化酶活性和丙二醛含量的影响[J]. 中国农学通报,2016,32(15):93-97.
[24] 魏杰,班艳丽,王媛,等. 环境胁迫对西藏拟溞SOD、CAT活性和MDA含量的影响[J]. 生物学杂志,2017(3):42-46.
[25] Junmei Y Q K. Effects of drought stress on induced protein in the different drought resistance alfalfa leaf[J]. Acta Agrestia Sinica,2005,13(3):199-202(in Chinese).
[26] Han J. The responses of rice(Oryza sativaL.)seedlings to the osmotic stress and relation to the osmotic adjustment[J]. Journal of Agricultural University of Hebei,1990,13(1):17-21(in Chinese).
[27] 李德会,邹琦,程炳嵩. 土壤干旱下不同抗旱性小麦品种的渗透调节和渗透调节物质[J]. 植物生理学报,1992,18(1):37-44.
[28] 李洁. 干旱胁迫对青稞幼苗可溶性蛋白的影响[J]. 江苏农业科学,2015,43(12):124-126.
[29] 董娜,李爽,马泽众,等. 水分胁迫对大豆渗透调节物质含量的影响[J]. 新农业,2017(23):4-7.
[30] Mccord J M,Fridovich I. Superoxide dismutase an enzymic function for erythrocuprein(Hemocuprein)[J]. Journal of Biological Chemistry,1969,244(22):6049-6055.
[31] 邵惠芳,陈征,许嘉阳,等. 两种烟草幼苗叶片对不同强度干旱胁迫的生理响应比较[J]. 植物生理学报,2016(12):1861-1871.
[32] 宋学华. 干旱胁迫对4种沙棘SOD和POD活性的影响[J]. 绿色科技,2016(3):38-39.
[33] 蒋明义,杨文英,徐江,等. 渗透胁迫诱导水稻幼苗的氧化伤害[J]. 作物学报,1994(6):733-738.

