五大连池药泉山矿泉微生物多样性及其地质和环境控制特征
张海燕,彭彤彤,温玉娟,高思萌,杨悦锁1,
1.地下水资源与环境教育部重点实验室(吉林大学),长春 130021 2.黑龙江省水文地质工程地质勘察院,哈尔滨 150030 3.区域污染环境生态修复教育部重点实验室(沈阳大学),沈阳 110044
0 引言
五大连池因其具有类型齐全的火山地质遗迹资源、疗效神奇的矿泉水资源和独特的生态系统而被评为联合国教科文组织世界地质公园和世界人与生物圈保护区。五大连池药泉山矿泉水区的南饮泉和北饮泉与俄罗斯高加索矿泉水、法国维希矿泉水并称世界三大冷矿泉[1],因此其资源和环境具有重要的研究价值。
近年来,随着环境地质和水文地质调查研究工作的不断开展,药泉山矿泉的成因和矿泉水的成分及其相关的环境水文地质等已经取得了较为详尽的研究成果。研究[2]表明药泉山矿泉是区域地下水循环形成的原生矿泉水和浅层玄武岩裂隙地下水通过断裂带上升至地表,并以泉的形式溢出而成为局部的小循环。也有研究[3]认为,药泉山矿泉水成因属于复合型,其成分复杂、矿泉水多源性标志明显;这是在多种矿化作用下共同影响发生的异常现象,也与多种围岩矿物的熔蚀富集序列不同有关。近来对药泉山地下水循环特征的研究[4]表明,矿泉水区的潜水主要接受大气降水和西部地下水的补给,地下水主要沿断裂从西南向东径流。但除此之外,针对五大连池药泉山矿泉中微生物组成的相关研究甚少。
目前,国内外对于矿泉水微生物的研究大体可以分为冷泉和热泉两个主要方向。关于冷泉微生物的相关研究,国外研究者以硫化物冷泉泉水为主,着重针对微生物组成、群落多样性以及功能进行调查。Koch等[6-10]认为冷泉原核微生物将泉水中的硫化物作为主要能源物质来维持群落的稳定性。Farnleitner等[11]对阿尔卑斯山中两个喀斯特冷泉泉水中细菌群落结构与水文、季节变化进行了监测,发现其细菌群落组成不受水文和季节性变化影响,并存在喀斯特生态系统专有的土著微生物群落。而热泉是由于火山爆发而形成的独特生态系统,在温度、压力、盐度以及pH值等理化指标方面都有鲜明特征,其包括陆地热泉和海底热泉两种。对于热泉微生物的研究,国际上多集中在宝贵的嗜热微生物资源上。1969年,Brock等[12]从美国黄石公园的热泉中分离出嗜热微生物水生栖热菌,并且从中分离出Taq酶,自此之后高温微生物的耐高温性引起了更多学者的研究兴趣。目前研究[13-14]成果显示,热泉生境微生物在为适应高温环境而进化出特殊的生理机制以及独特的基因,使它存在产生各种高温酶及其代谢产物或新酶及其新代谢物的可能,具有极高的科学研究价值和应用前景。因此,热泉生境微生物资源、生态与功能基因的挖掘已经成为当下研究热点之一[15-16]。而目前主要的研究区域集中在冰岛、美国黄石国家公园、新西兰,以及意大利等地,研究人员在这些地区发现了多种嗜热微生物,并进一步对部分嗜热菌的功能进行了探索[17-18]。
国内的研究者也在不同地区开展了此类研究:王红蕾等[19]选择了长白山热泉群中3个代表性热泉作为研究对象,利用分子生物学手段对长白山热泉生境的原核微生物系统进行了系统发育学研究,且从该生境中筛选并鉴定了两株高温菌的新种;明红[20]以腾冲热泉群为研究对象,通过纯培养分离、基因组学和宏基因组学方法系统地开展了热泉生境嗜热原核微生物资源的分离与培养与耐高温木聚糖酶的筛选研究。
而国内研究者曾军[21]将研究重点放在了低盐、不含硫化氢的新疆沙湾泉。研究结果显示,新疆沙湾冷泉中细菌多样性高,种类繁多,还有众多尚未知其种类的微生物群落;而古菌类群多样性低,不过存在大量高度适应这种低温、贫营养环境的泉古菌类群。薛娟[22]、高小其等[23]通过对乌鲁木齐10号泉微生物群落的监测与调查,发现地球水文化学参数影响细菌群落结构和多样性,微生物群落组成的多样性会随着地壳活动的增加而提高,乌鲁木齐10号泉中存在对地震敏感的细菌类群;古菌群落组成简单,存在着比较丰富的产甲烷古菌,说明该地区具有开发利用微生物资源的潜在价值。同样以乌鲁木齐10号泉泉水为研究对象,吴江超等[24]将研究角度集中在地震断裂带这一特殊地质构造所形成的泉水上,通过对10号泉泉水各项理化指标和其中微生物群落代谢功能多样性的研究,探查泉水理化条件动态变化对微生物群落结构的影响;研究表明该泉水微生物群落结构呈现动态变化过程并且其中的微生物对碳源利用具有偏嗜性。
五大连池药泉山的矿泉水被用于医疗和保健已有百余年历史,然而矿泉水资源非常珍贵,其资源的永续性尚不是非常明确,因而其开发利用受到当地有关部门的严格控制和保护。尽管近年来矿泉水的成因、水体成分和分布与五大连池的火山地质研究同步得到长足的进展,然而矿泉水中的微生物组分、微观粒子组分及可能的有机组分一直没有得到充分的研究,五大连池矿泉水的微环境研究尚属空白。本次研究选取药泉山矿泉水区的5个矿泉以及周边地下水为主要研究对象,利用分子生物学技术对其中的微生物群落多样性进行研究,主要分析矿泉微生物群落与五大连池地质因素与环境的相关性,以期为了解特殊冷泉的微生物生态特征提供科学数据,以及为五大连池珍贵的矿泉水和矿泥资源的科学保护、合理利用和进一步开发提供技术支持。
1 研究区概况
五大连池保护区位于黑龙江省西北部,地处小兴安岭山地向松嫩平原的过渡地带[25],地理坐标为48°30′00″N—48°51′00″N、126°00′00″E—126°25′00″E,总面积为1 060 km2。五大连池保护区位于东亚大裂谷的轴部,区内主要存在凹陷构造、隆起构造和断裂构造。断裂发育以北东向断裂为主,北西向断裂次之,另外还有南北向断裂和东西向断裂,其构成了棋盘式的构造格局。区内地层发育,分布广泛,大约占保护区区域面积的3/4,主要地层有石炭系板岩、片岩,白垩系泥岩、砂岩及第四系玄武岩、亚黏土等[26]。区内河、溪、湖泊和沼泽广泛分布,且有由充足的矿泉水所构成的地下水资源。地下水主要类型可以分为第四系松散岩类孔隙潜水、第四系火山熔岩孔洞裂隙潜水、白垩系砂砾岩孔隙裂隙承压水、寒武系变质岩裂隙承压水、燕山期及印支期花岗岩裂隙承压水[27]。
1.1 地质和水文地质特征

五大连池药泉山区域位于保护区南部,处于构造隆起区。药泉山区域中部有东西向的压扭性断裂,该断裂进一步被北东向压性断裂和北西向张扭性断裂切断。由于这两组大断裂阻挡了药泉山区域与外界的水力联系,加上白垩系泥岩的覆盖,使得药泉山区域形成了独立于区域水文地质单元、并受断裂控制的类似三角形的封闭地下水循环区域。五大连池药泉山研究区域地下水类型由上到下依次为:顶部第四系玄武岩孔隙、裂隙潜水;中部白垩系嫩江组砂岩孔隙承压水;底部寒武系片岩、板岩和印支期花岗岩中裂隙承压水。
1.2 矿泉水特征
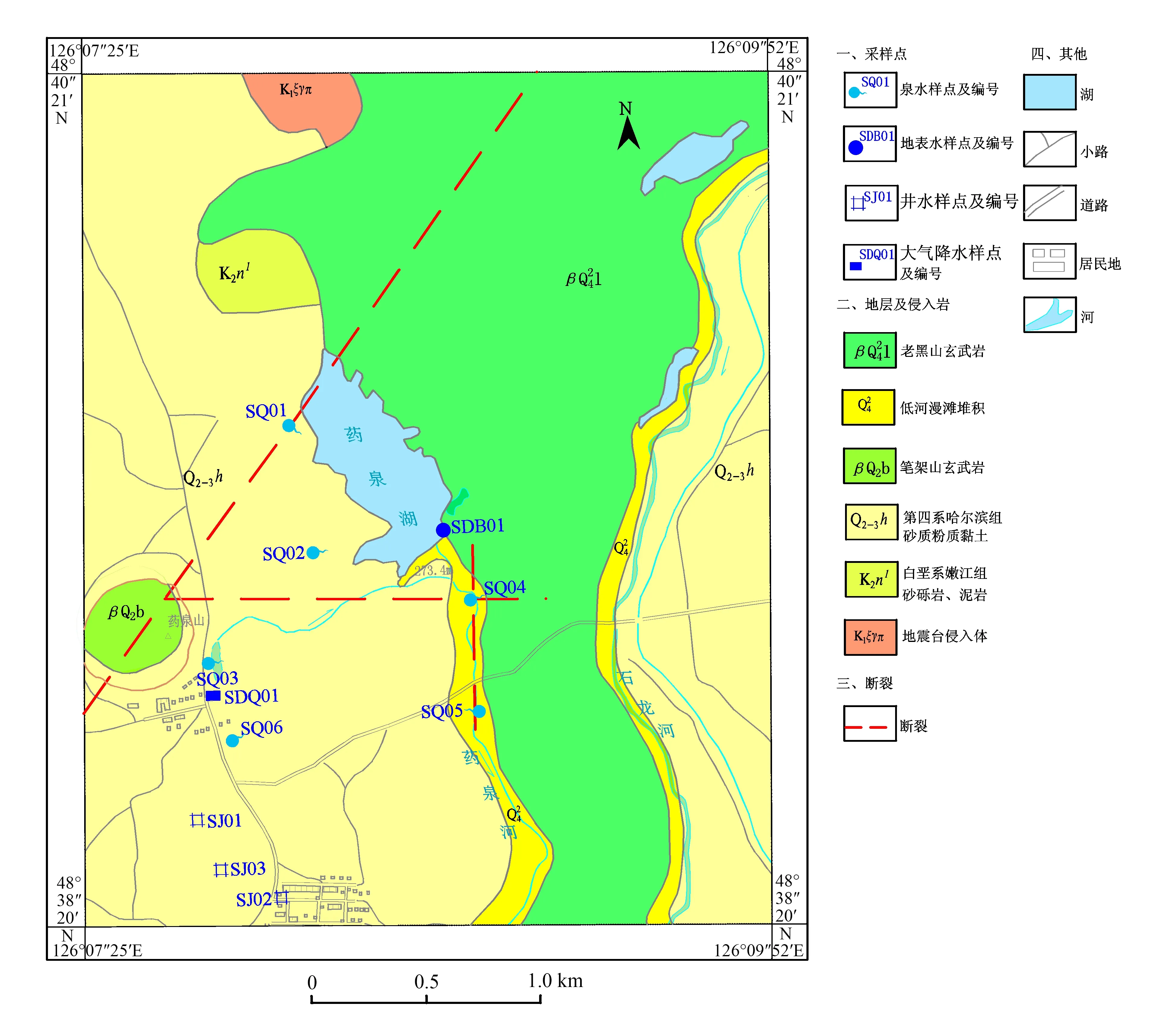
图1 研究区地质背景和取样点位布置示意图Fig.1 Geological setting and sampling points layout in the study area
五大连池保护区药泉山区域第四系潜水主要接受大气降水补给,在药泉山东侧的东西向和北东向断裂交汇处出露大流量的淡水泉,如翻花泉、二龙眼泉等。当潜水径流到北向断裂时,汇深层承压水混合溢出地表而形成南饮泉、北饮泉等。深层承压水北东向张性断裂接受潜水补给,在水头压力作用下向东、东南运移,到南北向断裂以泉的形式排出地表。南饮泉、北饮泉位于药泉山东偏南,石龙西侧的药泉河边,两泉出露于同一南北向断裂上,都是深成地下水补给来源的断层泉,富含CO2,水化学类型均为HCO3-Mg-Ca型。翻花泉据记载已有60多年历史,泉水自井口流至南侧的翻花泉浴场,泉水中不断有大量气泡溢出,其水化学特征与地表水相似,矿化度低。二龙眼泉出露于药泉山东侧山脚,是第四系玄武岩孔洞裂隙水和砂砾石孔隙潜水的自然排泄点,其水化学特征与地表水相似。
2 研究方法
2.1 野外调查和采样
根据五大连池的具体环境特征和研究目标,为了反映环境中微生物和微观成分对环境的响应情况,研究考虑了东北地区的极端气温特点,分别于炎热的夏季(2015年7月)和寒冷的冬季(2016年3月)进行了样品采集。现场检测水温、气温、pH值、电导率、氧化还原电位、ρ(溶解氧)、ρ(重碳酸根)及ρ(碳酸根),并采用微生物现场样品采集系统采集水样中的微生物。
2.2 环境样品特征
表1为五大连池夏季水样现场测试结果,主要采样点为8个,具体分布见图1。由表1可见:夏季各泉水和井水样品温度都低于8.00 ℃,属于冷水,药泉湖因属于地表水,其温度接近现场温度;北饮泉、二龙眼泉、南饮泉以及泉水1的pH值为7.00左右,波动幅度并不明显。值得注意的是,北饮泉与其他水样在电导率、ρ(重碳酸根)、ρ(溶解氧)等数据上差别较大,其中,北饮泉的ρ(重碳酸根)为1 067.80 mg/L,较南饮泉高出1倍以上,相比其余水样高出4~8倍;这主要是因为该地区火山活动产生了较多CO2气体,并从地幔中溢出,使得北饮泉中含有大量的溶解的CO2,同时这也是pH值呈弱酸性的原因。
表2为五大连池冬季水样现场检测结果。由表2可知:冬季水样温度都低于5.00 ℃;所有泉水的pH都在7.00上下波动,波动幅度并不明显,其中北饮泉、南饮泉、翻花泉水样的pH在6.00左右,主要原因为该地层中有大量的CO2气体溢出,泉水中溶解了大量CO2,故显示为弱酸性;所有样品均未检测出ρ(碳酸根),原因是由于冬季个水体水样pH均小于8.00,根据水中pH值与碳酸化合物的存在形态的相关关系,在该pH值范围内地下水中碳酸化合物主要以重碳酸根形态存在。此外,北饮泉、南饮泉与其余水样在电导率、ρ(重碳酸根)、ρ(溶解氧)上差别较大,造成此现象主要原因推测为泉的成因不同。
2.3 环境样品分子生物学PCR-DGGE研究
总DNA提取方法[28-29]:对于所采的样品,通过化学裂解试剂盒纯化的方法提取基因组总DNA,以此为模板进行PCR(聚合酶链式反应)扩增以及DGGE(变性梯度凝胶电泳)。PCR-DGGE:采用16SrDNA基因具有特异性的引物对GC-338F和518R,进行PCR扩增。PCR的反应条件为:98 ℃预变性10 min,95 ℃变性30 s,55 ℃退火30 s和72 ℃延伸30 s,共35个循环。PCR反应产物用1.0%琼脂糖进行凝胶电泳检测,并进行DGGE。变性梯度凝胶质量分数为8%,温度为60 ℃,电压为150 V,在1×TAE中电泳7 h,完毕后将凝胶进行EB(溴化乙锭)染色,并将图像在凝胶检测系统中拍照存档。

表1 研究区夏季水样现场主要水质参数检测结果

表2 研究区冬季水样现场主要水质参数检测结果
2.4 微生物多样性数据分析
研究区的水样分别在夏季丰水期(2015年7月)和冬季枯水季(2016年3月)进行取样分析和测试,包括大气降水、湖水、矿泉水和村镇的浅层井水、深层井水。基于PCR-DGGE分析的结果,进一步采用Quantity One分析软件对所得到的样品DGGE进行定量分析,计算得出对应样品的多样性指数、丰富度指数以及均匀度指数[30]。
多样性指数IH应用Shannon-Wiener多样性指数,计算公式为
IH=-ΣPilnPi。
(1)
式中,Pi为第i个物种的相对多度,Pi=ni/N,ni为第i个物种的个体数,N为观察到个体的总数。
丰富度指数ID应用Margalef丰富度指数,计算公式为
ID= (S-1) / lnN。
(2)
式中,S为群落中的总数目。
均匀度指数IE应用基于Shannon-Wiener指数的Pielou均匀度指数,计算公式为
IE=IH/lnS。
(3)
式中,lnS为最大的物种多样性指数。
2.5 数据聚类分析
聚类分析是对不同地质和环境条件下的样品参数进行多元统计学意义上的归类分析手段。将PCR-DGGE得到的凝胶结果通过上述Quantity One处理数据并进行聚类分析,得到一系列环境样品微生物聚类图——即指示不同环境样品微生物之间的相关关系。这些图件可以为环境样品微生物的地质和环境控制因素分析提供科学依据。
3 结果与讨论
3.1 药泉山矿泉水水化学特征
地下水化学类型,是指地下水化学成分的生成环境、基本特征,以及水中常量元素阴阳离子或者特殊成分(稀有元素)的质量浓度达到一定量时划分的地下水类型。由表3可知:南饮泉和北饮泉的总溶解固体(TDS)质量浓度(即矿化度)大于1 000.0 mg/L,属高盐类矿泉水,其中北饮泉的矿化度达到了2 317.65 mg/L,南饮泉为1 370.9 mg/L;其余水样的矿化度都小于500.00 mg/L,属较低盐类矿泉水。

3.2 水体微生物特征
为了研究不同环境样品的时空分布特点,我们对前面所得到的微生物数据进行进一步分析,以便确定不同地质条件对微生物[31]的控制作用。由PCR-DGGE的实验结果(图3、4)所示,研究区夏季和冬季在每个泳道中的片段位置不同且丰度不同。在多次DGGE平行试验中获得DGGE凝胶结果后,采用了Quantity One(4.6.2版本,BIO-Rad,USA)图像分析软件对其进行分析,该软件能够识别同一个凝胶不同泳道上占据相同位置的条带。分析软件对其进行了定量的分析,对泳道和条带进行识别和调整后进行数据分析,并利用公式(1)--(3)获得其多样性指数等参数。
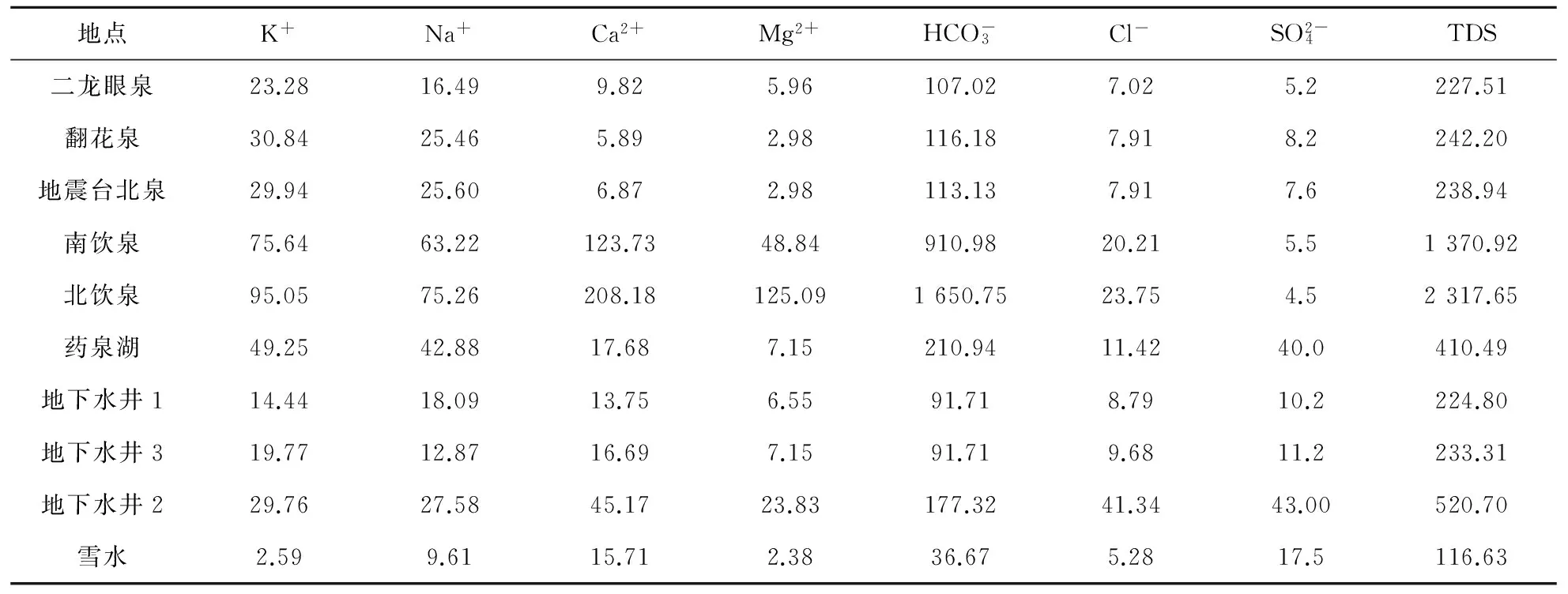
表3 研究区冬季主要离子及TDS质量浓度
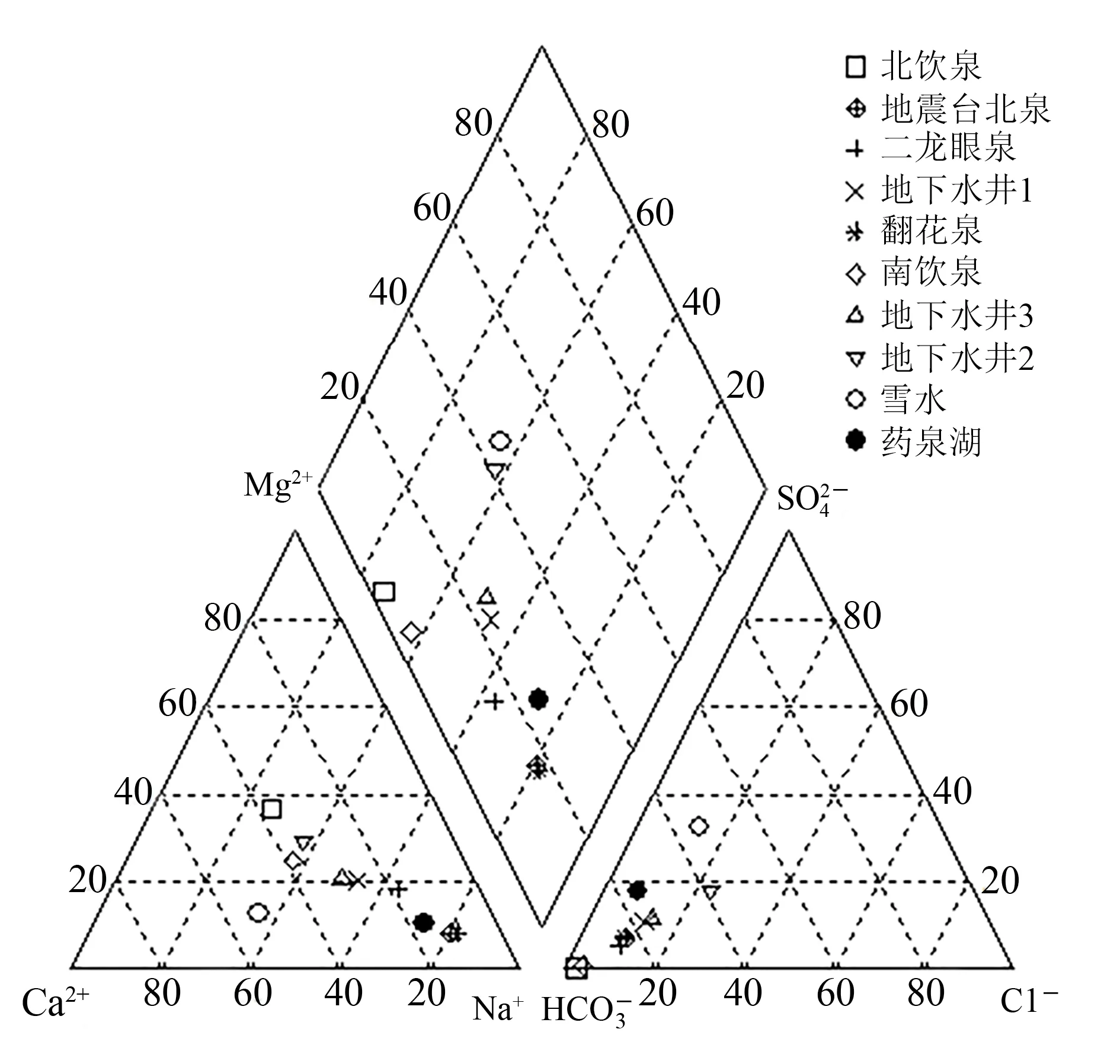
图2 研究区冬季水样的水质Piper图Fig.2 Piper diagram of water quality in winter in the study area

a.PCR结果;b.DGGE结果。1.雨水;2.泉水1;3.南饮泉;4.二龙眼泉;5.地下水井2;6.地下水井3;7.地下水井1;8.北饮泉;9.药泉湖。图3 研究区夏季水样分子生物检测Fig.3 Molecular biology testing of summer water samples in the study area
3.3 不同季节水样微生物多样性分析
在前文研究的基础上,进一步对五大连池药泉山水样的多样性数据进行计算。由表4可见,夏季多样性指数在0.656~2.460之间,丰富度指数在2~12之间,均匀度指数在0.947~0.990之间。这表明,研究区的微生物统计参数存在明显差异,这从统计学角度反映出药泉山不同矿泉水所处的地质环境条件对该处微生物的控制和影响作用是有明显差异的。
表4研究区夏季取样点水样多样性数据
Table4Biodiversityofsummerwatersamplesinthestudyarea

采样点编号水样IHIDIESJ01地下水井11.06030.970SJ02地下水井21.32940.959SJ03地下水井31.72060.960SQ03二龙眼泉1.75060.976SQ04北饮泉1.34840.972SQ05南饮泉0.65620.947SQ06泉水11.75060.977SDB01药泉湖2.290100.994SDQ01雨水2.460120.990
由表5可知:冬季多样性指数在1.164~1.318之间,丰富度指数在4~9之间,均匀度指数在0.510~0.951之间;均匀度指数和多样性指数变化幅度不大,丰富度指数变化最显著。
表5研究区冬季取样点水样多样性数据
Table5Biodiversityofwinterwatersamplesinthestudyarea
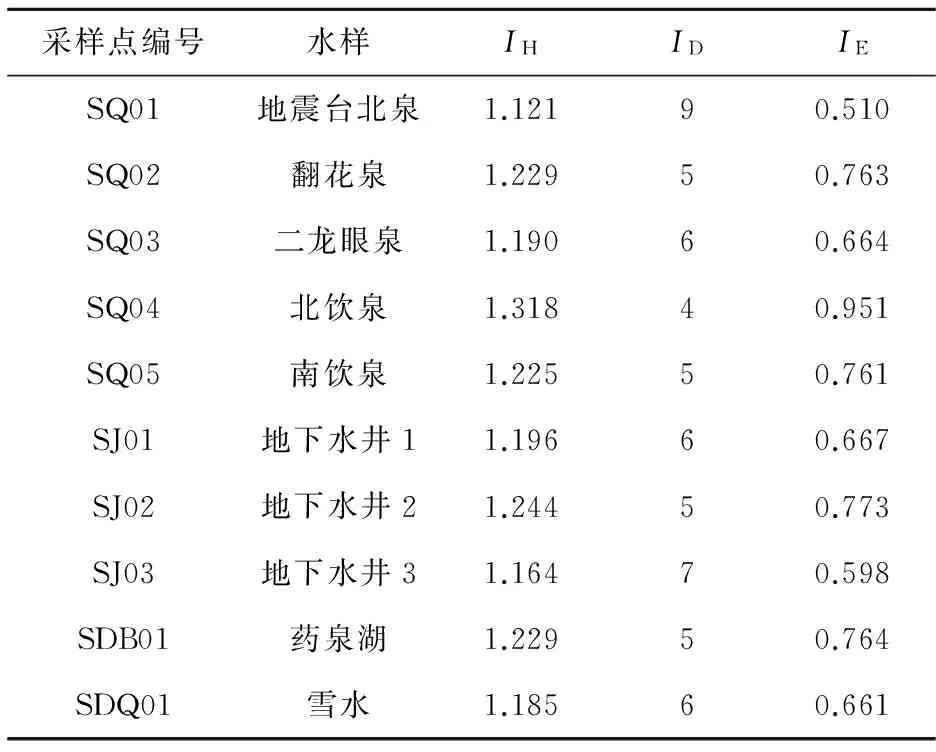
采样点编号水样IHIDIESQ01地震台北泉1.12190.510SQ02翻花泉1.22950.763SQ03二龙眼泉1.19060.664SQ04北饮泉1.31840.951SQ05南饮泉1.22550.761SJ01地下水井11.19660.667SJ02地下水井21.24450.773SJ03地下水井31.16470.598SDB01药泉湖1.22950.764SDQ01雪水1.18560.661
从表4、表5及图5所示的数据分布规律中可以看出,多样性指数、丰富度指数以及均匀度指数这几个微生物统计参数在不同空间位置变化较大。这说明,微生物对地质空间、环境条件的响应具有良好的一致性。数据变化还表明,研究区的微生物统计参数存在差异,根据前文对该研究区域的水文地质特征以及矿泉水成因的描述,可推测药泉山地质条件和环境温度条件对微生物具有一定的影响。此外,冬季水样的微生物多样性指数和均匀度指数呈现较为平稳的空间位置总体变化规律,这说明冬季微生物处于不活跃的“休眠”状态,因而缺乏对地质空间、环境条件的明显响应,具有比较良好的一致性或者均一性。
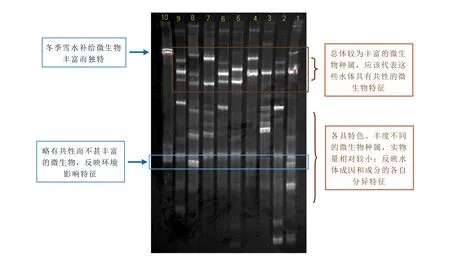
1.北饮泉;2.南饮泉;3.地震台北泉;4.翻花泉;5.二龙眼泉;6.地下水井1;7.地下水井2;8.地下水井3;9.药泉湖;10.雪水。图4 研究区冬季水样DGGE结果Fig.4 DGGE results of winter water samples in the study area

a.夏季;b.冬季。图5 研究区不同季节水体微生物多样性指数变化特征Fig.5 Biodiversity of the spring water at study area in different seasons
3.4 环境微生物聚类分析
从五大连池保护区药泉山夏季水样的聚类分析结果(图6)可以看出:雨水、药泉湖和泉水1微生物群落相似,因雨水即大气降水,药泉湖水样是在湖心汇水区所取,而泉水1是村镇中的浅层水,三者来源相似,故聚为一类;南饮泉、北饮泉与二龙眼泉微生物群落相似,因三者成因一致,都属于断层泉,可聚为一类;地下井1、地下水井2和地下水井3这3个水样都是村镇中的深层井水,并且根据前期调查结果可知以上3个地下水样均来源于药泉山二龙眼泉水线之上,因此以上3个样品微生物群落相似,可聚为一类。
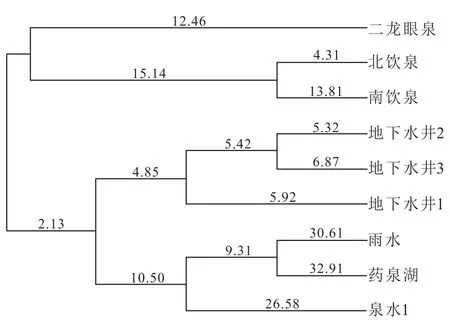
图6 研究区夏季水样生物数据聚类分析Fig.6 Cluster analysis of water bio-data in summer in the study area
类似地,对冬季泉水样品数据进行聚类分析,也可以得到这次环境样品微生物的相应聚类图,如图7所示。
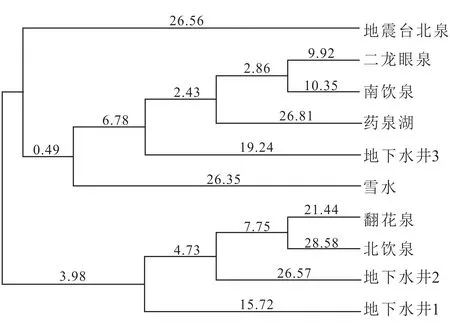
图7 研究区冬季水样聚类分析Fig.7 Cluster analysis of water bio-data in winter in the study area
从图7可知:地震台北泉和其余水样微生物群落多样性存在较大差异;二龙眼泉、南饮泉、药泉湖、地下水井3和雪水的微生物群落多样性相似,其中二龙眼泉是自然排泄点,南饮泉虽然属于断层泉,但接近地表,各项组分也更接近地表水样,药泉湖取样是在湖心的汇水区,地下水井3水样来源于药泉山二龙眼泉水线之上,雪水属于大气降水,以上水样的来源相似,因此微生物群落相似,可聚为一类;翻花泉、北饮泉、地下水井2、地下水井1水样相似,以上水样包括断层泉和深层井水,因此微生物群落组成较为相似。
冬季与夏季聚类分析结果相比较有明显不同,考虑其主要是由环境温度的影响造成的。温度为微生物生长的重要影响因素[32],可影响微生物蛋白的分泌以及微生物的代谢活动。由数据分析可知,夏季和冬季药泉湖温度相差较大,其他采样点位温度相差幅度不大,但南饮泉温度相差4 ℃,对于嗜冷微生物的生长具有一定的影响;因此聚类分析结果冬季与夏季相差结果明显不同。
3.5 结果分析和讨论
药泉山区域主要由不同的断裂带包围并分割开来,中部东西向的压扭性断裂横亘在南饮泉与北饮泉中间,沿南饮泉与北饮泉方向存在南北向张扭性断裂,北东向压性断裂和北西向张扭性断裂主要经过翻花泉、地震台北泉以及二龙眼泉周围。因此也可以解释南饮泉和北饮泉虽然相距不远,但是化学成分上却依然存在一定的差异的原因。其原因推测可能是:北饮泉距药泉山深成重碳酸盐-碳酸矿泉水富水带近,而且北饮泉位于药泉山东西向压扭性断裂和南北向张扭性断裂的交汇处,所以深成矿泉水对北饮泉的补给作用比较强,在向地表排泄过程中受到浅层地下水的影响就相对较弱,所以北饮泉的成分要更加接近深成矿泉水;然而南饮泉距药泉山深成重碳酸盐-碳酸矿泉水富水带较远,而且位于药泉山南北向张扭性断裂下盘,深成矿泉水对南饮泉的补给作用相对较弱,在向地表排泄过程中受到浅层地下水的影响却相对较强,所以导致了南饮泉和北饮泉在化学成分上的不同。
而从聚类分析图结果来看,各个样品点虽然存在微生物多样性差异,但是与断裂带并没有太大的关联,相比更多的是因为泉水成因的不同。这一结果也在预期之内,考虑到虽然样品采样点间存在断裂带,但是通过地下水径流,各采样点的水流依旧可以进行彼此间的交换汇流;因此,样品中微生物因地质因素导致的差异并不明显。为了更深一步地研究微生物在地质条件控制下的动态变化,并且对微生物细菌群落的组成成分进行研究,后期将采用高通量测序技术对其成分进行分析,并考察地质条件与微生物之间的响应。
4 结论
1)五大连池药泉山矿泉水区所采得的水样,无论是夏季还是冬季,矿泉温度都是常年低于10.00 ℃,属于冷泉。pH除北饮泉、南饮泉和翻花泉因水体溶解了大量CO2而呈微酸性(pH=6.00左右),其余水样的PH值都在7.00左右。其他水化学参数,如电导率、ρ(重碳酸根)、ρ(溶解氧)等,除了北饮泉外各水样基本一致。
3)分子生物学PCR-DGGE研究表明,药泉山区域水体的微生物多样性,以湖水和大气降水的多样性较高,变化最显著的是丰富度指数,而均匀度指数与多样性指数变化趋势基本一致。从对DGGE结果的聚类分析来看,虽然各个样品位于断裂带两侧,或者被断裂带从地图上划分开,但是数据表明其中的微生物群里依旧相互关联,彼此间微生物多样性差异性并不是很大。水样间存在差异的原因也大多是因为地表水和地下水的差异以及季节的影响,断裂等地质原因并没有起到太大作用。因此推测出虽然断裂带等地质因素会对微生物造成影响,但是这种影响大多只是造成了各个矿泉的成因和化学成分不同。实际上,水体通过地下水系彼此间相互连接,也会使微生物随水体进行交换。本次研究数据表明,对于微环境和微生物而言,断裂带等宏观地质因素并没有对其造成太大的影响。研究区微生物生态有待进一步深入分析和研究。
(
):
[1] 王元玉. 五大连池自然保护区生态旅游资源管理研究[D].沈阳:东北林业大学,2010.
Wang Yuanyu. Research on Eco-Tourism Resource Management of Wudalianchi Nature Reserve[D]. Shenyang: Northeast Forestry University, 2010.
[2] 赵继昌. 黑龙江五大连池药泉山矿泉形成特征[J]. 水文地质工程地质,1985(3):55-59.
Zhao Jichang. Characteristics of the Formation of Yaoquanshan Mineral Spring in Wudalianchi, Heilongjiang Province[J]. Hydrogeology and Engineering Geology ,1985(3):55-59.
[3] 张耀德 ,王允鹏, 李景喆,等. 五大连池药泉山矿水成因研究[J]. 水文地质工程地质,1988(4):24-27.
Zhang Yaode, Wang Yunpeng, Li Jingzhe,et al. Study on the Cause of Yaoquanshan Mineral Water in Wudalianchi[J]. Hydrogeology and Engineering Geology, 1988(4):24-27.
[4] 韩建超,张海燕,杨悦锁,等. 五大连池药泉山地下水循环特征的水化学证据[J]. 节水灌溉,2012(8):23-26,30.
Han Jianchao, Zhang Haiyan, Yang Yuesuo, et al. Hydrochemical Evidence of Circulation Characteristics of Yaoqunshan Groundwater in Wudalianchi[J].Water-Saving and Irrigation,2012(8):23-26,30.
[5] Perreault N N, Andersen D T, Pollard W H, et al. Characterization of the Prokaryotic Diversity in Cold Saline Perennial Springs of the Canadian High Arctic[J]. Applied & Environmental Microbiology, 2007, 73(5):1532-1543.
[6] Camacho A, Rochera C, Silvestre J J, et al. Spatial Dominance and Inorganic Carbon Assimilation by Conspicuous Autotrophic Biofilms in a Physical and Chemical Gradient of a Cold Sulfurous Spring: The Role of Differential Ecological Strategies[J]. Microbial Ecology, 2005, 50(2):172
[7] Rudolph C, Wanner G, Huber R. Natural Commu-nities of Novel Archaea and Bacteria Growing in Cold Sulfurous Springs with a String-of-Pearls-Like Morphology[J]. Applied & Environmental Microbiology, 2001, 67(5):2336.
[8] Rudolph C, Moissl C, Henneberger R, et al. Ecology and Microbial Structures of Archaeal/Bacterial Strings-of-Pearls Communities and Archaeal Relatives Thriving in Cold Sulfidic Springs[J]. Fems Microbiology Ecology, 2004, 50(1):1-11.
[9] Koch M, Rudolph C, Moissl C, et al. A Cold-Loving Crenarchaeon is a Substantial Part of a Novel Microbial Community in Cold Sulphidic Marsh Water[J]. Fems Microbiology Ecology, 2006, 57(1):55.
[10] Moissl C, Rudolph C, Huber R. Natural Commu-nities of Novel Archaea and Bacteria with a String-of-Pearls-Like Morphology: Molecular Analysis of the Bacterial Partners[J]. Applied & Environmental Microbiology, 2002, 68(2):933.
[11] Farnleitner A H, Wilhartitz I, Ryzinska G, et al. Bacterial Dynamics in Spring Water of Alpine Karst Aquifers Indicates the Presence of Stable Autochthonous Microbial Endokarst Communities[J]. Environmental Microbiology, 2005, 7(8):1248-1259.
[12] Brock T D, Freeze H. Thermus Aquaticus gen. n. and sp. n., A Nonsporulating Extreme Thermophile[J]. Journal of Bacteriology, 1969, 98(1): 289-297.
[13] Melendrez M C, Lange R K, Cohan F M, et al. Influence of Molecular Resolution on Sequence-Based Discovery of Ecological Diversity among Synechococcus Populations in an Alkaline Siliceous Hot Spring Microbial Mat[J]. Applied & Environmental Microbiology, 2011, 77(4):1359.
[14]Vick T J, Dodsworth J A, Costa K C, et al. Microbiology and Geochemistry of Little Hot Creek, a Hot Spring Environment in the Long Valley Caldera[J]. Geobiology, 2010, 8(2):140-154.
[15] Liu L J, You X Y, Zheng H, et al. Complete Genome Sequence of Metallosphaera Cuprina, a Metal Sulfide-Oxidizing Archaeon from a Hot Spring[J]. Journal of Bacteriology, 2011, 193(13):3387-3388.
[16] van der Meer M T J, Klatt C G, Wood J, et al. Cultivation and Genomic, Nutritional, and Lipid Biomarker Characterization of Roseiflexus Strains Closely Related to Predominantin Situ Populations Inhabiting Yellowstone Hot Spring Microbial Mats[J]. Journal of Bacteriology, 2010, 192(12):3033.
[17] Chan C S, Chan K G, Tay Y L, et al. Diversity of Thermophiles in a Malaysian Hot Spring Determined Using 16S rRNA and Shotgun Metagenome Sequencing[J]. Frontiers in Microbiology, 2015, 6:177.
[18] Hugenholtz P, Pitulle C, Hershberger K L, et al. Novel Division Level Bacterial Diversity in a Yellowstone Hot Spring[J]. Journal of Bacteriology, 1998, 180(2):366.
[19] 王红蕾. 长白山热泉生境微生物群落结构及嗜热菌分离鉴定[D]. 长春:吉林大学, 2014.
Wang Honglei. Isolation and Identification of Microbiome Community in Hot Spring Habitat in Changbai Mountain[D]. Changchun:Jilin University,2014.
[20] 明红. 云南腾冲热泉嗜热原核微生物资源挖掘和高温木聚糖酶筛选[D]. 昆明:云南大学, 2015.
Minghong. Mining of Thermonuclear Microbial Resources and Screening of High Temperature Xylitase in Tengchong Hot Spring in Yunnan[D]. Kunming:Yunnan University, 2015.
[21] 曾军. 新疆沙湾冷泉沉积物原核微生物多样性[D].乌鲁木齐:新疆大学, 2010.
Zeng Jun. Prokaryotic Microbial Diversity of Cold Spring Sediment in Shawan, Xinjiang[D]. Urumqi: Xinjiang University, 2015.
[22] 薛娟. 乌鲁木齐10号泉水体微生物对地震的响应[D]. 石河子:石河子大学, 2013.
Xue Juan. Response to Earthquake by Microorganism of Spring Spring 10 in Urumqi[D]. Shihezi: Shihezi University, 2013.
[23] 高小其, 娄恺. 新疆地区地震前后泉水中微生物异常反映的研究[J]. 国际地震动态, 2012(6):269-272.
Gao Xiaoqi, Lou Kai. Study on Abnormal Microbial Reflection in Spring Water Before and after Earthquake in Xinjiang[J]. International Earthquake Dynamics, 2012(6):269-272.
[24] 吴江超, 张涛, 孙建,等. 新疆地震断裂带泉水微生物群落功能多样性[J]. 新疆农业科学, 2010, 47(5):1052-1056.
Wu Jiangchao, Zhang Tao, Sun Jian,et al. Diversity of Microbial Community Function of Spring Water in Xinjiang Earthquake Fault Zone[J]. Xinjiang Agricultural Science, 2010, 47(5):1052-1056.
[25] 孟昭荣. 经济新常态下旅游小城镇经营研究[D].哈尔滨:哈尔滨师范大学,2016.
Meng Zhaorong. A Study on the Management of Small Towns Under the New Economic Normal[D]. Harbin: Harbin Normal University, 2016.
[26] 韩松山,丘顺帆. 1/5万五大连池农场幅、饮龙河农场幅、德都县幅、二龙山农场一分场四幅联测区域地质调查报告[R]. 哈尔滨:黑龙江省地质调查总院,2003:20-61.
Han Songshan, Qiu Shunfan. A Regional Geological Survey Report on a Joint Survey of Wudalianchi Farm, Yilong River Farm, Dedo County and Erlong Mountain Farm[R]. Harbin:General Institute of Geological Survey of Heilongjiang Province,2003:20-61.
[27] 孙如波,杜建国. 五大连池火山区水文地球化学背景[J]. 矿物岩石地球化学通报,1998,66(3):12-17.
Sun Rubo, Du Jianguo. Hydrogeochemical Background of Wudalianchi Volcanic Area[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 1998, 66(3):12-17
[28] 苏小四, 孟祥菲, 张文静, 等. 人工回灌过程中地下水微生物群落变化[J]. 吉林大学学报(地球科学版), 2015, 45 (2): 573-583.
Su Xiaosi, Meng Xiangfei, Zhang Wenjing, et al. Change of the Groundwater Microbial Community During Artificial Recharge Process[J]. Journal of Jilin University(Earth Science Edition), 2015, 45(2): 573-583.
[29]Casamayor E D, Schäfer H, Baeras L, et al. Identifi-cation of and Spatio-Temporal Differences Between Microbial Assemblages fromTwo Neighboring Sulfurous Lakes: Comparison by Micros-Copy and Denaturing Gradient Gel Electrophoresis [J]. Applied and Environment Microbiology, 2000, 66: 499-508.
[30] Emilie L, Bénédite L, Loïc T H, et al. Analysis of Bacterial Diversity in River Biofilms Using 16S rDNA PCR-DGGE: Methodological Settings and Fingerprints Interpretation [J]. Water Research, 2005, 39: 380-388.
[31] Josh D N, William W M. Fluorophore-Labeled Pri-mers Improve the Sensitivity, Versatility, and Normalization of Denaturing Gradient Gel Electrophoresis [J]. Applied and Environmental Microbiology, 2005, 71(8) :4893-4896.
[32] Lee G L Y, Ahmad S A, Yasid N A, et al. Biode-gradation of Phenol by Cold-Adapted Bacteria from Antarctic Soils[J]. Polar Biology, 2018, 41(3): 553-562.

