医用X射线设备及用具标准体系研究
孟昭阳,孙智勇,金玉博
辽宁省医疗器械检验检测院,辽宁 沈阳 110179
引言
标准体系是指一定范围内的标准按其内在联系形成的科学的有机整体;标准体系表是一定范围内的标准体系内的标准按其内在联系排列起来的图表,是表达标准体系概念的模型[1]。标准体系及路线图是对标准的制定进行顶层设计,研究建立我国医用X射线设备及用具标准体系对于诊断成像技术发展与应用具有十分重要的作用[2]。
1 国际电工委员会诊断成像设备标准发展状况
1.1 国际电工委员会诊断成像设备分技术委员会简介
国际电工委员会(International Electrotechnical Commission,IEC)诊断成像设备分技术委员会SC62B,致力于医用诊断成像设备(包括X射线成像设备、CT、核磁成像设备)的基本安全和主要性能方面的标准研究工作。目前已经制定并发布了43份国际标准,覆盖了医用诊断成像设备技术领域,为各国政府相关职能部门提供及监管依据;对全球诊断成像设备产品制造商的产品设计、生产和质量控制提供技术支持。SC62B根据其技术领域不同下设14个标准维护组MT,目前有2个已转为工作组WG。一个联合工作组、一个项目组、一个咨询组[2]。每个小组由一个召集人和来自世界各国的标准化专家组成,SC62B工作组清单,见表1。
1.2 诊断成像设备分技委(SC 62B)标准体系
IEC诊断成像设备分技委(SC 62B)标准体系基本可以按照标准应用范围分成软件类标准和硬件类标准(图1)。软件标准包括ISO 14971《医疗器械 风险管理对医疗器械的应用》、IEC 62304《医疗器械软件——软件生命周期过程》、IEC 82304-1《健康软件——第1部分:产品安全性的通用要求》。硬件的标准主要是IEC 60601医用电气安全标准族的标准,其体系构见图2。IEC 60601系列标准的第一部分为通用安全要求以及与基本安全性能并列的标准,是医用电气设备应普遍适用的安全标准,以及多数情况下仅限于具有某些特定功能或特性的设备才需要满足的安全标准要求[3-4],如:IEC 60601-1《医用电气设备第1部分:安全通用要求》、IEC 60601-1-1《医用电气设备 第1-1部分:安全通用要求并列标准:医用电气系统安全要求》;第二部分为医用电气设备的专用安全标准,是某一类医用电气设备应适用的安全标准,如IEC 60601-2-1《医用电气设备第2部分:能量为1 MeV至50 MeV电子加速器安全专用要求》;第四部分是指导和解释,是对第一部分标准的指导和解释,第三部分目前尚未制定标准。

表1 SC62B工作组清单

图1 IEC SC62B标准体系
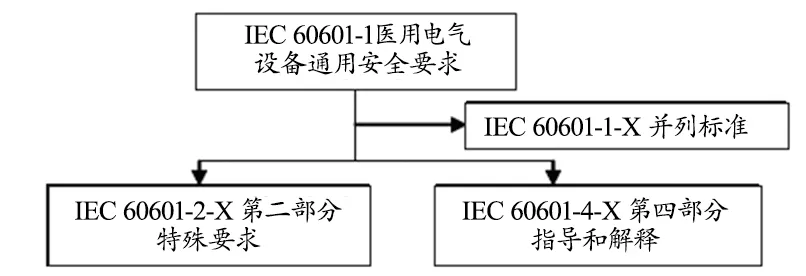
图2 电气安全标准体系结构
2 我国医用X射线设备及用具标准体系研究
2.1 建立标准体系的基础条件
全国医用X射线设备及用具标准化分技术委员会根据国家标准化管理委员会、国家食品药品监督管理总局的要求,加快对口国际标准的转化速度、加大国家/行业标准制修订力度[5]。目前,全国医用X射线设备及用具标准化分技术委员会归口标准113份,其中国家标准31份,行业标准82份,强制性标准16份,推荐性标准97份,等同转化IEC标准51份,自主制定标准52份。
2.2 标准体系结构图
标准体系结构主要反映了标准体系各部分的相互关系,由基础标准、方法标准、产品标准、管理标准组成[6-8]。其中,基础标准包括术语和符号,标识、说明书,包装、运输和储存也包括安全通用要求、安全专用要求、安全通用要求并列标准等,它是医用X射线设备及用具标准体系的基石和保障[9-10]。方法标准是具体指标的测试方法,或环境试验等。方法标准是为统一必要性能和安全指标的测试方法而制定,包括产品验收试验、稳定性试验标准等。产品标准是从某特定类产品的角度明确了基本安全和必要性能的要求,包括整机、部件及附属设备[11-13]。目前对产品标准进行框架性研究,逐步统一标准架构。管理标准主要包括在用医疗器械上市后监管标准。医用X射线标准体系划分依据,见图3,医用X射线标准体系结构图,见图4。

图3 医用X射线标准体系划分依据
2.3 标准体系表
医用X射线标准体系表是根据体系结构中的分类,由现有标准和未来3年要制修订的标准组成[14-15]。标准体系表的编号方式为X-XX,第一个X代表标准体系结构中的类别,第二个XX代表在该类别中的编号。例如:1-03代表基础标准中的第三个。标准体系标准中包含标准编号、标准名称、标准级别(国家标准/行业标准)、标准状态、发布时间、实施时间、是否采用国际标准、采用国际标准号、标准替代情况。具体格式实例,见图5。
3 中外标准体系对比及可借鉴的经验

图4 医用X射线标准体系结构图

图5 标准体系表示例
通过上文的对比可以看出,IEC SC62B制定的60601系列标准族主要是一些基础性的标准[16-17],它是在60601-1通用要求的大框架下延伸出60601-1-X和60601-2-X等针对不同设备的专用安全要求,关注点在于产品的基本安全性能。这样的体系设计较为直观,有利于标准之间的协调配合、降低标准覆盖面不全,交叉重叠的状况。而我国医用X射线设备及用具标准体系在借鉴IEC模式的基础上,结合我国实际监管需求,根据国家标准体系表编制原则与要求,将标准划分为基础标准、方法标准、产品标准、管理标准。从内容上既保留了IEC系列标准的安全性要求又增加了设备性能的要求,因此对IEC系列标准是一个补充。另外,从结构上这种划分方式更能直观的看出各类标准的数量,能够避免某一类标准过多过杂的情况。
4 结论
在标准体系的制定过程中,通过对本领域国际组织标准进行全面系统的查阅、研究和分析,有效地了解国际组织现有标准体系的组成、特点与水平等,找出我国与国际组织标准间的差距,取长补短。
通过对标准体系的研究为标准的制、修订中长期规划提供一个可靠的技术依据。在标准制、修订的过程中,可以做到抓住重点,安排好轻重缓急,优先制修订有利于行业健康发展、监管急需的技术标准,有的放矢,避免盲目性,减少交叉和重复。
[参考文献]
[1] GB/T 13016-2009,国家标准体系表编制原则与要求[S].2009.
[2] International Electrotechnical Commission[EB/OL].http://www.iec.ch/.
[3] 肖忆梅,欧阳昭连,李军.医疗器械国际标准体系现状与借鉴[J].中国医药导刊,2016,18(3):316-317.
[4] 姜晓燕,周舜元,刘长安,等.我国放射卫生防护标准体系介绍[J].中华放射医学与防护杂志,2010,30(5):591-594.
[5] 李军.我国医疗器械标准现况调研[J].中国医疗器械杂志,2009,33(5):362-368.
[6] 母瑞红,肖忆梅.我国医疗器械行业标准体系建设工作初探[J].中国医疗器械信息,2011,17(6):27-28.
[7] 彭亮,郑佳,余新华.医疗器械软件标准体系建设探讨[J].中国医疗设备,2015,30(3):59-62.
[8] 兰井志,郑伟.标准体系表编制的探讨——以矿业权评估标准体系为例[J].国土资源科技管理,2015,32(1):69-72.
[9] 郑佳,余新华,何骏,等.家用电子医疗器械标准体系研究[J].中国医疗器械杂志,2017,41(5):369-370.
[10] 李静莉,郑佳,张春青,等.中国医疗器械分类目录全面修订的设计与思考[J].中国医疗器械杂志,2017,41(4):283-285.
[11] 肖忆梅,李军.医疗器械通用标准体系研究[J].中国医疗器械杂志,2016,40(3):128-131.
[12] 杨婉娟,李军,李静莉.我国医疗器械命名体系建设思路初探[J].中国医疗器械杂志,2015,(6):442-444.
[13] 肖忆梅.我国医疗器械安全标准体系表研究[J].中国医疗器械信息,2012,18(8):42-43.
[14] 吴伟荣,黄鸿新.医疗器械灭菌包装标准体系研究[J].标准科学,2014,(6):46-50.
[15] 吴伟荣,胡昌明.浅谈国内外消毒领域标准化组织及标准体系[J].标准科学,2013,(8):92-95.
[16] 刘毅,李悦菱,廖晓曼,等.ISO与国内医疗器械标准化机构设置比较研究[J].首都医药,2013,(16):10-13.
[17] 母瑞红,李静莉.探索建立促进产业发展的医疗器械标准化工作新模式[J].中国医疗器械信息,2013,(9):25-27.

