典型设施环境条件对土壤活性磷变化的影响
黄 敏,梁荣祥,尹维文,刘 茜,蒲昌英,段军波
典型设施环境条件对土壤活性磷变化的影响
黄 敏*,梁荣祥,尹维文,刘 茜,蒲昌英,段军波
(武汉理工大学资源与环境工程学院,湖北 武汉 430070)
采用室内强化模拟试验,研究了90d培养期内环境温度、土壤酸化和盐渍化3种典型设施环境条件对土壤易解吸磷(CaCl2-P)、有效磷(Olsen-P)、微生物生物量磷(MB-P)以及微生物生物量碳磷比(MB-C/P)等活性磷的影响.结果显示,设施土壤MB-P含量随着环境温度的升高而显著上升;10℃培养结束时土壤CaCl2-P和Olsen-P含量比4℃对照分别提高15.6%和2.7%.酸化促进设施土壤CaCl2-P及Olsen-P含量增加,而使土壤MB-P含量显著下降.培养结束时,与pH值为6.89的对照土壤相比, pH值为6.11和5.30的酸化处理土壤CaCl2-P含量分别提高26.7%和156.1%,其Olsen-P含量分别增加14.1%和91.5%,其MB-P含量的降幅分别为13.3%和16.3%. 盐化对土壤CaCl2-P和Olsen-P含量的影响均不显著,土壤MB-P含量在12d后随盐化程度加重而显著下降.培养结束时,与土壤可溶性盐分为1.90g/kg的对照相比,可溶性盐分为3.05g/kg和5.01g/kg的土壤MB-P含量分别下降42.2%和45.8%.另外,设施环境温度提升、酸化和盐化使土壤MB-C/P在40d后整体上均呈下降趋势.综上所述,在4~25℃范围内提升环境温度,减缓土壤pH值从6.89降至5.30的酸化过程,阻控土壤可溶性盐分从1.90g/kg升至5.01g/kg盐化进程,可保证设施土壤磷素供应,降低土壤磷素流失风险,增强微生物调控土壤有效磷库的潜力.
设施土壤;活性磷;环境温度;土壤酸化;土壤盐渍化
设施土壤是高度集约化管理条件下发育的一种人为作用强烈的旱地土壤,由于其长期处于“高温、高湿、高度连作、无降水淋洗”等条件下,设施土壤往往出现养分富集、结构板结和酸化盐渍化等特性[1-2].磷作为植物生长发育必须的重要营养元素之一,不仅是作物生产力的重要限制因子,也在维持生态系统平衡中起着重要作用[3].盲目大量施用磷肥在设施栽培中相当普遍,而磷肥的当季作物利用率一般只有10%~25%[4],这导致设施土壤中磷的大量积累.设施栽培的微环境相对封闭,但其水分管理中的灌排措施仍会引起土壤磷素流失到周边地表水中,从而影响设施种植区域的水体质量[5-6].因此,保证设施土壤磷素供应能力,同时降低其磷素流失风险,是涉及设施农业可持续发展和区域生态平衡的重要问题.
土壤活性磷是指土壤中具有一定溶解性、移动快、易流失,对植物和土壤微生物活性较高的那部分磷素.其中,土壤易解吸磷(CaCl2-P)、有效磷(Olsen-P)和微生物生物量磷(MB-P)为表征土壤活性磷的常见形态[7-8].环境条件对各形态磷素水平影响比较显著.设施栽培一般在月均气温低于10℃以下的冬春季进行,其环境温度比露天气温高4~17℃[1,9];考虑到作物所需的适宜温度及生产成本,当月均气温高于10℃,生产者一般会拆除大棚等设施.温度可直接影响固相磷的吸附解吸特征[10]而影响土壤中有效磷的含量.丹麦Askov的田间长期定位试验结果显示,土壤Olsen-P含量在春冬季增加,而在夏秋季有所降低[11].有调查显示,设施土壤pH值一般在4.96~ 7.97之间,且酸化问题突出[9].土壤pH值是影响土壤磷素活性的关键因子并显著影响其组分分布[12],农业生产活动中可通过调节土壤pH值来提高土壤Olsen-P的含量[13].设施土壤次生盐渍化问题突出[1,9,14],其盐化程度最高可达露天土壤的20倍以上[15].土壤pH值和盐分含量直接影响其微生物活动,从而影响土壤磷素的微生物转化的过程与速率[16-17].
由此可见,土壤活性磷素的研究目前主要集中在露天的草地[18]、水田或旱地土壤[13]上,而对富磷的设施土壤[1-2,9]而言,所见报道较少.本研究以武汉近郊的富磷设施菜地土壤为研究对象,结合实际存在的土壤酸化及盐渍化问题,探讨环境温度、土壤酸化和盐化三种典型设施环境条件对土壤活性磷变化的影响规律,以期为设施土壤磷素管理,控制设施土壤磷淋失和改善区域环境提供理论依据.针对受人为作用强烈的设施土壤,其物理、化学及生物等过程往往不同于与自然条件下露天土壤[1,9]的特点来开展设施环境对土壤活性磷变化影响的探究,这正是本研究的创新之处.
1 材料与方法
1.1 供试材料
供试土壤采自武汉市东西湖区石榴红村具有代表性设施蔬菜种植基地(设施栽培历史达20a以上)的表层土壤(0~20cm).样品采用“S”形路线随机多点采集混合而成,将样品及时装入袋中带回实验室,去除根系等杂质后研磨过2mm筛,在4℃条件下存放备用.该设施土壤为壤质灰潮土,成土母质为河流冲积物.pH值为6.89,可溶性盐分含量为1.90g/kg,有效磷含量为80.18g/kg,全磷含量2.73g/kg,有机碳含量9.97g/kg.
1.2 试验设计
将供试土壤用蒸馏水调节含水量到田间持水量的45%后,置于(25±1)℃恒温恒湿的条件下进行7d的预培养.预培养结束后,取若干份1kg(以烘干基计)预培养过的新鲜土壤.分别设置环境温度、土壤酸化及土壤盐化3种不同因素实验,每种因素设置3种不同水平:①环境温度,分别为4℃(对照)、10℃和25℃;②土壤酸化通过人为调节土壤pH值来实现,pH值分别为6.89(对照)、6.11和5.30;③土壤盐化以可溶性盐分含量来反映,土壤可溶性盐分含量分别为1.90g/kg(对照)、3.05g/kg和5.01g/kg.各处理均设3次重复.环境温度利用恒温培养箱调节,其梯度设置是基于文献[1,8]和设施栽培的实际生产特点来考虑.土壤酸化和盐化的调节均不能带入新的离子种类,其中,土壤pH值以超纯水配置的1:9稀HNO3溶液和饱和KOH溶液进行调节,带入到土壤的阴离子为土壤中原本存在的NO3-和OH-;土壤可溶性盐分含量用两种混合盐溶液调配而成[混合盐溶液1,配方为32.80g/L Ca(NO3)2;混合盐溶液2,配方为3.02g/L NaHCO3、6.00g/L MgSO4、9.91g/L Na2SO4、3.21g/L NaCl、5.57g/L KCl、5.13g/L KNO3].酸化和盐化处理均在25 ℃条件下培养.各处理土样含水量最后均调至其饱和持水量的50%,分别装入2.5L密封塑料罐.在整个培养期内每隔3d通风换气1次,以保证微生物有充足的氧气供应.定期取样分析易解吸磷(CaCl2-P)、有效磷(Olsen-P)、微生物生物量磷(MB-P)及微生物生物量碳(MB-C)指标.
1.3 测定方法
土壤CaCl2-P采用CaCl2溶液提取法[19],土壤MB-P采用CHCl3熏蒸-NaHCO3提取法[20], Olsen-P为上述MB-P测定中未熏蒸部分提取的磷,上述三种提取溶液中的磷均采用钼蓝比色法测定.土壤MB-C采用CHCl3熏蒸-K2SO4浸提法测定[21].土壤微生物生物量碳磷比(MB-C/P)为土壤MB-C与MB-P含量的比值.土壤pH值采用土水比1:2.5搅拌,静置后用pH计测定;土壤可溶性盐分含量用电导仪测定.所有样品均测3次.
1.4 数据处理
试验结果均以3次重复的平均值±标准差表示.本研究中采用Microsoft Office与SPSS17.0进行数据处理分析及相关制图,其中,处理间的差异显著性采用检验分析.
2 结果分析与讨论
2.1 环境温度对土壤活性磷的影响
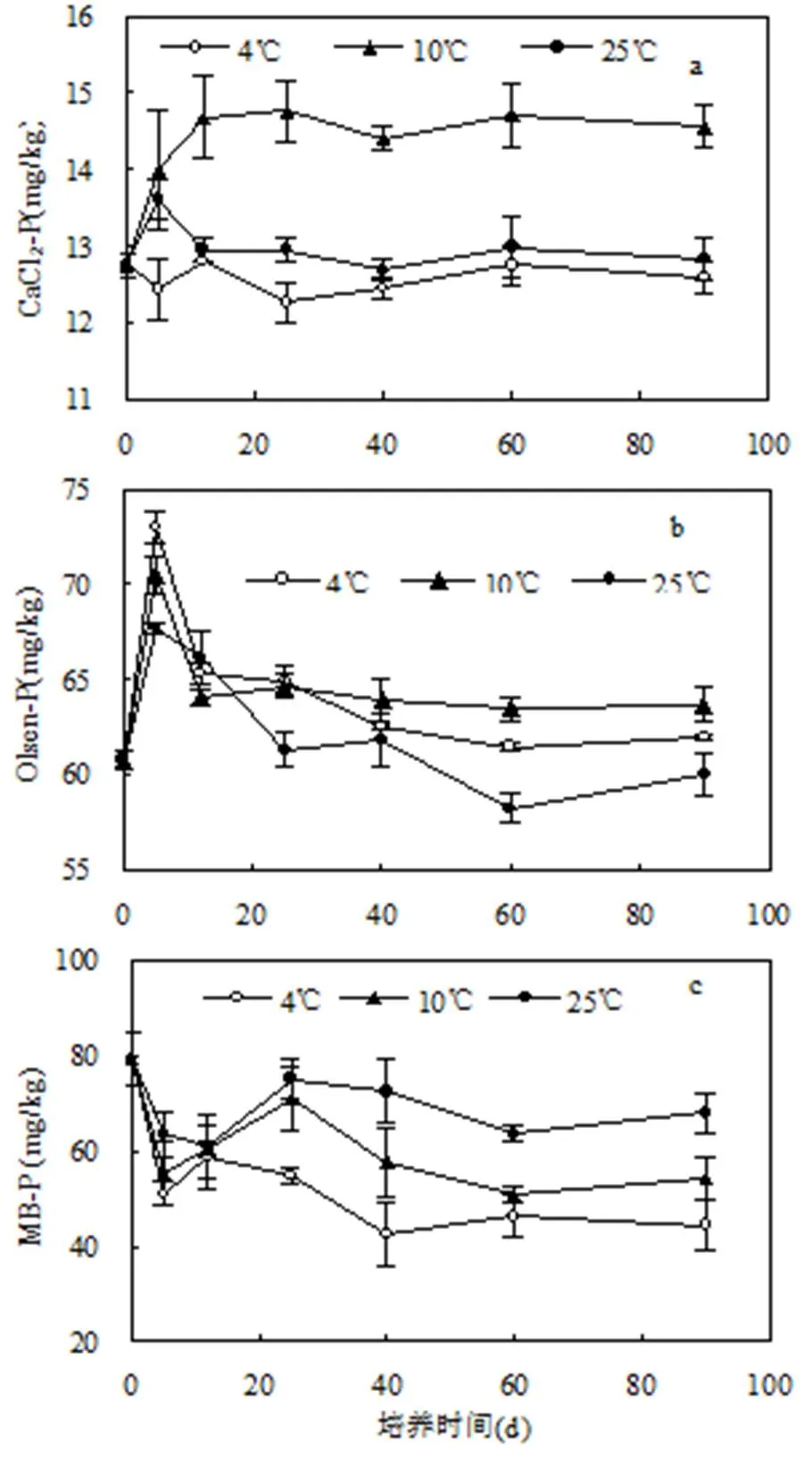
图1 不同环境温度下设施土壤活性磷的动态变化
图1显示了不同温度下土壤3种活性磷组分的动态变化.如图1(a)所示,与4℃对照相比,土壤CaCl2-P含量变化趋势在90d培养期内,10℃和25℃处理的土壤CaCl2-P含量均增加,但10℃处理的增加幅度远大于25℃处理.如培养结束时,4 ℃对照土壤CaCl2-P含量达到12.59mg/kg,而10℃和25℃处理比对照分别高出15.6%和1.9%.由图1(b)可知,土壤Olsen-P含量在培养前期(前5d)急剧上升,5d至12d快速下降,之后趋于稳定.培养前5d,土壤Olsen-P含量随温度的增加而下降;第5d时,对照4℃土壤Olsen-P含量较其起始值60.76mg/kg增加了20.1%,而10℃和25℃处理的土壤Olsen-P含量较对照分别降低了3.4%和7.3%.从20d至培养结束,与对照4℃相比,10℃处理的土壤Olsen-P含量增加,而25℃处理却降低.从第90d时的土壤Olsen-P含量来看,对照4℃为61.98mg/kg,10℃处理达到63.68mg/kg,而25℃处理却为60.01mg/kg.90d培养期内,3种温度条件下的土壤MB-P含量变化趋势一致(即培养前5d下降,5~25d增加,25d后略有降低),且土壤MB-P含量随着温度的升高呈递增趋势(图1(c)).培养结束时,与对照4℃土壤MB-P含量44.42mg/kg相比,10℃和25℃处理分别增加了22.1%和52.9%.
土壤CaCl2-P几乎全部为水溶态磷,能表征固相磷向液相释放的难易程度,是描述土壤磷素流失风险的重要指标[12,22-24].本研究结果显示,与4℃(冬春季露天的平均温度)相比,环境温度提升可促进设施土壤CaCl2-P含量增加,加大了土壤磷流失的风险.土壤Olsen-P是植物最易利用的部分,它是反映土壤磷素对植物供应能力的重要指标[13,25].而土壤MB-P因其周转速率快,是植物有效磷供应的重要来源.本实验中,不同温度条件下培养的土壤Olsen-P含量在前5d上升,而土壤MB-P含量在前5d却下降,可能是土壤微生物在培养初期适应新环境,大部分微生物死亡而导致MB-P释放为有效磷.环境温度直接影响土壤磷酸盐的沉淀与溶解、吸附与解吸,微生物对土壤磷的矿化与固定等反应平衡的结果.本研究中,土壤CaCl2-P和Olsen-P含量随温度升高而增加,原因可能在于:一方面,温度升高可加大土壤中磷酸盐溶解度,使得土壤活性磷含量增加;另一方面,温度提升有助于增强微生物活性,从而提高土壤有机质的分解矿化速率,降低了土壤氧化还原电位,使土壤中铁结合态磷中的Fe3+还原为Fe2+,土壤固相铁结合态磷转移至溶液中;另外,土壤微生物呼吸作用产生的CO2可使钙结合态磷溶解而使土壤溶解性磷含量增加[26].本研究还显示,土壤MB-P含量随着温度的升高而增加,说明10~25℃范围内的设施环境温度,有利于土壤微生物增殖而增加其生物量,同时需要同化更多磷素[27],这将减少CaCl2-P和Olsen-P等磷素流失的可能性,且较高的MB-P含量有利于维持作物磷素供应.
2.2 酸化对设施土壤活性磷的影响
由图2(a)可知,对照土壤(pH值为6.89)在整个培养期内的CaCl2-P含量保持相对稳定,而酸化处理的CaCl2-P含量均较对照显著增加(<0.05).培养前5d,酸化后的两种土壤(pH6.11和pH5.30)CaCl2-P含量增加迅速,较其起始值12.75mg/kg分别增加了3.31mg/kg和22.10mg/kg.90d培养结束时,与对照(pH=6.89)土壤CaCl2-P含量12.83mg/kg相比, pH值为6.11和5.30两种酸化处理土壤CaCl2-P含量分别提高了26.7%和156.1%.土壤Olsen-P受酸化的影响与CaCl2-P相似(图2(b)).土壤Olsen-P含量随酸化程度加大而显著上升(<0.05).培养结束时,两种酸化处理土壤(pH值为6.11和5.30)的Olsen-P含量比对照(60.01mg/kg)分别增加14.1%和91.5%.由图2(c)可以看出,酸化总体上可使土壤MB-P含量下降.培养前12d,与起始值相比,3种处理的土壤MB-P含量下降,在第12d时土壤MB-P含量均达到最低值,且pH值为6.11和5.30两种酸化处理的土壤MB-P含量较对照(60.93mg/kg)降低了37.8%和23.1%;之后,对照土壤(pH6.89)MB-P含量在60.93~75.07mg/kg范围内波动.酸化使土壤MB-P含量显著下降(< 0.05),如培养期结束,两种酸化处理土壤MB-P含量较对照分别降低13.3%和16.3%.pH值为6.11和5.30两种酸化处理土壤MB-P含量间的差异不显著.氮肥在土壤中分解后生成硝酸盐留在土壤中,设施环境缺乏淋洗条件,使得硝酸盐积累导致土壤pH值降低[9].土壤pH值是影响土壤活性的重要因素[12].本实验结果显示设施土壤的酸化问题增加了土壤磷素流失的风险.在90d培养期内,酸化可使土壤CaCl2-P含量显著增加,原因可能在于土壤pH值下降,促进了铁结合态磷、钙结合态磷、闭蓄态磷等固相无机磷的溶解,也可能与土壤黏粒含量、离子交换能力及土壤磷吸附饱和度等性质发生改变有关[28].
土壤Olsen-P含量随设施土壤酸化程度加大而显著上升(<0.05).Olsen-P包括水溶态磷和交换态磷(主要为后者),土壤pH值降低一方面可活化土壤难溶性磷,提高土壤磷素的生物有效性;另一方面,土壤pH值下降可提高磷在土壤固相表面的可交换能力,有利于Olsen-P的形成[29].尽管有90d的培养时间,酸化总体上使设施土壤MB-P含量下降,这与微生物对土壤pH值的适应有关,土壤pH值通过微生物的活性而影响MB-P的形成[30-31].土壤pH值变化较大时,土壤微生物往往需要相当长的驯化适应期,在适应期内微生物增殖受限,形成的微生物生物量小,微生物增殖时吸收磷所形成的土壤MB-P[32]含量自然就低.
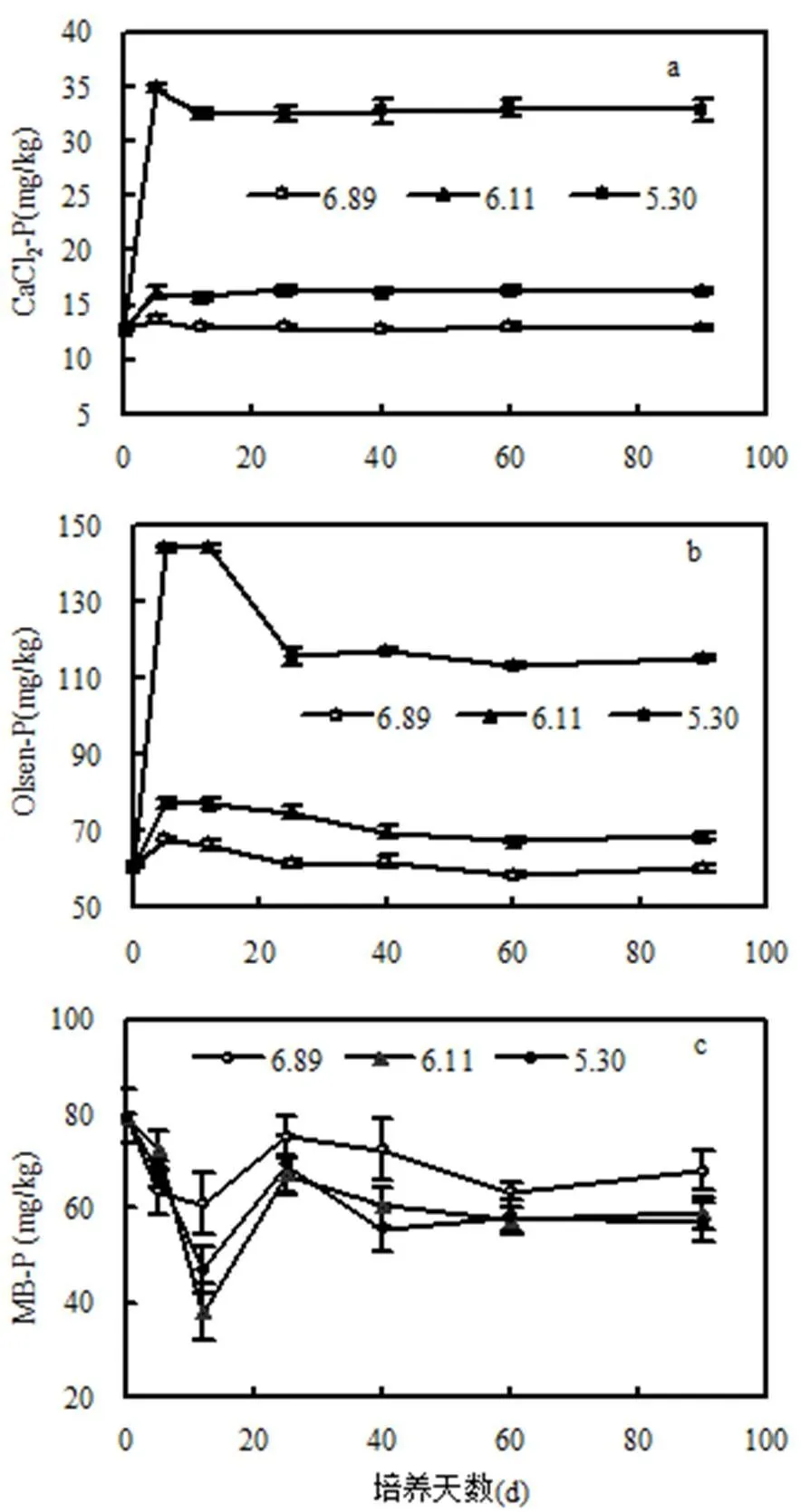
图2 不同pH值下设施土壤活性磷的动态变化
2.3 盐化对设施土壤活性磷的影响
图3(a)显示,在培养前40d内,3种盐化程度土壤间的CaCl2-P含量的规律性不明显;第40d至培养结束,与可溶性盐含量为1.90g/kg的对照相比,中度盐化土壤(可溶性盐含量为3.05g/kg)的CaCl2-P含量降低,重度盐化土壤(可溶性盐含量为5.01g/kg)的CaCl2-P含量却增加,但3种处理土壤CaCl2-P含量间的差异并不显著.可见,设施土壤盐化对土壤磷素的流失风险影响不大.
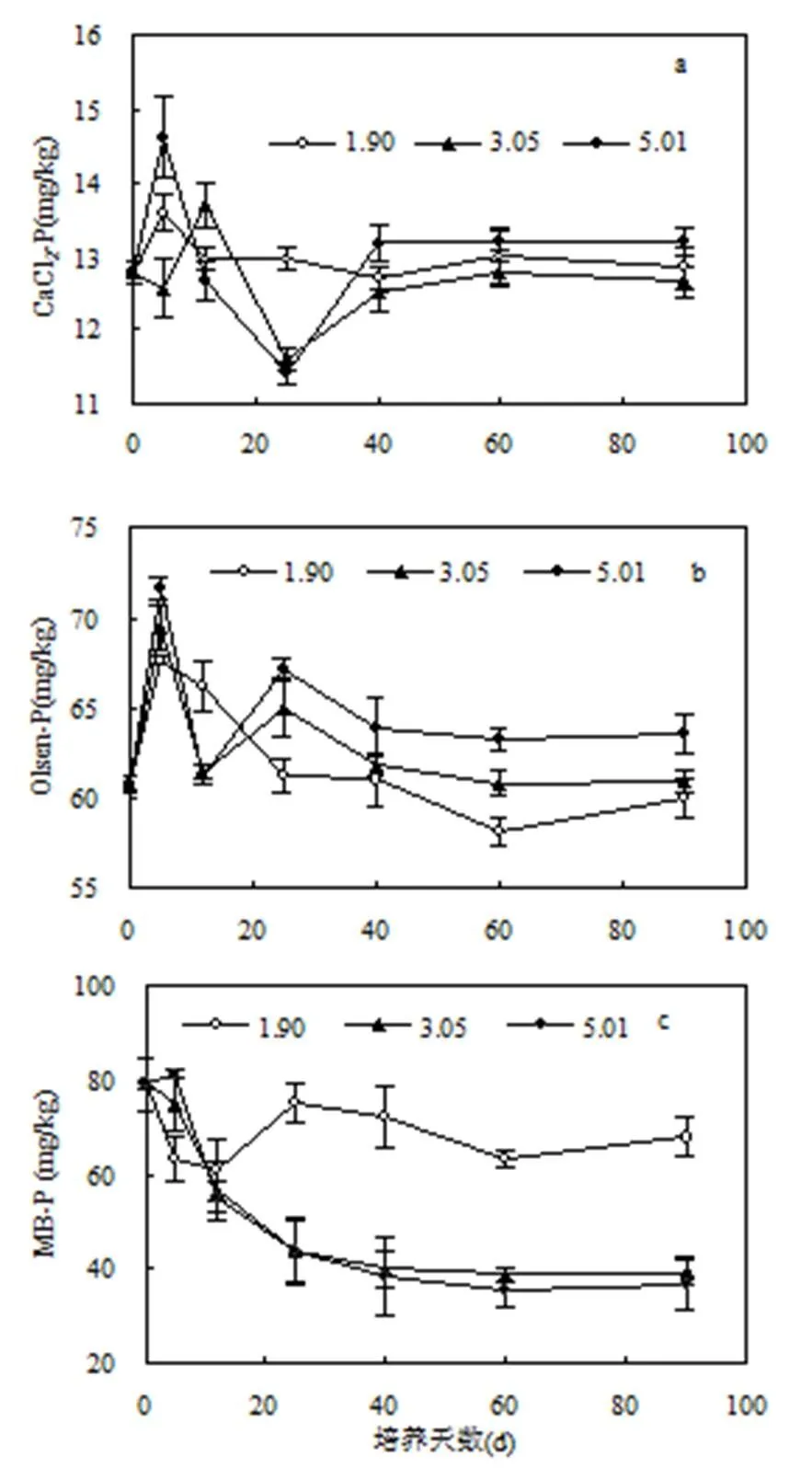
图3 不同盐化程度下设施土壤活性磷的动态变化
由图3(b)显示的土壤Olsen-P含量变化可见,培养前25d内,3种盐化程度土壤间的Olsen- P含量波动较大,无明显规律;第25d后,与对照相比,土壤Olsen-P含量随盐化程度的加重而上升.培养结束时,对照土壤Olsen-P含量为60.01mg/kg,中度和重度盐化土壤的Olsen-P含量较对照分别高出1.6%和6.0%.由图3(c)可见,盐化对设施土壤MB-P含量变化的影响在第12d存在拐点,即12d前,中度和重度盐化土壤的MB-P含量均比对照要高,而12d后这种趋势发生逆转,中度和重度盐化土壤的MB-P含量均显著低于对照(0.05).在第5d时,对照土壤MB- P含量为63.41mg/kg,中度和重度的土壤MB-P含量较对照分别增加了18.3%和28.3%.培养结束时,对照土壤MB-P含量为67.92mg/kg,中度和重度的土壤MB-P含量较对照分别下降了42.2%和45.8%.
研究结果显示,不同盐化程度土壤对CaCl2-P含量的影响不显著,这说明设施土壤盐渍化问题可不作为土壤磷素流失风险管控的主导因素.培养25d后,中度和重度盐化土壤的Olsen-P含量较比照略有增加,这可能与固相体系中可溶性盐基离子增加了固相磷的溶解和解吸等过程有关[33].盐化可使土壤MB-P含量降低40%以上,说明模拟的中度和重度两种土壤盐化程度已超过供试设施土壤微生物群落对盐基离子的耐受范围.过高的土壤盐分抑制了土壤微生物的生命活动[34],使土壤MB-P含量大幅度下降.
2.4 三种设施环境条件对土壤微生物生物量碳及微生物生物量碳磷比变化的影响
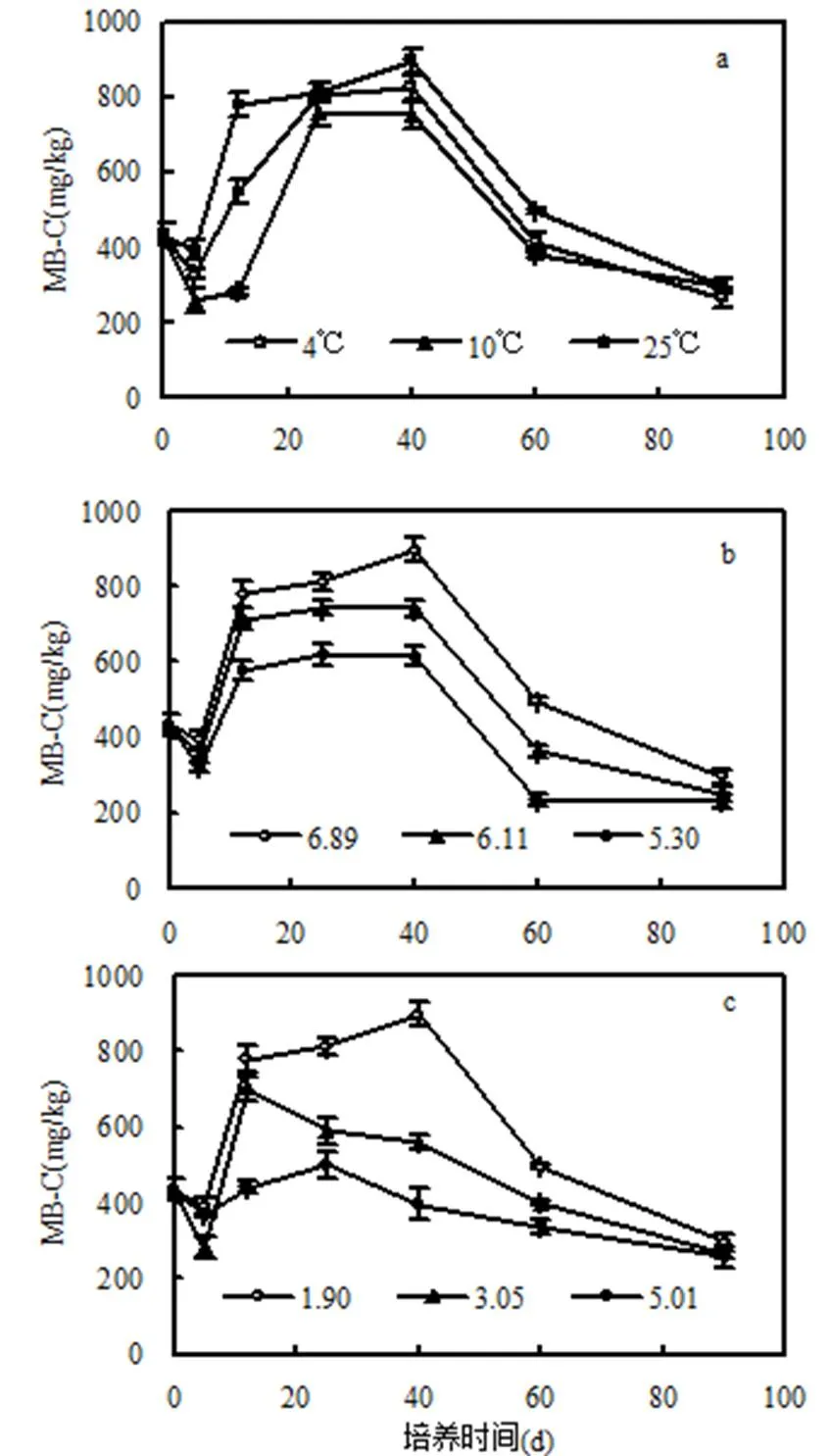
图4 不同设施环境条件下土壤微生物生物量碳的动态变化
微生物是土壤磷素转化的主要驱动力.土壤MB-P与微生物生物量大小和微生物吸收磷能力这两个指标有关.土壤MB-C是描述微生物生物量的常用指标.图2(c)和图3(c)显示土壤酸化和盐化使MB-P下降,这与对MB-C的影响趋势(图4b和图4c)基本一致,说明设施土壤酸化和盐化条件下土壤MB-P下降可能主要受微生物生物量大小的制约.
微生物在构建自身组织时可形成MB-C和MB-P,土壤MB-C/P取决于土壤微生物对环境条件的适应性及其微生物生物量[27].由3种设施环境条件的动态变化(图5)可见,设施环境温度提升使土壤MB-C/P有降低的趋势.尤其是在培养第40d时,10℃和25℃处理的土壤MB-C/P比4 ℃对照的要低33.4%和36.8%(图5a).第40d时,与4℃对照的土壤MB-C相比,10℃处理降低9.1%,25℃处理升高8.5%(图4a).设施环境温度从4℃提升至10 ℃,土壤MB-C下降而MB-P却上升(图1c),土壤MB-C/P降低只能是微生物对磷的吸收固持能力增强所致,说明设施环境温度从4℃提升到10℃时,土壤MB-P的变化受控于微生物吸收磷的能力大小.当设施环境温度从10℃提升至25℃时, MB-P和MB-C均呈增加趋势(图1c和图4c),而土壤MB-C/P比4℃对照低,这可能是由于土壤微生物生物量和微生物吸收磷能力的共同作用的平衡结果.图5(b)和图5(c)的结果显示,土壤酸化和盐化这2种条件对土壤MB-C/P的影响规律并不明显,但从培养期的第40d至培养结束这一时间段,土壤MB-C/P的动态变化存在共性,即土壤MB-C/P均随时间延长整体上呈下降趋势.
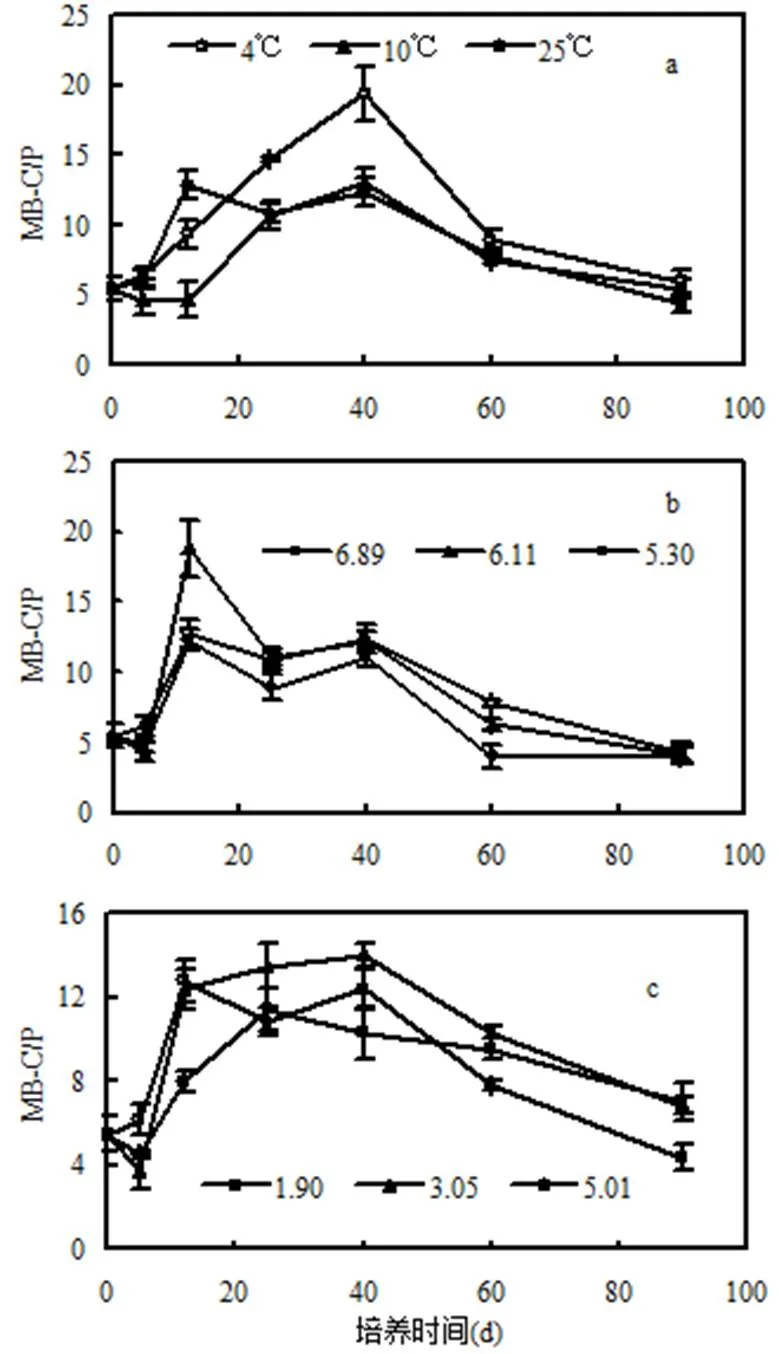
图5 不同设施环境条件下土壤微生物生物量碳磷比的动态变化
土壤MB-C/P反映了土壤微生物对磷有效性的调节作用潜力.当MB-C/P值较小时,土壤微生物释放磷的潜力较大,从而发挥补充有效磷库的功能.而当MB-C/P值过高时,微生物处于缺磷状态,趋于吸收土壤中有效磷,从而与作物争夺土壤中的有效磷[35-37].由此可见,在环境温度、土壤酸化和盐化这3种典型设施环境条件下,土壤MB-C/P最后均有所下降,微生物最终有可能固定吸收土壤中富余的磷素,具有发挥补充土壤有效磷库功能的潜力.
3 结论
3.1 设施环境温度增加,土壤CaCl2-P、Olsen-P和MB-P等活性磷的含量均增加,尤其从4℃提升至10℃,土壤CaCl2-P和Olsen-P含量增加尤为突出.设施环境温度低幅度提升虽利于土壤磷素生物有效性的提高,但也增加了磷素流失的风险.
3.2 土壤CaCl2-P和Olsen-P的含量随土壤酸化程度的加重而显著提高,设施土壤的酸化不利于土壤MB-P的形成.减缓设施土壤的酸化进程有利于土壤磷素的科学调控.
3.3 3种盐化程度土壤CaCl2-P含量间的差异不显著,设施土壤盐化问题对土壤磷素的流失风险影响不大.盐化程度对土壤Olsen-P的影响不显著,但设施土壤MB-P受盐化的影响存在时间拐点,后期随盐化程度加重而显著下降.
3.4 环境温度升高、土壤酸化及盐化3种典型设施环境条件对土壤MB-C/P的影响存在阶段性,土壤MB-C/P在后期均随时间延长整体上呈下降趋势.说明是设施土壤微生物最终有可能固定吸收土壤中富余的磷素,具有发挥补充土壤有效磷库功能的潜力.
[1] 张乃明,常晓冰,秦太峰.设施农业土壤特性与改良[M]. 北京:化学工业出版社, 2008.
[2] 余海英,李廷轩,张锡洲.温室栽培系统的养分平衡及土壤养分变化特征[J]. 中国农业科学, 2010,43(3):514-522.
[3] 鲁如坤.土壤-植物营养学原理和施肥[M]. 北京:化学工业出版社, 1998.
[4] 张经纬,曹文超,严正娟,等.种植年限对设施菜田土壤剖面磷素累积特征的影响[J]. 农业环境科学学报, 2012,31(5):977-983.
[5] 吴 漩,郑子成,李廷轩,等.灌水对不同次生盐渍化水平设施土壤氮、磷迁移特征的影响[J]. 水土保持学报, 2013,27(4):23-28.
[6] 李春越,王 益,党廷辉,等.不同施肥配比对土壤磷素固液相分配及组分的影响[J]. 中国环境科学, 2011,31(2):265-270.
[7] Potter R L, Jordan C F, Guedes R M, et al. Assessment of a phosphorus fractionation method for soils: problems for further investigation [J]. Agriculture Ecosystems & Environment, 1991, 34(1-4):453-463.
[8] 黄 敏,尹维文,余婉霞,等.两种外源性有机物料对设施土壤磷变化的影响[J]. 农业环境科学学报, 2015,34(3):501-508.
[9] 李东坡,武志杰,梁成华,等.设施土壤生态环境特点与调控[J]. 生态学杂志, 2004,23(5):192-197.
[10] 刘 凯,倪兆奎,王圣瑞,等.鄱阳湖不同高程沉积物中磷形态特征研究[J]. 中国环境科学, 2015,35(3):856-861.
[11] Rubaek G H, Sibbesen E. Soil phosphorus dynamics in a long-term field experiment at Askov [J]. Biology & Fertility of Soils, 1995,20(1):86-92.
[12] Devau N, Cadre E L, Hinsinger P, et al. Soil pH controls the environmental availability of phosphorus: Experimental and mechanistic modelling approaches [J]. Applied Geochemistry, 2009,24(11):2163-2174.
[13] 蔡 观,胡亚军,王婷婷,等.基于生物有效性的农田土壤磷素组分特征及其影响因素分[J]. 环境科学, 2017,38(4):1605-1612.
[14] 黄 敏,余婉霞,李亚兵,等.武汉城郊设施菜地土壤pH与可溶性盐分的变化规律分析[J]. 水土保持学报, 2013,27(6):51-61.
[15] 夏立忠,杨林章.大棚番茄优化施肥与土壤养分和盐分的变化特征[J]. 中国蔬菜, 2003,1(2):4-7.
[16] Borken W, Xu Y J, Brumme R, et al. A Climate Change Scenario for Carbon Dioxide and Dissolved Organic Carbon Fluxes from a Temperate Forest Soil Drought and Rewetting Effects [J]. Soil Science Society of America Journal, 1999,63(6):1848-1855.
[17] Jonasson S, Castro J, Michelsen A. Litter, warming and plants affect respiration and allocation of soil microbial and plant C, N and P in arctic mesocosms. [J]. Soil Biology & Biochemistry, 2004,36(7):1129-1139.
[18] 宋雄儒,尚振艳,李旭东,等.贺兰山西坡不同海拔梯度草地土壤磷特征及其影响因素[J]. 草业科学, 2015,32(7):1054-1060.
[19] Houba V J D, Novozamsky I, Lexmond T M, et al. Applicability of 0.01M CaCl2as a single extraction solution for the assessment of the nutrient status of soils and other diagnostic purposes [J]. Communications in Soil Science & Plant Analysis, 1989, 21(19/20):2281-2290.
[20] Brookes P C, Powlson D S, Jenkinson D S. Measurement of microbial biomass phosphorus in soil [J]. Soil Biology &Biochemistry, 1982,14(4):319-329.
[21] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C [J]. Soil Biology & Biochemistry, 1987,19(19):703-707.
[22] Oberson A, Friesen D K, Rao I M, et al. Phosphorus transformations in an Oxisol under contrasting land-use systems: the role of the soil microbial biomass [J]. Plant & Soil, 2001, 237(2):197-210.
[23] 杨丽霞,杨桂山,苑韶峰.施磷对太湖流域典型蔬菜地磷素流失的影响[J]. 中国环境科学, 2007,27(4):518-523.
[24] 王敏锋,严正娟,陈 硕,等.施用粪肥和沼液对设施菜田土壤磷素累积与迁移的影响[J]. 农业环境科学学报, 2016,35(7): 1351-1359.
[25] 章爱群,贺立源,赵会娥,等.有机酸对土壤无机态磷转化和速效磷的影响[J]. 生态学报, 2009,29(8):4061-4069.
[26] 韩沙沙,温琰茂.富营养化水体沉积物中磷的释放及其影响因[J]. 生态学杂志, 2004,23(2):98-101.
[27] 李洪杰,刘军伟,杨 林,等.海拔梯度模拟气候变暖对高山森林土壤微生物生物量碳氮磷的影响[J]. 应用与环境生物学报, 2016,22(4):599-605.
[28] 彭 娜,王凯荣, Buresh R. J.,等.不同水分条件下施用稻草对土壤有机酸和有效磷的影响[J]. 土壤学报, 2006,43(2):347-351.
[29] Kpomblekou-A K, Tabatabai M A. Effect of low-molecular weight organic acids on phosphorus release and phytoavailabilty of phosphorus in phosphate rocks added to soils [J]. Agriculture Ecosystems & Environment, 2003,94(2):275-284.
[30] Blackewll M S A, Brokes P C, Fuente-Martinez N D L, et al. Phosphorus solubilization and potential transfer to to surface waters from the soil microbial biomass following drying- rewetting and freezing-thawing [J]. Advances in Agronomy, 2010,106(1):1-35.
[31] 李春越,王 益, Philip B,等.pH对土壤微生物C/P比的影响[J]. 中国农业科学, 2013,46(13):2709-2716.
[32] 王 珊,李廷轩,张锡洲,等.设施土壤微生物学特性变化研究[J]. 水土保持学报, 2006,20(5):82-86.
[33] 安 敏,文 威,孙淑娟,等.pH和盐度对海河干流表层沉积物吸附解吸磷(P)的影响[J]. 环境科学学报, 2009,29(12):2616- 2622.
[34] 樊金萍,张建丽,王 婧,等.节水灌溉对盐渍土盐分调控与土壤微生物区系的影响[J]. 土壤学报, 2012,49(4):835-840.
[35] Chen G C, He Z L. Determination of soil microbial biomass phosphorus in acid red soils from southern China [J]. Biology & Fertility of Soils, 2004,39(6):446-451.
[36] Sharma P, Rai S C, Sharma R, et al. Effects of land-use change on soil microbial C, N and P in a Himalayan watershed [J]. Pedobiologia, 2004,48(1):83-92.
[37] Amador J A, Jones R D. Response of carbon mineralization to combined change in soil moisture and carbon-phosphorus ratio in a low phosphorus histosol [J]. Soil Science, 1997,162(4):275-282.
Effects of typical greenhouse factors on labile phosphorus in soil.
HUANG Min*, LIANG Rong-xiang, YIN Wei-wen, LIU Xi, PU Chang-ying, DUAN Jun-bo
(School of Resources and Environmental Engineering, Wuhan University of Technology, Wuhan 430070, China)., 2018,38(5):1818~1825
Labile phosphorus was considered as an important phosphorus pool in soil and played essential roles in soil phosphorus cycling. Based on a 90-day laboratory experiments, the effects of three greenhouse factors including environmental temperature, soil acidification and salinization on soil labile phosphorus were studied through the dynamics of readily desorption phosphorus (CaCl2-P), available phosphorus (Olsen-P), microbial biomass phosphorus (MB-P) and ratio of microbial biomass carbon to phosphorus (MB-C/P) in greenhouse soil. Results showed that MB-P content in the greenhouse soil was increased significantly with the rising of environmental temperature. Compared with the control (incubated under 4℃), the contents of CaCl2-P and Olsen-P in the greenhouse soil were increased by 15.6% and 2.7% under 10℃ at the end of incubation, respectively. Acidification of greenhouse soil promoted an increase in the contents of CaCl2-P and Olsen-P but a decrease in the MB-P content. Compared with the control (at pH 6.89) at the end of incubation, it was increased by 26.7% and 156.1% for CaCl2-P content, increased by 14.1% and 91.5% for Olsen-P content, but decreased by 13.3% and 16.3% for MB-P content in acidified soil at pH 6.11 and 5.30, respectively. Soil salinization showed no significant effect on the contents of CaCl2-P and Olsen-P in soil, whereas soil MB-P content was decreased dramatically with the aggravation of salinization after 12days of incubation. Compared with the control (1.90g/kg for soluble salt in soil), MB-P content in salinized soils with 3.05g/kg and 5.01g/kg of soluble salt was decreased by 42.2% and 45.8%, respectively. In addition, the MB-C/P in greenhouse soil after 40-day incubation showed a general downtrend with the increment in environmental temperature, soil acidification and salinization. Therefore, it was concluded that management practices, such as increasing environmental temperature in a range of 4~25℃, slowing down the acidification process of soil pH value from 6.89 to 5.30, and controlling the salinization process of soil soluble salt from 1.90g/kg to 5.01g/kg, could keep supplying phosphorus in greenhouse soil to plants. These practices could also reduce the risk of phosphorus loss from soil, and enhance the potential of available phosphorus pool which were regulated by soil microorganisms.
greenhouse soil;labile phosphorus;environmental temperature;soil acidification;soil salinization
X142;S153.4
A
1000-6923(2018)05-1818-08
2017-10-12
中国留学基金委资助项目(留金发[2014]3012);国家自然科学基金资助项目(41101210);武汉理工大学国家级大学生创新创业训练计划项目(20141049708004)
* 责任作者, 副教授, huangmin@whut.edu.cn
黄 敏(1973-),女,湖北荆州人,副教授,博士,主要从事土壤环境与区域生态研究.发表论文20余篇.

