K2FeO4氧化降解3,4-二甲基苯胺的机理研究
杨唯艺,李 孟,张 倩*,项文琪,2
K2FeO4氧化降解3,4-二甲基苯胺的机理研究
杨唯艺1,李 孟1,张 倩1*,项文琪1,2
(1.武汉理工大学土木工程与建筑学院,湖北 武汉 430070;2.武汉市政工程设计研究院有限责任公司,湖北 武汉 430023)
以3,4-二甲基苯胺为目标污染物,高铁酸钾(K2FeO4)为氧化剂,考察催化氧化过程中的表观动力学及反应机制,确定高铁酸钾降解3,4-二甲基苯胺的表观动力学方程为:= 0.0043A0.486B1.2477,反应级数为1.7337,符合准二级动力学方程.同时通过GC/MS技术,分析降解过程的中间产物,推测在高铁酸钾的作用下,3,4-二甲基苯胺先转变成2,4-二甲基苯胺,然后苯环上的氨基及甲基先后被氧化,生成4-硝基间苯二甲酸,再发生脱羧反应,生成硝基苯,硝基苯被高铁酸钾进一步攻击,生成苯环正离子,其后开环生成一系列小分子烃类物质,这些物质继续被氧化,最终生成二氧化碳与水.推测该氧化还原过程的控制反应为两步:第一步,高铁酸钾攻击3,4-二甲基苯胺苯环上的侧链;第二步为苯环的开环反应.此降解过程主要包括表面络合催化与界面催化两种反应机制.
高铁酸钾;3,4-二甲基苯胺;准二级动力学;表面络合催化;界面催化
3,4-二甲基苯胺是一种无色至淡黄色油状液体,有刺激性臭味,在空气中或阳光下易氧化使色泽变深.它是除草剂二甲戊乐的中间体,亦是医药维生素B2的中间体[1].该物质是占据制药行业浓污排水量81%的核黄素生产线的主要生产原料之一,其难被生物降解[2],在医药生产废水中通常要经过复杂的深度处理[3]才能达到有效降解.苯胺类物质具有强烈毒性,会危害人体的心脑血管系统、中枢神经系统、肝脏和肾脏等,是一种强烈的致癌物,若不经有效降解就排放到水体中会对人类的生活生产造成极大的危害[4].
高铁酸钾溶于水后,会电离出高铁酸根离子,该离子中的铁原子为正六价,处于铁元素的最高价态[5],具有极强的氧化能力.它在酸性、碱性条件下氧化还原电位分别为2.20V、0.72V[6],明显高于现今市面上的主流强氧化剂,这表明其在杀菌、消毒、去除难降解有机物等[7-8]水处理领域都具有优秀的应用前景.夏庆余等[9]研究发现向体积为25mL的苯胺(75mg/L)溶液中加入9mL高铁酸钾(18.4mmol/L)溶液,在pH值为5条件下,苯胺与COD去除率能分别达到99.6%与82%;董娟[10]研究发现,以物质的量比为10的比例向硝基苯废水中投加高铁酸钾,在pH值为9下反应30min后,水样中硝基苯和COD去除率能分别达到85%与55%;张洋等[11]研究发现在pH值为4,30℃的条件下,以0.5g/g COD的比例向危废填埋场渗滤液中加入高铁酸钾反应40min后,废液中CODcr含量从558.5mg/L降至159.1mg/L,去除率达到71.51%, B/C比从0.129增至0.315,可生化性得到改善; Jiang等[12]提出当采用硫酸铁与氯气联用工艺消毒时,投加量皆为8mg/L的情况下,才能完全消灭水体中所有的大肠杆菌,而相同条件下,只需投加6mg/L的高铁酸钾便能达到100%灭菌效果,相较于其他消毒剂,其用量更少且更为高效.
3,4-二甲基苯胺作为医药废水中一种典型难降解有机污染成分,目前对其有效降解的研究大多集中于光催化或者厌氧生物预处理等工艺,虽然取得了一定的效果,但仍普遍存在光能转换效率差,催化剂活性不高、处理效率较低等缺陷[13].因此本文拟利用经电解法制备出的高铁酸钾,考察其对3,4-二甲基苯胺的降解规律和效果,通过GC/MS技术检测降解液的成分来推测降解历程,并结合表观动力学的结果分析,对高铁酸盐各组分在降解过程中的反应机制进行深入讨论,以期为实际废水处理的应用提供参考依据.
1 材料与方法
1.1 实验试剂
3,4-二甲基苯胺、氢氧化钾、氢氧化钠为分析纯,二苯胺磺酸钠为化学纯,均购自国药集团化学试剂有限公司.二氯甲烷为色谱纯,购自天津市科密欧化学试剂有限公司.高铁酸钾、愈创木酚为分析纯,购自上海麦克林生化科技有限公司.浓硫酸、浓盐酸均为分析纯,购自信阳市化学试剂厂.其他试剂均为分析纯,购自国药集团化学试剂有限公司.实验用水为去离子水.
1.2 K2FeO4的制备
采用电解法[14]制备高铁酸钾,电解槽采用隔膜式,以高纯铁片作为阳极,泡沫镍板作为阴极,电解液采用氢氧化钾溶液.在外加电源条件下,作为阳极的高纯铁片会失去电子,并与电解液中的氢氧根离子发生反应,生成高铁酸根离子与水.而阴极处会发生还原反应,水分子从泡沫镍板处得到电子,生成氢氧根离子与氢气[15].综合考虑电流效率[16]与高铁酸钾浓度两项因素,确定最佳制备条件为:初始氢氧化钾浓度为16mol/L,电解溶液温度为50℃,阳极电流密度为50mA/cm2,电解时间5h,此时,高铁酸钾浓度可达11.13g/L.采用亚铬酸盐法[17]测定样品的高铁酸钾纯度,用环己烷与无水乙醇对高铁酸钾粗制品进行脱水、脱碱处理,纯度从84.2%提高至93.8%,纯化效果明显.
1.3 K2FeO4的材料表征
采用D8Advance X射线衍射仪(X-ray Diffraction, XRD,德国Bruker公司)对制备的高铁酸钾进行X射线衍射分析,测试条件:2,扫描范围:0°~80°,以4°/min速度扫描.
采用JSM-IT300扫描电子显微镜(Scanning Electron Microscope, SEM,日本电子株式会社)观察制备的高铁酸钾的表面特征.测试条件:二次电子像分辨率:3.0nm;背散射电子像分辨率:4.0nm;放大倍数范围:5倍~300000倍;加速电压: 0.3kV~30kV.
采用Phoenix能谱仪(Energy Disperse Spectroscopy, EDS,美国通用公司)进行表面元素分析.测试条件:能量扫描范围:0~5000eV;通过能范围:1~400eV;束斑范围:20~900μm.
1.4 表观动力学分析
配置一系列3,4-二甲基苯胺标准溶液,在451nm至459nm波长下,每隔1nm测一次吸光度,以去离子水为参比测吸光度,将测得的吸光度减去空白样的吸光度,并对照相应的3,4-二甲基苯胺含量绘制校准曲线[18].最终确定3,4-二甲基苯胺溶液的特征峰吸收波长为456nm,其线性方程为:
=7.4×10-3-3.5×10-3(2=0.9993) (1)
选用无水Na2SO3作为终止剂,在此基础上采用初始浓度法,测定初始反应速率和反应级数.分别固定K2FeO4(投加量为18mg)和3,4-二甲基苯胺(浓度为20mg/L)的浓度,控制初始反应的pH值为4,测定两种情况下3,4-二甲基苯胺浓度随时间变化的曲线,运用Curve Expert 1.4软件,对上述曲线分别进行5阶多项式拟合,并求出在T=0时刻的导数,算出不同初始浓度3,4-二甲基苯胺(高铁酸钾)对应的初始反应速率,然后以lgA0(lgB0)为横坐标,lg(-dAT=0/d)为纵坐标,进行曲线拟合,最终求出K2FeO4降解3,4-二甲基苯胺的表观动力学方程.测得反应6min后溶液的pH值为7.
1.5 机理分析
配制80mg/L 3,4-二甲基苯胺溶液1L,转移至容量为2L的锥形瓶中,控制溶液初始pH为4.在磁力搅拌条件下,向溶液中加入392.22mg的高铁酸钾粉末,反应30min后,加入6.0mL的1mol/L Na2SO3溶液,继续搅拌2min以至紫色完全褪去,此时pH值上升至9.5.将反应后的水样按照EPA Method 625-Base/Neutrals and Acids中的方法进行预处理.分析仪器采用气相色谱与质谱仪联用系统.将反应后水样的质谱图与工作站中的NIST谱库中的图谱进行比较,并参考保留时间、置信度及相关文献,选出可能性最高的对应谱图来确定该化合物.而对于相似度较低的物质,则根据质谱图特征峰来定性[19].
1.6 分析方法
降解过程的中间产物分析仪器采用Entech7100-Agilent 7890/5975气相色谱与质谱仪(Gas Chromatograph-Mass Spectrometer-computer,GC/MS)联用系统(美国Entech公司-美国Agilent公司),气相色谱柱采用HP-5毛细管色谱柱.分析条件如下:使用高纯度氦气作为载气,载气流量为1mL/min,分流比采取10:1,进样量取1μL.色谱柱温度:50℃保持2min(溶剂延迟),以5℃/min速率升温至150℃,保持1min后,再以20℃/min速率升温280℃,保持5min.电离方式为EI,质量扫描范围35amu~500amu,检索谱库为NIST谱库.3,4-二甲基苯胺的含量采用邻甲氧基苯酚分光光度法[20]测定.
2 结果与讨论
2.1 K2FeO4的材料表征分析
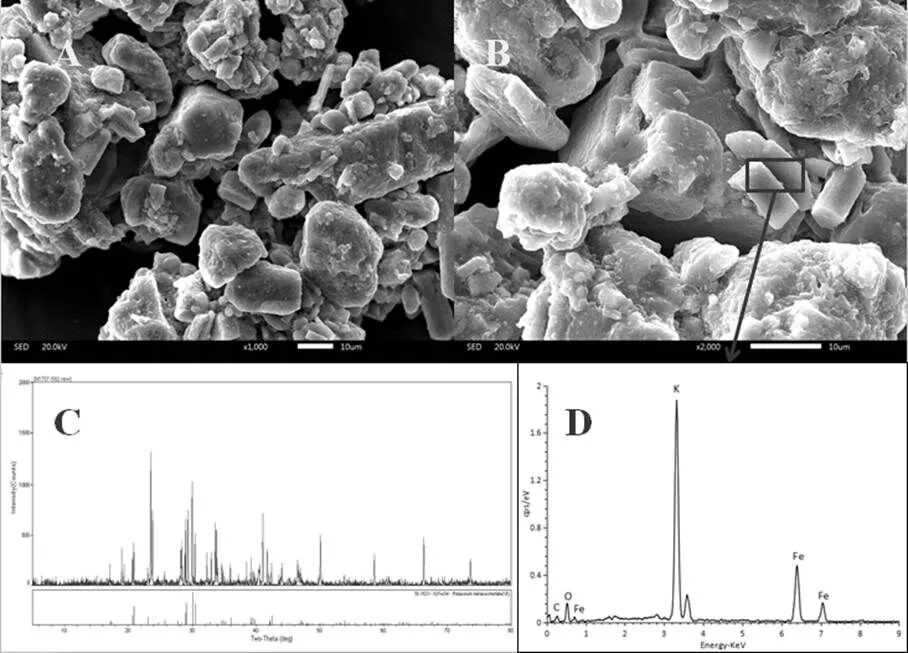
图1 自制高铁酸钾的相关材料表征
图A:SEM1000×,图B:SEM2000×,图C:XRD,图D:EDS
通过图1A、图1B可知,在放大1000倍的条件下可观察到制备的高铁酸钾晶体为形状不规则、尺寸无明显规律性的多边形柱体.在放大2000倍下,可发现其晶体多为长柱体,长度约为10 μm,表面粗糙且有少许微粒附着.通过自制K2FeO4样品的X射线衍射图与纯品K2FeO4衍射卡片的对比(图C),可明显看到自制K2FeO4样品的X射线衍射图中存在一些除高铁酸钾特征吸收峰之外的峰,这些峰可能是由于自制K2FeO4中含有氢氧化钾、氢氧化铁或氧化铁等物质所致.结合图A、B、C推测这些微粒可能是高铁酸钾自身分解产生的氢氧化铁、羟基氧化铁[21]等固体物质.而当高铁酸钾溶于水后这些氧化铁会生成新生态的水合氧化铁[22],其粒径非常小,具有良好的吸附性能,能够强化高铁酸钾的氧化作用.根据EDS的分析结果(图D)可知,送检的样品中含有K、Fe、O、C元素,且Fe元素出现了3个不同的峰,推测是由于高铁酸钾晶体中含有不同价态的Fe.而高铁酸钾溶于水后生成Fe3+对高铁酸钾的氧化和絮凝作用可起到良好强化作用.高铁酸钾溶液中投加Fe3+可诱发FeO42-发生分解作用,产生氧化能力高于FeO42-自身3到5个数量级,同时产生具有絮凝作用的Fe(III)[23].这些不同价态的Fe使得高铁酸钾具有较高的活性,在反应过程中呈现氧化能力叠加的趋势.
2.2 pH值对3,4-二甲基苯胺去除效果的影响
高铁酸钾在水溶液中的稳定性会受到pH值影响,pH值对高铁酸盐在水溶液中的存在形式也有重大影响[24]:当pH值在0~1.6间时,其在水中主要以H3FeO4+形式存在;当pH值在1.6~3.5间时,其在水中主要以H2FeO4形式存在;当pH值在3.5~7.5间时,其在水中主要以HFeO4-形式存在;当pH值在7.5~10.5间时,其主要以FeO42-形式存在.这些不同形式的离子会影响高铁酸钾与3,4—二甲基苯胺的作用,通过实验研究了反应溶液的初始pH对3,4—二甲基苯胺的去除效果的影响,结果如图2所示.
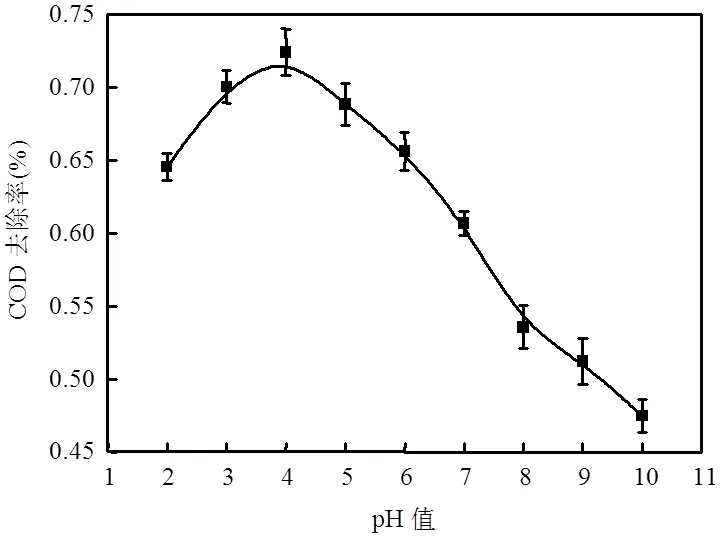
图2 反应溶液初始pH值对CODcr去除率的影响
由图2可知,随着溶液初始pH值的不断升高,CODcr去除率呈现出先升后降的现象.在pH值2~4区间时,CODcr去除率呈上升趋势,并在pH为4时,CODcr去除率达到最大值,此时CODcr去除率为72.42%.推测产生这一现象的原因可能是在酸性条件下,高铁酸钾的氧化还原电位较高,极强的氧化性使得高铁酸钾与有机物迅速作用,生成的Fe(III)可作为吸附絮凝剂,可增强高铁酸根与有机污染物的接触,从而使pH值升高至5~6时仍然有较高的CODcr去除率.而当pH继续升高时,高铁酸钾的氧化还原电位逐步降低,稳定性不断提高,较弱的氧化能力不能将水中的有机物降解,因此,表现出CODcr去除率随pH值的继续升高而迅速下降的趋势.
2.3 K2FeO4降解3,4-二甲基苯胺的表观动力学
2.3.1 表观动力学原理 高铁酸钾与3,4-二甲基苯胺的反应如下:
K
2
FeO
4
+3,4-二甲基苯胺→产物 (2)
假定反应进行时刻时,3,4-二甲基苯胺的浓度为A,溶液中高铁酸钾的浓度为B,反应速率为,则根据上述反应建立的表观动力学方程为:

假设3,4-二甲基苯胺的初始浓度为A0,高铁酸钾的初始浓度为B0,在=0时刻根据式(2)、式(3)可推出:

式中:为该反应的速率常数;为3,4-二甲基苯胺的反应级数;为高铁酸钾的反应级数.
2.3.2 表观动力学方程(1)固定K2FeO4的投加量 将1.4中固定高铁酸钾投加量后求出的3,4-二甲基苯胺剩余浓度随时间的变化绘制成曲线图,如图3所示.
将图3中的曲线进行曲线拟合,结果如图4所示.
故该线性回归方程为:
lg(-dAT=0/d)=0.486lgA0+0.470 (5)
这表明3,4-二甲基苯胺的反应级数为0.486,lg+lgB0=0.470.
(2)固定3,4-二甲基苯胺的初始浓度将1.4中固定3,4-二甲基苯胺浓度后求出3,4-二甲基苯胺剩余浓度随时间的变化绘制成曲线图,如图5所示:
如(1)中将图5中的曲线进行曲线拟合,得其线性回归方程为:
lg(-dAT=0/d)=1.2477lgB0-1.759 (6)
这表明高铁酸钾的反应级数为1.2477,lg+lgA0=-1.759.
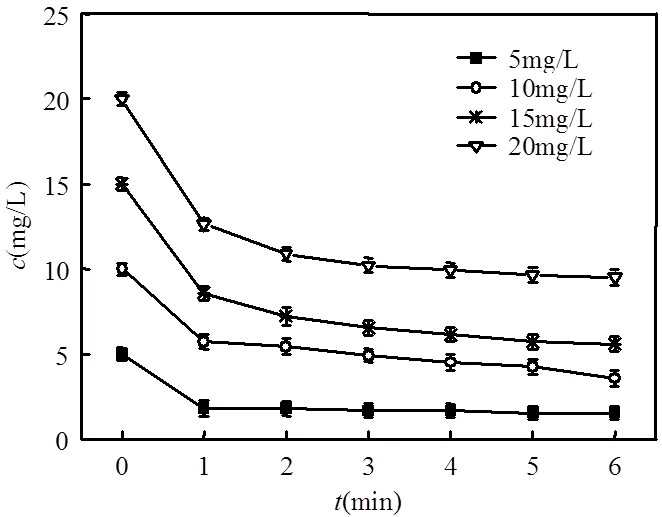
图3 3,4-二甲基苯胺浓度随时间的变化
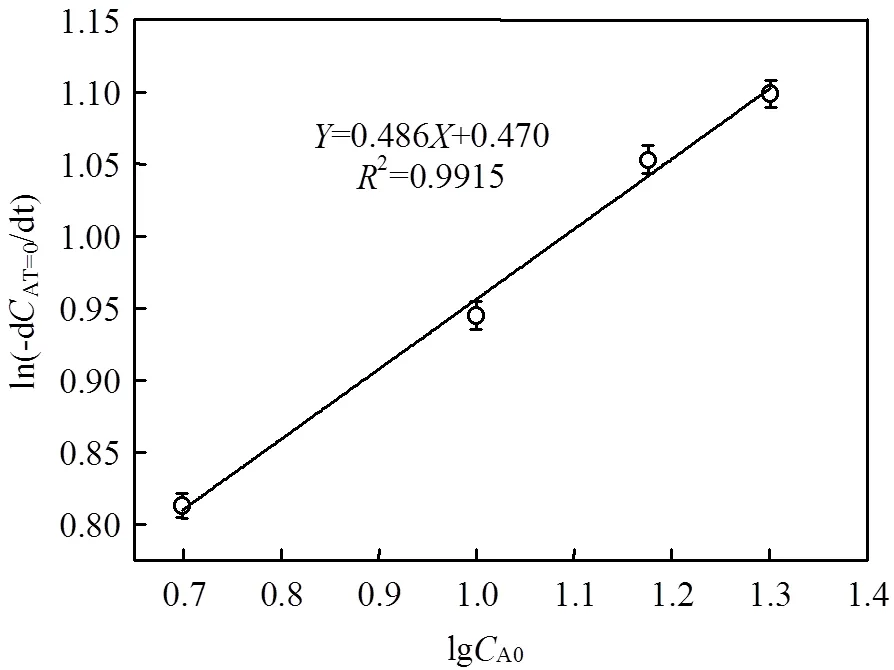
图4 lgCA0与lg(-dCAT=0/dt)的关系
将式(5)与式(6)相加可得:=0.0043.
将、、代入式(3),得3,4-二甲基苯胺与高铁酸钾的反应动力学方程为:= 0.0043A0.486B1.2477,高铁酸钾氧化还原3,4-二甲基苯胺的反应为1.7337级.
上述求出的反应级数接近于二级反应,故推测此反应的控制步骤应分为两步.第一步为高铁酸钾溶于水后释放出具有强氧化性的FeO42-,这些离子先攻击3,4-二甲基苯胺苯环上的侧链,将氨基与甲基分别氧化为硝基和羧基,再脱羧生成苯环正离子;第二步为高铁酸根进一步攻击苯环正离子,使其开环生成小分子烃类物质,这些物质继续被氧化降解,最终生成二氧化碳与水.
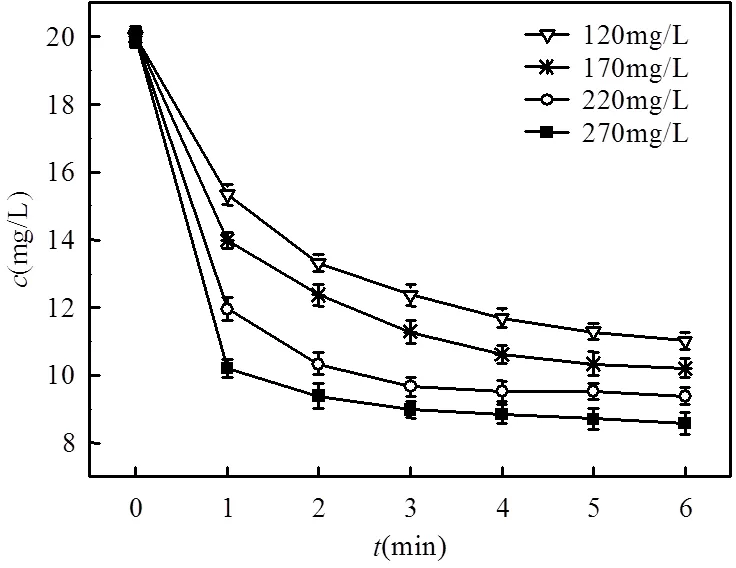
图5 3,4-二甲基苯胺浓度随时间的变化
2.4 K2FeO4降解3,4-二甲基苯胺机理分析
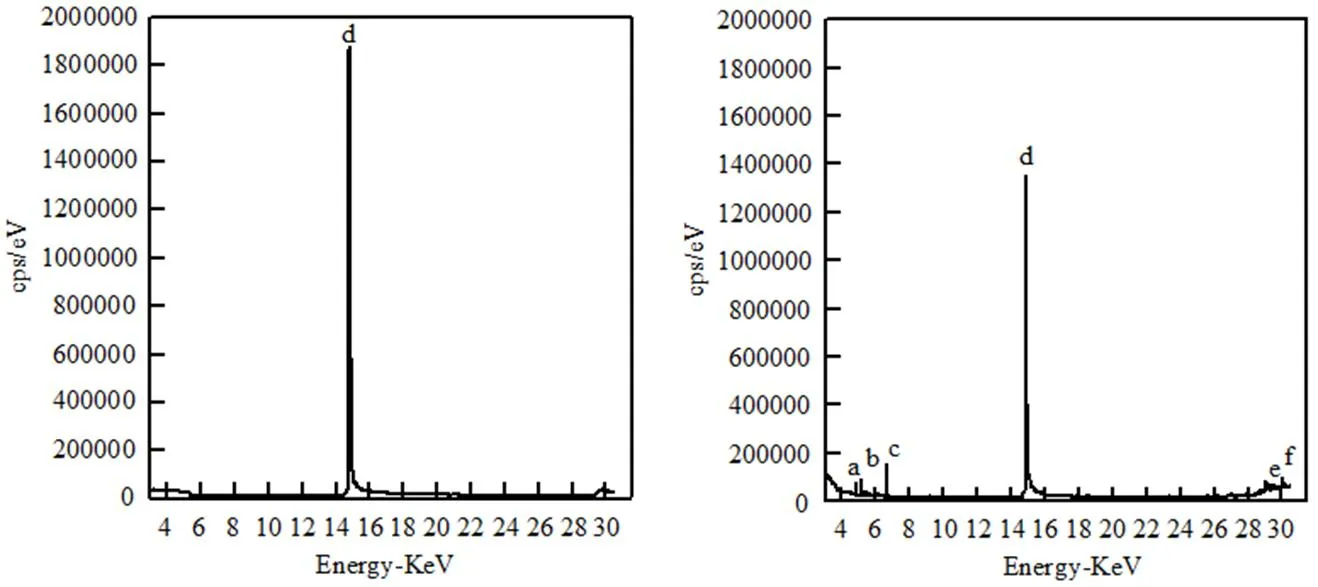
图6 3,4-二甲基苯胺原液与降解液的气相色谱质谱

表1 降解产物
2.4.1 降解中间产物 对比3,4-二甲基苯胺原液与降解液的气相色谱图,如图6所示.对液体中所含成分进行分析,结果如表1所示.
2.4.2 降解历程 在第一步反应中,酸性条件下K2FeO4分子由于质子化作用发生结构重整,在分子内发生氧化还原反应并在瞬间完成[25].在反应初始,由于氨基氮具有孤对电子,可以与苯环形成p-π共轭,具有比甲基与苯环形成的σ-π共轭更强的推电子效应.同时高铁酸钾在水解过程中会产生Fe(Ⅴ)、Fe(Ⅵ),这些具有强氧化性的基团使得与氨基相连的碳原子上电子云密度变低,邻位上电子云密度升高,而由于电子云的传递效应,间位上电子云密度变低,对位上电子云密度变高[26],故会使部分的3,4-二甲基苯胺间位上的甲基转移到邻位上,形成更稳定的2,4-二甲基苯胺(d),反应式如下:

高铁酸钾分解后产生FeO2-及Fe(OH)3络合物,这些活性物质提供的表面活性位点可吸附有机物形成表面络合物[27].而由于氨基还原性远高于甲基,所以高铁酸钾会与2,4-二甲基苯胺上的氨基先反应,高铁酸根离子先攻击氨基上的氢原子,产生一类似酯的键H-O-Fe,形成过渡态的桥状中间体.随后高铁酸根的Fe-O键发生断裂,通过耦合作用在表面络合物中发生电子转移,氧原子转移到氨基上,形成N-O-H,然后O-H键断裂,生成N-O•自由基与Fe(Ⅳ).N-O•自由基非常不稳定,会与Fe(Ⅳ)进一步反应生成N=O键与Fe(Ⅲ),反应式如下:

随后,高铁酸根继续攻击苯环上甲基的氢离子,使甲基上的一个C-H键变为C-O-H键,然后在表面络合物中发生电子转移,-CH2-OH基被进一步氧化成醛基-CHO,醛基上的羰基与水加成后,在高铁酸根作用下脱氢,变成羧基-COOH,生成4-硝基间苯二甲酸与Fe(Ⅲ).被还原生成的Fe(Ⅲ)、Fe(Ⅳ)增多,将产生更多的FeO2-及Fe(OH)3络合物,使得上述过程不断重复进行,高铁酸钾的氧化能力得到叠加.反应式如下:
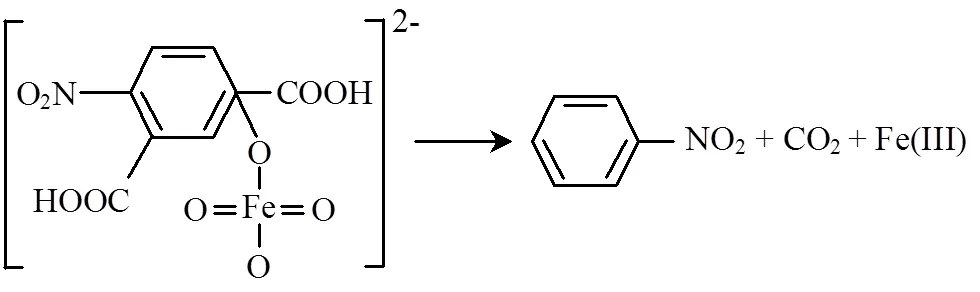
在第二步反应中,生成的硝基不断积累,游离态的FeO42-不断增多,这些有强吸电子作用的基团使得第一步反应形成的表面络合物中电子转移的速度变慢[28],随着形成的表面络合物不断增多,此时络合物之间开始竞争表面活性位,构成了复杂的界面反应,出现由过渡态金属离子到配体的电子迁移[29].根据脱羧反应的作用机理[30],高铁酸根作为一强吸电子基团,当其与4-硝基间苯二甲酸上羧基相连的-C发生连接时,它会顺利地脱羧,生成表1中检测到的硝基苯(c)与二氧化碳,反应式如下:
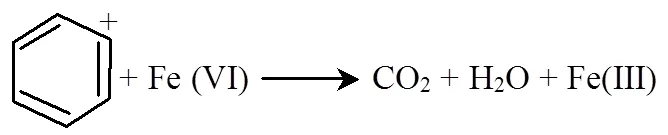
此外,高铁酸根上的氧原子可能直接与硝基苯上的氮原子产生一类似酯的N-O键,形成过渡态的中间体.随后伴随Fe-O键与C-N键的断裂,以及电子转移,而后处于激发态的表面络合物解离并释放出N-O•自由基和 C-O•自由基和更多的Fe(Ⅵ)参与到反应体系中,生成苯环正离子、硝酸根离子与Fe(Ⅳ)[31].更多的自由基与强氧化性的高铁酸根攻击苯环正离子,使其开裂生成一系列烃类物质,如表1中检测到的2,2-二甲基-3-辛烯(a)、1-甲基-3-正丙基-环己烷(b)等,这些物质被继续氧化降解,最终生成二氧化碳与水.此反应过程也与2.2中对K2FeO4降解3,4-二甲基苯胺的反应级数的计算结果相一致,证明了苯环侧链的氧化、脱落与苯环的开环为整个降解历程的两个控制反应.反应式如下:
根据GC/MS检测结果及查阅国内外相关文献,推测K2FeO4催化氧化3,4-二甲基苯胺的一种降解途径为:3,4-二甲基苯胺先转变成2,4-二甲基苯胺,然后苯环上氨基及甲基先后被高铁酸钾氧化,生成4-硝基间苯二甲酸,再发生脱羧反应,生成硝基苯,硝基苯被高铁酸钾进一步攻击,生成苯环正离子后再开环生成一系列小分子烃类物质,这些物质被继续氧化,最终生成二氧化碳与水.
3 结论
3.1 高铁酸钾氧化还原3,4-二甲基苯胺的反应为1.7337级,其反应速率方程为:
= 0.0043A0.486B1.2477
K2FeO4与3,4-二甲基苯胺的反应级数为1.7337级,符合准二级反应动力学方程,故推测此降解过程的控制反应分为两步.第一步为高铁酸钾将3,4-二甲基苯胺上的侧链氧化并脱落生成苯环正离子;第二步为高铁酸根进一步攻击苯环正离子,使其开环生成小分子烃类物质.
3.2 结合3,4-二甲基苯胺原液及降解液的GC/MS分析结果,推测在高铁酸钾作用下,3,4-二甲基苯胺先转变成2,4-二甲基苯胺,然后苯环上氨基及甲基被先后氧化,生成4-硝基间苯二甲酸,再发生脱羧反应,生成硝基苯,硝基苯被高铁酸钾进一步攻击,生成苯环正离子,其后开环并被继续氧化,最终生成二氧化碳与水.
3.3 在整个降解过程的控制反应中包含了两种反应机制,第一步中高铁酸钾分解后产生FeO2-及Fe(OH)3络合物与强氧化性基团Fe(Ⅴ)、Fe(Ⅳ)形成表面络合物,通过耦合作用使得电子转移发生在表面络合物内,氧化苯环侧链基团,形成表面络合催化反应机制;第二步中具有强吸电子性的基团不断增多,导致形成的表面络合物之间开始竞争活性位,出现由过渡态金属离子到配体的电子迁移,具有强氧化性的基团开始直接攻击苯环,形成复杂的界面催化反应机制.
[1] 崔 凯,沈 宏.3,4-二甲基苯胺的合成研究 [J]. 化学试剂, 2017,39(8):901-903.
[2] 孙文敬,高润香.核黄素合成路线的优化[J]. 中国药学杂志, 1999,34(8):562-564.
[3] 宋 鑫,任立人,吴 丹,等.制药废水深度处理技术的研究现状及进展 [J]. 广州化工, 2012,40(12):29-31.
[4] Falguni B, Chandra S N, Anilava K. Effects of aniline-an aromatic amine to some freshwater organisms [J]. Ecotoxicology (London, England), 2003,12(5):397-404.
[5] Hoppe M L, Schlemper E O, Murmann R K. Structure of dipotassium ferrate (VI) [J]. Acta Crystallographica, 2001,38(8): 2237-2239.
[6] Sharma V K. Destruction of cyanide and thiocyanate by ferrate [Iron (VI)] [J]. European Journal of Mineral Processing & Environmental Protection, 2003,3:1303-868.
[7] 苑宝玲,曲久辉.高铁酸盐氧化絮凝去除藻类的机制 [J]. 中国环境科学, 2002,22(5):397-399.
[8] 刘 伟,马 军.高铁酸盐预氧化对藻类细胞的破坏作用及其助凝机理 [J]. 环境科学学报, 2002,22(1):24-28.
[9] 夏庆余,王丽琼,陈力勤,等.电解制备高铁酸盐及其处理苯胺废水的研究[J]. 化工环保, 2005,25(2):88-92.
[10] 董 娟.化学氧化法制备高铁酸钾及其处理有机废水的研究[D]. 上海:东华大学, 2007:54-56.
[11] 张 洋,罗志勇,屈勇军,等.高铁酸钾预处理垃圾渗滤液[J]. 环境工程学报, 2014,8(6):2451-2455.
[12] Jiang J Q, Wang S, Panagoulopoulos A. The role of potassium ferrate (VI) in the inactivation of Escherichia coli and in the reduction of COD for water remediation [J]. Desalination, 2007,210(1):266-273.
[13] 苑丹丹,田 蕾,沈筱彦.苯胺有机废水处理技术研究进展 [J]. 能源化工, 2017,38(2):60-64.
[14] Bouzek K, Roušar I. Influence of anode material on current yields during ferrate(VI) production by anodic iron dissolution Part I:Current efficiency during anodic dissolution of grey cast iron to ferrate (VI) in concentrated alkali hydroxide solutions [J]. Journal of Applied Electrochemistry, 1996,26(9):919-923.
[15] 乔 磊.电解制备高铁酸钾及其降解污染物的研究[D]. 郑州:郑州大学, 2007:15-16.
[16] 覃奇贤,刘淑兰.电镀液的电流效率及其测定方法 [J]. 电镀与精饰, 2008,30(4):27-29.
[17] 姜洪泉,刘 红.亚铬酸盐滴定法测定高铁酸钾[J]. 佳木斯大学学报, 2001,19(1):106-108.
[18] 郑怀礼,邓琳莉,吉方英,等.高铁酸钾制备新方法与光谱表征 [J]. 光谱学与光谱分析, 2010,30(10):2646-2649.
[19] 赵国保,任 源,蒋争明,等. O3/UV深度处理焦化废水的条件控制及其效能评估[J]. 中国给水排水, 2013,29(5):32-36.
[20] 杨晓芬,赵美萍,李元宗,等.水中苯胺类化合物的分光光度法测定[J]. 分析化学, 2002,30(5):540-543.
[21] 冉 亮,周 俊,郝祥忠,等.高铁酸钾的研究现状 [J]. 安徽化工, 2007,(1):20-23.
[22] De Marco M J, Sengupta A K, Greenleaf J E. Arsenic removal using a polymeric/inorganic hybrid sorbent [J]. Water Reserch, 2003,37(1):164-176.
[23] 曲久辉,林 谡,田宝珍,等.高铁酸盐氧化絮凝去除水中腐殖质的研究[J]. 环境科学学报, 1999,19(5):510-514.
[24] Kamachi T, Kouno T, Yoshizawa K. Participation of multioxidants in the pH dependence of the reactivity of ferrate (VI) [J]. Journal of Organic Chemistry, 2005,70(11):4380-4388.
[25] 杨卫华,王鸿辉,曾晓旭,等.高铁酸钾处理水中十六烷基三甲基溴化铵[J]. 环境科学, 2009,30(8):2277-2281.
[26] 邝代治,张志坚,冯泳兰,等.氨基在苯胺亲电取代反应中的定位效应讨论[J]. 化学教学, 2010,(6):6-8.
[27] Xue X F, Hanna K, Abdelmoula M, et al. Adsorption and oxidation of PCP on the surface of magnetite: Kinetic experiments and spectroscopic investigations [J]. Applied Catalysis B: Environmental, 2009,89(3/4):432-440.
[28] 庞素艳,江 进,马 军,等. MnO2催化KMnO4氧化降解酚类化合物[J]. 环境科学, 2010,31(10):2331-2335.
[29] Lin S S, Gurol M D. Catalytic decomposition of hydrogen peroxide on iron oxide: kinetics, mechanism, and implications [J]. Environmental Science & Technology, 1998,32(10):1417-1423.
[30] 龚 艳,林 鹿,孙 勇,等.脱羧反应途径及其机制的研究进展[J]. 化学与生物工程, 2008,25(4):1-6.
[31] 郑 璐.高铁酸盐的制备和应用基础研究[D]. 上海:复旦大学, 2006:71-73.
Mechanism of degradation of 3,4-dimethylaniline by K2FeO4.
YANG Wei-yi1, LI Meng1, ZHANG Qian1*, XIANG Wen-qi1,2
(1.School of Civil Engineering and Architecture, Wuhan University of Technology, Wuhan 430070, China;2.Wuhan Municipal Engineering Design and Research Institute Co. Ltd., Wuhan 430023, China)., 2018,38(5):1744~1751
The apparent kinetics and reaction mechanism of catalytic oxidation were investigated by using 3,4-dimethylaniline as the target pollutant and potassium ferrate (K2FeO4) as the oxidant. The new equation established for 3,4-dimethylaniline degradation by K2FeO4was as follows:=0.0043A0.4855B1.2479. The reaction order was 1.7334, which conformed to the pseudo-second order kinetic equation. Meanwhile, the intermediate products during the degradation were analyzed through the GC/MS technology. It was presumed that 3,4-dimethylaniline was converted to 2,4-dimethylaniline at first, then the amide & methyl on the benzene ring were oxidized successively before 4-nitroisophthalic acid was formed. Due to decarboxylation, 4-nitroisophthalic acid was oxidized to nitrobenzene and further to a batch of cationic benzenes, and then decomposed into a series of small molecular hydrocarbons by destroying the phenyl structure. In final, these hydrocarbons were degraded into carbon dioxide and water. It was presumed that the control reaction of the oxidation-reduction was a two-steps process: in the first step, the potassium ferrate attacked the side chains on the 3,4-dimethylaniline benzene ring; secondly the ring-opening reaction of the benzene occurred. All in all, this degradation process mainly composed of two kinds of reaction mechanisms: surface complexation and interfacial catalysis.
potassium ferrate;3,4-dimethylaniline;pseudo-second order kinetics;surface complexation catalysis;interface catalysis
X703
A
1000-6923(2018)05-1744-08
2017-10-11
国家自然科学基金资助项目(51208397);中央高校自主创新基金项目(2017Ⅱ29GX);武汉理工大学研究生优秀学位论文培育项目资助(2017-YS-042)
* 责任作者, 副教授, qianzhang@whut.edu.cn
杨唯艺(1993-),女,广西桂林人,武汉理工大学硕士研究生,主要研究方向为水污染控制技术.

