针康法对脑缺血大鼠神经功能及缺血半暗区皮层细胞凋亡相关蛋白表达的影响①
叶涛,朱路文,阮野,李宏玉,吴孝军,陈玉宏,赵一点,田源,唐强
1.黑龙江中医药大学,黑龙江哈尔滨市150040;2.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001
脑卒中是中国人的主要死亡原因,也是全球成年人永久性残疾的最常见原因,其中缺血性脑卒中约占所有病例的80%,治疗方案有限[1]。针康法是脑卒中康复的一种新策略[2],即在头穴丛刺长留针期间同步进行各种康复训练,强调“针康同步、动态治疗、整体康复”的治疗理念,能显著改善脑卒中患者运动障碍、平衡障碍、言语障碍及吞咽障碍等,提高日常生活活动能力,总有效率达94.67%,优于单一针刺、康复训练。既往我们从脑缺血后神经再生、血管新生、轴突再生、炎症反应、细胞凋亡等多个方面对针康法的脑保护作用进行探讨,为针康法的临床推广应用奠定理论基础[2-9]。
脑缺血再灌注损伤诱导的caspase家族“瀑布式”次序激活,与神经细胞的凋亡密切相关。本课题组研究证实,针康法的抗凋亡机制与促进缺血半暗区X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)表达、抑制caspase-9蛋白活化有关[4]。
在caspase级联反应中,caspase-8和caspase-3分别为起始者与执行者的核心,是细胞凋亡发生的关键步骤及凋亡信号传导的共同通路[10-11];细胞凋亡抑制蛋白1(cellular inhibitor of apoptosis 1,cIAP1)能直接抑制caspase家族成员,调节细胞凋亡相关传导通路,具有广泛的抗凋亡活性[12-13]。
本研究观察针康法对脑缺血大鼠神经功能及cleaved-caspase-8、cleaved-caspase-3和cIAP1表达的影响,探讨针康法脑保护作用的相关机理。
1 材料与方法
1.1 实验动物及分组
SPF级Sprague-Dawley大鼠,雄性,10~12周龄,初始体质量240~260 g,购于辽宁长生生物技术有限公司,合格证号SCXK(辽)2015-0001。
大鼠饲养于黑龙江中医药大学药物安全性评价中心SPF级屏障环境。人工光照12 h∶12 h明暗交替,室温(24±1)℃,湿度(65±10)%,噪音<60 dB,通风良好,自由食水。
实验前,大鼠适应性跑台训练,速度15 m/min,每天15 min,共3 d,筛选愿意跑台训练的大鼠90只。
本实验经黑龙江中医药大学动物实验管理委员会批准,实验大鼠的处置符合2006年科技部发布的《关于善待实验动物的指导性意见》。
随机数字表法[4]将90只大鼠分入假手术组、模型组、针刺组、康复组和针康组,每组18只,再分成3d、7 d、14 d三个亚组(n=6)。
造模失败或实验中死亡,另选大鼠补充。
1.2 主要仪器和试剂
ZH-PT型动物实验跑台:徐州利华电子科技发展有限公司。R03-1型大鼠转棒疲劳仪:上海欣软信息科技有限公司。ELX-800型酶标仪:美国BIOTEK公司。WD-9413B型凝胶成像系统、WD-9405B型水平摇床、DY-CZ-24DN型双垂直蛋白电泳仪、DYY-7C型电泳仪、DYCZ-40D型转移槽:北京六一生物科技有限公司。一次性无菌针灸针:北京汉医医疗器械中心。
cleaved-caspase-8、cleaved-caspase-3多克隆抗体:美国CELL SIGNALING TECHNOLOGY公司。cIAP1多克隆抗体:美国SANTA CRUZ公司。PVDF膜:美国MILLIPORE公司。预染蛋白分子量标准:加拿大FERMENTAS公司。TEMED:美国AMRESCO公司。驴抗山羊IgG-HRP:上海碧云天生物技术公司。内参抗体β-actin、羊抗兔IgG-HRP、ECL发光液:沈阳万类生物科技有限公司。
1.3 造模及入组
参考前期实验研究[6],改良Koizumi线栓法[14]制备大鼠永久性大脑中动脉闭塞脑缺血模型。大鼠术前12 h禁食,不禁水。10%水合氯醛300 mg/kg腹腔注射麻醉。于(37±1)℃恒温手术台上固定大鼠,颈部术区备皮、消毒,钝性剥离皮下组织,暴露右侧颈总、颈外、颈内动脉,依序结扎颈总动脉近心端、颈外动脉远心端,颈总动脉主干下方备活结。微动脉夹阻闭分叉处血流,距分叉处5 mm开一个“V”形口,将3 cm线栓(前端2~3 mm石蜡包埋处理)由此口插入;松开微动脉夹,线栓沿颈内动脉进入,达大脑中动脉分支起始处,固定颈总动脉上的活结。常规消毒、缝合,白炽灯照射维持肛温(37±1)℃至苏醒。
假手术组不插入鱼线,其余操作相同。
术后24 h行Longa评分,1~3分大鼠纳入实验。
1.4 干预方法
术后24 h,针刺组予头穴丛刺治疗。定位大鼠百会穴及其左右旁开2 mm处,采用直径0.25 mm、长25 mm针灸针丛刺,快速捻转1 min后留针2 h,每天1次。
康复组予循序渐进电动跑台训练。坡度0°,速度前3 d 8 m/min,4~7 d 12 m/min,7 d后15 m/min,每次30 min,每天1次。
针康组予头穴丛刺,在长留针期间,行跑台训练。针刺和跑台方案同针刺组和康复组。
假手术组和模型组术后同等条件抓取,不进行任何治疗。
1.5 神经功能评定
1.5.1 改良神经功能缺损评分(modified Neurological Severity Score,mNSS)[6]
各亚组采用mNSS,从运动、感觉、横梁平衡与反射缺损和异常活动四方面评估各组大鼠神经功能缺损。0分正常,1~6分轻度损伤,7~12分中度损伤,13~18分重度损伤。由不参与动物实验的2名研究人员分别进行,取平均值。
1.5.2 转棒测试
各亚组采用平衡运动转棒仪测试大鼠运动协调能力[15-16]。开启电源,转轮匀速后,将大鼠置于旋转的转轮上,开始加速,在5 min内,将速度从4 r/min加速到40 r/min,如果动物从转轮上脱落或抓住装置并连续旋转两次而不尝试在转轮上行走,则测试结束,记录大鼠在转杆上停留的时间。每天2次,重复测试3次,每次间隔15 min。动物术前3 d开始训练,术前1 d测试作为基线对照值;计算术后3 d、7 d及14 d测试值与对照值的比值[17-18]。
1.6 Western blotting
神经功能评定后,各亚组10%水合氯醛4 ml/kg腹腔注射麻醉后断头取脑,冠状位切取缺血侧前囟前后各2 mm脑组织,液氮速冻5 min后转移至-80℃冰箱备用。取适量样本,加入蛋白裂解液,制成蛋白匀浆;冰上静置5 min后,4℃12000 r/min离心10 min,取上清液,BCA法测定蛋白总量。上样体积20 μl,含蛋白40 μg。
浓缩胶浓度5%,分离胶浓度10%(cIAP1、cleaved-caspase-8)、 13% (cleaved-caspase-3)。SDS-PAGE电泳分离目的蛋白(80 V,2.5 h),电转移至PVDF膜上(80 V,1.5 h)。5%脱脂奶粉室温封闭1 h,加 cleaved-caspase-8(1∶ 500)、 cleaved-caspase-3(1∶500)一抗4℃过夜,加入羊抗兔IgG-HRP(1∶5000)二抗,37℃孵育45 min。加入cIAP1(1∶100)一抗4℃过2夜,加入驴抗山羊IgG-HRP(1:5000)二抗,37℃孵育2 h。洗膜后ECL发光液孵育5 min,显影后拍摄。内参β-action(1∶1000)检测过程同目标蛋白。
采用Gel-Pro-Analyzer 4.0分析条带灰度值,以目标蛋白条带灰度值/β-action条带灰度值为该样本目标蛋白相对表达量,以模型组某一样本蛋白相对表达量为1,其余样本均为与其校正后的相对表达量[4]。
1.7 统计学分析
采用SPSS 22.0进行统计学处理。数据均以(±s)表示。采用单因素方差分析,两两比较,方差齐者用LSD-t检验,不齐者用Tamhane's T2检验。显著性水平α=0.05。
2 结果
2.1 神经功能评定
2.1.1 mNSS
术后各时间点,假手术组mNSS评分均为0;与假手术组比较,模型组mNSS评分升高(P<0.05)。与模型组比较,各治疗组mNSS评分降低(P<0.05)。术后7 d、14 d,与针刺组、康复组比较,针康组mNSS评分进一步降低(P<0.05)。见表1。
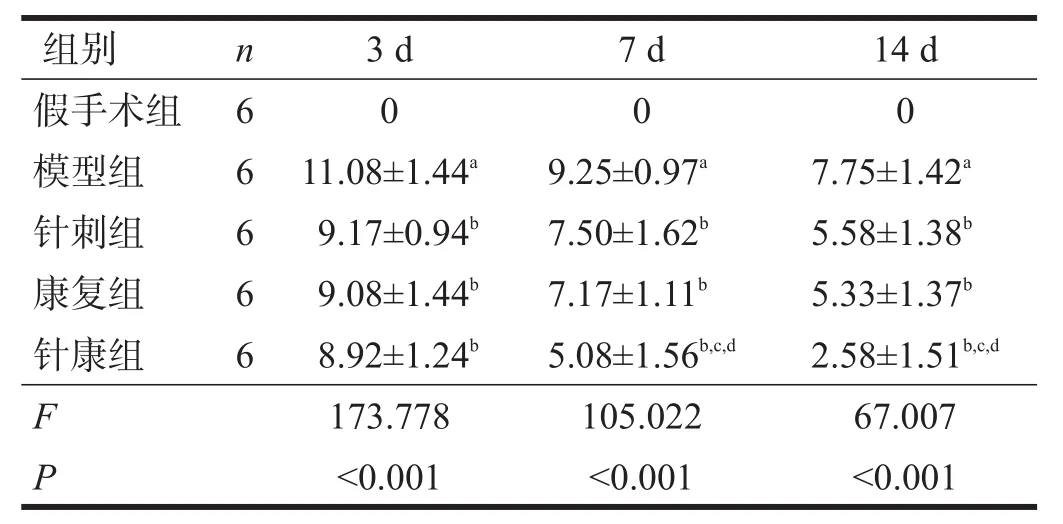
表1 术后各时间点各组mNSS评分比较
2.1.2 转棒测试
术后各时间点,与假手术组比较,模型组停留时间缩短(P<0.05)。与模型组比较,各治疗组停留时间均延长(P<0.05)。术后7 d、14 d,与针刺组、康复组比较,针康组停留时间进一步延长(P<0.05)。见表2。
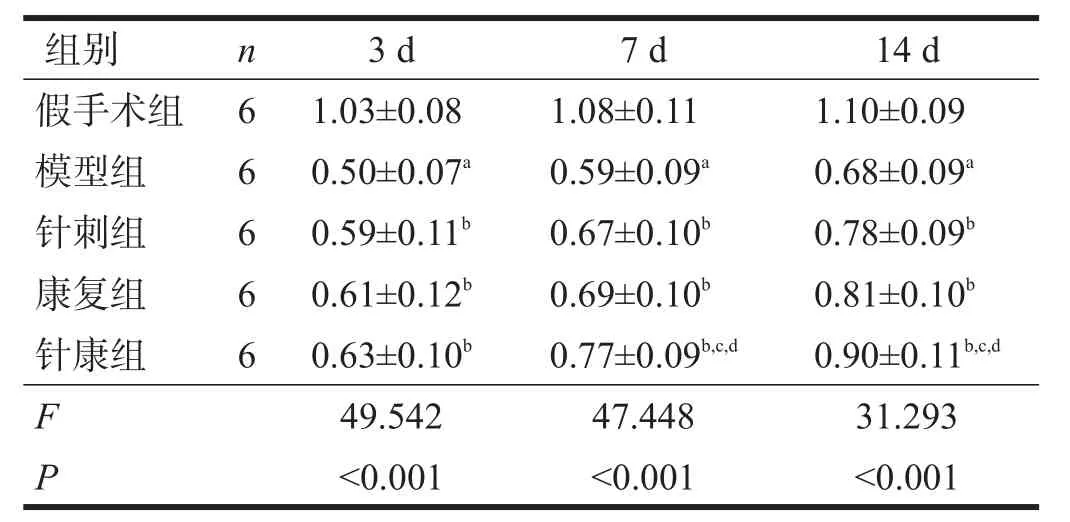
表2 术后各时间点各组转棒测试比较
2.2 Western blotting
术后各时间点,假手术组可见cleaved-caspase-8、cleaved-caspase-3少量表达。与假手术组比较,各时间点模型组cleaved-caspase-8、cleaved-caspase-3表达升高(P<0.05);与模型组比较,各治疗组各时间点cleaved-caspase-8、cleaved-caspase-3表达降低(P<0.05)。与针刺组、康复组比较,术后7 d、14 d,针康组cleaved-caspase-8表达进一步降低(P<0.05)。见图1~图2、表3~表4。
术后各时间点,假手术组可见cIAP1蛋白高表达。与假手术组比较,各时间点模型组cIAP1表达降低(P<0.05)。与模型组比较,各治疗组各时间点cIAP1表达升高(P<0.05)。与针刺组、康复组比较,术后7 d、14 d,针康组cIAP1表达进一步升高(P<0.05)。见图3、表5。
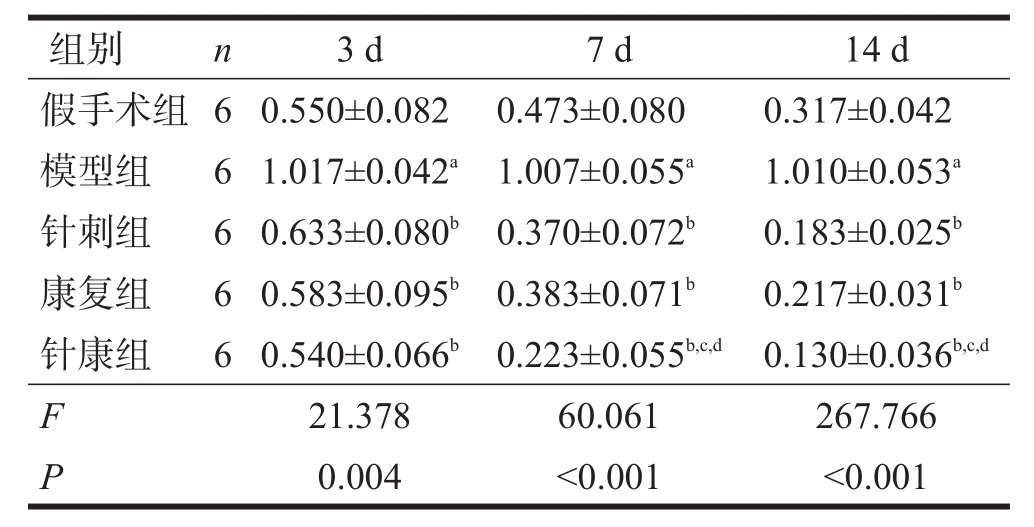
表3 术后各时间点各组cleaved-caspase-8蛋白比较

图1 术后各时间点各组cleaved-caspase-8蛋白表达
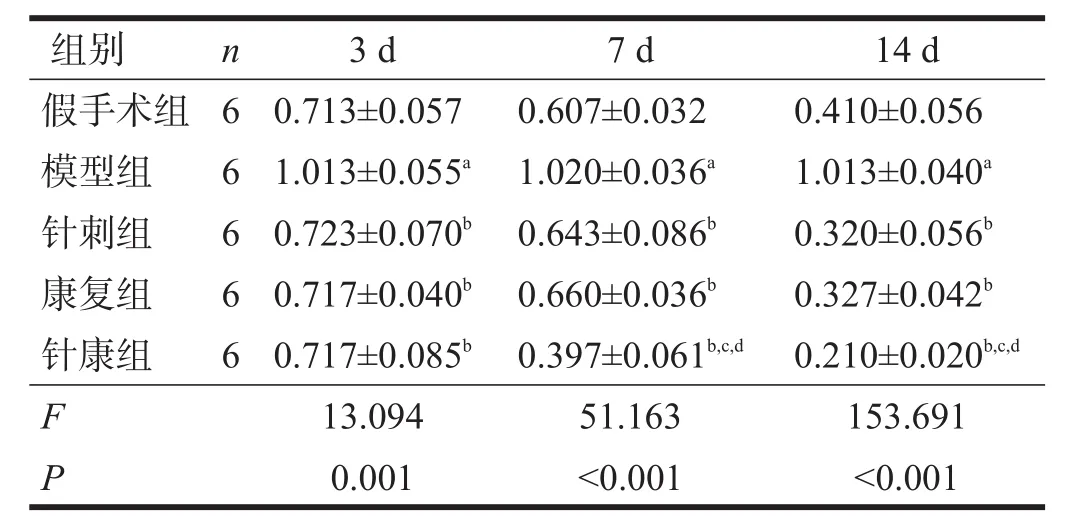
表4 术后各时间点各组cleaved-caspase-3蛋白比较

图2 术后各时间点各组cleaved-caspase-3蛋白表达
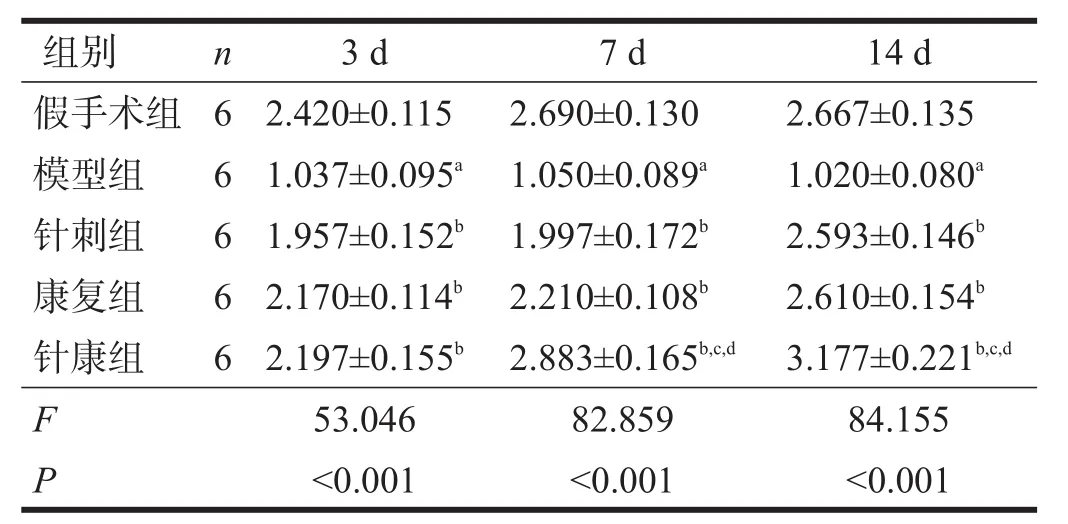
表5 术后各时间点各组cIAP1蛋白比较

图3 术后各时间点各组cIAP1蛋白表达
3 讨论
缺血急性期,缺血中心区由于突发血液供应中断,发生严重细胞膜离子泵功能障碍及能量代谢衰竭,引发神经细胞死亡,形成不可逆性脑组织损害;而缺血半暗区脑组织,由于存在侧支循环或大动脉残留血流等原因,细胞处于休眠状态,具有可逆性。挽救处于休眠状态的神经细胞,对于受损脑组织的结构重塑、神经功能的恢复,具有重要意义。
前期研究证实[4],针康法能有效抑制脑缺血后神经细胞凋亡,改善大鼠神经功能缺损,优于单一的针刺、康复训练,机制与其上调脑缺血后缺血半暗区XIAP蛋白表达,抑制caspase-9活化,降低线粒体途径介导的细胞凋亡有关。本研究显示,脑缺血后,大鼠神经功能损伤严重,存在明显运动协调功能障碍;随着时间延长,大鼠神经功能和运动障碍有一定程度改善;针康法在促进神经功能改善的同时,也促进大鼠协调运动功能的恢复,并在一定时期后,优于单一针刺和康复训练,有一定治疗优势。
caspase家族在细胞凋亡调控机制网络中处于中心地位。caspase-8、caspase-9分别为死亡受体途径、线粒体凋亡途径的上游“起始者”,而caspase-3为启动凋亡发生的最终“执行者”。caspase-8在死亡受体介导的凋亡途径中扮演重要角色[10,19-21]:无论是Fas介导通路,还是肿瘤坏死因子(tumor necrosis factor,TNF)凋亡途径,最终都激活caspase-8,进而活化caspase-3、caspase-6、caspase-7等,激活caspase级联反应,导致细胞凋亡。激活的caspase-8能在胞浆中裂解Bcl-2家族成员Bid,裂解产物的羧基端片段tBid转移到线粒体上,诱导线粒体释放细胞色素C,启动caspase-9介导的线粒体凋亡途径[22]。这说明无论在细胞外途径还是在细胞内途径中,caspase-8都是关键的调控蛋白,活化的caspase-8连接着死亡受体通路与线粒体通路的Cross-talk。
IAP家族是生物发育和生长过程中广泛表达的凋亡抑制因子,其凋亡抑制作用比包括Bcl-2家族在内的其他任何家族都要广泛。它一方面可直接作用于caspase,通过与其相互作用并抑制其活性,发挥抗细胞凋亡作用;另一方面又在调控凋亡信号转导途径中发挥关键作用[12,23-24]。有文献报道[25-26],cIAP1、cIAP2、XIAP可以通过阻断细胞色素C诱导的caspase-9活化,阻止pro-caspase-3、pro-caspase-6、pro-caspase-7的蛋白水解;这些IAP家族成员不能阻止caspase-8诱导的pro-caspase-3蛋白水解活化,但可通过直接抑制活化的caspase-3,中断下游凋亡事件。另有报道[27],TNF信号有诱导核因子-κB(nuclear factor κB,NF-κB)的能力,而NF-κB的过度表达可抑制细胞凋亡发生。
cIAP1/2的抗凋亡活性与其调节先天性免疫应答中的NF-κB信号传导途径的能力有关[23],可触发K63自我泛素化和受体相互作用蛋白1(receptor interacting protein 1,RIP1)的K11和K63泛素化,导致NF-κB激活和细胞存活[28];与肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factors,TRAFs)绑定,促使cIAP1/2与TNF受体反应,而与Smac/Diablo的绑定能使Smac与XIAP分离,实现XIAP对caspases家族成员的抑制[13,29-31]。此外,cIAP1还能对含有RING结构域的cIAP2、XIAP和Livin等IAPs家族成员进行调控,使其经过泛素-蛋白酶体途径降解[30]。
本研究显示,脑缺血后,cleaved-caspase-8、cleaved-caspase-3持续高表达,cIAP1持续低表达,提示caspase介导的凋亡途径在调控脑缺血后细胞凋亡中发挥重要作用,cIAP1表达缺陷与caspase激活介导的细胞凋亡途径间存在某种关联。针刺、康复及针康治疗均可有效抑制caspase-8、caspase-3活化介导的细胞凋亡,解除cIAP1表达抑制,上调cIAP1表达水平,共同抑制caspases介导的细胞凋亡级联反应。脑缺血后7 d、14 d,针康法的这种抗凋亡效应优于单一针刺、康复训练。
最近,我们通过免疫荧光双标检测发现,脑缺血后3 d、7 d、14 d,cIAP1在脑缺血后的神经元(NeuN标记)、微血管(CD31标记)上均存在共表达,针康法治疗可上调cIAP1在神经元、微血管的表达量,提示cIAP1是介导针康法发挥神经元保护和血管保护的共同靶点。
综上所述,针康法可以改善脑缺血大鼠神经功能缺损,促进运动协调能力恢复,优于单一针刺、康复训练;其机制可能与抑制caspase-8、aspase-3蛋白活化,促进cIAP1蛋白表达,从而抑制caspases介导的细胞凋亡级联反应有关。
当前,我们尚不能明确脑缺血后cIAP1与caspsae-8、caspase-3存在何种联系,cIAP1的缺失是否会反转针康法的抗凋亡作用。下一步我们将采用慢病毒介导的cIAP1基因沉默技术,进一步探讨cIAP1在针康法发挥脑保护作用中的作用及相关机制,为针康法的临床应用奠定坚实的基础。
[参考文献]
[1]Winstein CJ,Stein J,Arena R,et al.Guidelines for adult stroke rehabilitation and recovery:a guideline for health care professionals from the American Heart Association/American Stroke Association[J].Stroke,2016,47(6):e98-e169.
[2]唐强,朱路文.脑卒中康复新策略——针康法[J].中国康复医学杂志,2015,30(10):1071-1073.
[3]唐强,姜云飞,朱路文,等.针康法对局灶性脑缺血大鼠神经功能缺损及缺血区碱性成纤维细胞生长因子、血管抑制素蛋白表达的影响[J].中国康复理论与实践,2015,21(10):1151-1155.
[4]唐强,田源,叶涛,等.针康法对脑缺血大鼠缺血半暗区细胞凋亡及X连锁凋亡抑制蛋白和cleaved-caspase-9蛋白表达的影响[J].中国康复理论与实践,2017,23(12):1365-1371.
[5]唐强,叶涛,朱路文,等.针康法对脑缺血大鼠神经功能和细胞外信号调节激酶1/2信号通路的影响[J].中国康复理论与实践,2017,23(1):27-31.
[6]叶涛,唐强,朱路文,等.针康法对脑缺血大鼠神经功能和缺血半暗区皮层血管内皮生长因子受体表达的影响[J].中国康复理论与实践,2017,23(5):520-524.
[7]朱路文,唐强,王艳,等.针康法对脑缺血后神经血管单元重塑的影响[J].针灸临床杂志,2016,32(6):70-73.
[8]唐强,叶涛,朱路文,等.针康法对局灶性脑梗死大鼠神经功能缺损及梗死灶周边区RhoA、ROCK-Ⅱ蛋白表达的影响[J].针灸临床杂志,2016,32(8):73-77.
[9]唐强,朱路文,邢艳丽,等.针康法对脑缺血大鼠运动功能及GAP-43、Nogo-A表达的影响[J].针灸临床杂志,2015,31(1):54-57.
[10]毛德文,陈月桥,王丽,等.Caspase-8及Caspase-3与细胞凋亡[J].辽宁中医药大学学报,2008,10(10):148-150.
[11]Mohamed MS,Bishr MK,Almutairi FM,et al.Inhibitors of apoptosis:clinical implications in cancer[J].Apoptosis,2017,22(12):1487-1509.
[12]Estornes Y,Bertrand MJ.IAPs,regulators of innate immunity and inflammation[J].Semin Cell Dev Biol,2015,39(3):106-114.
[13]Varfolomeev E,Goncharov T,Vucic D.Roles of c-IAP proteins in TNF receptor family activation of NF-κB signaling[M]//May M.NF-kappa B.Methods in Molecular Biology.New York:Humana Press,2015:269-282.
[14]Koizumi J.Experimental studies of ischemic brain edema.1.A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area[J].Jpn J stroke,1986,16(8):1-8.
[15]Tsai LK,Wang Z,Munasinghe J,et al.Mesenchymal stem cells primed with valproate and lithium robustly migrate to infarcted regions and facilitate recovery in a stroke model[J].Stroke,2011,42(10):2932-2939.
[16]林冰冰,王鲜,柳维林,等.弥散张量成像观察电针对缺血性脑卒中大鼠运动皮层-纹状体神经传导束的影响[J].中国康复理论与实践,2017,23(7):756-761.
[17]Zhang QW,Deng XX,Sun X,et al.Exercise promotes axon regeneration of newborn striatonigral and corticonigral projection neurons in rats after ischemic stroke[J].PLoS One,2013,8(11):e80139.
[18]Chen J,Sanberg PR,Li Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[19]李花,刘旺华,周小青,等.活血通络组方对大鼠脑缺血再灌注损伤后神经功能恢复及其抗凋亡机制研究[J].中国康复医学杂志,2009,24(10):880-883.
[20]夏相宜,肖长江,王宇红,等.脑健胶囊对MCAO大鼠脑组织Fas凋亡途径的影响[J].湖南中医药大学学报,2015,35(1):11-15.
[21]赵瑞杰,李引乾,王会,等.Caspase家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):73-78.
[22]Pfeffer CM,Singh AT.Apoptosis:a target for anticancer therapy[J].Int J Mol Sci,2018,19(2):E448.
[23]Gyrd-Hansen M,Meier P.IAPs:from caspase inhibitors to modulators of NF-κB,inflammation and cancer[J].Nat Rev Cancer,2010,10(8):561-574.
[24]Dubrez-Daloz L,Dupoux A,Cartier J.IAPs:more than just inhibitors of apoptosis proteins[J].Cell Cycle,2008,7(8):1036-1046.
[25]Deveraux QL,Roy N,Stennicke HR,et al.IAPs block apoptotic events induced by caspase-8 and cytochrome C by direct inhibition of distinct caspases[J].EMBO J,1998,17(8):2215-2223.
[26]Eckelman BP,Salvesen GS.The human anti-apoptotic proteins cIAP1 and cIAP2 bind but do not inhibit caspases[J].J Biol Chem,2006,281(6):3254.
[27]Figiel I.Pro-inflammatory cytokine TNF-alpha as a neuroprotective agent in the brain[J].Acta Neurobiol Exp(Wars),2008,68(4):526-534.
[28]Berthelet J,Dubrez L.Regulation of apoptosis by inhibitors of apoptosis(IAPs)[J].Cells,2013,2(1):163-187.
[29]Hu S,Yang X.Cellular inhibitor of apoptosis 1 and 2 are ubiquitin ligases for the apoptosis inducer Smac/DIABLO[J].J Biol Chem,2003,278(12):10055-10060.
[30]Cheung HH,Plenchette S,Kern CJ,et al.The RING domain of cIAP1 mediates the degradation of RING-bearing inhibitor of apoptosis proteins by distinct pathways[J].Mol Biol Cell,2008,19(7):2729-2740.
[31]Feltham RL,Moulin M,Vince JE,et al.Tumor necrosis factor(TNF)signaling,but not TWEAK(TNF-like weak inducer of apoptosis)-triggered cIAP1(cellular inhibitor of apoptosis protein 1)degradation,requires cIAP1 RING dimerization and E2 binding[J].J Biol Chem,2017,292(34):14310.

