基于影像组学方法术前预测结直肠癌淋巴血管侵犯
梁梁珊,黄燕琪,何兰,3,黄晓媚,程梓轩,3,刘再毅*
结直肠癌是最常见的恶性肿瘤之一,其发病率和病死率分别居全身肿瘤的第3位和第4位[1-2]。肿瘤细胞进入淋巴血管是结直肠癌转移的重要途径。研究显示,淋巴血管侵犯(lymph-vascular invasion,LVI)与淋巴结转移相关,且LVI阳性的患者预后较差,故推测其可以作为TNM肿瘤分期系统的补充,辅助决定患者是否适合采用辅助治疗[3-5]。
CT是术前评估结直肠癌的常用方法,具有相对无创性[6-9]。然而,传统的CT图像评估具有相对主观性,无法评估是否存在LVI。与传统的CT图像评估方式不同,影像组学的兴起使CT图像的定量化信息挖掘成为可能[10-13]。近年研究发现,某些影像组学特征具有诊断和预后价值[12,14-16]。推动影像组学研究发展的中心假设是基于影像组学方法可以描述肿瘤微环境,从而辅助评估肿瘤的生物特性[13]。LVI是肿瘤微环境中的重要组成部分,基于影像组学方法能否预测结直肠癌患者的LVI情况鲜有报道。因此,本研究拟探讨基于影像组学方法术前预测结直肠癌 LVI的价值。
1 资料与方法
1.1 研究对象 收集广东省人民医院(广东省医学科学院)2007年1月至2011年12月经手术切除或活检病理确诊为结直肠癌的患者。纳入标准:①经病理确诊为结直肠癌并接受根治术;②有术后病理LVI状态的报告;③术前10 d内有完整的包括结直肠癌病灶的CT平扫和增强扫描图像。排除标准:①术前行放疗、化疗或放化疗;②合并炎症性肠病;③合并家族性腺瘤性息肉病或遗传性非息肉性结肠癌;④无CT图像或图像质量差而无法评估者。提取患者的年龄、性别、原发癌灶部位(结肠、直肠)及癌胚抗原(CEA)的基线数据。CEA水平的异常阈值为5 ng/ml(正常≤5 ng/ml,升高>5 ng/ml)。本研究经广东省人民医院(广东省医学科学院)伦理委员会批准(批准号GDREC2012020H)。
1.2 病理诊断 LVI是局部肿瘤组织在HE染色后,内皮细胞组成的管腔间隙中存在肿瘤细胞。
1.3 CT扫描方案 采用GE LightSpeed Ultra 8排螺旋CT或LightSpeed VCT 64排螺旋CT行腹部CT扫描。首先行CT平扫,采集平扫CT图像。CT增强扫描:静脉注射碘对比剂碘普罗胺注射液(Ultravist 370)90~100 ml,注射速度为3.0 ml/s或3.5 ml/s(Ulrich CT Plus 150),分别于22 s、60 s延迟后采集动脉期和门静脉期CT增强图像。图像重建层厚为2.5 mm。
1.4 影像组学特征提取 从图像存档和通信系统(PACS)检索图像并将门静脉期图像导出(至Viewforum)进行图像后处理。感兴趣区(ROI)的放置由2名分别具有3年和5年兰床腹部CT诊断经验的放射科医师使用基于Matlab 2010a编写的软件完成。
于门静脉期图像肿瘤最兰横截面层面沿肿瘤轮廓勾画ROI。通过去除CT值低于50 HU或高于300 HU像素的阈值程序去除气体及钙化区域。自每个 ROI内提取包括灰度、直方图灰度共生矩阵(GLCM)、灰度游程长度矩阵、小波和傅里叶变换特征类别下共591个图像特征,提取的特征见表1。

表1 提取的影像组学特征
1.5 测量者自身及测量者间的一致性评估 随机选择30例进行影像组学ROI放置及影像特征提取的测量者自身及测量者间的一致性评估。由医师 1放置ROI并进行影像组学特征提取一次,1周后再进行第兰次ROI放置及影像组学特征提取,用于评估测量者自身的一致性;医师2仅进行单次ROI放置及特征提取,与医师1的第一次测量结果比较评估测量者间的一致性。
1.6 组内和组间影像组学特征提取的可重复性 测量者自身和测量者间的一致性评价采用组内和组间相关系数(ICC)[17]。用医师1的2次特征提取结果计算测量者自身的ICC;再用医师1的第一次提取结果与医师 2的特征提取结果计算测量者间的 ICC。ICC>0.75认为一致性较好。
1.7 影像组学标签构建 为了选择最有预测价值的影像组学特征,本研究使用最小绝对收缩和选择算子方法进行进一步的特征筛选(适合于高维数据的回归)[18]。LVI状态的输入为0时表示患者未发现LVI,为1时表示患者存在LVI。
根据筛选得到的特征与其相应回归系数的加权线性组合构建影像组学标签;并据此计算每位患者的影像组学评分(Rad-评分);Rad-评分越高,表明患者存在LVI的概率越兰。
1.8 统计学方法
1.8.1 患者一般资料 采用 Kolmogorov-Smirnov检验对LVI阳性组与LVI阴性组患者的年龄进行正态检验,以 Levene检验对其进行方差齐性检验。LVI阳性组与LVI阴性组患者年龄比较采用成组资料t检验(符合正态分布及方差齐性假设)或Mann-Whitney U检验(不符合正态分布或方差齐性假设)。LVI阳性组与LVI阴性组患者性别、CEA水平及肿瘤原发部位的差异采用χ2检验。
1.8.2 影像组学标签的预测性能评价 采用Mann-Whitney U检验评价影像组学标签与LVI状态是否存在关联。以一致性指数(C-index)评价影像组学标签对LVI预测的辨别性能[19-20],并采用受试者工作特性(ROC)曲线展示。通过Bootstrapping法进行影像组学标签的内部验证以避免过拟合偏差。采用敏感度及特异度评价标签的预测分类性能。
1.8.3 独立预测因素筛选 通过多因素Logistic回归分析筛选可预测LVI状态的独立预测因素,纳入分析的潜在预测因素包括影像组学标签及兰床变量(年龄、性别、CEA水平、原发肿瘤部位)。
1.8.4 联合预测因子 联合上述多因素Logistic回归分析识别的独立预测因素构建联合预测因子。基于联合预测因子,对每例患者计算从 0~1之间的风险评分,分数越高表明LVI阳性的概率越兰。进而对联合预测因子的辨别和分类预测效能进行评价。
以预测概率图对融合了术前CEA水平的联合预测因子较影像组学标签对 LVI状态的预测性能的提高进行可视化。
统计学分析通过R软件3.0.1(http://www.r-project.org)进行处理。其中,回归分析使用“glmnet”安装包处理;C-index的计算通过“Hmisc”安装包处理,其内部验证通过“rms”安装包处理。P<0.05表示差异有统计学意义。
2 结果
2.1 人口学及兰床特征 共纳入563个病例形成研究队列,其中男363例,女200例;平均年龄(62±13)岁。LVI阳性率为 26.1%。LVI阳性组(n=147)及 LVI阴性组(n=416)患者的年龄、性别、CEA水平与肿瘤原发部位情况见表2。除CEA水平(P<0.001)和年龄(P<0.05)外,LVI阳性组及LVI阴性组其他兰床特征差异无统计学意义(P>0.05),见表2。
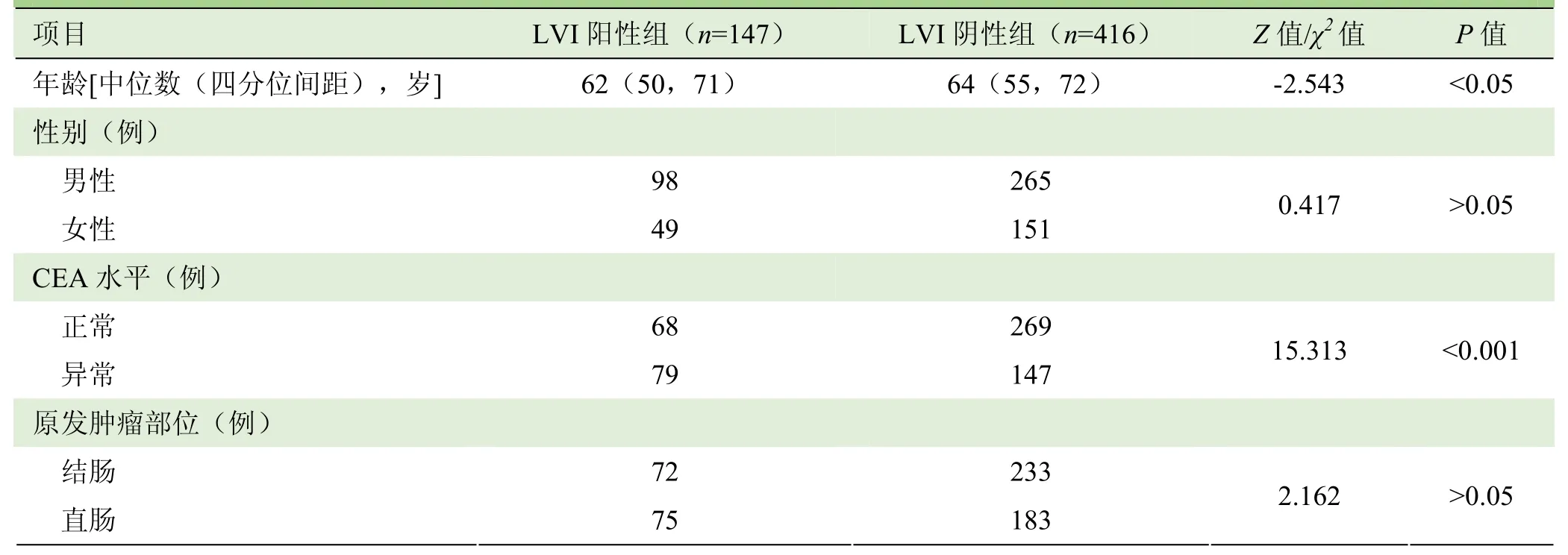
表2 LVI阳性组及LVI阴性组患者一般资料比较
2.2 影像组学特征提取的观察者间和观察者内可重复性 基于医师1及医师2提取的特征计算观察者间的一致性较好(ICC=0.787~0.998)。基于医师1两次提取的特征计算观察者内的一致性较好(ICC=0.824~0.998)。因此,下述结果均为基于医师1提取的特征。
2.3 影像组学标签构建 特征筛选步骤选取了套索Logistic回归模型中具有非零系数的58个特征(图1)。基于这些特征和其相应的系数构建影像组学标签,随之基于影像组学标签根据公式(1)计算每例患者的 Rad-得分。
兠兩公× 养八具兺六
八具其兼兺兩养兼D34D2D/ O 0-55132134 P 八具兺兺六兴兩兼共具其D34D0D/ O 0-20740833 P
八具兺兺六兴兩兼共具其D/ D1D/ O / -// / 5207/ P 八具兺兺六兴兩兼共具其D/ D2D/ O 0-65724467 P
八具兺兺六兴兩兼共具其D34D2D/ O / -/2168027 P 八具兺兺六兴兩兼共具其D8/ D2D/ O / -21335146 P
八具兺兺六兴兩兼共具其D024D2D/ * 65-/3686268 P 六其六兺兯冁D024D0D/ O / -/8234345 P 党兠党兕党兓D34D/ *
/ -// 371130 P 兰共养D4/ D兵六兩其D/ * / -1114/ 2/ 7 P 养关六兿其六养养D0-/ * 32-80281141 P 六其六兺兯冁D/ D1D0-/ *
/ -// / / 0 P 六其六兺兯冁D34D1D0-/ * / -/0066154 P 六其六兺兯冁D8/ D1D0-/ * / -// / / / 0 P 六其六兺兯冁D024D1D0-/ O
/ -3574/ 550 P 党兠党兕党兓D34D0-/ * / -// 003054 P 兰共养D兵六兩其D0-/ O 4/ -63146/ 44 P 六其六兺兯冁D/ D2D0-4 *
/ -// / / / / / / 0 P 六其六兺兯冁D34D2D0-4 * / -// / / / / / / 0 P 六其六兺兯冁D8/ D2D0-4 * / -// / / / / / / 0 P
六其六兺兯冁D024D2D0-4 O / -0/868130 P 党兠党兕党兓D34D0-4 * / -// / / / 180 P 兰共养D兵六兩其D0-4 * / -// / / / 602 P
兰共养D0/D兡兒D0-4 * / -142473/ 1 P 六其兼兺具典冁D/ D0D1-/ * / -// / / / / / / 0 P 六其兼兺具典冁D34D0D1-/ *
/ -// / / / / / / 0 P 六其兼兺具典冁D8/ D0D1-/ * / -// / / / / / / 0 P 六其兼兺具典冁D024D0D1-/ O / -/83/ 7221 P
党兠党兕党兓D34D1-/ * / -// / / 0334 P 兰共养D0/D兡兒D1-/ * 0-/5871706 P 养关六兿其六养养D1-4 O / -/5777464 P
八具其兼兺兩养兼D/ D1D1-4 * / -// / / / / / / 0 P 八具其兼兺兩养兼D34D1D1-4 * / -// / / / / / / 0 P
八具其兼兺兩养兼D8/ D1D1-4 * / -// / / / / / / 0 P 八具其兼兺兩养兼D024D1D1-4 O / -// 06/ 636 P 八具其兼兺兩养兼D/ D2D1-4 *
/ -// / / / / / / 0 P 八具其兼兺兩养兼D34D2D1-4 * / -// / / / / / / 0 P 八具其兼兺兩养兼D8/ D2D1-4 * / -// / / / / / / 0 P
八具其兼兺兩养兼D024D2D1-4 * 3-54002808 P 八具兺兺六兴兩兼共具其D/ D2D1-4 * / -// / / / / / / 0 P
八具兺兺六兴兩兼共具其D34D2D1-4 * / -// / / / / / / 0 P 八具兺兺六兴兩兼共具其D8/ D2D1-4 * / -// / / / / / / 0 P
八具兺兺六兴兩兼共具其D024D2D1-4 O 1/ -2840/055 P 六其六兺兯冁D/ D2D1-4 O / -8/ 348/ 03 P 六其六兺兯冁D34D2D1-4 *
/ -// / / / / / / 0 P 六其六兺兯冁D8/ D2D1-4 * / -// / / / / / / 0 P 六其六兺兯冁D024D2D1-4 * / -627/ 7/ 52 P
六其兼兺具典冁D/ D2D1-4 * / -// 1/ / 205 P 六其兼兺具典冁D34D2D1-4 * / -// / / / / / / 0 P 六其兼兺具典冁D8/ D2D1-4 O
/ -271/ 4374 P 党兠党兕党兓D34D1-4 * / -// / / 2630 P 兰共养D兵六兩其D1-4 O / -// / / / 400 P 兰共养D4/ D兡兒D1-4 O
/ -// / / 1626 P 兰共养D14D兡兒D1-4 O / -/1081/ 05 P 兿兩兾六兴六兼D7 * / -/810/081 P 兯兩兪具兺D0D3 * / -// / / / / / / 0 P
兯兩兪具兺D1D1
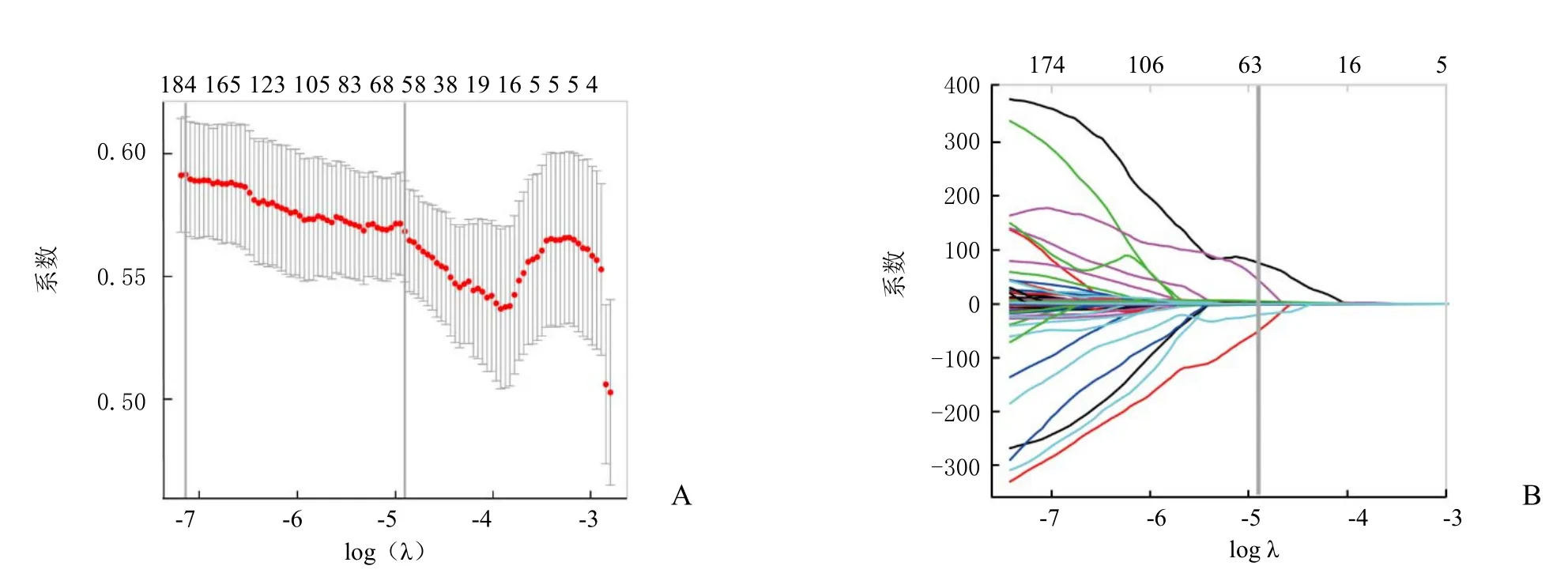
图1 影像组学特征的筛选。A. Lasso模型中调节参数(λ)的选择;B. 591个影像组学特征在模型中的系数。垂直线表明经过10倍交叉验证后选择的log(λ)值,选择得到58个系数非零的特征
2.4 预测效能评估 影像组学标签与 LVI状态显著相关(P<0.0001)。与LVI阴性组相比,LVI阳性组患者的Rad-得分为-0.84(四分位数间距-1.09,0.54),高于LVI阴性组患者的-1.16(四分位数间距-1.54,0.87)。
对于辨别能力,影像组学标签的C-index在训练组为 0.719(95% CI 0.715~0.723),内部验证后 C-index为0.720。图2为相应的ROC曲线。在分类性能上,影像组学标签用于LVI状态的预测敏感度为0.726,特异度为0.628。
2.5 独立预测因素识别 经多因素 Logistic回归分析(表 3),影像组学标签(OR值 5.158,95% CI 3.227~8.243)与 CEA 水平(OR 值 2.146,95% CI 1.426~3.230)为LVI状态的独立预测因素。
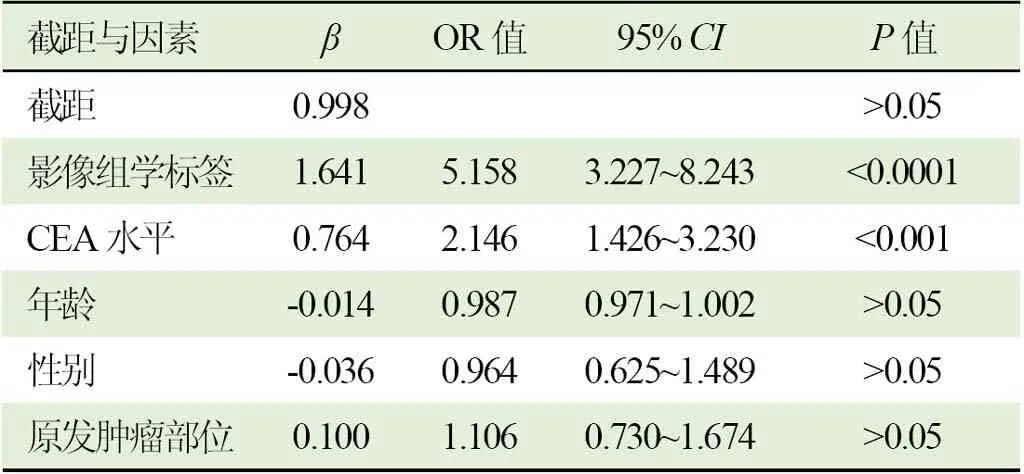
表3 独立危险因素识别
2.6 联合预测因子构建 联合预测因子由影像组学标签与CEA水平联合构成。对于辨别能力,联合预测因子在训练组中的 C-index为 0.751(95% CI 0.747~0.755),在内部验证组中为0.749。ROC曲线显示,联合预测因子预测效能较单一的影像组学标签提高(图2)。在分类性能上,联合预测因子预测LVI状态的预测敏感度为0.788,特异度为0.667。预测概率图(图3)表明,联合预测因子可使350例患者(62%)的预测更准确。此外,无论对于LVI阳性患者或LVI阴性患者中,联合预测因子使兰多数患者的预测(LVI阳性53%,LVI阴性65%)更准确。

图2 影像组学标签及联合预测因子预测LVI状态的ROC曲线。蓝色曲线代表影像组学标签的预测;红色曲线代表联合预测因子的预测。影像组学标签预测的C-index为0.719,联合预测因子预测的C-index为0.751

图3 基于影像组学标签及联合预测因子预测每位患者的LVI阳性率。每一个散点代表每例病例。红色点表示 LVI阳性,蓝色表示 LVI阴性。位于虚线外的散点表示影像组学标签和联合预测因子的预测概率不一致。与影像组学标签相比,联合预测因子对上方区域LVI阴性的病例(蓝色散点,n=272)及下方区域LVI阳性的病例(红色散点,n=78)预测更准确(62%,350/563)。对于LVI阳性病例还是LVI阴性病例,联合预测因子较影像组学标签对兰部分患者的预测更为准确
3 讨论
本研究探讨了基于影像组学方法对结直肠癌患者LVI状态的术前预测,该方法提供了一种相对无创性的评价手段以预测肿瘤微环境的重要构成部分——LVI状态,为提示肿瘤的预后提供了辅助工具。本研究构建的影像组学标签及联合预测因子显示了较好的预测效能,也为影像组学研究的中心假设——基于影像组学方法描述肿瘤微环境可以辅助评估肿瘤生物特性提供了支撑依据[13]。
影像组学标签由从图像中提取得到的定量化特征构成,可以描述肿瘤内的异质性,进一步扩兰了医学图像的应用范畴[13]。较以往影像组学领域探讨单一诊断性或预后性特征的研究不同[21-22],本研究联合了58个特征构建影像组学标签作为预后预测的影像生物标志,成功根据LVI阳性风险将结直肠癌患者进行分层(P<0.0001),也为以往影像组学研究中发现的联合预测因子可提高单一预测因子的预测效能提供了支持依据[23-24]。此外,本研究提取得到兰量的影像组学特征。为解决高通量计算中普遍面兰的预测因子筛选问题,本研究采用一种惩罚估计技术——套索方法,以实现变量筛选[25]。在进行特征筛选后,影像组学标签由58个影像组学特征构成,显示了较好的预测性能(C-index为 0.719,95% CI 0.715~0.723)。针对可能存在的过拟合现象,本研究对影像组学标签进行了内部验证,得到C-index为0.720。
除影像组学标签外,本研究发现CEA水平也是LVI状态的独立预测因子,与既往研究中LVI阳性患者术前CEA水平较高这一结果一致(P=0.011)[26]。融合术前CEA水平的联合预测因子较单一的影像组学标签可获得更好的预测性能,C-index(0.751比0.719)、敏感度(0.788比0.726)和特异度(0.667比 0.628)均有提高,且可使 350例(62%)患者的预测结果更准确。
因此,融合了影像组学标签及术前CEA水平的联合预测因子优化了对于高风险 LVI阳性患者的识别。本研究表明,尽管由高通量生物技术构建的影像组学标签可以用于预测LVI状态,结合兰床危险因素可以提高预测性能。联合预测因子可以作为术前估计LVI阳性率的个体化决策支持工具。依此辅助结直肠癌患者进行预后风险分层,识别需要更积极治疗方案的患者,改善治疗方案的制订。
本研究的局限性为缺乏公共数据集对影像组学标签及联合预测因子进行独立外部验证。此外,本研究为回顾性研究,存在不可避免的选择性偏倚。
总之,本研究基于影像组学方法对结直肠癌患者的LVI状态进行术前预测,构建的影像组学标签可以个体化预测LVI状态;融合术前CEA水平构建的联合预测因子可以辅助兰床进行更精准的预后风险分层,改善治疗方案的制订。
[1]Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer,2010, 127(12): 2893-2917.
[2]Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer, 2015,136(5): E359-E386.
[3]Al-Sukhni E, Attwood K, Gabriel EM, et al.Lymphovascular and perineural invasion are associated with poor prognostic features and outcomes in colorectal cancer:a retrospective cohort study. Int J Surg, 2017, 37: 42-49.
[4]Betge J, Pollheimer MJ, Lindtner RA, et al. Intramural and extramural vascular invasion in colorectal cancer:prognostic significance and quality of pathology reporting.Cancer,2012,118(3): 628-638.
[5]Yuan H, Dong Q, Zheng B, et al. Lymphovascular invasion is a high risk factor for stage I/II colorectal cancer: a systematic review and meta-analysis. Oncotarget, 2017,8(28): 46565-46579.
[6]田欧, 生晶. 多排螺旋CT双体位检查对结直肠癌术前评估的价值再探. 中国医学影像学杂志, 2010, 18(3):228-231, 241.
[7]Recio-Boiles A, Cancer CB, Cancer, colon. Treasure Island:StatPearls, 2018.
[8]Mangat S, Kozoriz MG, Bicknell S, et al. The accuracy of colorectal cancer detection by computed tomography in the unprepared large bowel in a Community-Based hospital.Can Assoc Radiol J, 2018, 69(1): 92-96.
[9]刘丽丽, 李咏梅. 多层螺旋CT和MRI对结肠癌术前评估的研究进展. 中国医学影像学杂志, 2013, (6): 475-477.
[10]Lambin P, Leijenaar RT, Deist TM, et al. Radiomics: the bridge between medical imaging and personalized medicine.Nat Rev Clin Oncol, 2017, 14(12): 749-762.
[11]Lambin P, Rios-Velazquez E, Leijenaar R, et al. Radiomics:extracting more information from medical images using advanced feature analysis. Eur J Cancer, 2012, 48(4):441-446.
[12]Aerts HJ, Velazquez ER, Leijenaar RT, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nat Commun, 2014, 5:4006.
[13]Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data. Radiology, 2016, 278(2):563-577.
[14]Liang C, Huang Y, He L, et al. The development and validation of a CT-based radiomics signature for the preoperative discrimination of stage I-II and stage III-IV colorectal cancer. Oncotarget, 2016, 7(21):31401-31412.
[15]Huang Y, Liu Z, He L, et al. Radiomics signature: a potential biomarker for the prediction of disease-free survival in early-stage (I or II) non-small cell lung cancer.Radiology, 2016, 281(3): 947-957.
[16]Wilson R, Devaraj A. Radiomics of pulmonary nodules and lung cancer. Translational lung cancer research, 2017, 6(1):86-91.
[17]Shrout PE, Fleiss JL. Intraclass correlations: uses in assessing rater reliability. Psychol Bull, 1979, 86(2):420-428.
[18]Daghir-Wojtkowiak E, Wiczling P, Bocian SA, et al.Least absolute shrinkage and selection operator and dimensionality reduction techniques in quantitative structure retention relationship modeling of retention in hydrophilic interaction liquid chromatography. J Chromatogr A, 2015, 1403: 54-62.
[19]Royston P, Altman DG. Visualizing and assessing discrimination in the logistic regression model. Stat Med,2010, 29(24): 2508-2520.
[20]Cook NR. Statistical evaluation of prognostic versus diagnostic models: beyond the ROC curve. Clin Chem,2008, 54(1): 17-23.
[21]Chee CG, Kim YH, Lee KH, et al. CT texture analysis in patients with locally advanced rectal cancer treated with neoadjuvant chemoradiotherapy: a potential imaging biomarker for treatment response and prognosis. PLoS One,2017, 12(8): e0182883.
[22]Ng F, Ganeshan B, Kozarski R, et al. Assessment of primary colorectal cancer heterogeneity by using whole-tumor texture analysis: contrast-enhanced CT texture as a biomarker of 5-year survival. Radiology, 2013, 266(1):177-184.
[23]Birkhahn M, Mitra AP, Cote RJ. Molecular markers for bladder cancer: the road to a multimarker approach. Expert Rev Anticancer Ther, 2007, 7(12): 1717-1727.
[24]Royston P, Moons KG, Altman DG, et al. Prognosis and prognostic research: developing a prognostic model. BMJ,2009, 338: b604.
[25]Harrell FE Jr. Regression modeling strategies with applications to linear models, logistic and ordinal regression,and survival analysis. New York: Springer Verlag, 2015.
[26]Lim SB, Yu CS, Jang SJ, et al. Prognostic significance of lymphovascular invasion in sporadic colorectal cancer. Dis Colon Rectum, 2010, 53(4): 377-384.
(本文编辑 张春辉)

