多参数MRI对前列腺癌诊断价值的Meta分析
蒋小凤,李宏伟,王朗,雷丽程,刘川,朱丽,刘竣,杜勇
前列腺癌(prostate cancer,PCa)是男性生殖系统最常见的恶性肿瘤之一。2015—2016年美国癌症协会统计数据显示,在所有男性癌症患者中,PCa以年新增病例18万~20万例居第1位,年病死率居第2位[1]。近年来,PCa在亚洲的病死率呈上升趋势[2]。目前应用多参数磁共振成像(multiparametric magnetic resonance imaging,mp-MRI)诊断PCa是前列腺影像学研究的热点,T2WI、扩散加权成像(DWI)及动态增强(dynamic contrast enhancement,DCE)是其3大核心序列[3]。mp-MRI对PCa早期诊断、临床评价及分级具有较高的灵敏性和特异性,可提供关于前列腺形态、代谢和细胞变化的信息以及表征组织血供情况[4]。既往研究评价 mp-MRI对PCa的诊断价值多为单个临床试验样本资料,且各研究间的敏感性与特异性差异较大。因此,为进一步综合评价mp-MRI对PCa的诊断价值,本研究采用Meta分析评价mp-MRI诊断PCa的价值,以期为临床研究和科学决策提供依据。
1 资料与方法
1.1 文献检索 计算机检索2013年1月1日至2017年9月31日PubMed、Ebsco、Ovid、中国生物医学文献数据库、维普、万方和中国知网数据库,收集mp-MRI对PCa诊断价值评价相关主题文献。为尽量避免漏查文献,采用主题词与自由词相结合的方式,并对纳入文献的参考文献进行二次检索。英文检索词包括Prostate cancer、 Prostatic Neoplasms、 Cancer of Prostate、PCa、Multiparametric MRI、multiparametric magnetic resonance imaging、mp-MRI、MR、MRI、Magnetic resonance imaging;中文检索词包括前列腺癌、前列腺肿瘤、多参数功能成像、磁共振成像。
1.2 纳入标准
1.2.1 研究类型 采用mp-MRI成像诊断PCa的相关文献,前列腺 mp-MRI序列包括 T2WI、DWI和DCE-MRI。
1.2.2 研究对象 临床疑似PCa患者的前列腺组织的单个感兴趣区(ROI)。
1.2.3 诊断“金标准”设定 以病理学检查作为“金标准”,包括超声引导下(transrectal ultrasound,TRUS)前列腺穿刺活检、前列腺切除术后组织活检、经直肠超声引导前列腺穿刺活检(transretal prostatic biopsy,TPB)、经会阴模板定位前列腺活检(template prostate mapping biopsy,TPM)。
1.3 排除标准 ①研究对象<10例;②包括其他功能MR序列,如MRS等;③信件、重复发表、动物实验、综述类文献;④无法直接或间接获得四格表数据的文献。
1.4 纳入研究的风险偏倚评价 由2名评价员按照Cochrane协作网推荐的QUADAS-2工具评价诊断性文献质量[5]。
1.5 文献筛选和资料提取 由2名研究者独立进行文献筛选和资料提取,并交叉核对。有争议时协商,或咨询第三方协助判断。筛选文献时,首先阅读标题和摘要,排除明显不相关的文献。再进一步阅读全文进行复筛,以决定是否纳入。提取的主要资料包括第一作者、发表年限、国家、研究类型、场强、线圈类型、诊断“金标准”、样本量、患者年龄、前列腺特异抗原(prostate specific antigen,PSA)、Gleason评分及四表格数据[真阳性(TP)、假阳性(FP)、假阴性(FN)、真阴性(TN)]。
1.6 统计学方法 采用 Meta-Disc 1.4和Stata 14.0软件进行分析。首先采用Spearman相关分析检验有无阈值效应引起的异质性。若P>0.05,提示无阈值效应,采用固定效应模型进行分析;若P<0.05,提示存在阈值效应,采用随机效应模型进行分析。按照可能产生异质性的因素进行亚组或Meta回归分析。随后对全部纳入研究进行Meta分析,计算合并敏感度(Sen合并)、合并特异度(Spe合并)、合并阳性似然比(+LR合并)、合并阴性似然比(-LR合并)以及合并诊断比值比(DOR合并),绘制汇总受试者工作特性曲线,并计算曲线下面积(AUC)。P<0.05表示差异有统计学意义。
2 结果
初检出相关文献1343篇。经过逐层筛选后,最终20篇文献符合纳入标准[6-25]。文献筛选流程及结果见图 1。纳入研究的患者基本特征见表 1。纳入研究的风险偏倚评价见图2。
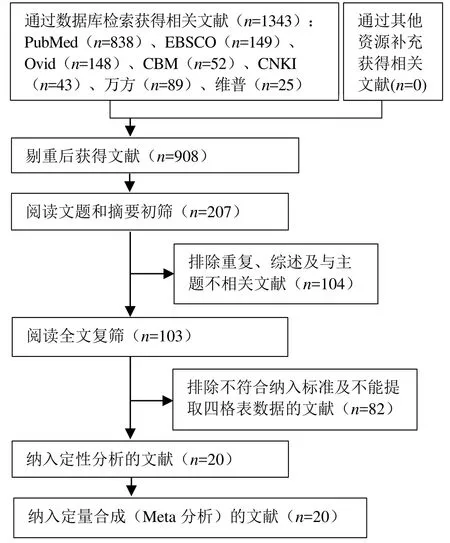
图1 文献筛选流程
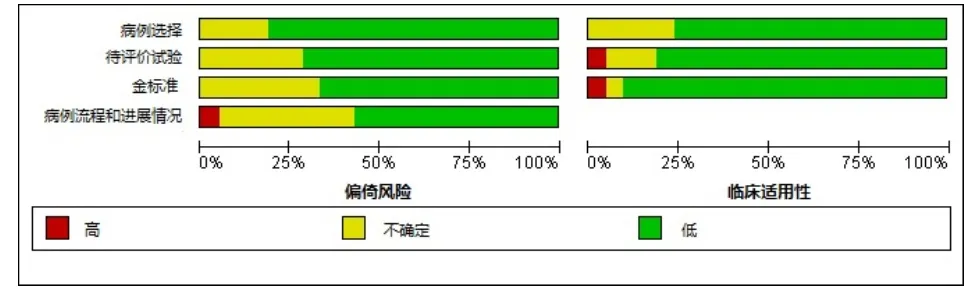
图2 纳入研究的风险偏倚评价
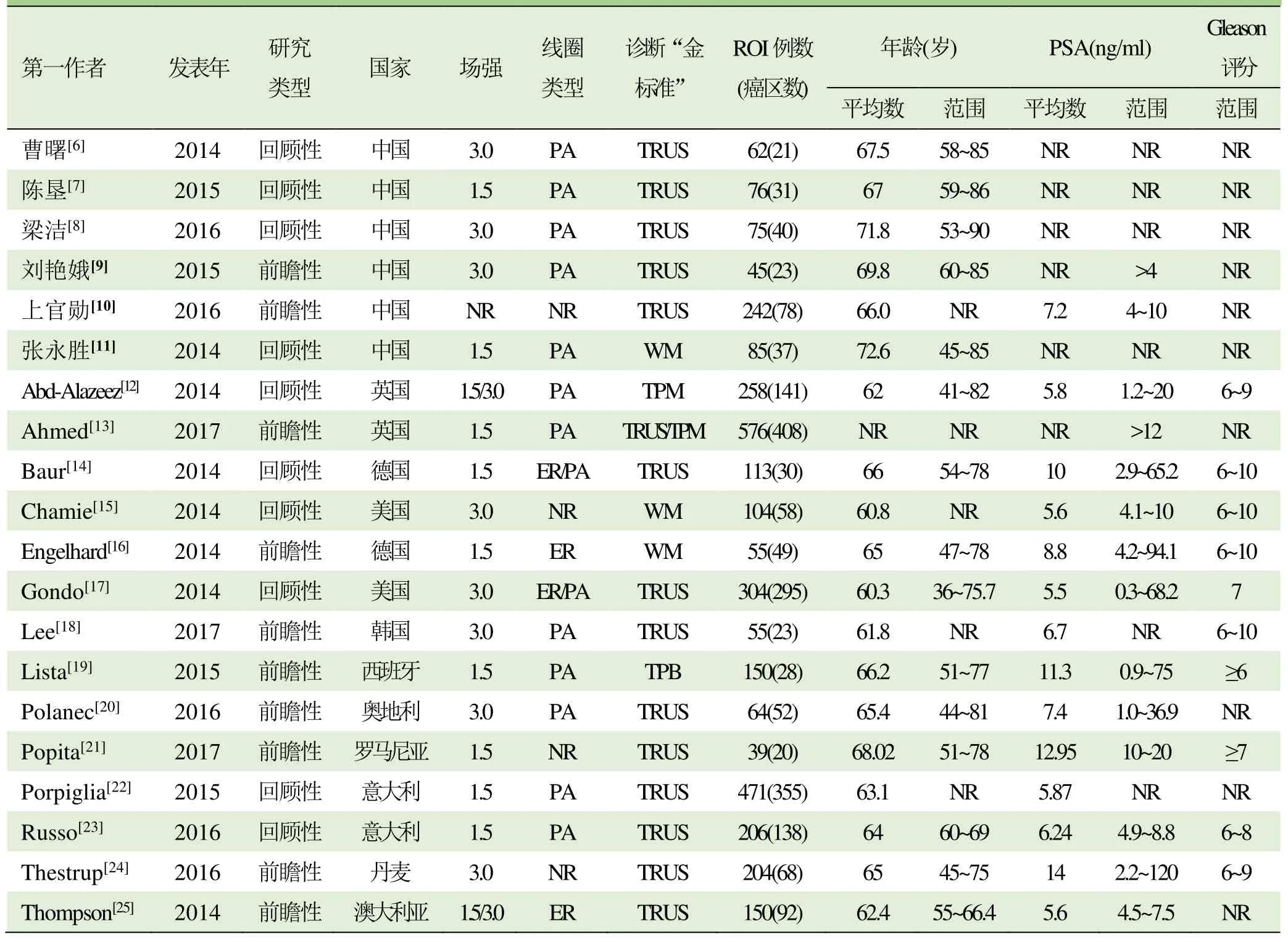
表1 纳入研究的患者基本特征
2.1 异质性检验及发表偏倚 计算 Sen对数与(1-Spe)对数的Spearman相关系数,P=0.29,提示不存在阈值效应。异质性检验结果显示P=0.000、I2=93.5%,提示纳入的20个研究结果间存在较大的统计学异质性,故采用随机效应模型进行合并分析。经Egger检验,P=0.127,表明纳入文献未发现发表偏倚。但 Deeks漏斗图中回归线并不与DOR轴垂直,提示存在一定程度的发表偏倚(图3)。
2.2 敏感性分析 剔除质量较低的研究进行敏感性分析,结果显示总体合并敏感度、特异度变化较小,改变效应模型,结果也无明显改变,说明Meta分析结果的稳定性较好,可信度较高。
2.3 Meta分析结果及亚组分析 Meta分析结果显示,mp-MRI诊断PCa的Sen合并=0.89(95% CI 0.87~0.92)、Spe合并=0.76(95% CI 0.67~0.84)、+LR合并=3.8(95% CI 2.7~5.4)、-LR合并=0.14(95%CI 0.11~0.17)、DOR合并=27(95% CI 17~44)、AUC合并=0.92(95% CI 0.89~0.94),见图 4、5。鉴于研究方法、场强、线圈类型可能是导致研究结果异质性较大的原因,因此对其进行亚组分析。结果见表2。
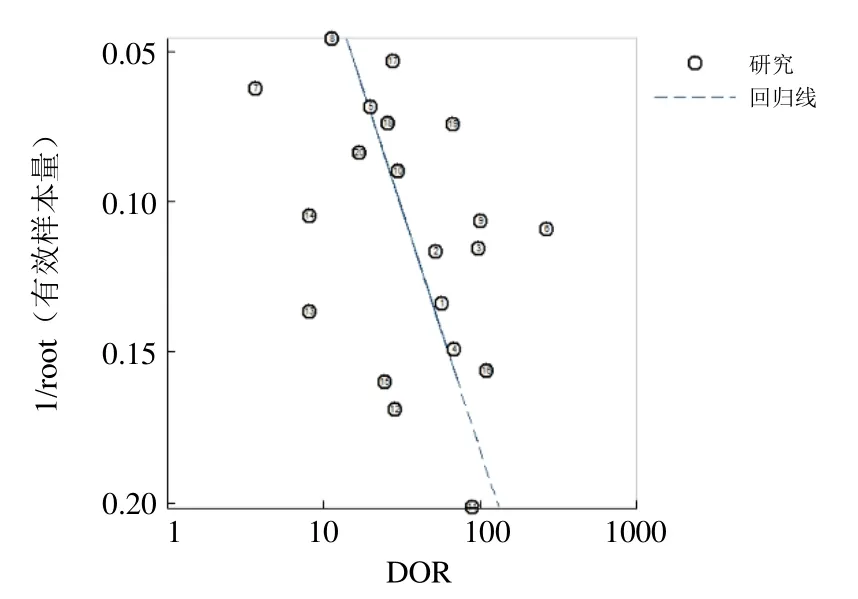
图3 mp-MRI诊断PCa的发表偏倚
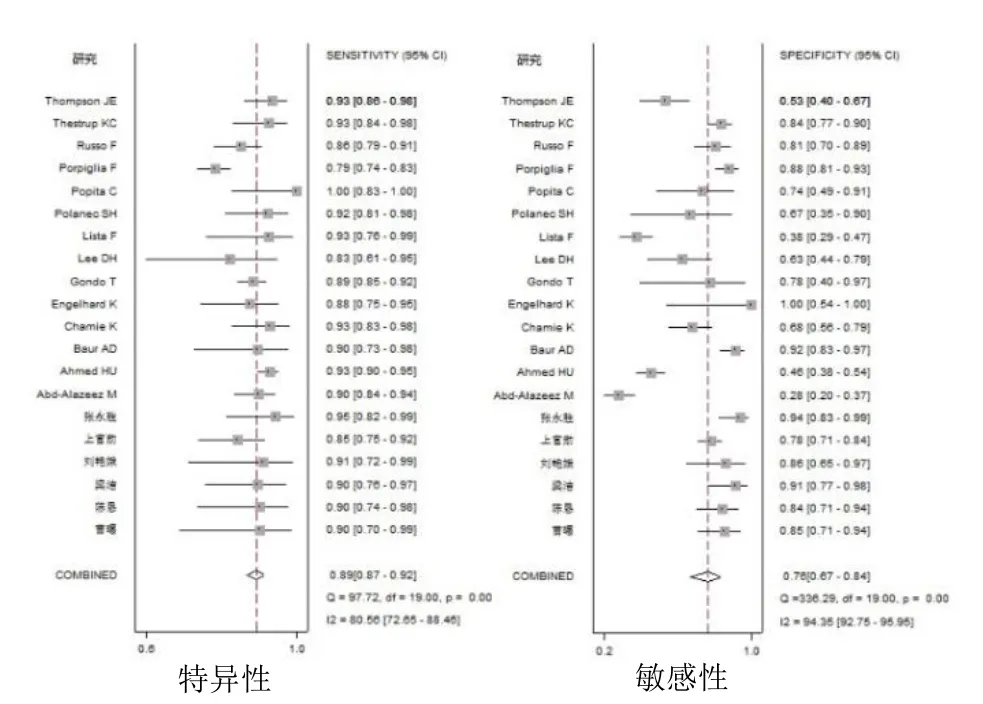
图4 mp-MRI诊断PCa敏感度和特异度的Meta分析
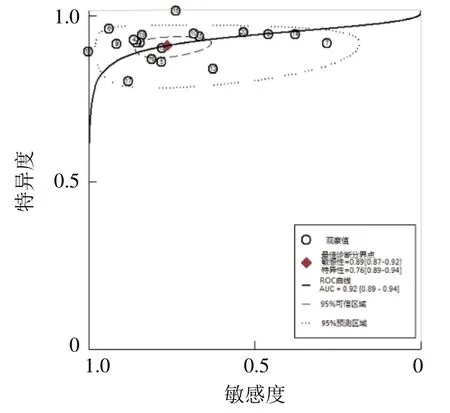
图5 mp-MRI诊断PCa的汇总受试者工作特性曲线
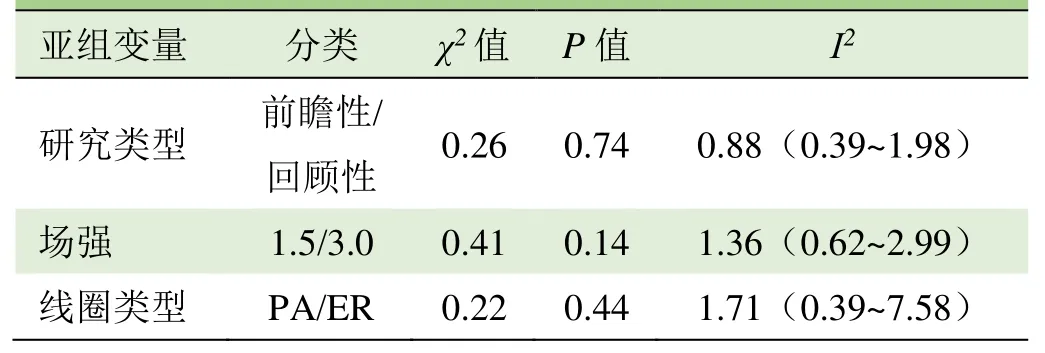
表2 纳入研究的Meta回归分析结果
3 讨论
随着精准医学的发展,mp-MRI在诊断前列腺疾病中的应用越来越广泛。本研究汇总国内外文献,综合评价mp-MRI对PCa的诊断价值,为影像和临床医师的决策提供科学依据。本Meta分析结果显示,Sen合并、Spe合并分别为 0.89、0.76,提示敏感度较高,特异度中等;AUC=0.92,说明mp-MRI对PCa的诊断效能较高。由于存在异质性,故进一步开展了Meta回归分析异质性的来源,结果未发现存在临床意义的因素。
目前针对前列腺癌的主要检查方式包括直肠指检、穿刺活检及PSA指标等,但均不能兼顾准确性及安全性[26]。MRI前列腺检查完全无创伤、无辐射,是目前公认的前列腺疾病最佳影像学检查方法,其中以T2WI+DWI+DCE的联合扫描方案最佳。上述序列不仅可从形态学上观察前列腺,还能从分子及功能性水平对前列腺病变进行诊断[8]。3.0T MRI可增加图像信噪比,提高图像的空间分辨率和时间分辨率,有利于肿瘤的检出[27]。因此在临床工作中,推荐 3.0T MRI用于前列腺检查。场强低于1.5T的MRI因未得到较好的验证故不建议使用。临床工作中常用体部线圈进行扫描。尽管直肠内线圈对观察PCa是否穿破包膜,侵犯精囊腺,盆腔淋巴结、骨盆、骶骨是否有转移更加敏感,但价格昂贵、操作繁琐,目前国内应用报道较少[28]。
前列腺结构在T2WI上显示最佳。外周带PCa在T2WI上常表现为低信号,因前列腺癌细胞排列比较紧密,其间缺乏储存液体和黏蛋白的足够空间,造成病灶信号减低[29];但这并非PCa的特异性表现,良性前列腺增生、前列腺炎、出血、内分泌或放疗后改变等部分良性病变也可有类似表现[30]。发生于中央腺体的PCa和正常组织在T2WI上均表现为低信号,不易被检出[31]。梁洁等[8]研究显示,T2WI对PCa的诊断敏感度为65.00%,特异度为85.71%。DWI能够检测组织水分子的扩散情况,恶性细胞密度增加,使得细胞外间隙变小、含水量少,其表观扩散系数值将低于良性病变。前列腺周围组织结构复杂,不同组织磁化率差别较大,DWI可有效鉴别良性增生和前列腺癌[32]。宋惠珍等[33]研究显示,在采用较高 b 值(600、800、1000 s/mm2)的情况下,DWI诊断PCa的特异度和敏感度分别为0.61(95% CI 0.57~0.65)、0.89(95% CI 0.88~0.90),具有较高的应用价值。DCE能够检出前列腺的血流动力学特征,反映前列腺各部分的血流变化。正常外周带的微血管密度明显低于PCa与良性增生。前列腺时间-信号强度曲线可分为3类:①流入型,即信号强度持续增加;②平台型,即信号强度增高后出现平台状态;③流出型,即增强早期迅速上升后出现明显下降期。PCa组织具有较多通透性强的新生血管,并较正常组织有更大的细胞外间隙,因此对比剂易从组织进入血管腔内,呈“快进快出”表现,比周围正常组织强化更早、更明显,可弥补T2WI特异性不高的缺点[34]。Tan等[34]的Meta汇总分析显示,DCE对PCa的诊断敏感度及特异度分别为 0.55(95% CI 0.45~0.65)、0.85(95% CI 0.81~0.89)。
通常,PCa患者的PSA值高于正常人,且随着肿瘤的增大而增加;但其不能作为诊断依据,还需进一步检查。TRUS活检是临床常用且相对便捷的前列腺诊断方案,但其漏诊率较高,且对前列腺中肿瘤病灶的定位比较盲目,导致疾病的过度诊断[35]。mp-MRI作为前列腺穿刺活检前的检查可使约 27%的患者免于穿刺活检。与标准条件相比,结合 mp-MRI进行TRUS活检,检出率高出约18%[13]。但目前尚无公认的参考标准对mp-MRI进行评估。既往研究显示,mp-MRI对高危病变具有较高的敏感性[36]。因此,该技术可用于评估PSA升高患者的活检或随访。
本研究的局限性:①本研究的异质性较高,故进行亚组及敏感性分析的原因。但只提取3个亚组的数据,且亚组分析并未找到异质性来源,故全面分析异质性的来源需要更多的亚组数据。②纳入的研究存在扫描条件不统一、评定“金标准”不一致的问题,可能存在判读偏倚。③纳入ROI多数为影像表现典型的癌灶,mp-MRI对早期PCa的检测还有待进一步评价。④上述文献的研究对象部分为PCa患者,部分为癌性病灶;且未将外周带与中央区PCa分别加以描述,今后需要更加具体、细化的ROI。⑤纳入研究质量参差不齐,今后需要更多设计良好、质量较高的研究进一步证实。
本研究显示 mp-MRI对 PCa具有较高的诊断准确性,可作为PCa的主要诊断方法之一,可为临床医师对前列腺疾病的判断及临床决策提供重要的理论依据。今后还需通过开展高质量、多中心研究增加样本量,更深层次地探讨mp-MRI在前列腺疾病中的应用价值。
[1]Keilani M, Hasenoehrl T, Baumann L, et al. Effects of resistance exercise in prostate cancer patients: a metaanalysis. Support Care Cancer, 2017, 25(9): 2953-2968.
[2]Chen R, Sjoberg DD, Huang Y, et al. Prostate specific antigen and prostate cancer in Chinese men undergoing initial prostate biopsies compared with western cohorts. J Urol, 2017, 197(1): 90-96.
[3]李慧燕, 郑泽宇, 许乙凯. 前列腺疾病的多参数磁共振成像. 实用医学杂志, 2016, 32(4): 624-626.
[4]Boesen L. Multiparametric MRI in detection and staging of prostate cancer. Dan Med J, 2017, 64(2): 5327.
[5]Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med, 2011, 155(8): 529-536.
[6]曹曙, 胡卫列, 曹惠霞, 等. 多参数磁共振成像技术在前列腺癌诊断中的应用价值. 临床泌尿外科杂志, 2014,29(4): 284-286.
[7]陈恳, 刘洋洋, 杨世平, 等. 多参数磁共振成像用于前列腺癌诊断76例分析. 中国药业, 2015, 24(12): 139-140.
[8]梁洁, 季建伟, 樊子健, 等. 3.0T磁共振T2WI联合DWI及DCE对前列腺癌的诊断价值. 磁共振成像, 2016, 7(5):337-341.
[9]刘艳娥. 浅谈多参数核磁共振成像技术在诊断前列腺癌中的应用价值. 当代医药论丛, 2015, 13(13): 59-60.
[10]上官勋, 王艳青, 樊连城, 等. 多参数 MRI对PSA为 4-10μg/L前列腺癌的诊断价值分析. 临床泌尿外科杂志,2016, 31(9): 781-786.
[11]张永胜, 陈瑶, 陈祖华, 等. MRI多参数成像对前列腺癌诊断价值的研究. 浙江医学, 2014, 36(14): 1224-1227.
[12]Abd-Alazeez M, Ramachandran N, Dikaios N, et al.Multiparametric MRI for detection of radiorecurrent prostate cancer: added value of apparent diffusion coefficient maps and dynamic contrast-enhanced images. Prostate Cancer Prostatic Dis, 2015, 18(2): 128-136.
[13]Ahmed HU, El-ShaterBosaily A, Brown LC, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet, 2017, 389(171): 815-822.
[14]Baur AD, Maxeiner A, Franiel TA, et al. Evaluation of the prostate imaging reporting and data system for the detection of prostate cancer by the results of targeted biopsy of the prostate. Invest Radiol, 2014, 49(6): 411-420.
[15]Chamie K, Sonn GA, Finley DS, et al. The role of magnetic resonance imaging in delineating clinically significant prostate cancer. Urology, 2014, 83(2): 369-375.
[16]Engelhard K, Labanaris AP, Bogner KA, et al. How good is post-biopsy multiparametric magnetic resonance imaging in detecting and characterising the index lesion of localised prostate cancer? Scand J Urol, 2014, 48(6): 499-505.
[17]Gondo T, Hricak H, Sala E, et al. Multiparametric 3T MRI for the prediction of pathological downgrading after radical prostatectomy in patients with biopsy-proven Gleason score 3+4 prostate cancer. Eur Radiol, 2014, 24(12): 3161-3170.
[18]Lee DH, Nam JK, Lee SS, et al. Comparison of multiparametric and biparametric MRI in first round cognitive targeted prostate biopsy in patients with PSA levels under 10 ng/mL. Yonsei Med J, 2017, 58(5): 994-999.
[19]Lista F, Castillo E, Gimbernat H, et al. Multiparametric magnetic resonance imaging predicts the presence of prostate cancer in patients with negative prostate biopsy. Actas Urol Esp, 2015, 39(2): 85-91.
[20]Polanec SH, Pinker-Domenig K, Brader PA, et al.Multiparametric MRI of the prostate at 3 T: limited value of 3D H-1-MR spectroscopy as a fourth parameter. World J Urol, 2016, 34(5): 649-656.
[21]Popita C, Popita AR, Sitar-Taut A, et al. 1.5-Tesla multiparametric-magnetic resonance imaging for the detection of clinically significant prostate cancer. Clujul Med, 2017, 90(1): 40-48.
[22]Porpiglia F, Russo F, Manfredi M, et al. Preoperative prostate biopsy and multiparametric magnetic resonance imaging:reliability in detecting prostate cancer. Int Braz J Urol, 2015,41(1): 124-133.
[23]Russo F, Regge D, Armando E, et al. Detection of prostate cancer index lesions with multiparametric magnetic resonance imaging (mp-MRI) using whole-mount histological sections as the reference standard. BJU Int, 2016,118(1): 84-94.
[24]Thestrup KC, Logager V, Baslev I, et al. Biparametric versus multiparametric MRI in the diagnosis of prostate cancer.Acta Radiol Open, 2016, 5(8): 2058460116663046.
[25]Thompson JE, Moses D, Shnier R, et al. Multiparametric magnetic resonance imaging guided diagnostic biopsy detects significant prostate cancer and could reduce unnecessary biopsies and over detection: a prospective study.J Urol, 2014, 192(1): 67-74.
[26]张一然, 潘盼, 连振鹏, 等. 磁共振扫描对经直肠超声引导前列腺穿刺活检的影响. 天津医科大学学报, 2017,23(2): 99-102.
[27]Ullrich T, Quentin M, Oelers C, et al. Magnetic resonance imaging of the prostate at 1.5 versus 3.0T: a prospective comparison study of image quality. Eur J Radiol, 2017, 90:192-197.
[28]朱斌, 张冰, 李茗, 等. 直肠内线圈MR在前列腺癌诊断中作用:肿瘤位置和分期. 医学影像学杂志, 2010, 20(10):1496-1499.
[29]Harvey H, deSouza NM. The role of imaging in the diagnosis of primary prostate cancer. J Clin Urol, 2016, 9(2 Suppl): 11-17.
[30]李鹏, 黄英, 李艳, 等. 多参数磁共振成像诊断和鉴别诊断外周带早期前列腺癌和前列腺炎. 中华医学杂志,2016, 96(37): 2973-2977.
[31]Bao J, Wang X, Hu C, et al. Differentiation of prostate cancer lesions in the transition zone by diffusion-weighted MRI. Eur J Radiol Open, 2017, 29(4): 123-128.
[32]胡成一, 钱琦, 徐莉, 等. 磁共振DWI及ADC值在前列腺疾病中的应用价值. 浙江临床医学, 2017, 19(8): 1519-1520.
[33]宋惠贞, 尹喜, 张林. 磁共振动态增强及扩散加权成像对前列腺癌灶诊断价值的 Meta分析. 中国医学影像学杂志, 2016, 24(9): 701-705.
[34]Tan CH, Hobbs BP, Wei W, et al. Dynamic contrastenhanced MRI for the detection of prostate cancer: metaanalysis. Am J Roentgenol, 2015, 204(4): 439-448.
[35]Sugano D, Sidana A, Calio B, et al. MRI-targeted biopsy: is systematic biopsy obsolete? Can J Urol, 2017, 24(4): 8876-8882.
[36]Cornud F, Legmann P, Delongchamps NB. Can multiparametric MRI rule in or rule out significant prostate cancer? Curr Opin Urol, 2015, 25(6): 490-497.
(本文编辑 闻浩)

