超声波辅助酶法提取枇杷叶多糖工艺研究
(吉首大学化学化工学院,湖南吉首 416000)
枇杷叶为蔷薇科植物枇杷(Eriobotrya japonica(Thunb.)Lindl.)的干燥叶,有清肺止咳、降逆止呕的功效,主要用于治疗肺热咳嗽、胃热呕逆、口渴烦热[1]等症。由于枇杷叶的平咳祛痰功效可能与其机体免疫调节功能密切相关,而多糖物质的一个主要活性就是免疫调节[2-4],故对其提取方法进行优化选择,为枇杷叶中水溶性多糖的提取提供参考。
多糖因具有抗炎症、抗凝血、抗辐射、降血脂等作用,而成为天然药物的研究热点之一,植物多糖的提取物现已被制成多种保健品。现有研究表明,枇杷叶多糖能明显提高小鼠抗疲劳能力,目前全球至少有12种多糖分别作为抗肿瘤药物正在进行临床试验。枇杷叶多糖成品液可制成枇杷叶多糖口服液或枇杷叶多糖口服胶囊,易服用和携带。
目前,国外对于枇杷叶多糖的研究报道较少,而国内的研究主要集中在提取枇杷萜类、熊果酸、苦杏仁苷等方面,仅有的几篇枇杷多糖提取的研究报道也多集中在酸浸碱提、超声波提取[5]、超声-微波协同萃取[6],少有超声波辅助酶法提取枇杷叶多糖的研究报道。开展枇杷叶多糖的综合提取研究工作,可为枇杷资源综合利用提供科学依据。
1 试验部分
1.1 仪器和药品
1.1.1 试验仪器
DS-1型高速组织捣碎机,上海标本模型厂产品;SB-3200YDTD型超声波清洗机,宁波新芝生物科技股份有限公司产品;HH.S型精密恒温水浴锅,江苏金坛市医疗仪器厂产品;GZX-9246MBE型数显热鼓风干燥箱,上海博迅实业有限公司医疗设备厂产品;LXJ-IIB型飞鸽牌离心机,上海安亭科学仪器厂产品;ES-3KCA型电子计数天平,沈阳龙腾电子有限公司产品;721E型可见分光光度计,上海光谱仪器有限公司产品;PHS-25型数字式pH计,上海日岛科学仪器有限公司产品。
1.1.2 试验材料
枇杷叶,产自湖南湘西自治州;果胶酶(1 016 250 U/g,湖州纯米生物科技有限公司提供;蒽酮、浓硫酸、葡萄糖、95%乙醇,均为分析纯。
1.2 试验方法
1.2.1 枇杷叶多糖提取工艺流程
枇杷叶→清洗→干燥→粉碎→过筛→称量→料液混匀→超声波处理→冷却→调pH值→酶解处理→灭酶→离心分离→取上清液测量体积→乙醇沉淀→离心→取沉淀溶解稀释→测定多糖得率。
1.2.2 枇杷叶多糖含量的测定
采取硫酸-蒽酮法测定枇杷叶多糖含量,吸取枇杷叶多糖样液之前充分摇匀,在波长620 nm处测量其吸光度,根据回归方程计算枇杷叶多糖含量。
1.2.3 单因素试验
分别探讨超声波处理时间、料液比、酶解时间、果胶酶用量、酶解温度、pH值对枇杷叶多糖提取效果的影响。
1.2.4 响应面优化试验
在单因素试验的基础上,根据Box-Behnken的中心组合设计原理,选择果胶酶用量、酶解温度、pH值、料液比为响应面优化的考查因素,以枇杷叶多糖提取率为响应值进行中心组合试验设计,在多组试验得出试验数据的基础上,运用SAS 8.1软件对所得数据进行处理,得到优化试验工艺参数,并进行验证性试验[7-9]。
1.2.5 枇杷叶多糖得率的计算
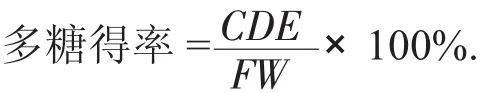
式中:C——样液中多糖质量浓度,mg/mL;
D——样液体积,100 mL;
E——上清液体积,mL;
F——吸取上清液体积,10 mL;
W——枇杷叶质量,mg。
2 结果与分析
2.1 超声波辅助酶法单因素试验
2.1.1 超声波处理时间对枇杷叶多糖得率的影响
称取枇杷叶粉末5.0 g,料液比1∶10(g∶mL),超声波处理温度50℃,处理时间分别为30,45,60,75,90 min,冷却,调pH值为4.5,再用添加量为0.4%的果胶酶处理,在50℃水浴酶解2 h后于80℃下水浴灭酶15 min。
超声波处理时间对枇杷叶多糖得率的影响见图1。
由图1可知,枇杷叶多糖得率随着超声提取时间的延长而升高,在60 min达到最大,而在60~90 min,枇杷叶多糖得率没有明显变化。由于在提取的初期,超声波对细胞膜的破碎作用比较大,枇杷叶多糖被不断浸出,但随着提取时间的延长,枇杷叶多糖的浸出量达到最大,再延长时间也不能将多糖得率提高,故超声波处理时间选择60 min。

图1 超声波处理时间对枇杷叶多糖得率的影响
2.1.2 料液比对枇杷叶多糖得率的影响
称取枇杷叶粉末5.0 g,料液比分别为1∶10,1∶12,1∶14,1∶16,1∶20 (g∶mL),超声波处理温度为50℃,处理时间为30 min,冷却,调pH值为4.5,再用添加量0.4%的果胶酶处理,在50℃水浴中酶解2 h后于80℃条件下水浴灭酶15 min。
料液比对枇杷叶多糖得率的影响见图2。
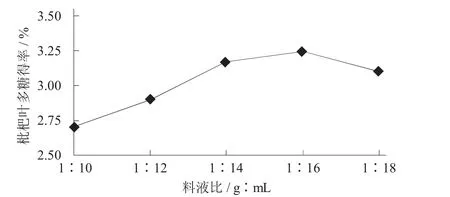
图2 料液比对枇杷叶多糖得率的影响
由图2可知,枇杷叶多糖得率随着料液比增加而升高,在料液比1∶16时达到最高,之后随料液比增加而下降。由于料液比1∶10时,体系黏稠度大,经超声处理后体系内乳化现象严重,酶与底物接触不充分,酶解效果差;随着料液比增加,乳化现象减弱,酶解效果增强;继续增加料液比,底物浓度降低,酶解效果减弱,多糖得率下降,故料液比选择1∶16。
2.1.3 酶解时间对枇杷叶多糖得率的影响
称取枇杷叶粉末5.0 g,料液比为1∶16(g∶mL),超声波处理温度50℃,处理时间30 min,冷却,调pH值4.5,再用添加量为0.4%的果胶酶处理,在50℃水浴酶解,时间分别为1.0,1.5,2.0,2.5,3.0 h,于80℃下水浴灭酶15min。
酶解时间对枇杷叶多糖得率的影响见图3。
由图3可知,枇杷叶多糖得率随着酶解时间增加而升高,当酶解时间超过2 h后,枇杷叶多糖得率增加趋于平缓。这主要是因为时间短,酶促反应不充分;增加酶解时间可以使果胶酶对细胞壁中的果胶物质充分酶解,但酶解时间过长,酶的催化活性降低,进而对枇杷叶多糖得率影响不大,所以酶解的最佳时间为2 h。
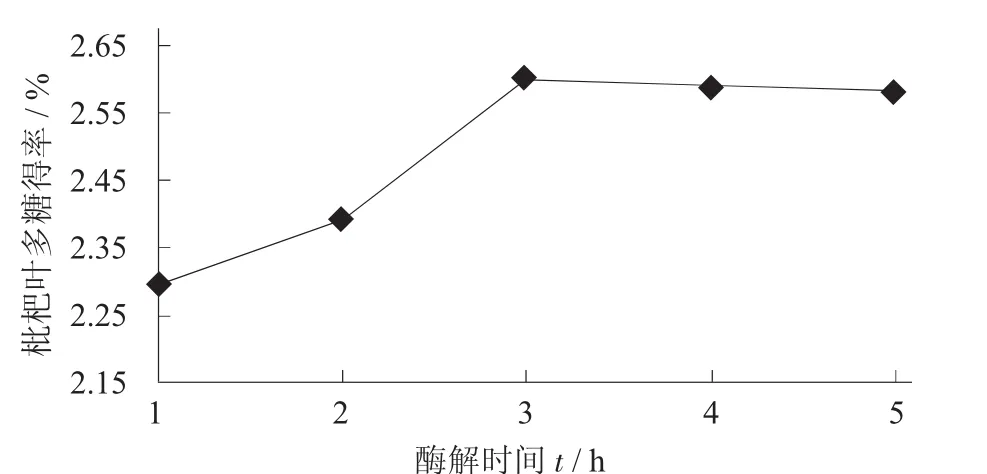
图3 酶解时间对枇杷叶多糖得率的影响
2.1.4 果胶酶添加量对枇杷叶多糖得率的影响
称取枇杷叶粉末5.0 g,料液比1∶16(g∶mL),超声波处理温度50℃,处理时间30 min,冷却,调pH值4.5,分别用添加量0.4%,0.8%,1.2%,1.6%,2.0%的果胶酶处理,在50℃水浴酶解2 h后于80℃下水浴灭酶15 min。
果胶酶添加量对枇杷叶多糖得率的影响见图4。
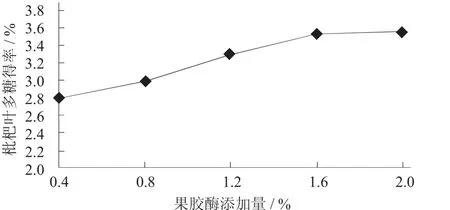
图4 果胶酶添加量对枇杷叶多糖得率的影响
由图4可知,枇杷叶多糖得率随着果胶酶添加量增加而升高,由于果胶是植物组织中与纤维素、半纤维素、木质素、蛋白质等结合的不溶于水的一类物质,果胶酶有利于多糖的释放,当果胶酶添加量超过1.6%后,枇杷叶多糖得率的增加趋于平缓,综合考虑酶成本及多糖得率,故果胶酶添加量为1.6%。
2.1.5 酶解pH值对枇杷叶多糖得率的影响
称取枇杷叶粉末5.0 g,料液比1∶16(g∶mL),超声波处理温度50℃,处理时间30 min,冷却,调pH值分别为3.0,3.5,4.0,4.5,5.0,再用添加量为0.4%的果胶酶处理,在50℃水浴中酶解2 h后于80℃下水浴灭酶15 min。
酶解pH值对枇杷叶多糖得率的影响见图5。

图5 酶解pH值对枇杷叶多糖得率的影响
由图5可知,枇杷叶多糖得率在pH值为4.5最高,由于果胶酶受pH值影响较大,pH值4.5时果胶酶发挥最大活力,破坏细胞壁的效率大大增强,使枇杷叶溶出效率也达到最大值;pH值过高或者过低都会抑制果胶酶活力;pH值可以通过影响底物分子的解离影响反应速度,故选择pH值为4.5。
2.1.6 酶解温度对枇杷叶多糖得率的影响
称取枇杷叶粉末5.0 g,料液比为1∶16(g∶mL),超声波处理温度50℃,处理时间30 min,冷却,调pH值4.5,用添加量为0.4%的果胶酶处理,分别在水浴温度为35,40,45,50,55℃的条件下酶解2 h后于80℃条件下水浴灭酶15 min。
酶解温度对枇杷叶多糖得率的影响见图6。

图6 酶解温度对枇杷叶多糖得率的影响
由图6可知,随着酶解温度升高,枇杷叶多糖得率在50℃最高,高于50℃时,多糖得率反而下降。由于温度升高时,分子热运动加快,活化分子数增多,从而使反应速度加快;超过最适温度后,随着温度升高酶蛋白开始变性,酶活力逐渐降低,从而影响多糖提取,故果胶酶酶解温度选择50℃。
2.2 Box-Behnken中心试验设计优化枇杷叶多糖提取工艺
2.2.1 优化试验
在单因素试验基础上,依据Box-Behnken中心设计原理,以果胶酶添加量(X1)、酶解温度(X2)、pH值(X3)、料液比(X4)为自变量,枇杷叶多糖得率为响应值,设计四因素三水平试验,共27个试验点,其中24个为分析因子(1~24),3个中心试验点(25~27)。
Box-Behnken试验设计因素与水平设计见表1。

表1 Box-Behnken试验设计因素与水平设计
2.2.2 Box-Behnken试验设计方案及试验结果
Box-Behnken试验设计与结果见表2。
2.2.3 模型的建立及显著性检验
回归统计分析见表3。

表2 Box-Behnken试验设计与结果
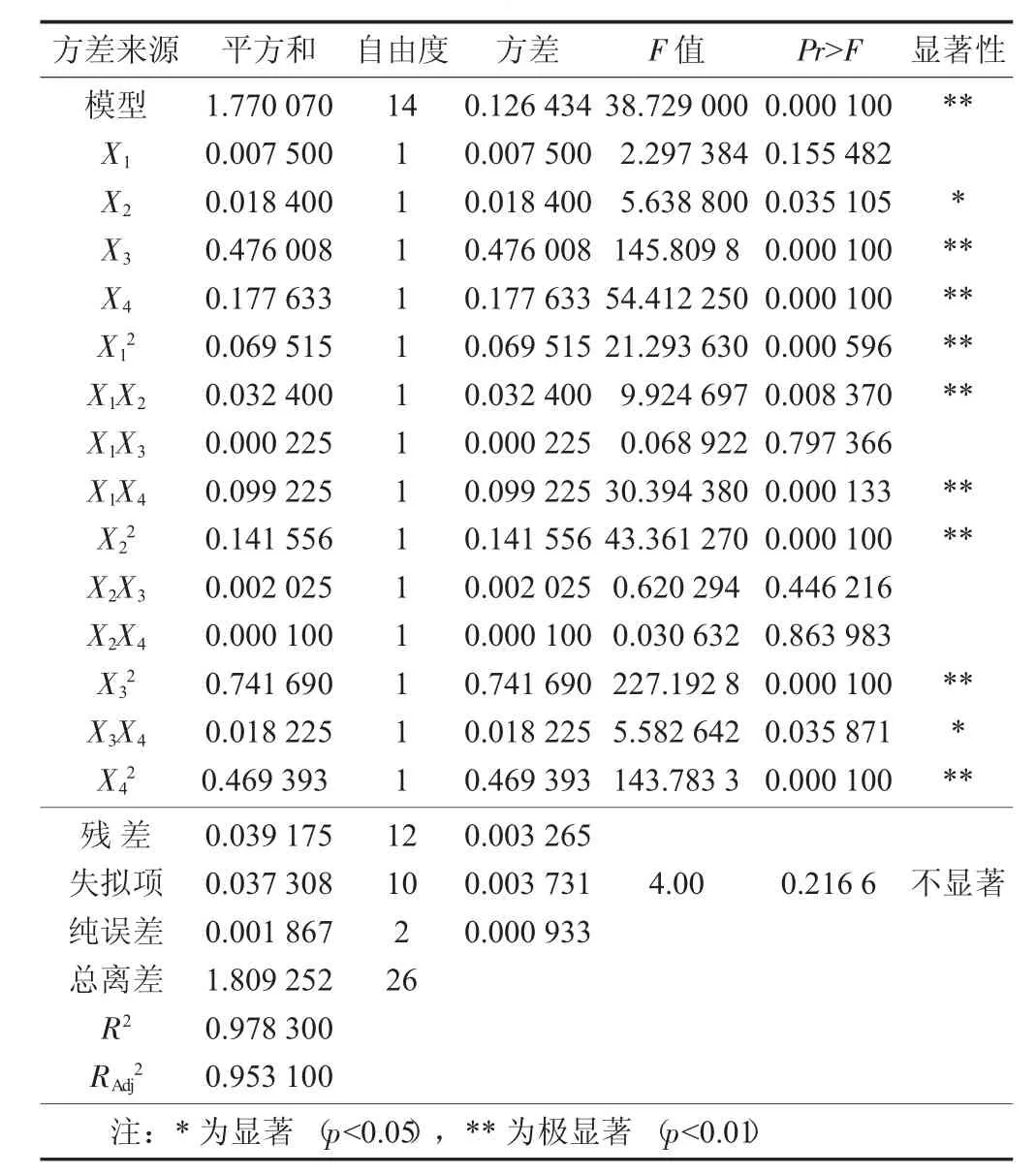
表3 回归统计分析
经SAS 8.1软件对27个试验点的枇杷叶多糖得率进行回归分析,得出数学模型:

从表3可看出模型极显著(p<0.000 1),因变量与所考查自变量之间的线性关系显著(R2=97.83%),模型调整确定系数=95.31%,说明响应值的变化有97.83%来源于所选因子变化,拟合程度良好,失拟项不显著(p>0.05),说明试验所得二次回归方程高度显著,能很好地对响应值进行预测。一次项X3,X4及二次项表现为极显著,X2、X3X4显著,说明它们对响应值影响大,且所考查因素对响应值影响不是简单的一次线性关系。由表3可知,影响因素主次顺序为pH值>料液比>酶解温度>果胶酶添加量。
2.2.4 响应面图形分析
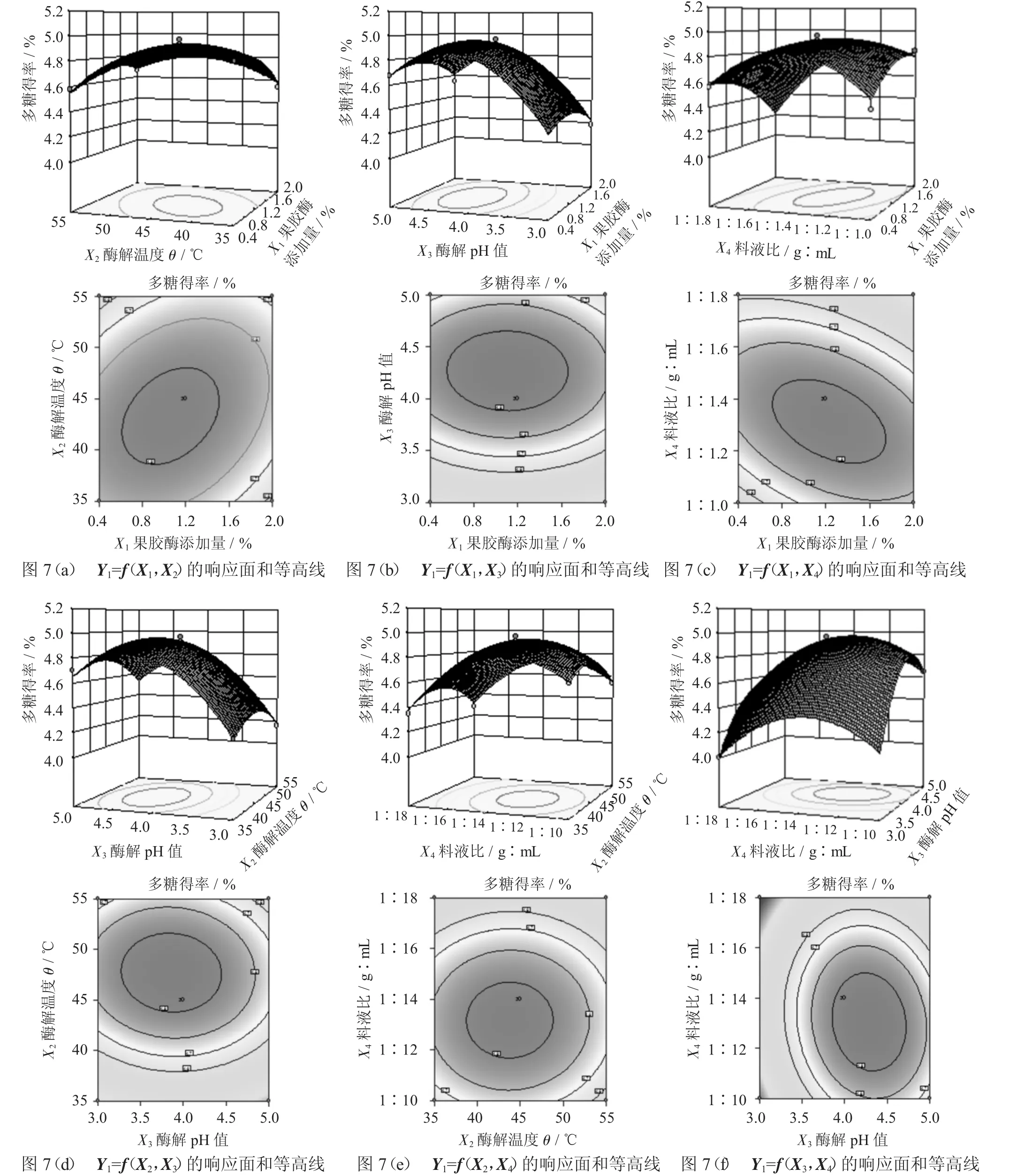
果胶酶添加量(X1)、酶解温度(X2)、pH值(X3)、料液比(X4)交互作用的响应面及等高线图,直观地反映各因素对响应值的影响,找出最佳工艺参数及各参数之间的相互作用,从响应面的最高点和等高线可以看出在所选的范围内存在极值,响应面的最高点同时也是等高线中的最小椭圆的中心点。此外,等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反。
Y1=f(X1,X2)的响应面和等高线见图7(a),Y1=f(X1,X3)的响应面和等高线见图 7(b),Y1=f(X1,X4)的响应面和等高线见图 7(c),Y1=f(X2,X3)的响应面和等高线见图 7(d),Y1=f(X2,X4)的响应面和等高线见图 7(e),Y1=f(X3,X4)的响应面和等高线见图 7(f)。
2.2.5 最优条件的求解及验证
由SAS软件分析并考虑实际操作性,故选定调整后工艺参数为酶添加量1.9%,酶解温度52℃,酶解pH值4.5,料液比1∶15。在优化后的条件下进行验证试验,重复3次,测得枇杷叶多糖得率为4.967%,4.971%,4.972%,即平均值为4.97%,与理论计算值误差在1%以内。
3 结论
通过单因素试验考查了果胶酶添加量、酶解温度、pH值、料液比对枇杷叶多糖得率的影响并通过响应面分析法优化分析,建立了枇杷叶多糖提取率的数学模型:得到的最佳的条件为超声波处理时间60 min,酶解时间2 h,酶添加量1.9%,酶解温度52℃,酶解pH值4.5,料液比1∶15。在此工艺条件下,枇杷叶多糖的理论得率4.973%,实际测得平均得率为4.97%。从测定结果发现,枇杷叶中可溶性多糖的含量较高,可回收提取利用,而超声波辅助酶法提取具有时间短、反应条件温和等优点,可供枇杷叶中水溶性多糖的提取提供参考。
参考文献:
[1]国家药典委员会.中华人民共和国药典 [S].北京:中国医药科技出版社,2015:204.
[2]Li Jingjing,Ji Li,Sun Lin,et al.Analysis of Herba Asari polysaccharides and their immunological activity[J].Carbohydrate Polymers,2012 (1):551-556.
[3]Zhang Yangyang,Li Sheng,Wang Xiaohua,et al.Advances in lentinan:isolation,structure,chain conforma-tion and bioactivities[J].Food Hydrocolloids,2011,25(7):196-206.
[4]Yang Liqun,Zhang Liming.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009 (3):349-361.
[5]王明艳,许瑞波,贺俊霞.超声波技术用于枇杷叶多糖的提取研究 [J].中药材,2006,29(11):1 230-1 232.
[6]王志高,鄢贵龙,武华宜,等.超声-微波协同萃取枇杷叶多糖的工艺研究 [J].食品工业科技,2008,29(8):207-209.
[7]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2011,32(2):79-83.
[8]张顺,曹龙奎.响应面法优化超声波提取小米糠黄酮的工艺研究 [J].农产品加工,2016(12):36-39.
[9]王敬敬,麻成金,曾巧辉,等.响应面优化超声波辅助水酶法提取茶叶籽油工艺 [J].中国食物与营养,2010(10):53-57.◇

