氨水吸收CO2的一级反应动力学研究
李清方,陆诗建
(中石化节能环保工程科技有限公司,湖北 武汉 430223)
在溶剂吸收法工业捕集CO2工艺中,MEA溶液与氨水溶液是应用较为广泛的基础药剂,是有机醇胺溶液和无机氨溶液的典型代表。在吸收反应动力学方面,学者们对这两类药剂做了很多报道。合适并且精确的动力学数据对溶液吸收CO2反应过程模拟和模型的建立甚至是工业级放大应用都起着十分重要的作用。而实验室技术、物性关联和解释机理等能严重影响到获取的动力学数据。因此基于新开发的湿壁塔装置,采用MEA及氨水两种典型吸收剂进行相关研究,并与前人的研究数据做对比。不仅可以检验此湿壁塔的精确性和可靠性,还可以拓展此方面的研究数据。氨水溶液能够克服醇胺药剂的缺点,因为其高负载量及低能耗,已经提上了工业应用[1]。基于氨水溶液进行吸收动力学数据量测,有望对实际工业运行起到指导意义。
1 实验装置与测试原理
1.1 实验流程及装置
如图1,动力学实验装置由反应系统和控制系统组成。反应系统分为气液两路。气路:气体经加热器加热,由质量流量控制仪控制流量大小,经气体饱和器形成饱和气体后从湿壁塔底部进入气液接触室,与液体反应后从湿壁塔顶端流出,经气液分离器分离出残留液体后由湿式气体流量计测出气体剩余流量;液路:为了保证反应液体能够在湿壁柱上形成稳定的液膜,先将液体经由平流泵泵入高位槽,再从高位槽底部流出经水浴加热后流入湿壁塔,从湿壁柱顶端向下降膜,与接触室内的气体反应,反应后流入废液槽。
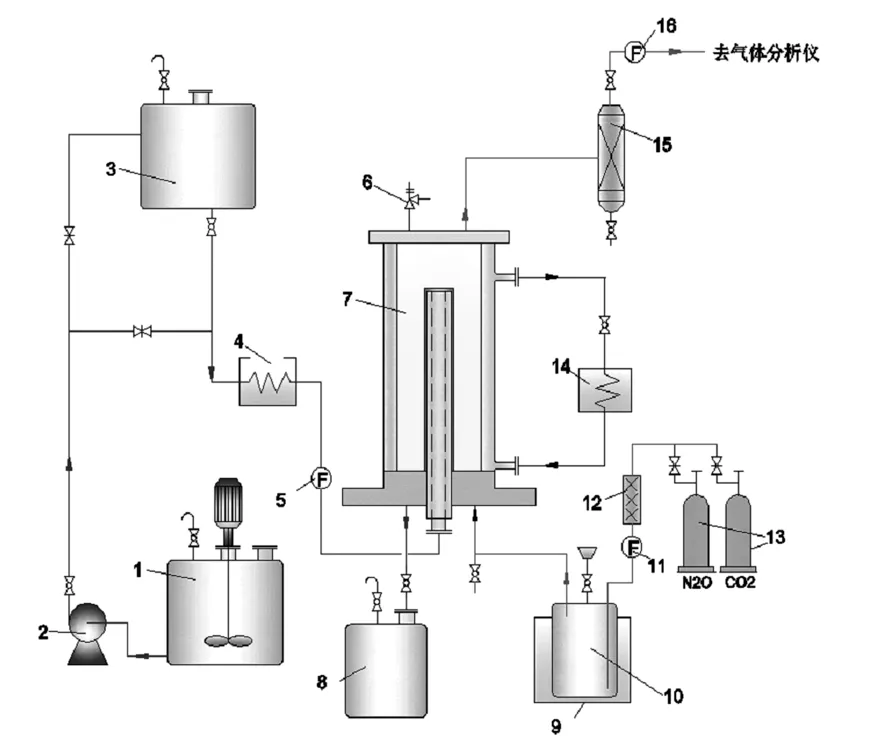
1-配液槽;2-大流量平流泵;3-高位槽;4-液体水浴控温槽;5-液体质量流量计;6-安全阀;7-湿壁塔;8-废液槽;9-气体饱和器水浴控温槽;10-气体饱和器;11-a,11-b气体质量流量控制仪;12-气体加热器;13-气瓶;14-湿壁塔水浴控温槽;15-气液分离器;16-湿式气体流量计
图1 CO2吸收动力学实验流程图
Fig.1 Modified schematic diagram of kinetics of CO2absorption
2 氨水溶液基础数据研究
氨水溶液吸收CO2反应,涉及到几个组份。以总吸收角度讲,氨和OH-是最主要的组份。Pinsent认为与它们有关的主要控制反应是平行反应[2],表达式如下:
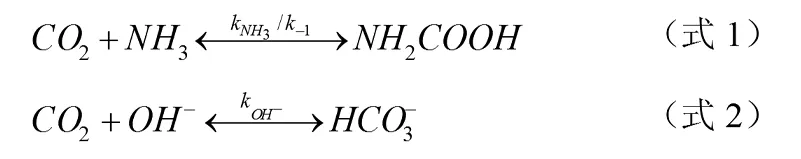
在平行反应中,CO2与胺溶液的反应速率可表达为下式:
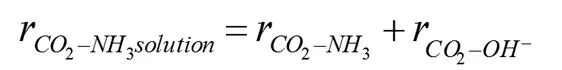
上述反应速率通过CO2浓度可表达为下式:
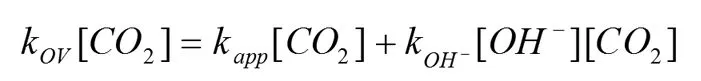
因此,CO2与NH3反应的表观反应速率常数可表达为下式:
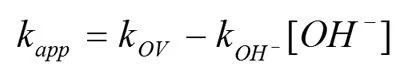
KOH-的值与温度有关,溶液中OH-的浓度可以通过氨水解离常数计算。
在根据式(4)计算kov时,CO2气体在氨水溶液中扩散系数DA及亨利系数HA的计算,均采用其他学者广泛采用的方法。
扩散系数采用Stokes-Einstein公式估算[3]:
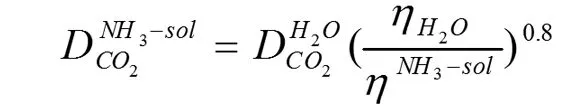
(式6)
亨利系数采用类比定律计算:

(式7)
Versteeg等人研究认为,N2O在氨水中的亨利系数几乎与氨水溶液的浓度无关[4]。在影响可以忽略的情况下,根据类比定律,可认为与CO2在氨水中和在水中的亨利系数近似相同。
量测的基础物性参数如表1所示。
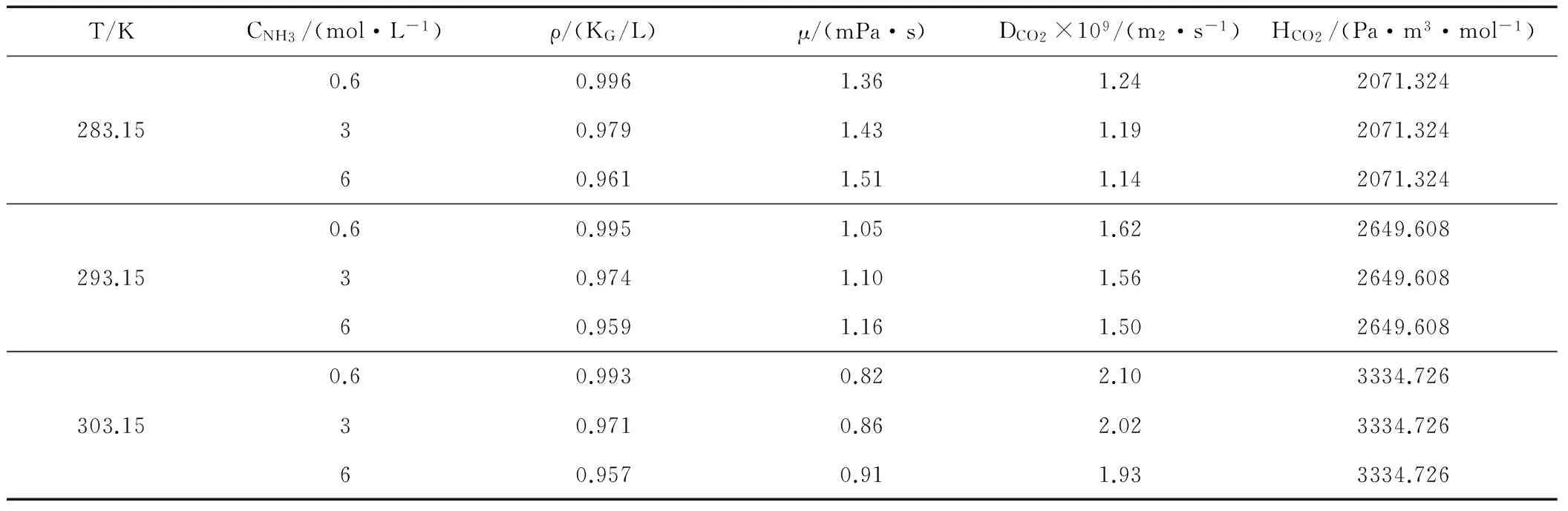
表1 氨水溶液基础物性数据量测
实验先量测了283.15、293.15、303.15K温度条件下浓度在0.3~6mol·L-1范围内无负载氨水溶液吸收CO2气体的动力学数据。如表2~4所示。
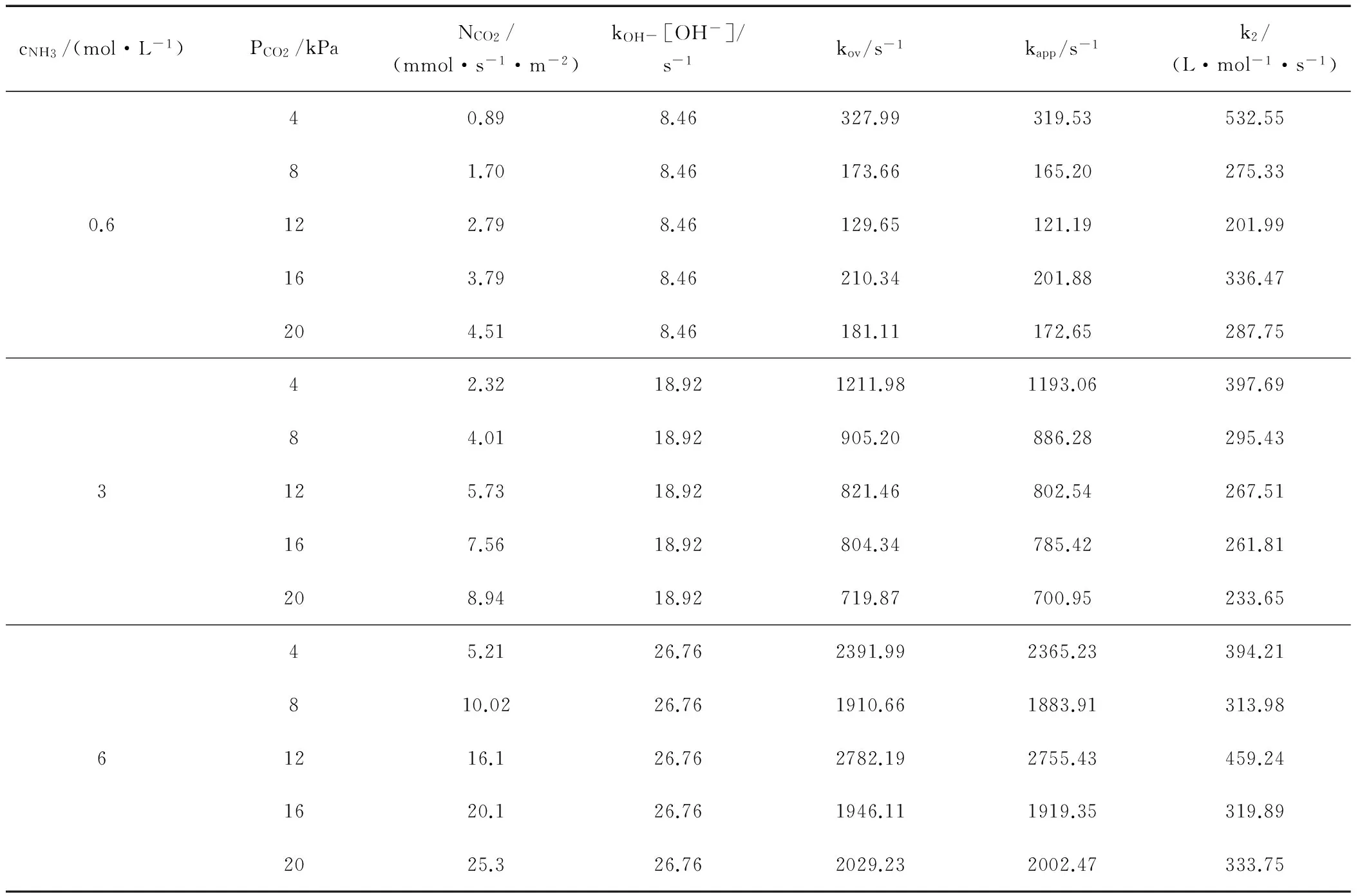
表2 基础数据量测(283.15K)

表3 基础数据量测(293.15K)
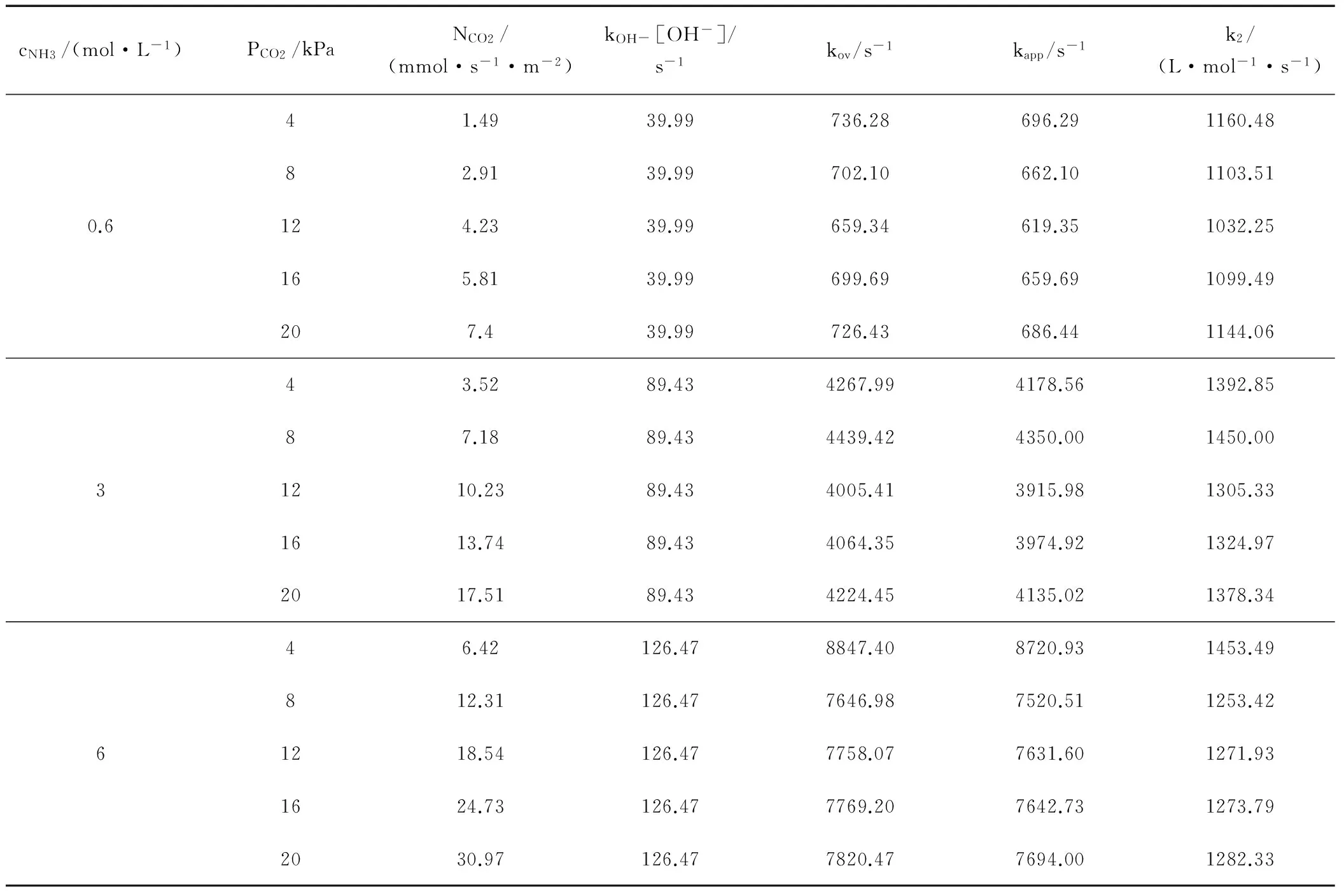
表4 基础数据量测(303.15K)
分析表中不同温度、浓度下的实验数据,发现kOH-[OH-]在kov中所占的比例最大不足1%,并且随氨水浓度的升高呈下降趋势。因此可推断,氨水吸收CO2主反应由第一步控制。OH-的贡献很小,也说明氨水溶液中OH-浓度很低。但是NH3和OH-依然是溶液中的主要碱性成份。
将kapp与氨水浓度作图,并拟合直线,见图2。

图2 kapp值与氨水浓度关系图
取点位置为对应温度及浓度下所量测到的所有kapp值。从所拟合的直线中可以观察出,氨水的浓度越高,kapp值越大,并且成线性规律。这说明氨水吸收CO2的反应对NH3的反应级数为一级。每条直线的斜率便是对应温度下的二级反应速率常数k2。所拟合得到的k2值见表5。
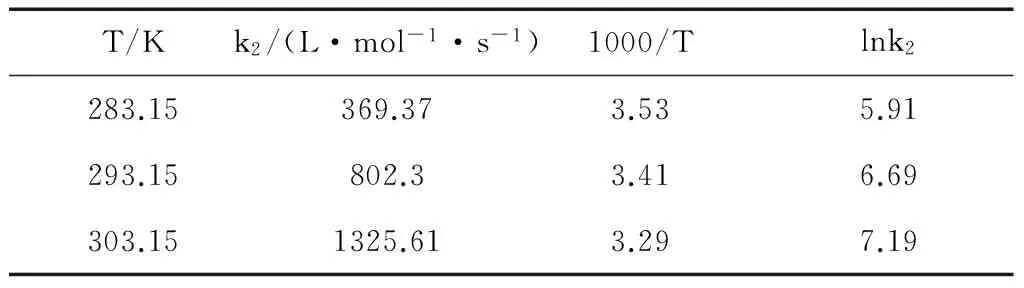
表5 反应速率常数k2
将lnk2与1000/T作图,见图3,并由阿伦尼乌斯公式求得关系式。
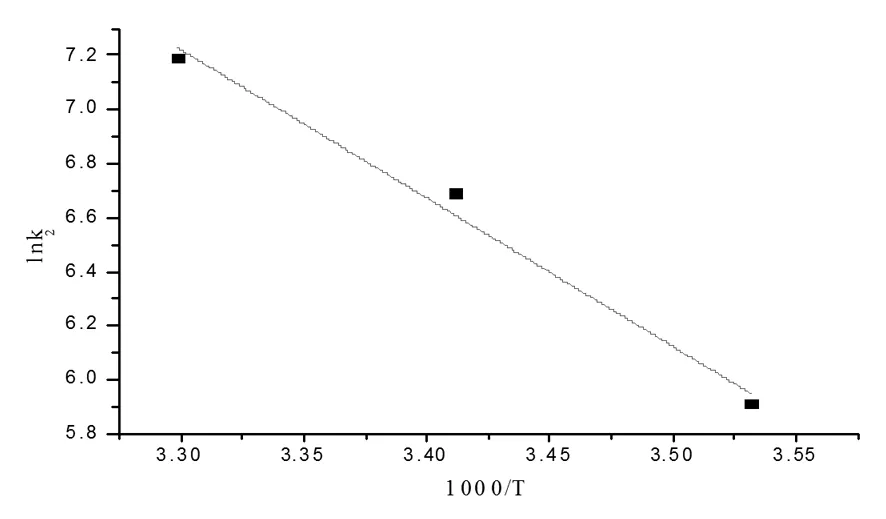
图3 氨水反应速率常数与温度的关系
拟合得到:
(式8)
前面指出,在整个反应过程中OH-浓度对整个反应速率的影响较小,所以CO2与氨水溶液反应速率表达式可表达为:
rCO2-NH3solution=k2[NH3][CO2]
(式9)
同样需要验证假设拟一级反应模型的条件。计算的Ha和Ei值列于表6中。由所得结果可知,应用条件成立。

表6 氨水吸收过程中Ha和Ei计算值
3 氨水溶液传质特性研究
研究氨水溶液吸收CO2的传质特性,不同温度下的CO2吸收速率NCO2与分压PCO2的关系如图4~6所示。
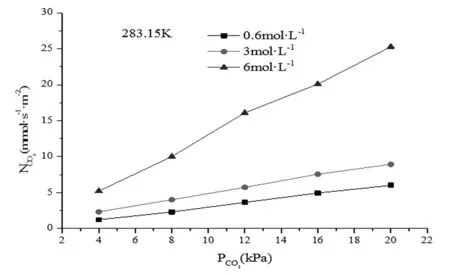
图4 CO2的吸收速率与分压的关系(283.15K)

图5 CO2的吸收速率与分压的关系(293.15K)
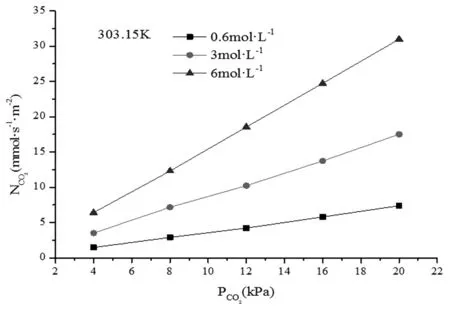
图6 CO2的吸收速率与分压的关系(303.15K)
从图4~6中可以看出,CO2吸收速率均随着分压和氨水浓度的升高而增大。分压和浓度的增大均有利于传质,不管是物理吸收还是化学吸收均增强。并且吸收速率与CO2分压的一次方成正比。这说明氨水溶液吸收CO2反应过程对CO2同为一级反应。则吸收过程为对CO2和氨均为一级反应的二级反应。
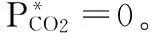
NCO2=KG·PCO2
(式10)
图4~6中各直线所对应的斜率即为对应温度浓度下溶液吸收CO2的传质系数KG。以283.15K,0.6 mol·L-1的氨水溶液为例,作图并拟合直线如图7所示。

图7 CO2吸收速率与分压的关系(283.15K,0.6mol·L-1)
求得对应传质系数KG=0.2331mmol·s-1·m-2·kPa-1,截距为实验带来的误差。同时分别拟合了其他浓度及温度下所对应的传质系数,见表7所示。
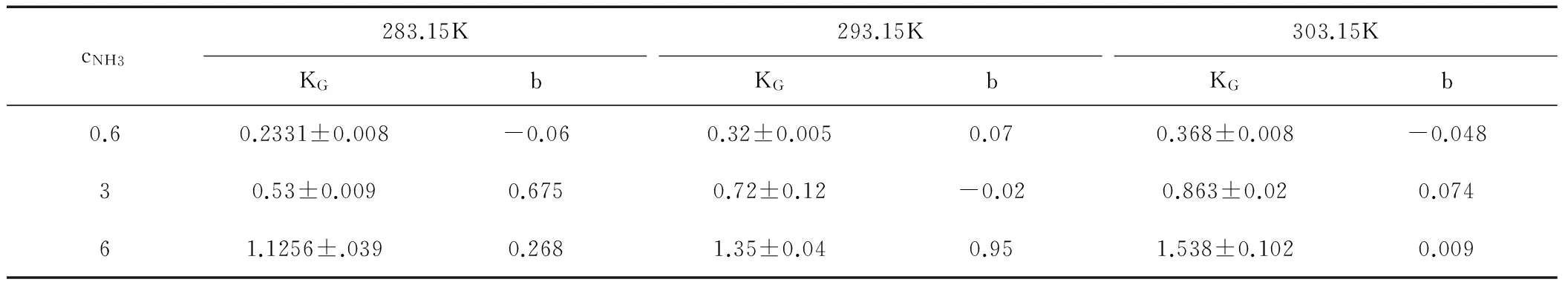
表7 纯氨水溶液吸收CO2的传质系数

表中所示数据在类似条件下与文献中运用中试填料塔实验装置吸收CO2测试所得的结果相近[5]。截距很小,表明纯氨水溶液中CO2的平衡分压可以视为0。
在氨水溶液负载不为0时,将测得的NCO2与PCO2数值作为横纵坐标绘图,通过线性回归可求得到总传质系数KG,通过截距可求得对应负载条件下的CO2平衡分压。
本研究工作测定了283.15K、293.15K和303.15K温度条件下,负载为0~0.8的氨水溶液吸收CO2传质系数,如表8所示。
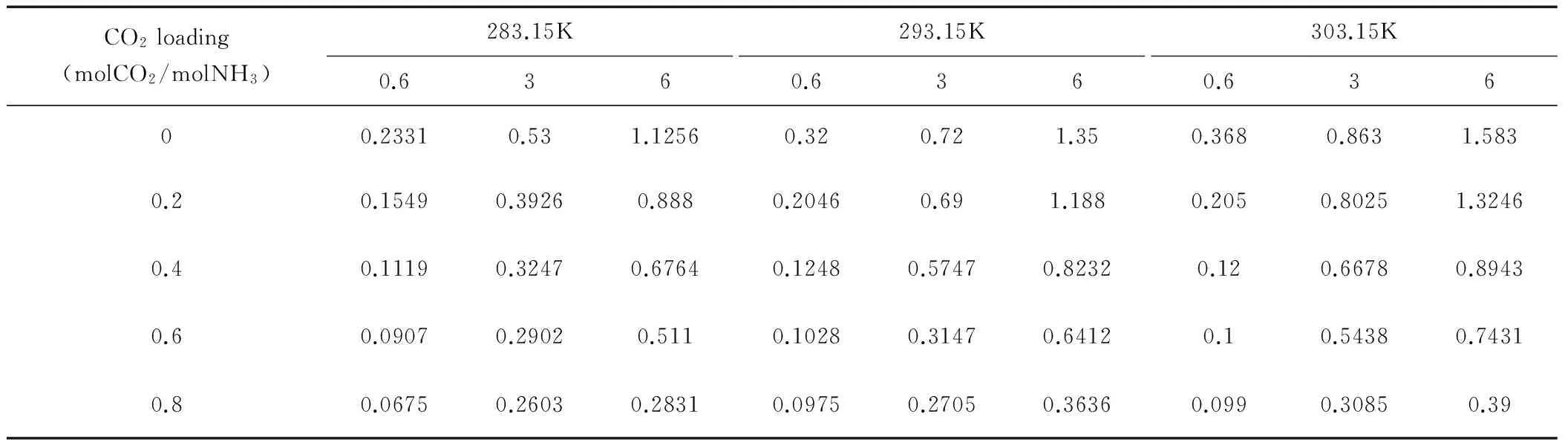
表8 负载氨水溶液传质系数
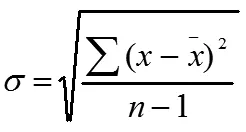
可以看出传质系数受到氨水浓度、负载和温度的影响。实验过程中发现,温度或负载较低时,在气液分离器底部会形成少量白色晶体。经研究,这些白色晶体在高于室温时又会自动分解,表明这些晶体应该是NH4HCO3。因为碳酸铵和氨基甲酸铵在室温时不会分解,NH4HCO3形成过程是由气相中的CO2和NH3分子在分离器中冷凝。此行为会影响到出湿壁塔气体CO2的含量,理论上应该计算生成NH4HCO3量,并修正CO2的出口浓度。但生成量实在太少,本研究工作暂不考虑。
将对应温度、浓度下所量测到的传质系数与负载的关系作图,如图8所示。将纵坐标进行对数缩放,有利于局部放大,可更好地观察数据。
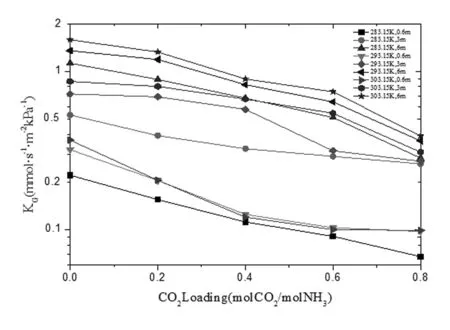
图8 KG与液相CO2负载关系曲线
实验结果与Puxty在类似条件下的研究结果大致吻合[1]。从图8中可以观察出,传质系数对氨水的浓度最为敏感。在283.15K,纯氨水溶液浓度范围在0.6~6 mol·L-1时,传质系数从0.2335 mmol·s-1·m-2·kPa-1增长至1.1516 mmol·s-1·m-2·kPa-1。其他温度条件下的规律与此类似,传质系数能提升5倍左右,并且在图片中分布区域明显。
在各温度和浓度下KG值均随着液相中CO2负载的升高而降低。图8中纵坐标通过对数放缩,曲线下降趋势在部分条件下可成线性。负载由0升至0.2时,可观察到传质系数降低达20%~30%左右。此时,OH-离子的浓度比未负载溶液大大降低,而自由氨的作用也下降了。在最高负载0.8时,传质系数在0.06~0.3 之间变化。这是个非常大的差距,说明化学吸收依然在增强传质。当氨水溶液负载达如此之高时,传质速率大大下降,那么气液反应就需要更大的接触面积。有文献报道在CO2负载达到最高0.8时,CO2脱除率仅能达到1%,而纯氨水溶液在初始状态吸收CO2脱除率可达99.5%以上。
在浓度为3 mol·L-1和6 mol·L-1时,可以明显观察到传质系数随着温度的升高而增大。温度越高,反应活性越强,对吸收传质的影响较为明显,传质系数可提升1.5~2倍左右。303.15K,3 mol·L-1的吸收曲线与283.15K,6 mol·L-1的曲线发生交叉,说明此时温度对吸收的影响高于浓度的影响。
在0.6 mol·L-1时出现反常情况,见图9所示。
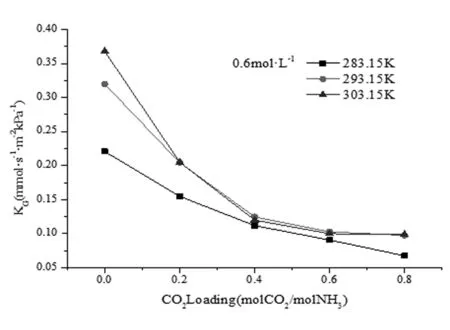
图9 0.6 mol·L-1时KG与液相CO2负载关系曲线
在温度为293.15K和303.15K时所测得传质系数相近,甚至303.15K时更低。这可能是在温度较高氨水浓度较低时,液膜的氨挥发损耗导致的。此时氨分子的扩散限制着吸收速率。从整个图表观察,在高温时传质速率差距明显,而在低温时差距很小。说明温度较低时,溶质活性较低。同时挥发损耗降低,但是吸收速率下降,温度对动力学性质影响较小。
4 MEA与氨水吸收CO2传质效果对比
在捕集工厂中,最大的成本消耗是能量和材料。而吸收塔器的设计建造在材料消耗中占主要地位。吸收塔的尺寸由CO2吸收速率决定。吸收速率越快,则所需气液接触面积就越小,塔径越小。所以测定吸收药剂的传质速率意义重大。对于一个运行工艺来说,药剂传质速率对比非常重要。下面以基础药剂MEA和氨水的传质速率进行对比分析,见图10。
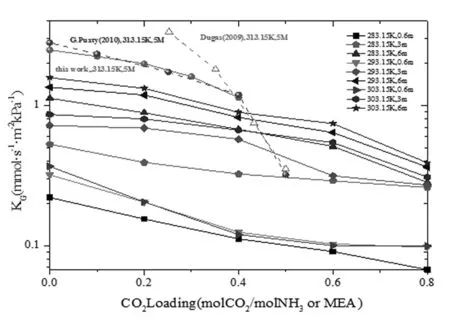
Fig.10 Comparison of KG between aqueous ammonia and MEA
图中所示为工业条件下的MEA溶液KG和在不同温度浓度下氨水溶液KG随负载变化关系。可知,氨水吸收CO2最佳温度为283.15~293.15K,最佳浓度为5%~10%,即3~6 mol·L-1。而MEA药剂的工业应用已经成熟,图中在各自适应的条件下对比,可以对氨水工艺塔器设计提出指导。例如,KG减为一半,说明在同样的气体处理条件下,反应面积需要加倍才能达到相同的脱除率。MEA溶液在负载0~0.4的KG值是293.15K、6mol·L-1氨水各负载下KG值的1.5~2倍左右。说明如果氨水工艺应用条件为293.15K,浓度为6 mol·L-1,则所需的气液接触面积是MEA的1.5~2倍大。如若采取氨水工艺温度浓度更低,接触面积将成倍增长。
溶液负载对捕集工厂的操作运行意义重大。对于氨水捕集工艺来说,因为其具有高挥发性,为了能够减少氨的损耗和达到低能耗的目标,需要界定运行时的负载(即贫富液负载)。国内示范装置MEA工艺负载一般在0.1~0.4左右,如若定位氨水负载为0.3~0.6,则需要吸收塔的尺寸远大于MEA。从本实验的研究结果看出,氨水吸收CO2生成氨基甲酸盐的反应速率常数要比MEA低一个数量。此外,由于氨水易挥发,目前已经运行的氨法脱除CO2示范装置均采用较低的温度,使得氨水吸收CO2速率慢的问题明显。目前应用最出色的是阿尔斯通公司的冷冻氨工艺,运行温度在283.15K以下,可知其吸收塔体积必定庞大。所以决定尺寸的因素还需要考虑浓度、温度及工艺运行所采用的贫富液负载模式。前面的研究结果与文献Putxy等人的结果一致,说明湿壁塔与中试填料塔的实验结果有着较好的一致性。因此可以通过实验型湿壁塔有效的预测大型填料吸收塔的总传质速率。
参考文献
[1]Bert M.Intergovernmental Panel on Climate Change[C]//Working GroupⅢ. IPCC special report on carbon dioxide capture and Storage. Cambridge: Cambridge University Press,2005:440.
[2]Danckwerts P V. The reactions of CO2with ethanolamines[J]. Chem Eng Sci,1979,34(4): 443-446.
[3]董文峰. 大规模电厂烟气CO2捕集高效塔内件模拟优化[D].青岛:青岛科技大学,2014.
[4]Ludovic Raynal,Pierre-Antoine Bouillon,Adrien Gomez,et al. From MEA to demixing solvents and future steps,a roadmap for lowering the cost of post-combustion carbon capture[J]. Chemical Engineering Journal,2011,171:742-752.
[5]EIA.Emissions of greenhouse gases in the United States 2008[A].U.S:EIA,2009:1-68.
[7]Coninck H,Stephens J C,Metz B.Global learning on carbon captureand storage: a call for strong international cooperation on CCS demonstration[J].Energy Policy,2009,37:2161-2165.
[8]Sanpasertparnich T,Idem R,Bolea L,et al. Integration of post-combustion capture and storage into a pulverizedcoal-&ed power plant[J]. Int J Greenhouse Gas Control,2010,4:499-510.
[9]骆仲泱,方梦祥,李明远,等. 二氧化碳捕集、封存和利用技术[M]. 北京:中国电力出版社,2012:40-42.

