FAM19A4基因启动子甲基化检测在宫颈癌组织中的临床意义
布俏雯 张亮 王三锋 马健 胡桂英 伍恒英 罗喜平
广州医科大学附属广东省妇幼保健院妇科(广州 510010)
宫颈癌是世界范围内继乳腺癌及直肠癌后的第三大女性恶性肿瘤,每年约有500 000的新发病例,造成250 000例死亡[1]。因此能尽早发现宫颈病变,对宫颈癌的预防和治疗有重要意义。目前主要通过液基薄层细胞学检测(thinprep cytologic test,TCT)和HPV联合检测手段筛查宫颈癌。但TCT敏感性较低,造成较高的假阴性率,联合HPV检测虽然提高了发现CIN2+以上病变的灵敏度,但是特异度仍较低。最新研究[2]发现联合DNA甲基化检测技术既能保持诊断宫颈病变的灵敏度,又能提高特异性。因此,将靶基因甲基化检测技术应用到宫颈癌的早期筛查中能提高宫颈病变的检出率。研究[3]表明在宫颈癌及癌前病变中,宿主基因DNA甲基化导致抑癌基因沉默,从而导致癌变。因此,寻找在宫颈癌中高甲基化而在正常宫颈中非甲基化的特异性分子标志物,补充目前宫颈癌早期筛查方法的不足,具有重要意义。国外已有研究[4-5]发现在宫颈细胞中,FAM19A4基因甲基化能作为新型的肿瘤标记物,高效鉴别宫颈癌与正常宫颈组织。但国内目前尚无FAM19A4基因启动子甲基化在宫颈癌及其癌前病变诊断中应用价值的相关文献报道。本文采用双探针荧光定量PCR技术检测正常宫颈组织、宫颈HSIL及宫颈癌组织中FAM19A4基因的甲基化情况,并比较该甲基化情况在宫颈癌的不同临床特征中的差异,分析该基因的甲基化在宫颈癌发生、发展中的诊断价值。
1 资料与方法
1.1 资料来源 随机收集2017年1月至2017年8月间就诊于我院,分别因宫颈癌、宫颈HSIL、子宫脱垂行子宫切除术的甲醛固定-石蜡包埋组织(formalin-fixed and paraffin-embedded,FFPE)标本,经我院2名以上病理医师分别诊断为宫颈癌、宫颈HSIL(CIN3)及正常宫颈共76例(分别为31例、22例和23例)。不同宫颈病变组别平均年龄分别为:(47.42 ± 9.34),(42.45 ± 9.06),(48.30 ± 12.32)岁,年龄间差异无统计学意义(P>0.05)。
1.2 研究方法
1.2.1 DNA的提取 利用TIANamp FFPE DNA提取试剂盒(北京天根公司生产)提取石蜡包埋标本的DNA,按试剂盒说明书提供的方法操作。以上提取的DNA使用Quawell Q5000紫外分光光度计进行浓度测量,保存于-20℃冰箱备用。
1.2.2 重亚硫酸盐修饰 将提取的DNA进行重亚硫酸氢盐处理(模板DNA浓度为500 ng),利用EZ DNA Methylation-DirectTM试剂盒(美国Zymo Research公司产品),按试剂盒说明书提供的方法操作。重亚硫酸盐修饰后的DNA立即用于荧光定量PCR检测,剩余样本储存在-20℃冰箱。
1.2.3 双探针荧光定量PCR 美国ABI 7500型实时荧光定量PCR系统(Life Tech)用于进行实时荧光定量PCR技术检测宫颈细胞刷液中FAM19A4基因的甲基化情况。以宫颈癌FFPE-DNA、正常外周血DNA、双蒸水分别作为阳性对照、阴性对照和空白对照模板。反应体系共20 μL,主要包括:2×Premix Type试剂10 μL;50 × Rox Reference Dye II试剂0.2 μL;FAM19A4基因上、下游引物各0.5μl;ACTB内参基因上、下游引物各0.5 μL;FAM19A4基因及ACTB内参基因探针各0.8 μL;纯水5.2 μL;样本量1 μL(FAM19A4基因及ACTB内参基因的引物及探针序列如表1所示)。PCR反应条件:95℃预变性3 min;然后95℃变性15 s,56℃退火20 s及65℃延伸40 s,共进行40个循环。每个样本均进行了3次重复试验。扩增结果判定:荧光定量PCR技术扩增后,经ABI 7500收集荧光信号,获得内参基因和目标基因的循环阈值(CT值)及扩增曲线(宫颈癌、正常宫颈及空白对照的扩增曲线如图1所示),计算两基因CT值间的阈值差(ΔCT),综合判定不同样本的甲基化程度。以ACTB为内参,计算ΔCT=CT目标基因-CT内参,并同时结合扩增曲线判断甲基化情况,且ΔCT值越小,扩增曲线目标基因越早扩增,表示基因甲基化水平越高。
1.3 统计学方法 采用SPSS 23.0软件进行统计学分析。计量资料以均数±标准差表示。计数资料采用Pearson卡方检验或连续校正或Fisher精确概率法,α=0.05;其中组内两两比较采用Bonferroni校正。线性趋势采用Cochran-Armitage趋势检验,以P<0.05为差异有统计学意义。

表1 FAM19A4及ACTB基因的引物及探针序列Tab.1 The sequences of primers and probes for the FAM19A4 and ACTB genes
2 结果
2.1 比较不同严重程度宫颈病变FFPE样本的FAM19A4基因启动子甲基化检出率的差异 采用双探针荧光定量PCR分别检测宫颈癌、宫颈HSIL和正常宫颈组织FFPE中FAM19A4基因启动子发生甲基化的情况,发现在31例宫颈癌FFPE中FAM19A4基因甲基化检出率最高(96.8%),22例宫颈HSIL组织有16例发生甲基化(72.7%),21例正常宫颈组织仅2例发生甲基化(8.7%),3组间甲基化检出率存在统计学差异(P<0.05)。接着进行组内两两比较,经分析发现宫颈癌组的FAM19A4基因甲基化检出率高于宫颈HSIL组(96.8%vs.72.7%,P<0.05);宫颈癌组的FAM19A4基因甲基化检出率高于正常宫颈组(96.8%vs.8.7%,P<0.05);宫颈HSIL组的FAM19A4基因甲基化检出率高于正常宫颈组(72.7%vs.8.7%,P<0.05)。见表2。
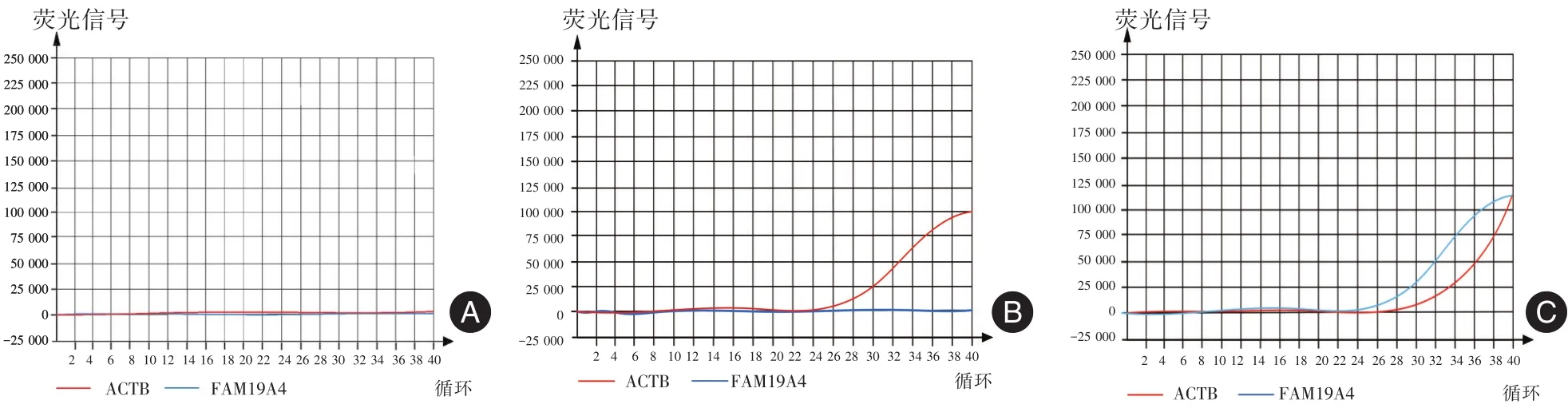
图1 宫颈癌、正常外周血DNA及空白对照样本的的扩增曲线Fig.1 Amplification curves of cervical cancer,normal peripheral blood DNA and blank control samples
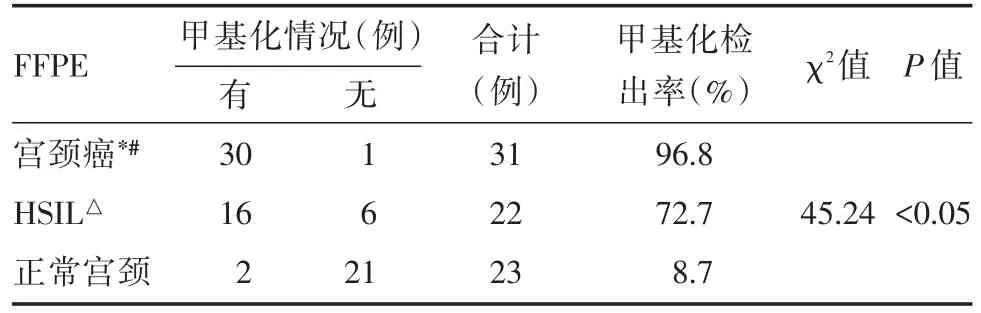
表2 宫颈癌与非癌病变FFPE组织中FAM19A4基因启动子甲基化检出率的比较Tab.2 Comparison of detection rates of FAM19A4 gene promotor methylation in FFPE tissues of cervical cancer and non-cancerous lesions
采用Cochran-Armitage趋势检验判断宫颈病变程度与FAM19A4甲基化之间是否存在线性趋势,发现二者间存在线性趋势(χ2=42.572,P<0.05),即从正常宫颈到癌前病变再进展为宫颈癌,随着宫颈病变严重程度增加,FAM19A4基因甲基化的检出率逐渐升高。
2.2 宫颈癌不同临床病理特征与FAM19A4基因启动子甲基化检出率间的关系 31例宫颈癌患者的平均年龄为47.42岁,宫颈癌的年龄分组、组织学分型、临床分期(FIGO,2009年)、肿瘤大小及淋巴结转移状态的分组情况如下表所示,发现宫颈癌不同年龄段、病理类型、临床分期、肿瘤大小及淋巴结转移状态的FAM19A4基因启动子的甲基化检出率间差异均无统计学意义(P>0.05)。见表3。

表3 宫颈癌临床病理特征与FAM19A4基因启动子甲基化检出率间的关系Tab.3 Relationship between clinicopathological characteristics of cervical cancer and the detection rates of FAM19A4 gene promoter methylation 例
3 讨论
3.1 DNA甲基化与宫颈癌的关系及FAM19A4基因的功能介绍 宫颈癌是妇科常见的恶性肿瘤,其发病率及病死率均较高,但发病机制仍不明确。高危型HPV(high risk human papillomavirus,hr-HPV)感染是宫颈癌及其癌前病变的主要致病原因,hr-HPV还能诱导宿主细胞发生遗传及表观遗传的改变导致癌变[6]。表观遗传改变是指无需改变基因核苷酸序列但能改变基表型的过程。研究表明,表观遗传水平发生变异的频率是基因突变频率的10倍[7]。因此,检测表观遗传学变异诊断肿瘤具有更高的稳定性、灵敏度和特异度。其中DNA甲基化是最常见的表观遗传学之一,由DNA甲基转移酶(DNMT)催化并维持,使DNA启动子CpG岛中胞嘧啶残基的C5转化为5-甲基胞嘧啶,进一步导致基因的沉默失活[3]。研究[8]表明,DNA启动子甲基化与宫颈癌的发生发展密切相关,可作为宫颈癌早期诊断的分子标志。具有序列相似性的19家族(趋化因子(C-Cmotif)-样)成员 A4(family with sequence similarity 19 member A4,FAM19A4)是TAFA基因家族成员,其编码的细胞因子FAM19A4是一种分泌蛋白,是甲酰肽受体-1(FPR1)的配体,能趋化巨噬细胞,促进吞噬酵母聚糖并增加ROS释放。研究发现FAM19A4在正常组织中呈低表达,而在单核细胞及巨噬细胞中表达上调,能促进巨噬细胞的吞噬及迁移作用,调控炎症感染及应激反应[9-10]。
3.2 FAM19A4基因甲基化检测在宫颈癌诊断中的临床意义 STEENBERGEN等[4]首先使用人染色体核型分析技术在宫颈组织水平验证了FAM19A4基因启动子甲基化有望作为宫颈癌的新型靶向分子标记物。研究发现其在宫颈癌及正常宫颈组织中的检出率存在明显表达差异(84%vs.5%),其中鳞癌与腺癌分别占91%(39/43)和73%(19/26)。本研究也发现了,与正常宫颈组织相比,FAM19A4基因甲基化检出率在宫颈癌组织中异常增高(8.7%vs.96.8%),与文献报道相似[4]。本研究在宫颈癌前病变中(HSIL),同样检测到较高水平的FAM19A4基因甲基化(72.7%),远高于STEENBERGEN等报道的10%(4/42),提示该基因甲基化同样有望成为预测宫颈癌前病变的分子标记物。此外,已有研究在宫颈细胞刷液或灌洗液中,发现FAM19A4基因甲基化也能有效检测出宫颈癌及其癌前病变[5,11-13]。STROOPER 等[5]发现HPV感染持续5年以上的CIN2/3及宫颈癌病变中,均检测出FAM19A4基因甲基化;而HPV感染持续不足5年的CIN2/3病变中,仅有42.1%检测出FAM19A4基因甲基化。该研究表明FAM19A4甲基化水平随着宫颈病变进展而增高,该基因的甲基化检测能预测不同程度的宫颈病变进展为癌变的风险。本研究通过趋势检验也进一步说明了随着宫颈病变严重程度增加,FAM19A4甲基化检出率越高,FAM19A4基因甲基化可能促进宫颈癌的发生发展,是宫颈细胞癌变的特异性生物标志物。本研究也首次结合宫颈癌的临床病理特征分析,发现FAM19A4基因甲基化均与年龄、病理类型、临床分期、肿瘤大小及淋巴结转移状态无关。由此推测,FAM19A4基因甲基化是宫颈癌发生的早期事件,但可能与宫颈癌的生长活力及侵袭转移特征无关。
3.3 FAM19A4基因甲基化检测与传统宫颈癌筛查技术(HPV分型及TCT)的比较 与细胞学及HPV16/18分流相比,FAM19A4基因启动子甲基化对检测CIN3及以上病变(≥CIN3)的灵敏度不明显劣于前两者,但特异度均显著增高(分别为49.8%和57.4%vs.71.1%),有望成为hr-HPV阳性妇女的分流方案[13]。为了避免细胞学的额外取材,有研究将HPV16/18分型与FAM19A4基因甲基化结合用于检测≥CIN3或≥CIN2病变,发现两者结合虽然较单纯甲基化检测降低了特异度,但大大增加了灵敏度(分别为92%和76.5%)[11-12]。因此将HPV分型与靶基因甲基化检测同时结合运用于宫颈癌(前)的筛查,能显著减少其漏诊风险。
综上所述,本研究从宿主基因水平的变化表明了宫颈组织可能受表观遗传影响发生癌变,但仅在组织水平验证了FAM19A4基因甲基化可能是宫颈癌病变的分子标志物,并未从取材更为方便的宫颈细胞刷液水平做进一步研究,更未进行随访研究,论证发生FAM19A4基因甲基化的癌前病变是否具有更高进展为恶性肿瘤的风险,这是本研究不足之处。未来研究中拟从宫颈细胞刷液甚至自取宫颈细胞灌洗液出发,进行前瞻性的队列研究,探索FAM19A4基因甲基化与宫颈癌(前)病变的关系,希望将该基因甲基化检测应用在宫颈癌(前)病变的早期诊断中。
参考文献
[1]TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]SAHASRABUDDHE V V,LUHN P,WENTZENSEN N.Human papillomavirus and cervical cancer:biomarkers for improved prevention efforts[J].Future Microbiol,2011,6(9):1083-1098.
[3]JONES P A,BAYLIN S B.The fundamental role of epigenetic events in cancer[J].Nat Rev Genet,2002,3(6):415-428.
[4]STEENBERGEN R D,ONGENAERT M,SNELLENBERG S,et al.Methylation-specific digital karyotyping of HPV16E6E7-expressing human keratinocytes identifies novel methylation events in cervical carcinogenesis[J].J Pathol,2013,231(1):53-62.
[5]De STROOPER L M,MEIJER C J,BERKHOF J,et al.Methylation analysis of the FAM19A4 gene in cervical scrapes is highly efficient in detecting cervical carcinomas and advanced CIN2/3 lesions[J].Cancer Prev Res(Phila),2014,7(12):1251-1257.
[6]STEENBERGEN R D,SNIJDERS P J,HEIDEMAN D A,et al.Clinical implications of(epi)genetic changes in HPV-induced cervical precancerous lesions[J].Nat Rev Cancer,2014,14(6):395-405.
[7]THOMAS R K,BAKER A C,DEBIASI R M,et al.Highthroughput oncogene mutation profiling in human cancer[J].Nat Genet,2007,39(3):347-351.
[8]WENTZENSEN N,SHERMAN M E,SCHIFFMAN M,et al.Utility of methylation markers in cervical cancer early detection:appraisal of the state-of-the-science[J].Gynecol Oncol,2009,112(2):293-299.
[9]WANG W,LI T,WANG X,et al.FAM19A4 is a novel cytokine ligand of formyl peptide receptor 1(FPR1)and is able to promote the migration and phagocytosis of macrophages[J].Cell Mol Immunol,2015,12(5):615-624.
[10]LIU H,WANG X,SHI S,et al.Efficient production of FAM19A4,a novel potential cytokine,in a stable optimized CHO-S cell system[J].Protein Expr Purif,2015,113:1-7.
[11]LUTTMER R,De STROOPER L M,DIJKSTRA M G,et al.FAM19A4 methylation analysis in self-samples compared with cervical scrapes for detecting cervical(pre)cancer in HPV-positive women[J].Br J Cancer,2016,115(5):579-587.
[12]De STROOPER L,VERHOEF V,BERKHOF J,et al.Validation of the FAM19A4/mir124-2 DNA methylation test for both lavage-and brush-based self-samples to detect cervical(pre)cancer in HPV-positive women[J].Gynecol Oncol,2016,141(2):341-347.
[13]LUTTMER R,De STROOPER L M,BERKHOF J,et al.Comparing the performance of FAM19A4 methylation analysis,cytology and HPV16/18 genotyping for the detection of cervical(pre)cancer in high-risk HPV-positive women of a gynecologic outpatient population(COMETH study)[J].Int J Cancer,2016,138(4):992-1002.

