大豆分离蛋白-花青素复合物的制备及其蛋白结构与功能性质分析
江连洲,陈 思,李 杨,吴长玲,王中江,张巧智,齐宝坤,隋晓楠,*,陈复生,许振国
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.河南工业大学粮油食品学院,河南 郑州 450001;3.山东省高唐蓝山集团总公司,山东 聊城 252000)
大豆分离蛋白(soy protein isolate,SPI)是一种营养价值丰富的食用蛋白资源,由于其较高的蛋白含量及优良的功能特性,目前已被广泛地应用于食品加工[1]。在SPI的生产加工过程中,喷雾干燥、复性等多个环节均需要经过加热处理,且热处理会显著影响蛋白的二级结构及功能性质。Petruccelli等[2]发现,pH值为中性的条件下,98 ℃热处理SPI一段时间,其持水性增强,但溶解性明显下降。在此研究基础上,Petruccelli等[3]继续研究80、92 ℃热处理对SPI的影响,发现其乳化性得到明显改善。
花青素是一种含量丰富、广泛应用于食品中的黄酮类植物色素,具有较强的1,1-二苯基-2-三硝基苯肼自由基清除能力[4],可以延缓衰老。此外其还具有抑菌、预防癌症、抗心血管疾病等多种功能[5-7]。花青素是一种小分子活性物质,且具有较强的蛋白亲和性,可以与蛋白复合形成具有功能性质的复合体系。在食品的生产加工过程中,蛋白质不可避免的会受到这类小分子的影响,因此近年来蛋白质与花青素的复合对蛋白结构与功能性质的影响备受关注。Kanakis等[8]研究茶多酚与牛奶蛋白的相互作用发现,茶多酚的加入会改变牛奶蛋白的结构构象,使牛奶蛋白结构更加稳定。Koningsvel等[9]的研究结果表明,酚类化合物与马铃薯蛋白的结合会降低蛋白的溶解性。Rawel等[10]研究发现酚类化合物可诱导蛋白质与其发生交联,这种相互作用会改变蛋白质分子的净电荷,进而影响复合物的溶解度。刘勤勤等[11]研究发现,SPI与茶多酚通过范德华力和氢键发生相互作用,且茶多酚的加入导致SPI二级结构发生改变。以上研究说明多酚类成分可以和蛋白相互作用,同时影响蛋白的结构及功能性质,然而相关研究鲜见涉及SPI与花青素的交互作用,而对于热处理SPI与花青素的复合对蛋白二级结构、功能性质更鲜见研究。因此明确SPI与花青素的相互作用可以显著提高SPI的生物利用率,进而极大地发挥SPI在食品中的作用。
本实验主要通过溶解性、乳化性及乳化稳定性探究热处理SPI与花青素复合体系对蛋白功能性质的影响,采用粒度分析、Zeta电位分析进一步解释花青素对复合体系中蛋白功能性质影响的变化规律,最后采用荧光光谱探究热处理SPI和花青素复合体系对蛋白二级结构的影响,以期对SPI在食品复合组分中的合理应用提供一定的数据参考。
1 材料与方法
1.1 材料与试剂
SPI由实验室自制;花青素(花青素质量分数为25%,进一步经过固相萃取分离纯化,除去蛋白质、多糖、有机酸和酚类物质,得到花青素纯化物,其花青素质量分数为35%) 陕西天之润生物科技有限公司;Lowry法测溶解度试剂盒 上海荔达生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠 北京新光化工试剂厂;正己烷、乙酸乙酯、甲醇 天津北科化学品有限责任公司;其他化学试剂均为分析纯。
1.2 仪器与设备
ULTRA-TURRAX UTL2000乳化机 德国IKA仪器设备公司;F-4500荧光分光光度计 日本Hitachi公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司;ZetaPALS-Zeta电位仪 美国布鲁克海文仪器公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 SPI的制备
参考Meinlschmidt等[12]的方法。将新鲜大豆碾碎成粉后,与正己烷按照料液比1∶3(g/mL)混合,室温下搅拌2 h进行3 次脱脂。将脱脂豆粉与去离子水按照1∶10(g/mL)比例混合后,用2 mol/L NaOH溶液调节pH值至8.5,室温下搅拌2 h后,9 000×g离心20 min,取上清液用2 mol/L HCl溶液调节pH值至4.5。静置2 h后6 000×g离心20 min得到蛋白沉淀,最后将蛋白沉淀溶于去离子水,用2 mol/L NaOH溶液将蛋白质pH值调节至7.0。将蛋白溶液冷冻干燥后得粉末状SPI。
1.3.1.2 花青素的提纯
参照Sui Xiaonan等[13]的方法,将富含花青素的黑米提取物粉末溶于去离子水,使用固相萃取技术去除黑米提取物中杂质。具体纯化步骤:首先用2 个柱体积的酸化水去除不溶性成分,如糖、酸等,然后用2 个柱体积的乙酸乙酯去除多酚类化合物,如酚酸、黄酮等,最后用甲醇洗脱吸附在吸附柱上的花青素。使用旋转蒸发器于40 ℃除去甲醇,即可得纯化后的花青素,在-20 ℃条件下贮存备用,于280 nm波长处检测花青素的吸光度。
1.3.1.3 SPI-花青素复合物的制备
根据王中江等[14]的研究发现未经加热处理的SPI中7S和11S球蛋白变性温度分别为73.2 ℃和92.7 ℃,因此本实验选择70(7S和11S均未变性)、85(7S变性而11S没有变性)、100 ℃(7S和11S完全变性)作为不同的热处理条件。将SPI粉末溶于去离子水后分别置于70、85、100 ℃水浴锅内热处理15 min,取出后立即冰浴至室温,将溶液冷冻干燥后使用。将热处理SPI粉末用0.01 mol/L磷酸盐缓冲液(pH 7.4)配制成1 g/100 mL的SPI溶液。按照质量比50∶1将花青素(0.02 g/100 mL)加入到SPI溶液中室温下磁力搅拌90 min制成SPI-花青素复合物。其中未加热SPI、70 ℃热处理SPI、85 ℃热处理SPI、100 ℃热处理SPI组分别用A、B、C、D表示,相应的SPI-花青素复合物组分别表示为A’、B’、C’、D’。
1.3.2 SPI-花青素复合物指标的测定
1.3.2.1 溶解性的测定
参考Sammoto等[15]的方法,精确称取10 mL加入花青素前后的热处理SPI溶液,3 000×g离心15 min。上清液经适当稀释后,应用Lowry法测定上清液蛋白含量。以牛血清白蛋白为标准物质绘制标准曲线,用凯氏定氮法测定样品总蛋白含量。按公式(1)计算其溶解度:

1.3.2.2 乳化性及乳化稳定性的测定
参考Li Chen等[16]的方法,取9 mL加入花青素前后的热处理SPI,加入3 mL牡丹籽油后充分混合搅拌,在25 ℃条件下使用高压均质机10 000 r/min分散1 min,立即吸取50 μL用0.1 g/100 mL SDS溶液稀释250 倍。用紫外分光光度计测定500 nm波长处的吸光度A0。静置30 min后测定吸光度A1,分别按公式(2)、(3)计算乳化性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI):

式中:N为稀释倍数(250);C为SPI质量浓度/(g/mL);V为乳化液中油相体积分数/%;A0为0 min时样液吸光度;A30为30 min时样液吸光度。
1.3.2.3 粒径分布的测定
利用Mastersizer 2000激光粒度仪对加入花青素前后的热处理SPI溶液样品进行粒径分布测定。颗粒折射率1.46,分散剂折射率1.33,吸收参数0.001。实验采用体积平均直径(D[4,3])表征液滴粒度的大小[17]。
1.3.2.4 Zeta电位的测定
参考Xu Duoxia等[18]的方法采用Zeta电位仪测定样品的Zeta电位,加入花青素前后的热处理SPI溶液样品适度稀释,上样体积为1 mL,测定温度为25 ℃,温度平衡时间为2 min。
1.3.2.5 荧光光谱的测定
向10 mL热处理SPI溶液(1.0×10-6mol/L)中分别逐滴加入100 μL 2.0×10-6、4.0×10-6、6.0×10-6、8.0×10-6、10.0×10-6mol/L的花青素溶液,涡旋振荡后,分别在25、33、41 ℃的恒温水浴锅中保温5 min。选择激发波长280 nm、激发狭缝5 nm、扫描速率240 nm/min,连续扫描记录发射波长为300~500 nm。样品的三维荧光光谱测定条件:室温条件下,以280 nm为激发波长,连续扫描记录发射波长为300~500 nm。荧光猝灭一般可分为动态猝灭和静态猝灭2 种作用机制。应用Stern-Volmer方程判断猝灭类型[17],见公式(4):
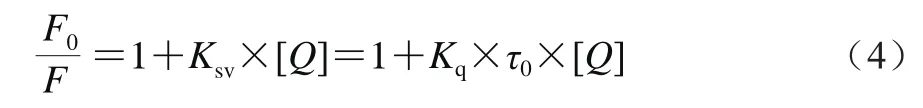
式中:F0和F分别为未加入和加入猝灭剂花青素时SPI溶液的荧光强度;[Q]为花青素的浓度/10-6mol/L;Kq为双分子猝灭速率常数/(L/(mol·s));Ksv为动态猝灭常数/(L/mol);τ0为猝灭剂不存在时荧光体的寿命,生物大分子的平均寿命约为10-8s[16]。
1.4 数据统计与分析
每组数据均重复3 次,利用Origin 8.5软件处理数据作图。利用SPSS V17.0软件对数据进行ANOVA差异显著性分析及t检验。
2 结果与分析
2.1 SPI-花青素复合物对热处理SPI溶解度的影响

图1 SPI-花青素复合物对热处理SPI溶液溶解度的影响Fig. 1 Effect of anthocyanins on the solubility of heated SPI
由图1可知,与未加热SPI相比,经70、85 ℃热处理的SPI溶液溶解度提高,可能是由于原本部分不溶性的蛋白聚集体由于热处理而发生解聚[20-21]。100 ℃热处理的SPI溶液溶解性降低,可能是由于高温处理使得蛋白中的7S和11S成分全部变性,11S球蛋白的碱性亚基与7S球蛋白的β-亚基之间形成了不可溶性热聚集体[22],使蛋白溶液溶解性下降。加入花青素后,热处理SPI-花青素复合物与热处理SPI相比,溶解度显著下降(P<0.05)。与未加热SPI-花青素复合物的现象相同,但从图1可以看出,85 ℃热处理SPI-花青素复合物溶解度最大。Rawel等[10]研究发现酚类物质的加入,会封闭蛋白质相应的亲水性氨基酸,使溶菌酶溶解度下降。因此花青素的加入,可能会封闭蛋白质中较大量的游离氨基和色氨酸,同时花青素和蛋白可能复合生成某些不溶性聚合物从而降低溶液的溶解度。如在pH值不小于8.0时,原花青素与溶菌酶反应生成醌类不溶性聚集物从而使溶菌酶溶解度显著下降[23];在强酸的条件下,马铃薯果汁中的酚类化合物和马铃薯蛋白质相互作用产生不溶性聚集,从而使马铃薯蛋白质溶解性下降[9]。
2.2 SPI-花青素复合物对热处理SPI的EAI和ESI的影响

图2 花青素对热处理SPI溶液EAI及ESI的影响Fig. 2 Effect of anthocyanins on the EAI and ESI of heated SPI solutions
EAI表示SPI-花青素复合物形成油-水界面的能力;ESI是指SPI-花青素复合物乳状液形成小液滴的抗应变能力[24]。复合物中蛋白质乳化性受多种因素影响,如蛋白质与花青素的结合程度、分子的柔顺性或蛋白质分子质量分布等[25]。由图2可知,未加入花青素时,随着热处理温度的升高,蛋白EAI和ESI均先增大再减小,85 ℃热处理蛋白EAI和ESI最强。由于热处理温度的升高,蛋白质的二级、三级结构舒展,使得链节变得十分柔顺,好的柔顺性有利于界面上分子有序重排,从而使得蛋白亲水亲油性增强,乳化性增强[26]。100 ℃热处理后,蛋白EAI和ESI明显下降,这可能是SPI分子结构进一步展开,极化的蛋白分子间发生吸引产生相互作用重新形成大尺度聚集体所导致。加入花青素后,热处理SPI的EAI均显著增大(P<0.05),相应复合物中85 ℃热处理SPI的EAI和ESI最好。可能是由于花青素的加入增强界面薄膜的表面压力和黏弹性,形成较稳定的界面膜,增加复合物的EAI[27]。另外,蛋白与花青素复合后,油-水界面层一部分被蛋白质占据,另一部分被花青素占据,形成第1层乳化膜。蛋白质的疏水基团充分暴露和花青素通过疏水相互作用形成第2层的乳化膜,因此EAI显著提升。这与Liu Fuguo等[28]的研究结果一致,中性条件下SPI-花青素复合物的形成会提高乳液的乳化性。此外,花青素的加入使热处理SPI的ESI增强,这种效应可以归因于花青素与蛋白复合后,液滴间空间斥力的增加及表面电荷的变化。
2.3 SPI-花青素复合物对热处理SPI粒径分布的影响
粒径分布可较为直观地表征复合物的ESI,体积平均直径D[4,3]表征复合物液滴的平均大小。从图3a可以看出,热处理SPI溶液呈双峰分布,与花青素复合后溶液呈单峰分布,说明复合后溶液中液滴具有相似的直径,稳定性较强。同未加热SPI比较,70、85 ℃热处理后SPI溶液液滴的粒径变小,可能是由于热处理后蛋白疏水基团暴露,蛋白柔性结构的展开,乳化性增强,维持体系液滴以小液滴存在,所以体系液体的粒径较小。当SPI经过100 ℃处理后,粒径开始增大,这说明100 ℃处理后,SPI完全变性发生热聚集作用从而生成大尺度聚集体,使粒径增大。热处理蛋白与花青素复合后,体积平均直径D[4,3]均显著降低(P<0.05),与未加热大豆蛋白结果相同,相应复合物中85 ℃热处理SPI体积平均直径最小,ESI最强,与2.2节ESI结果一致。Sorgentini等[27]研究发现热处理导致蛋白质解折叠,疏水基团暴露。故花青素与SPI间通过疏水相互作用发生了紧密缩合从而降低粒径。
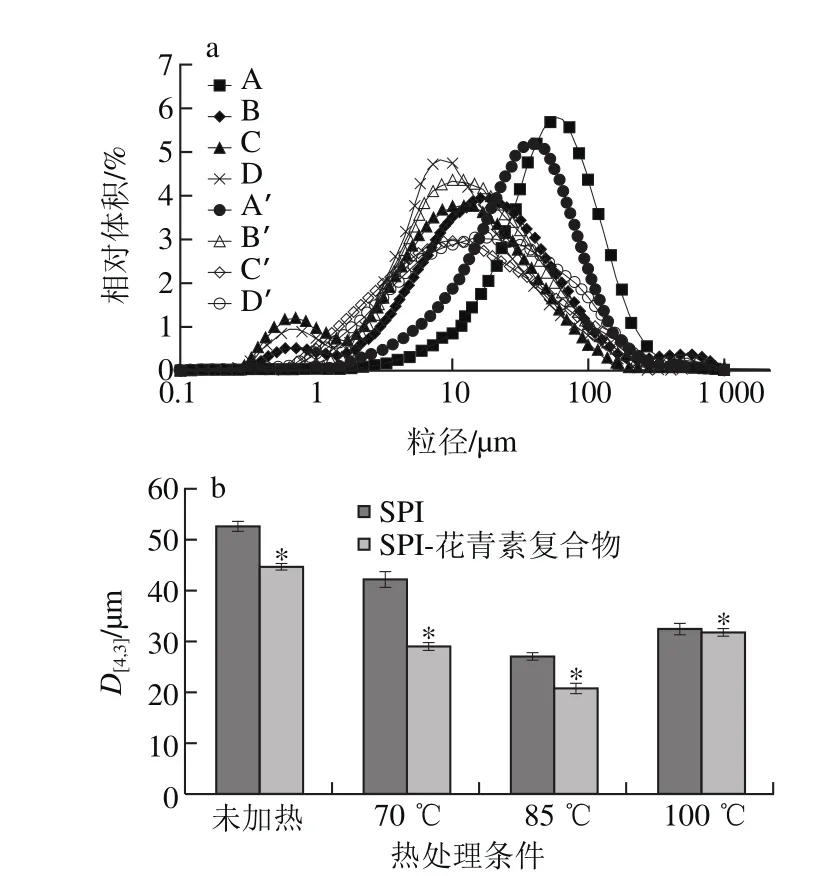
图3 加入花青素前后热处理SPI溶液粒径分布(a)和体积平均直径D[4,3](b)Fig. 3 Particle size distribution (a) and volume mean diameter D[4,3] (b) in heated soybean protein solutions before and after being complexed with anthocyanins
2.4 SPI-花青素复合物对热处理SPI Zeta电位的影响

图4 花青素对热处理SPI溶液Zeta电位的影响Fig. 4 Effect of anthocyanins on Zeta potential of heated SPI solutions
Zeta电位可较好地表征颗粒之间相互吸引能力[29]。通过Zeta电位的绝对值可以判断溶液体系的稳定性。绝对值越高,粒子间的相互排斥力越大,越不易发生相互碰撞而聚集。反之,绝对值越低,粒子间极易相互吸引而发生聚集。由图4可知,未加入花青素的热处理SPI样品液滴表面呈现出较低的负电性,且变化不大(-13.2~-14.5 mV)。加入花青素后,溶液的Zeta电位绝对值均显著增大(P<0.05),且相应复合物中85 ℃热处理SPI的Zeta电位绝对值最大,稳定性最强,这与Von Staszewski[30]和Rodríguez[31]等的研究结果一致。可能是由于花青素带负电荷[32],并且在pH值为7.4时,花青素中的酚羟基可以去质子化,所产生的氧中心可以输出高的负电荷密度,与蛋白的正电基团结合,使得SPI的负电荷相对增加。此外,由于与花青素的复合,蛋白质上的带正电荷基团较少暴露出来,从而使SPI负电性增强。这说明热处理SPI与花青素复合可以提高体系稳定性。该结果与样品乳化稳定性较好的结果一致。
2.5 SPI-花青素复合物的荧光光谱分析
2.5.1 花青素对热处理SPI内源荧光光谱的影响
蛋白质的内源荧光主要依赖于色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),在激发波长为280 nm时,只考虑Trp和Tyr,Phe可以忽略[8]。由图5可知,在25 ℃、pH 7.4的条件下,固定激发波长280 nm,扫描300~500 nm波长范围内随花青素浓度的增加,蛋白内源荧光发射光谱的变化情况。固定热处理SPI溶液浓度,随着花青素的不断加入,热处理SPI荧光强度逐渐降低,说明花青素对热处理SPI的内源荧光产生了猝灭作用。同时发现SPI的最大荧光发射波长发生了红移,未加热SPI从342 nm红移至352.8 nm,红移了10.8 nm,70、85、100 ℃热处理SPI分别红移了10.2、11.6 nm和10.6 nm,这说明花青素与SPI发生了结合,从而改变了SPI的结构构象,Trp和Tyr的微环境发生改变,由疏水环境变为亲水环境,肽链结构舒展[33]。
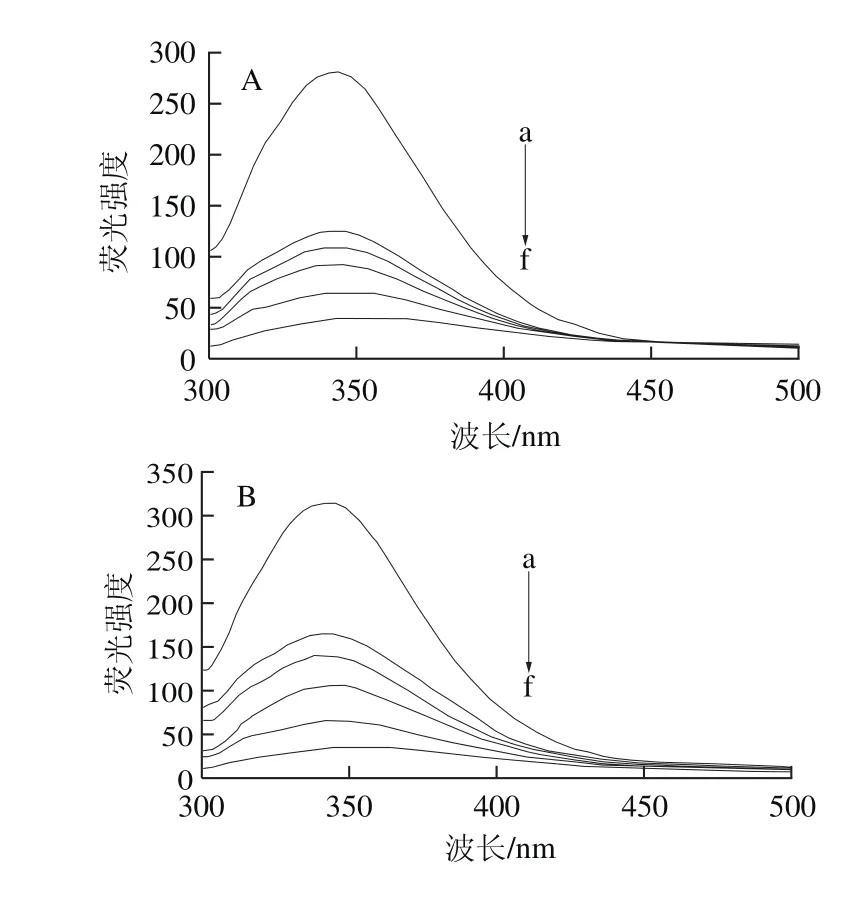
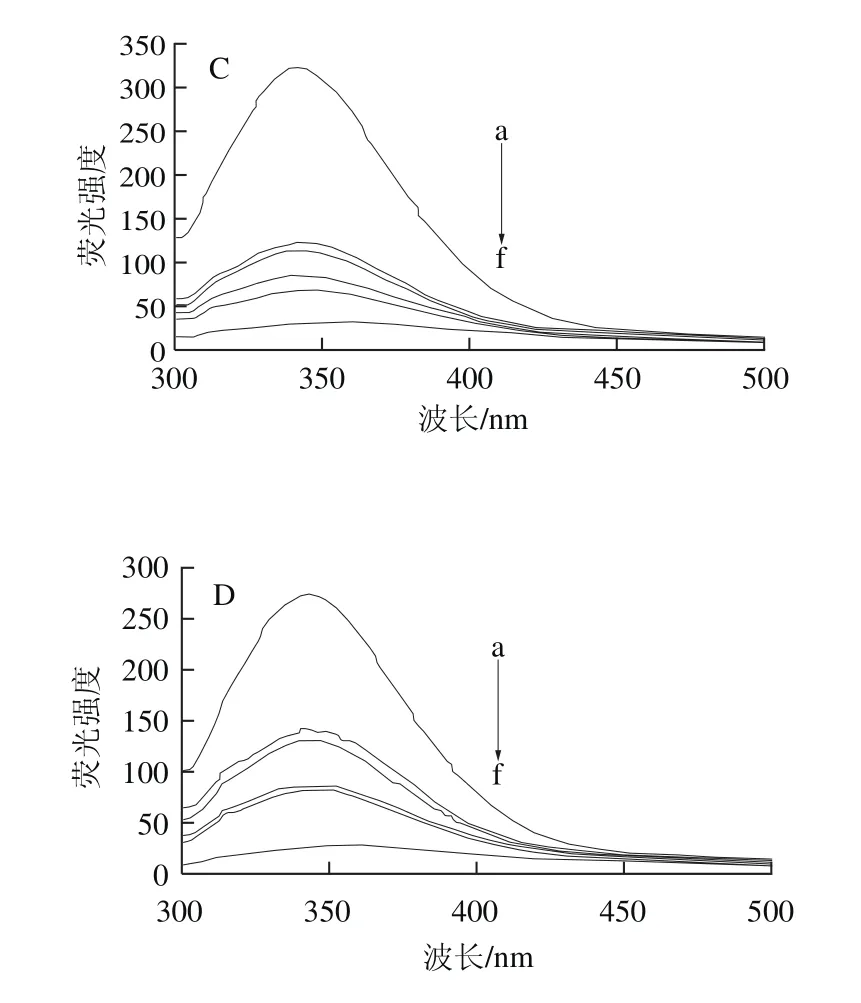
图5 花青素对热处理SPI溶液荧光光谱的影响Fig. 5 Effect of anthocyanins on the fluorescence spectrum of heated SPI
2.5.2 SPI-花青素复合物的结合常数、结合位点数
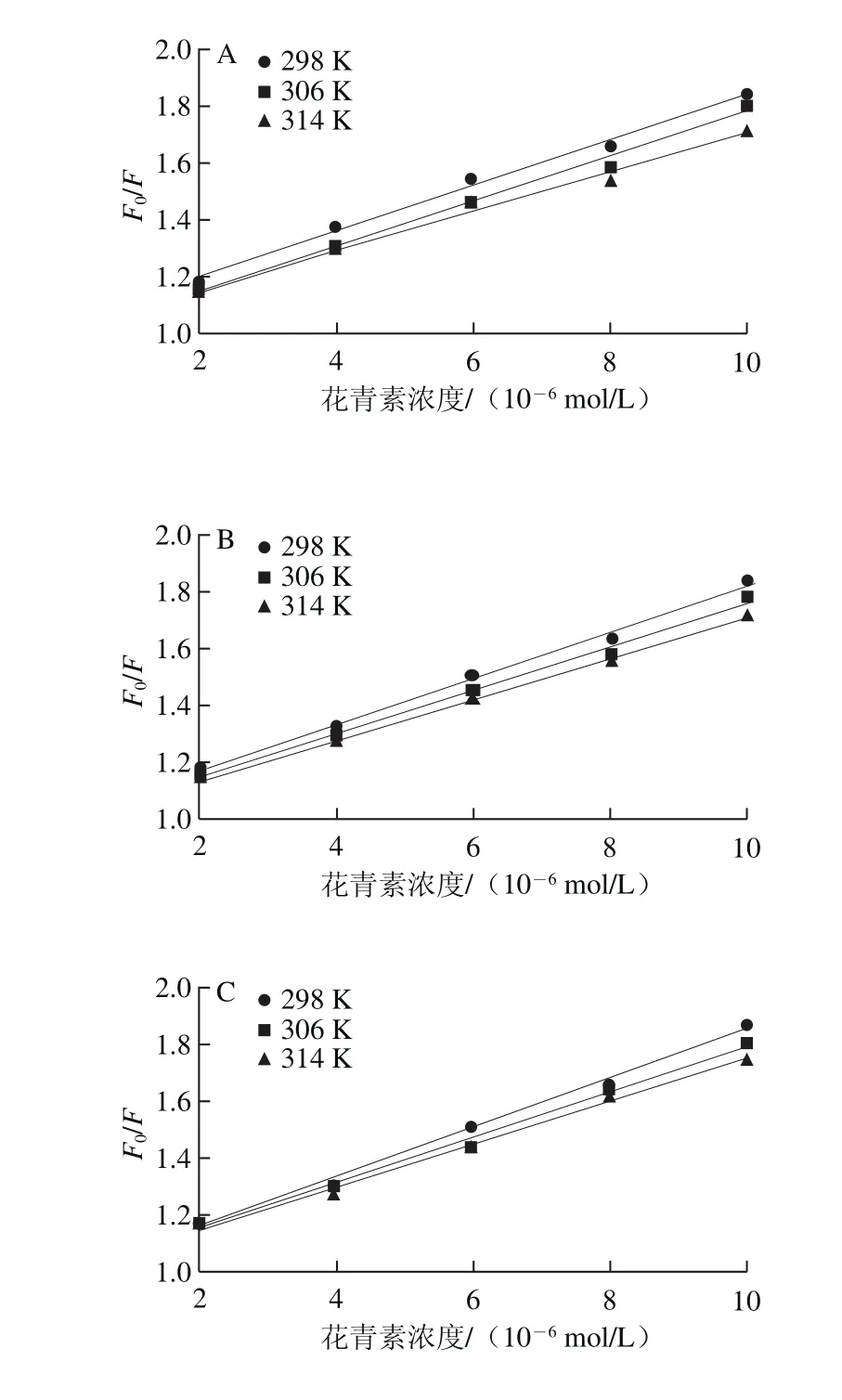

图6 不同温度条件下花青素猝灭热处理SPI的Stern-Volmer图Fig. 6 Stern-Volmer plots for the quenching of heated SPI by anthocyanins at different temperatures
根据Stern-Volmer方程,以[Q]为自变量,F0/F为因变量,作图得图6,根据图6直线的斜率可以计算出SPI-花青素复合物的Ksv和Kq,结果见表1。
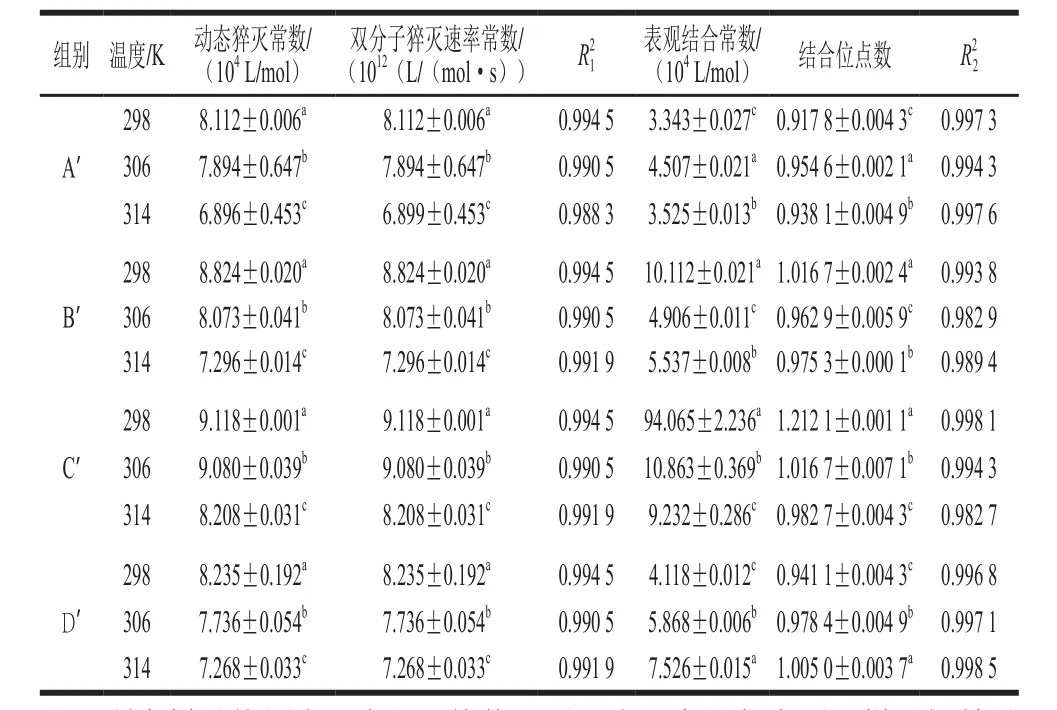
表1 SPI-花青素复合物的荧光猝灭常数、结合位点数、表观结合常数Table 1 Fluorescence quenching constants, binding sites and apparent binding constants of anthocyanin-heated soybean protein complex
对于动态猝灭,随着温度的升高,猝灭常数增大,即Stern-Volmer曲线斜率增大。如果是静态猝灭则相反。通过图6和表1可以看出,随着温度的升高,热处理SPI的Stern-Volmer曲线斜率逐渐变小,说明花青素对热处理SPI的荧光猝灭机制是静态猝灭。一般情况猝灭剂对于生物大分子最大猝灭速率常数为2×1010L/(mol·s),而花青素对热处理SPI的荧光猝灭速率数量级均为1012,这进一步表明花青素对热处理SPI的作用机制为静态猝灭。
对于静态猝灭过程,可应用公式(5)求得结合位点数:
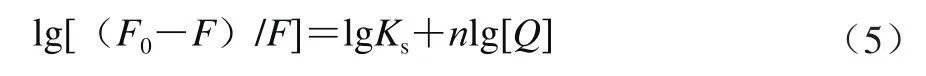
式中:Ks为表观结合常数;n为结合位点数。
按公式(5),以lg[(F0-F)/F]对lg[Q]作图得图7,根据直线斜率和截距可以得到花青素与热处理SPI间的表观结合常数和结合位点数(表1)。从表1可以看出,花青素与热处理大豆蛋白间的表观结合常数数量级为104,说明花青素与热处理SPI发生了紧密的结合,且均形成了结合位点数接近于1的复合物。

图7 不同温度条件下花青素猝灭热处理SPI的双对数图Fig. 7 Double logarithmic curves of heated SPI quenched by anthocyanins at different temperatures
2.5.3 三维荧光光谱分析结果
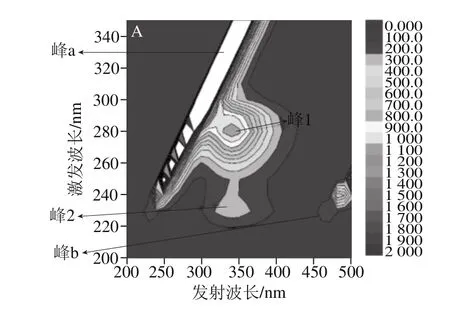


图8 花青素与热处理SPI结合对蛋白影响的三维荧光光谱分析图Fig. 8 Three dimensional fluorescence spectrum analysis of the effect of complexation between anthocyanins and heated SPI on protein structure
如图8所示,峰a表示拉曼散射,峰b表示瑞利散射,SPI-花青素复合物的形成使得光散射作用增强,从而使得这2 个散射峰的荧光强度增强。图中峰1表示Trp和Tyr产生的特征峰[33],加入花青素后热处理SPI的峰1峰的颜色均变浅,该现象说明花青素的加入使得蛋白质荧光强度显著降低,等高线变稀疏。花青素的加入使得蛋白质中部分Trp和Tyr残基的疏水基团被掩埋在SPI-花青素复合物的疏水区域中。相应复合物中,85 ℃蛋白的峰1峰颜色最浅,说明此时蛋白的荧光强度最低,Trp和Tyr残基的疏水基团掩埋最深。峰2表示多肽链骨架结构产生的特征峰[34],复合花青素后此区域面积变小,说明花青素的复合使得蛋白质多肽链的骨架伸展,蛋白结构发生变化。
3 结 论
本实验探究了热处理SPI与SPI-花青素复合物对蛋白二级结构与功能性质的影响。实验结果表明,花青素对热处理SPI的猝灭方式为静态猝灭,热处理SPI与花青素间存在着强烈的相互作用,二者均可形成结合位点近似于1的复合物。三维荧光光谱结果表明花青素的复合使得蛋白质多肽链的骨架伸展,蛋白结构发生变化。同时花青素的加入使得热处理SPI的Zeta电位绝对值增大,溶液体积平均直径变小,EAI及ESI增强,但溶液溶解性有所下降。85 ℃热处理SPI相应复合物的Zeta电位绝对值最大,体积平均直径最小,乳化性及乳化稳定性增强,溶解性最大,说明85 ℃热处理SPI与花青素复合后具有最好的溶解性、EAI及ESI,因此85 ℃为热处理SPI最宜温度。该结果说明花青素的复合对热处理SPI的界面性质及蛋白的二级结构有着不可忽视的影响,此研究将为SPI在食品复合组分中的合理应用提供参考。
参考文献:
[1]GRAHAM D E, PHILLIPS M C. Proteins at liquid interfaces:III. molecular structures of adsorbed films[J]. Journal of Colloid and Interface Science, 1979, 70(3): 427-439. DOI:10.1016/0021-9797(79)90050-X.
[2]PETRUCCELLI S, AÑÓN M C. Relationship between the method of obtention and the structural and functional properties of soy protein isolates. I: structural and hydration properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2161-2169.DOI:10.1021/jf00046a017.
[3]PETRUCCELLI S, ANON M C. Thermal aggregation of soy protein isolates[J]. Journal of Agricultural and Food Chemistry, 1995, 43(12):3035-3041. DOI:10.1021/jf00060a009.
[4]NIZAMUTDINOVA I T, KIM Y M, CHUNG J I, et al. Anthocyanins from black soybean seed coats preferentially inhibit TNF-α-mediated induction of VCAM-1 over ICAM-1 through the regulation of GATAs and IRF-1[J]. Journal of Agricultural and Food Chemistry, 2009,57(16): 7324-7330. DOI:10.1021/jf900856z.
[5]COLLINS B, HOFFMAN J, MARTINEZ K, et al. A polyphenolrich fraction obtained from table grapes decreases adiposity, insulin resistance and markers of inflammation and impacts gut microbiota in high-fat-fed mice[J]. The Journal of Nutritional Biochemistry, 2016,31: 150-165. DOI:10.1016/j.jnutbio.2015.12.021.
[6]JENNINGS A, WELCH A A, FAIRWEATHER-TAIT S J, et al. Higher anthocyanin intake is associated with lower arterial stiffness and central blood pressure in women[J]. The American Journal of Clinical Nutrition,2012, 96(4): 781-788. DOI:10.3945/ajcn.112.042036.
[7]KONCZAK I, ZHANG W. Anthocyanins-more than nature’s colours[J]. BioMed Research International, 2004, 2004(5): 239-240.
[8]KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3):1046-1055. DOI:10.1016/j.foodchem.2011.01.079.
[9]VAN KONINGSVELD G A, GRUPPEN H, DE JONGH H H J, et al.The solubility of potato proteins from industrial potato fruit juice as influenced by pH and various additives[J]. Journal of the Science of Food and Agriculture, 2002, 82(1): 134-142. DOI:10.1002/jsfa.1015.
[10]RAWEL H M, KROLL J, ROHN S. Reactions of phenolic substances with lysozyme-physicochemical characterisation and proteolytic digestion of the derivatives[J]. Food Chemistry, 2001, 72(1): 59-71.DOI:10.1016/S0308-8146(00)00206-5.
[11]刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J].食品科学, 2015, 36(17): 43-47. DOI:10.7506/spkx1002-6630-201517009.
[12]MEINLSCHMIDT P, SCHWEIGGERT-WEISZ U, BRODE V, et al.Enzyme assisted degradation of potential soy protein allergens with special emphasis on the technofunctionality and the avoidance of a bitter taste formation[J]. LWT-Food Science and Technology, 2016,68: 707-716. DOI:10.1016/j.lwt.2016.01.023.
[13]SUI X, BARY S, ZHOU W. Changes in the color, chemical stability and antioxidant capacity of thermally treated anthocyanin aqueous solution over storage[J]. Food Chemistry, 2016, 192: 516-524.DOI:10.1016/j.foodchem.2015.07.021.
[14]王中江, 张潇元, 隋晓楠, 等. 热处理大豆蛋白体外消化产物结构特征分析[J]. 食品科学, 2017, 38(1): 20-26. DOI:10.7506/spkx1002-6630-201701004.
[15]SAMOTO M, MAEBUCHI M, MIYAZAKI C, et al. Abundant proteins associated with lecithin in soy protein isolate[J]. Food Chemistry,2007, 102(1): 317-322. DOI:10.1016/j.foodchem.2006.05.054.
[16]LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727.DOI:10.1016/j.ultsonch.2014.03.018.
[17]TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104. DOI:10.1016/j.ijbiomac.2006.06.013.
[18]XU D X, ZHANG J J, CAO Y P, et al. Influence of microcrystalline cellulose on the microrheological property and freeze-thaw stability of soybean protein hydrolysate stabilized curcumin emulsion[J]. LWTFood Science and Technology, 2016, 66: 590-597. DOI:10.1016/j.lwt.2015.11.002.
[19]LI N. Complex of nicosulfuron with human serum albumin: a biophysical study[J]. Journal of Molecular Structure, 2010, 975(1):256-264. DOI:10.1016/j.molstruc.2010.04.033.
[20]HILL S E, LEDWARD E A, MITCHELL J R. Functional properties of food macromolecules[M]. 2nd ed. Gaithersburg: Springer Science &Business Media: 1998.
[21]CHEN C S, HWANG D C, JIANG S T. Purification and characterization of milkfish (Chanos chanos) myosin[J]. Bulletin Japanese Society Scientific Fisheries, 1988, 54(8): 1423-1427. DOI:10.2331/suisan.54.1423.
[22]韩敏义, 徐幸莲. 兔骨骼肌肌球蛋白的纯化及溶液浊度和溶解度研究[J]. 食品科学, 2004, 25(12): 50-54. DOI:10.3321/j.issn:1002-6630.2004.12.006.
[23]PRIGENT S V E, VORAGEN A G J, VAN KONINGSVELD G A, et al. Interactions between globular proteins and procyanidins of different degrees of polymerization[J]. Journal of Dairy Science, 2009, 92(12):5843-5853. DOI:10.3168/jds.2009-2261.
[24]张根生, 岳晓霞, 李继光, 等. 大豆分离蛋白乳化性影响因素的研究[J]. 食品科学, 2006, 27(7): 48-51. DOI:10.3321/j.issn:1002-6630.2006.07.005.
[25]KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2005,89(3): 363-372. DOI:10.1016/j.foodchem.2004.02.042.
[26]周荧, 黄行健, 吕思伊, 等. 物理作用力对大豆分离蛋白乳化性及乳化稳定性的影响[J]. 食品科学, 2010, 31(7): 71-74.
[27]SORGENTINI D A, WAGNER J R, ANÓN M C. Effects of thermal treatment of soy protein isolate on the characteristics and structurefunction relationship of soluble and insoluble fractions[J]. Journal of Agricultural and Food Chemistry, 1995, 43(9): 2471-2479.DOI:10.1021/jf00057a029.
[28]LIU F, WANG D, SUN C, et al. Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions:multilayer coatings formed using protein and protein-polyphenol conjugates[J]. Food Chemistry, 2016, 205: 129-139. DOI:10.1016/j.foodchem.2016.02.155.
[29]李向红. 大豆蛋白聚集体-多糖混合体系相行为及微观结构的研究[D].无锡: 江南大学, 2008: 5-10. DOI:10.7666/d.y1399328.
[30]VON STASZEWSKI M, RUIZ-HENESTROSA V M P, PILOSOF A M R. Green tea polyphenols-β-lactoglobulin nanocomplexes:interfacial behavior, emulsification and oxidation stability of fish oil[J]. Food Hydrocolloids, 2014, 35: 505-511. DOI:10.1016/j.foodhyd.2013.07.008.
[31]RODRÍGUEZ S D, VON STASZEWSKI M, PILOSOF A M R.Green tea polyphenols-whey proteins nanoparticles: bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50: 108-115.DOI:10.1016/j.foodhyd.2015.04.015.
[32]孙利娜, 王璋. 草莓汁色泽和悬浮稳定性的研究[J]. 冷饮与速冻食品工业, 2006, 12(3): 11-14.
[33]WANG Y Q, ZHANG H M, ZHANG G C, et al. Interaction of the flavonoid hesperidin with bovine serum albumin: a fluorescence quenching study[J]. Journal of Luminescence, 2007, 126(1): 211-218.DOI:10.1016/j.jlumin.2006.06.013.
[34]RAWEL H M, MEIDTNER K, KROLL J. Binding of selected phenolic compounds to proteins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4228-4235. DOI:10.1021/jf0480290.

