纳米粒子共存下白藜芦醇与牛血清白蛋白相互作用的光谱研究
陈代武
(邵阳学院 药学院,湖南邵阳,422000)
白藜芦醇(Resveratrol,简写为Res),化学名:3,4',5-三羟基二苯乙烯,为非黄酮类多羟基和苯乙烯结构化合物,广泛存在于多种植物体内,在葡萄和葡萄酒中含量较高[1],现已发现Res具有多种药理活性,是细胞内有效的氧化剂,对氧化DNA的损害具有保护作用[2],能抗肿瘤,降血压,抗细菌和真菌感染,影响胃酸分泌等;对人的皮肤真菌和皮肤细菌具有抑制作用[3-7]。目前,Res引起了广大学者们的极大关注。纳米材料可用于生物检测和疾病诊断,也可作为药物载体[8-10],碳纳米管(carbon nanotubes简写为CNTs)具有很高的化学稳定性和很大的表面积,可以作为细胞内蛋白质转运和抗癌药物的载体[11]。小分子与蛋白质的作用可以提供相关药物结合的特征及药物疗效的影响。由于血清蛋白中含有酪氨酸(Tyr)或色氨酸(Trp)和苯丙氨酸(Phe)等残基,这些残基都具有特殊的光学性质,因此分子间的相互作用常用光学技术来监测,这种方法简单,灵敏度高。牛血清白蛋白(Bovine Serum Albumin,简写为BSA)作为应用于研究蛋白质的代表物[12],被广泛地应用于蛋白质与其他化合物配合的荧光光谱法分析,但未查到碳纳米粒子存在时Res与牛血清白蛋白结合的荧光光谱法研究,因此,本研究采用荧光光谱法研究Res与牛血清白蛋白结合及共存纳米粒子的影响具有一定的研究意义,对了解药物吸收、代谢、药理机理及药物改良和研发具有参考作用。
1 材料与方法
1.1 试剂与设备
BSA(Sigma,MW=68000),Res(长沙艾茵生物制品有限公司),0.1mol·L-1磷酸盐缓冲溶液(简 称 PBS,pH=7.4),CNTs(多壁,直径约 20nm,纯度>95%,深圳市纳米港有限公司),实验用水为MilliQ超纯水,NaH2PO4,Na2HPO4,Na2SO4,氯金酸,柠檬酸三钠硼氢化钠,所有试剂为分析纯。
F4500荧光分光光度计(Hitachi,日本),Tu-1221紫外-可见分光光度计(北京普析通用仪器有限公司),pHS-3C pH计(上海雷磁仪器厂),SigmaPlot V2.0科学绘图软件。
1.2 实验方法
分别量取缓冲溶液3.0mL至1cm大小的不同荧光比色皿中,用微量注射器加入一定量的样品液,配成多个不同浓度的待测溶液。每次测量前样品要求充分反应,至少放置10min以上,Res的激发/发射波长分别为326/410nm,BSA的激发/发射波长分别为282/345nm,测试BSA的狭缝宽度均为5nm,Res的狭缝宽度为10nm,光电倍增管电压为700 V,在300-550nm范围内记录室温下的荧光光谱。
2 结果与讨论
2.1 Res和BSA的荧光光谱及紫外吸收光谱
图1为pH=7.20,λex=282nm时Res对BSA的荧光猝灭光谱,从图1可以看出:Res使BSA的荧光减弱,发生了显著的猝灭作用,说明Res与BSA之间有较强的结合和能量的变化,所有曲线都相交在410nm,证实Res与BSA相互作用形成了结合物,说明BSA荧光的猝灭依靠BSA与Res的相互作用形成络合物所致。由图1看出Res只引起BSA的最大发射波长轻微移动,说明在此条件下Res并没有引起BSA构象显著变化。
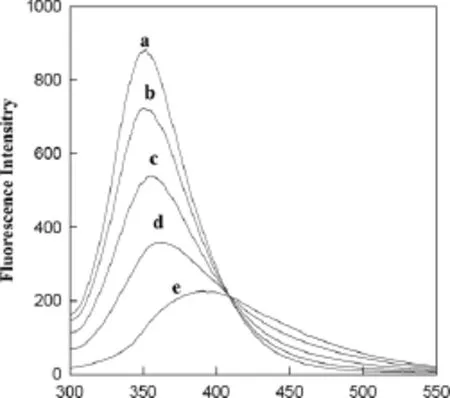
图1 0.1mol·L-1PBS中Res对 BSA荧光光谱的影响Fig.1 Effect of resveratrol on the fluorescence quenching of BSA under the condition of 0.1mol·L-1 PBS.c(resveratrol)/10-6mol·L-1,a to e:0.00,1.00,2.00,5.00,7.00
图2是BSA和Res及二者混合后的紫外吸收光谱谱图。从图中可以看出,三者在200~240nm之间均有较强的吸收,BSA的吸收峰位于206nm,Res的吸收峰位于214nm,二者混合物的吸收峰位于220nm,且Res和BSA混合液的吸光度远远大于Res和BSA的吸光度。同时Res在310nm处有一个较强的吸收峰,混合物在280nm处有一个较弱的吸收峰,而BSA没有。三者吸收曲线的不同说明Res和BSA之间有强烈的相互作用,生成了配合物。
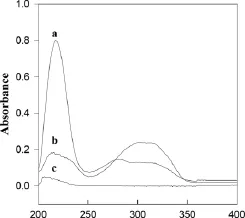
图2 BSA和Res的紫外吸收光谱Fig.2 UV absorbance spectra of BSA and Res(a)2.00×10-6mol·L-1BSA in the presence of 2.00×10-6mol·L-1resveratrol;(b)5.00×10-6mol·L-1resveratrol;(c)5.00×10-6mol·L-1BSA
2.2 Res和BSA配合物的荧光光谱
根据2.1我们知道,Res与BSA能相互作用形成配合物,且该配合物在410nm处有荧光发射,从图3(b)发现在Res中加入不同浓度BSA时,配合物的荧光强度随BSA浓度的增加而增加,图3(a)为减去BSA的荧光背景下的配合物的荧光光谱图,可以发现其荧光光谱强度小很多,但其荧光强度也随BSA浓度的增加而增大,这是由于Res与BSA作用不断形成配合物。
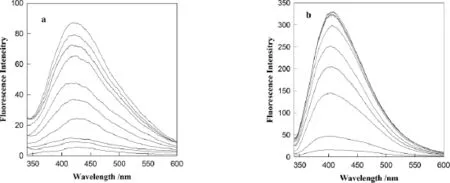
图3 在1.00×10-6molL-1Res溶液中加入不同浓度的BSA溶液的荧光光谱图,图a为消除BSA荧光背景的Res与BSA混合物的荧光光谱图,图b是分别加入浓度为0.00,2.00 5.00,10.0,20.0,40.0,60.0,80.0,100.0,120.0,130.0×10-6molL-1BSA 的 Res荧光光谱图(从下至上)Fig.3 Fluorescence intensity of BSA in the presence of 1.00×10-6molL-1Res.(λex=326nm).The concentrations of the added BSA were 0.00,2.00 5.00,10.0,20.0,40.0,60.0,80.0,100.0,120.0,130.0 × 10-6mol· L-1respectively(from bottom to top)at 298K.(a)subtract the BSA fluorescence background from the mixture fluorescence versus cBSA curves,(b)Fluorescence intensity of Res with different concentrations of BSA
2.3 金纳米粒子和碳纳米管对BSA和Res的荧光猝灭效应
图4和图5分别为不同浓度AuNP或CNTs的BSA的荧光光谱图,从图4和图5看出:在BSA溶液中加入AuNP和CNTs时,BSA的荧光强度都发生改变,随着纳米粒子的浓度增大,BSA荧光强度降低,由此证明AuNP和CNTs对BSA的荧光具有猝灭效应。Res在326nm光的激发下,在410nm左右有较强的荧光信号,同理AuNP和CNTs同样对Res的荧光具有猝灭效应。
猝灭过程一般使用 Stern-Volmer方程来描述[12-14]:
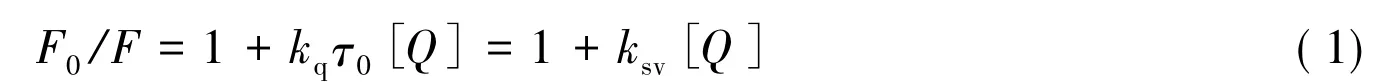
式中F0和F分别加入AuNP和CNTs等猝灭剂前后的BSA或Res荧光强度,kq为两种相互作用分子的表观猝灭常数,τ0为纳米粒子不存在时荧光分子的平均寿命,[Q]为猝灭剂CNTs和AuNP溶液的浓度,ksv为猝灭常数,且kq和ksv之间关系为:

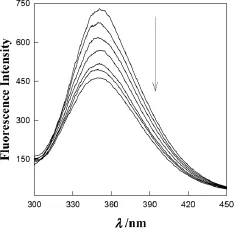
图4 在2.00"mol·L-1BSA中加入不同浓度CNTs的荧光光谱图(cCNTs0.00,7.00,15.00,25.00,40.00,55.00,70.00"mol·L-1从上至下)Fig.4 Fluorescence spectra of 2.00"mol·L-1 BSA in 0.1mol·L-1PBS with different concentrations of CNTs
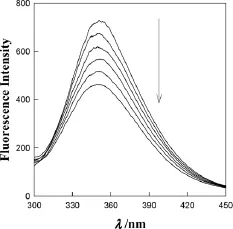
图5 在2.00"mol·L-1BSA中加入不同浓度AuNP 的荧光光谱图(cAuNP:0.00,7.00,15.00,25.00,40.00,55.00,70.00"mol·L-1,从上至下)Fig.5 Fluorescence spectra of 2.00"mol·L-1 BSA in 0.1mol·L-1PBS with different concentrations of AuNP
图6为CNTs猝灭BSA(a)和Res(b)荧光的Stern-Volmer曲线,图7为AuNP猝灭BSA(a)和Res(b)荧光的Stern-Volmer曲线,用F0/F对浓度[Q]作图,将实验数据代入拟合而得一直线,求出图6和图7中直线的斜率得到猝灭常数(ksv)和相关系数(r)列于表1。因生物大分子荧光寿命约为10-8s[14],根据式(2)可以求出他们的表观猝灭常数(kq)也列入表1,从表1可看出表观猝灭常数均大于猝灭常数,故属于形成复合物的静态猝灭,服从Lineweaver- Burk 方程[13]:
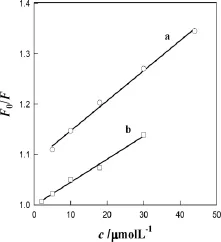
图6 CNTs猝灭BSA(a)和Res(b)荧光的Stern-Volmer曲线Fig.6 Stern-Volmer curves of BSA(a)and resveratrol(b)fluorescence quenched by CNTs
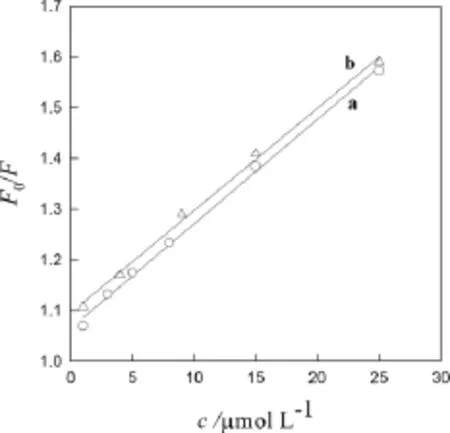
图7 AuNP猝灭BSA(a)和Res(b)荧光的Stern-Volmer曲线Fig7 Stern-Volmer curves of BSA(a)and resveratrol(b)fluorescence quenched by AuNP
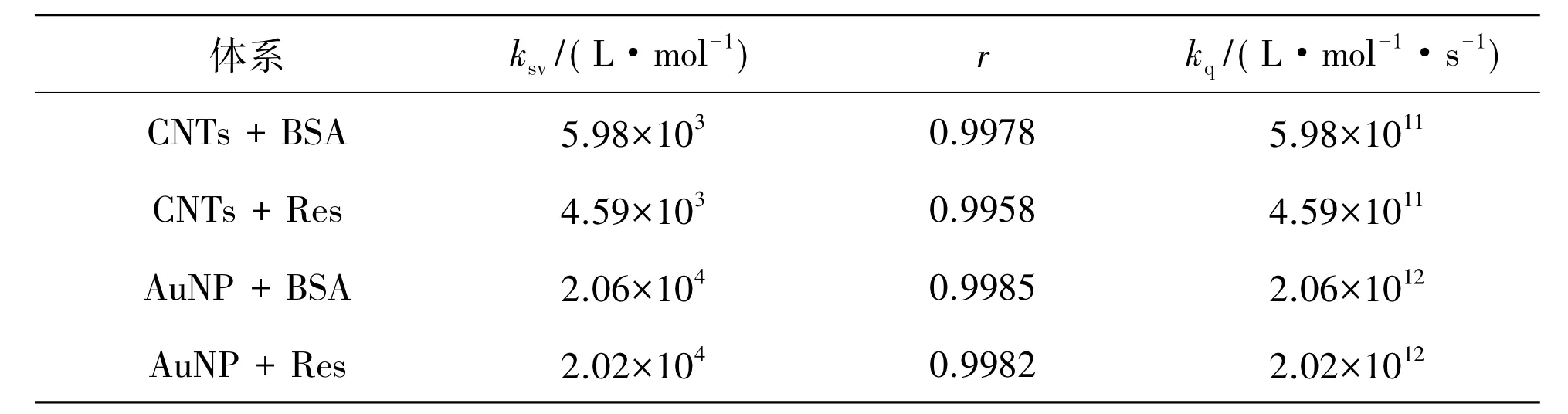
表1 CNTs和AuNP与BSA和Res作用时的ksv和kq值Table 1 ksvand kqvalues of the interaction of CNTs or AuNP with BSA or Res
式中 Kx为结合常数,同理,根据式(3)进行实验数据处理,将(F0-F)-1对[Q]-1做图得图8和图9,再从图8和图9求出直线的斜率,根据斜率和F0可求得结合常数Kx(结果见表2)。可见在常温下CNTs和AuNP能与BSA和Res有效结合,因此CNTs和AuNP可以作为Res与BSA相互作用的载体。
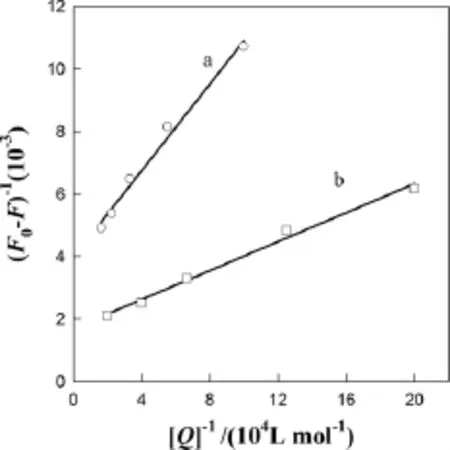
图8 CNTs猝灭BSA(a)和Res(b)荧光的Lineweaver-Burk 图Fig.8 Lineweaver-Burk curves of the BSA(a)and resveratrol(b)fluorescence quenched by CNTs
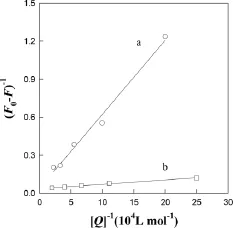
图9 AuNP猝灭BSA(a)和Res(b)荧光的Lineweaver-Burk 图Fig.9 Lineweaver-Burk curves of the BSA(a)and resveratrol(b)fluorescence quenched by AuNP
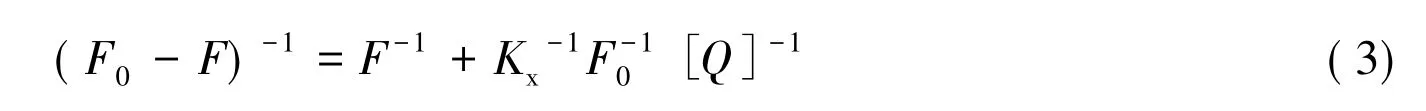

表2 CNTs和AuNP与BSA和Res作用时的Kx值Table 2 Kxvalues for interactions of CNTs+BSA or Res and AuNP+BSA or Res
2.4 同步荧光光谱法研究CNTs、AuNP和Res对BSA构象的影响
在同步荧光中,在Δλ=60nm和Δλ=15nm时分别表现出色氨酸残基(Trp)和酪氨酸残基(Tyr)的特征荧光光谱,因此根据最大发射波长的改变可判断蛋白质构象的变化。
在CNTs和AuNP存在下,BSA的同步荧光光谱见图10,从图10看出:在BSA溶液中加入CNTs和AuNP时,BSA的荧光强度减小,表明对BSA具有猝灭效应,在猝灭过程中,色氨酸残基的最大发射波长发生了较小的改变,从图中看到稍有蓝移,表明色氨酸残基所处的环境发生改变,疏水性增加,由此证明CNTs和AuNP引起BSA构象的变化。

图10 CNTs对BSA分子的Trp(a)和AuNp对BSA分子的Trp(b)的同步荧光光谱及log(F0-F)/F与logc的拟合曲线(c):(1:AuNP+Trp,2:CNTs+Trp)Fig.10 The synchronous fluorescence spectra and log(F0-F)/F versus logc curves of tryptophan residuals of BSA with CNTs(a)and AuNP(b),(c)curves(1:AuNP+Trp,2:CNTs+Trp)
图11为Res对BSA影响的同步荧光光谱图,随Res浓度增大,BSA的荧光强度减小,表明BSA中的酪氨酸和色氨酸残基荧光均被猝灭,酪氨酸残基(290nm左右)和色氨酸残基(350nm左右)的最大发射波长均略有蓝移,表明Trp和Tyr的疏水性增加,酪氨酸和色氨酸残基所处环境发生变化,因此Res也能引起BSA的构象变化。
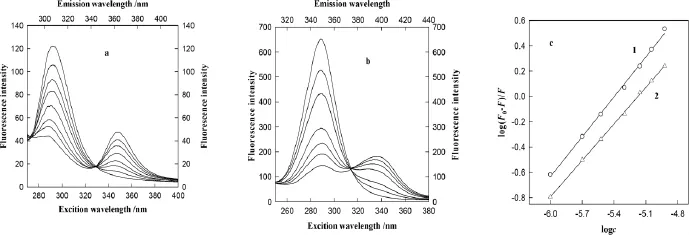
图11 Res对BSA分子的Tyr(a)和Trp(b)的同步荧光光谱及log(F0-F)/F与logc的拟合曲线(c)(1.Res-Trp,2:Res+Tyr)Fig.11 The synchronous fluorescence spectra of Tyr(a)and Trp(b)of BSA with resveratrol and log(F0-F)/F versus logc curves of tryptophan residuals(c)(1:resveratrol-Trp,2:resveratrol+Tyr)
从同步荧光光谱可以看到(见图11),在BSA中加入Res后,与荧光光谱的实验相同,Res与BSA中的Tyr和Trp作用时也有一个很好的交点,同样证明Res能和BSA发生反应形成配合物。
2.5 同步荧光光谱法求算K及n
根据同步荧光研究发现:CNTs和AuNP不改变BSA分子中酪氨酸残基的荧光,只改变色氨酸残基的荧光,而Res对BSA中的酪氨酸和色氨酸残基荧光都发生了改变,说明CNTs和AuNP只与BSA中的Trp残基作用,可能是因为BSA分子的Trp靠近BSA分子表面,而Tyr一般都处于蛋白质分子内部[14],又因为CNTs和AuNP的大小与蛋白质分子接近,故只能与蛋白质分子表面的Trp作用。而Res分子较小,可以插入到分子内部与BSA分子中的酪氨酸和色氨酸作用。
在同步荧光光谱中,根据荧光强度的变化数据,利用用静态猝灭公式,可以求出CNTs、AuNP、Res与BSA分子中酪氨酸和色氨酸作用的结合常数K和结合位点数n。
表3为同步荧光法测得的Res与BSA的Trp或Tyr残基作用的K和n,从表3可以看出:Res与BSA中的氨基酸残基的结合常数大于CNTs和AuNP的结合常数,且结合的位点数大,说明Res和BSA的结合能力强,在纳米粒子存在下不会影响Res与BSA的结合,因此,当使用CNTs和AuNP作为载体时,不会影响小分子和蛋白质的结合。由表3发现Res与Trp的作用比与Tyr的作用强,结合的位点数大,可能是与Trp处于蛋白质的表面,作用的机会比Tyr大的缘故。

表3 同步荧光法测得的Res与BSA的Trp或Tyr残基作用的K和nTable 3 The K and n values of the interactions of Res with Tyr or Trp residuals of BSA by synchronous fluorescence
3 结论
当Res和BSA混合时,Res和BSA的荧光光谱和紫外吸收光谱都发生改变,通过对Res和BSA混合液的荧光光谱与BSA的荧光光谱的比较,证明了Res与BSA之间能相互作用并形成了配合物。CNTs、AuNP对Res和BSA具有荧光猝灭效应,根据荧光猝灭原理,求出了CNTs和AuNP与Res和BSA的结合常数,结果表明CNTs和AuNP可以作为Res与BSA相互作用的载体;同时采用了同步荧光光谱法,利用Lineweaver-Burk方程求算了CNTs(或AuNP)与Trp/BSA)和Res与Trp/BSA(或Tyr/BSA)的结合常数K和配位数n,研究结果表明CNTs和AuNP主要与BSA表面附近的Trp残基作用,不与分子内部的Tyr残基作用,而Res可与Trp和Trp两种残基结合,且Res与Trp的结合比与Tyr的结合强;Res与BSA中的氨基酸残基的结合常数大于CNTs和AuNP的结合常数,若使用CNTs和AuNP作为载体,不会影响Res和BSA之间的相互作用。
参考文献:
[1]李先宽,李赫宇,李帅,等.白藜芦醇研究进展[J].中草药,2016,47(14):2568-2578.
[2]沈志嘉,郑桓,费硕,等.白藜芦醇对H9c2心肌细胞抗氧化应激损伤的内质网应激机制研究[J].中国新药杂志,2015,24(01):74-78.
[3]成薇,沈长波,王莉,等.白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响[J].中 国药理学通报,2015,31(01):113 -117.
[4]贾永明,刘志浩,刘克辛.白藜芦醇对药物转运体和代谢酶影响的研究进展[J].药学学报,2016,51(06):860-865.
[5]郜攀,司良毅,徐强,等.白藜芦醇对血管紧张素Ⅱ诱导的血管平滑肌细胞增殖的抑制作用及其机制观察[J].解放军医学杂志.2013,38(04):268-273.
[6]刘盛楠邵淑丽,隋文静,等.白藜芦醇诱导肺癌 A549细胞凋亡[J].基因组学与应用生物学,2015,34(04):685-691.
[7]孙治坤,马兴荣,韩笑,等.白藜芦醇对阿尔茨海默病合并糖尿病大鼠的氧化应激作用[J].中国实用神经疾病杂志,2017,20(23):1-5.
[8]张园园.新型仿生纳米材料的制备及其在生物检测中的应用研究[D].南京:东南大学,2016:16-31.
[9]徐成.氧化石墨烯复合纳米材料的制备及其在药物递送和生物成像上的应用[D].长沙:湖南大学,2016:17-23.
[10]陈万松,刘又年.黑磷纳米材料及其在生物医药中的应用[J].科学,2017,69(06):18-21.
[11]张金超,杨康宁,张海松,等.碳纳米材料在生物医学领域的应用现状及展望[J].化学进展,2013,25(2-3):397-408.
[12]张啸天,张林,朱卫华,等.米格列奈钙与牛血清白蛋白相互作用的光谱研究[J].光学学报,2017,37(11):1130002-1-1130002-7.
[13]张亮亮,徐曼,胡新宇,等.EGCG-Cu络合物与牛血清蛋白相互作用研究[J].林业工程学报,2017,2(05):46-50.
[14]陈代武,谢青季,蒋雪琴,等.槲皮素与酪蛋白和牛血清白蛋白的相互作用及共存碳纳米管的影响[J].物理化学学报,2008,24(03):379-387.

