中药复方糖肾安对实验性2型糖尿病大鼠肾组织Nrf2/ARE通路的影响
王 璐,张殿鸿,王 镁
(1.辽宁中医药大学,辽宁 沈阳 110032;2. 辽宁中医药大学附属医院,辽宁 沈阳 110032)
糖尿病性肾脏疾病(DKD)是糖尿病最常见的微血管并发症之一,已成为终末期肾病的重要原因[1]。DKD的发生与氧化应激及炎症反应密切相关。核因子NF-E2相关因子(Nrf2)通过与抗氧化反应元件(ARE)相互作用调节编码抗氧化蛋白,是内源性抗氧化应激最重要的通路[2]。而Nrf2与ARE上的GCTGAGTCA结合,启动Nrf2一系列下游的抗氧化酶基因及Ⅱ相解毒酶表达,如血红素加氧酶(HO-1)、超氧化物歧化酶(SOD)等[3]。研究表明核因子κB(NF-κB)是众多炎症因子的转录调节蛋白,NF-κB信号激活可以直接在转录水平抑制Nrf2/ARE信号通路介导的基因转录表达,从而导致Nrf2无法激活[4]。复方糖肾安是王镁教授以“补益脾肾”为基础理论,在实践中不断优化而创立的中药方剂。前期实验研究已证明,糖肾安对肾脏的保护作用与抗氧化应激反应有关[5]。本研究进一步探讨了糖肾安的肾脏保护作用与Nrf2/ARE通路的关系,现将结果报道如下。
1 实验资料
1.1实验动物 SPF级健康雄性SD大鼠50只,体质量230~300 g,动物合格证编号:SCSK(辽)2010-0001,购于沈阳龙云经济动物养殖场,饲养于辽宁中医药大学实验中心。
1.2主要实验试剂及药品 糖肾安煎剂(由白术、茯苓、黄芪等中药组成)中的药材购于辽宁中医药大学附属医院;蛋白裂解液(碧云天生物技术公司);链脲佐菌素(STZ)(美国Sigma公司);厄贝沙坦(购自杭州赛诺菲安万特民生制药有限公司,生产批号:2A292);磷酸缓冲盐溶液(PBS);Nrf2抗体、HO-1抗体、NF-κB抗体(购自武汉博士德公司)。
1.3主要仪器设备 EQ.0603-021型PCR仪(购自日本Ta KaRa公司),Bioshine GelX 1520 型凝胶成像系统(购自美国UVP公司),血糖仪及血糖试纸(购自德国拜耳公司安康系列)。
1.4实验方法
1.4.1模型制作 50只健康雄性SD大鼠普通饲料适应性喂养1周,随机分为正常组8只和造模组42只。参照文献[6-8]方法,造模组大鼠给予高糖高脂饲料(普通饲料67%、蔗糖20%、胆酸盐1%、胆固醇2%、猪油10%)喂养4周,然后禁食不禁水12 h,一次性腹腔注射1% STZ 35 mg/kg,注射72 h后,尾静脉采血测血糖,血糖≥16.7 mmol/L且有多饮、多食、多尿的症状提示2型糖尿病大鼠造模成功(3只大鼠未成模,予以剔除)。正常组注射相应量的柠檬酸-柠檬酸钠缓冲液。
1.4.2动物分组及给药 将成模大鼠随机分为模型组7只,糖肾安低、中、高剂量组及西药组各8只。糖肾安低、中、高剂量组分别给予糖肾安6,18,60 g/(kg·d)灌胃,西药组给予厄贝沙坦13.5 mg/(kg·d)灌胃,正常组和模型组每天给予相应量的生理盐水灌胃,均1次/d,连续灌胃8周。实验过程中糖肾安低剂量组2只死亡,从实验中剔除。
1.4.3样本采集 各组大鼠末次灌胃1 h后称体质量,取10%水合氯醛3 mL/kg腹腔内注射麻醉,腹腔暴露,游离肾脏,去除被膜,滤纸吸干血迹,切取左侧肾脏,部分肾组织置于4%多聚甲醛中浸泡固定,4 ℃冷藏保存,留做免疫组织化学观察;切取右侧肾脏,一分为二,部分置于冻存管中,用于Western blot检测,部分置于1 mL Trizol溶液中用于RT-PCR检测,置于-80 ℃冷冻保存。
1.5观察指标
1.5.1大鼠肾组织中Nrf2、HO-1蛋白检测 采用免疫组化SP法检测。每组各取5只大鼠标本,常规处理石蜡切片,灭活内源性过氧化酶,高压煮沸法进行抗原修复,血清封闭后依次加入相应的一抗、二抗。DAB显色,苏木精复染。
1.5.2大鼠肾组织中NF-κBp65蛋白检测 采用Western blot技术检测。每组各取6只大鼠肾皮质组织约100 mg,加入细胞裂解缓冲液,在玻璃研磨器中研磨,冰浴1 h,BCA法测定上清液蛋白浓度。各组取50 μg组织裂解蛋白进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,电转移至PVDF膜;5%脱脂奶粉封闭PVDF膜2 h,TBST洗膜,分别加入一抗NF-κBp65置于4 ℃孵育过夜;TBST洗膜,各组加入二抗后置于37 ℃孵育2 h;以上两步后TBST洗膜10 min×3次;用ECL发光法检测各组NF-κBp65蛋白表达情况,以GAPDH为内参,用凝胶图像处理系统分析。Image J分析系统软件对Western条带进行定量分析,确定条带的吸光度值。
1.5.3大鼠肾组织中NF-κBp65 mRNA检测 采用RT-PCR技术检测。每组各取6只大鼠肾组织,采用Trizol沉淀法提取肾组织总RNA,操作按照逆转录试剂盒的说明书进行;将所得样品cDNA用于Real-Time PCR反应;同时将GAPDH作为内在参照基因;将PCR产物进行测序并做熔解曲线,以保证以上PCR反应产物良好的特异性,计算△Ct值用来比较给药前后mRNA的表达变化。
1.5.4大鼠肾组织中SOD活性检测 取各组大鼠肾组织,制成10%均浆,采用ELISA法检测肾组织中SOD活性,操作顺序严格按照试剂盒说明书进行。

2 结 果
2.1各组大鼠肾组织中Nrf2、HO-1表达水平比较 模型组及各给药组Nrf2、HO-1表达水平均显著高于正常组(P均<0.05);糖肾安中、高剂量组及西药组Nrf2、HO-1表达水平均显著高于模型组(P均<0.05 );糖肾安低剂量组Nrf2、HO-1表达水平均显著低于西药组(P均<0.05),糖肾安高剂量组HO-1表达水平显著高于西药组(P<0.05)。见表1及图1~12。

表1 各组大鼠肾组织中 Nrf2、HO-1表达水平比较
注:①与正常组比较,P<0.05;②与正常组比较,P<0.01;③与模型组比较,P<0.05;④与模型组比较,P<0.01;⑤与西药组比较,P<0.05;⑥与西药组比较,P<0.01。
2.2各组大鼠肾组织中NF-κBp65蛋白和mRNA表达情况比较 模型组NF-κBp65蛋白和mRNA表达水平均显著高于正常组(P均<0.05),各给药组NF-κBp65蛋白表达水平和糖肾安低中剂量组及西药组NF-κBp65 mRNA表达水平均显著高于正常组(P均<0.05);各给药组NF-κBp65蛋白和mRNA表达水平均显著低于模型组(P均<0.05);糖肾安低剂量组NF-κBp65蛋白mRNA表达水平均显著高于西药组(P均<0.05)。见图13、图14及表2。

图1 正常组大鼠肾组织中Nrf2表达情况
图2 模型组大鼠肾组织中Nrf2表达情况
图3 糖肾安低剂量组大鼠肾组织中Nrf2表达情况

图4 糖肾安中剂量组大鼠肾组织中Nrf2表达情况

图5 糖肾安高剂量组大鼠肾组织中Nrf2表达情况

图6 西药组大鼠肾组织中Nrf2表达情况
图7 正常组大鼠肾组织中HO-1表达情况

图8 模型组大鼠肾组织中HO-1表达情况

图9 糖肾安低剂量组大鼠肾组织中HO-1表达情况
图10 糖肾安中剂量组大鼠肾组织中HO-1表达情况
图11 糖肾安高剂量组大鼠肾组织中HO-1表达情况

图12 西药组大鼠肾组织中HO-1表达情况
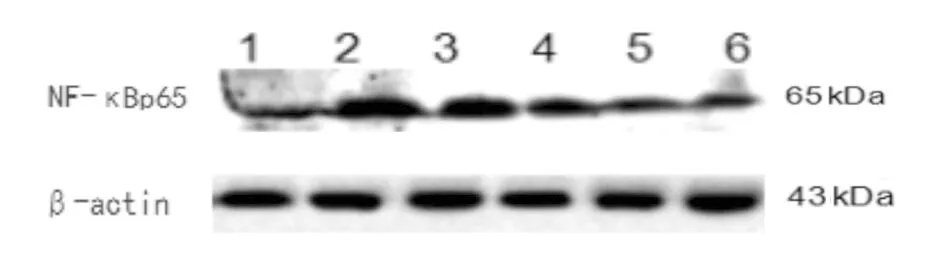
1为正常组;2为模型组;3为糖肾安低剂量组;4为糖肾安中剂量组;5为糖肾安高剂量组;6为西药组图13 各组大鼠肾组织中NF-κBp65蛋白表达情况

1为正常组;2为模型组;3为糖肾安低剂量组;4为糖肾安中剂量组;5为糖肾安高剂量组;6为西药组图14 各组大鼠肾组织中NF-κBp65 mRNA表达情况
2.3各组大鼠肾组织中SOD活性比较 正常组、模型组、糖肾安低剂量组、糖肾安中剂量组、糖肾安高剂量组及西药组大鼠肾组织中SOD活性分别为(148.82±7.50)IU/mL、(22.37±10.15)IU/mL、(43.66±18.73)IU/mL、(81.87±15.41)IU/mL、(96.09±11.91)IU/mL、(96.57±10.93)IU/mL,模型组及各给药组SOD活性均显著低于正常组(P均<0.05),各给药组SOD活性均显著高于模型组(P均<0.05),糖肾安低、中剂量组SOD活性均显著低于西药组及糖肾安高剂量组(P均<0.05),糖肾安高剂量组及西药组比较差异无统计学意义(P>0.05)。

表2 各组大鼠肾组织中NF-κBp65蛋白和mRNA表达情况
注:①与正常组比较,P<0.01;②与正常组比较,P<0.05;③与模型组比较,P<0.05;④与模型组比较,P<0.01;⑤与西药组比较,P<0.05;⑥与西药组比较,P<0.01。
3 讨 论
DKD的发生发展不仅与蛋白非酶糖化、糖脂代谢紊乱、血流动力学、遗传背景有关,还与氧化应激、炎症反应密切相关。ARE是细胞保护蛋白基因表达和Ⅱ相解毒酶的上游调节区,这一序列的激活因子是Nrf2。活化的Nrf2从Keap1解离后进入细胞核,与细胞核内Maf蛋白结合成异二聚体后与ARE序列结合,进而启动ARE所调控基因的转录,称为Keap1-Nrf2-ARE通路,该通路是一种重要的抗氧化应激通路[9]。高糖状态下产生过多的活性氧(ROS),消耗了通过机体自身Nrf2/ARE通路激活所增加的HO-1等抗氧化蛋白,使机体抗氧化应激能力减弱,激活内源性抗氧化应激Nrf2/ARE信号通路,减轻肾脏的氧化应激反应,从而发挥对机体肾脏的保护作用,可延缓糖尿病的发展,预防糖尿病并发症的发生,改善代谢紊乱,减轻糖尿病引起的肾损害[10-12]。张镍等[13]研究结果显示积雪草酸可激活糖尿病大鼠肾脏Nrf2-ARE信号通路,增强机体抗氧化蛋白HO-1的表达,提高肾脏的抗氧化应激能力,从而延缓DKD的进展。
糖尿病状态下肾素-血管紧张素系统(RAS)活性增高,尤其是肾组织中AngⅡ含量增加,可促进ROS的合成,ROS激活丝裂原激活蛋白激酶(MAPK)信号传导通路,核因子抑制蛋白(IκB)磷酸化而被降解,使IκB与NF-κB分离,激活NF-κB的表达[14]。NF-κB是重要的炎症递质转录调节因子,而Nrf2是细胞防御多种氧化应激损伤的核心转录调节因子,具有抗氧化损伤及抗炎等作用,并能抑制NF-κB活性[15]。陈凯等[16]观察经血管紧张素Ⅱ受体拮抗剂缬沙坦干预后,糖尿病大鼠肾脏组织内质网膜蛋白NK-κB蛋白表达明显下调,表明缬沙坦能够激活 NF-κB系统,抑制炎症反应,从而保护糖尿病大鼠肾脏组织。本实验结果显示,模型组大鼠肾组织中NF-κBp65表达水平显著高于正常组,提示激活了糖尿病大鼠肾组织中炎症反应,与此同时,Nrf2、HO-1在核蛋白中的表达增高,推测糖尿病大鼠肾组织的炎症反应与氧化应激引起了机体保护性应激反应,刺激Nrf2的活化引起其下游靶基因HO-1上升;给予糖肾安干预后,各组大鼠肾组织中Nrf2及HO-1水平继续上调,NF-κBp65水平降低,活化受到抑制,并呈浓度梯度依赖,提示在糖肾安干预下,Nrf2活性激活,调控HO-1表达升高,进一步启动机体抗炎、抗氧化反应,抑制NF-κBp65表达,减轻糖尿病大鼠肾组织炎性及氧化应激反应,从而发挥保护肾脏作用。
综上所述,中药复方糖肾安治疗糖尿病肾病的机制与激活内源性抗氧化应激通路Nrf2/ARE,提高Nrf2及其下游因子HO-1的活性,抑制NF-κBp65的表达,减轻肾脏炎症水平,从而发挥抗氧化作用有关。
[参考文献]
[1] Marshal SM. Recent advances in diabetic nephropathy[J]. Postgrad Med J,2004,80(949):624-633
[2] Mima A. Inflammation and oxidative stress in diabetic nephropathy:new insights on its inhibition as new therapeutic targets[J]. J Diabetes Res,2013,2013:248563
[3] Nguyen T,Nioi P,Pickett CB. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J]. J Biol Chem,2009,284(20):13291-13295
[4] Siebenlist U,Franzoso G,Borwn K,et al. Structure regulation andfaction of NF-κB[J]. Aunu Rev Cell Biol,1994,10:405-455
[5] 曹光,王镁. 糖肾安煎剂对糖尿病大鼠氧化应激影响的研究[J]. 中华中医药学刊,2009,27(4):761-762
[6] 周敏,柴可夫. 实验性2型糖尿病动物模型研究及其进展[J]. 浙江中医学院学报,2001,25(5):79-80
[7] 张玉领,陈培,刘家秀,等. 2型糖尿病大鼠模型的建立[J]. 现代预防医学,2012,39(15):3922-3924
[8] 何清华,周迎生,王征,等. 2型糖尿病大鼠模型制备的影响因素及其特点[J]. 中国实验动物学报,2007,15(6):425-429
[9] Menshikova EB,Tkachev VO,Zenkov NK. Redox-dependent signaling system Nrf2/ARE in inflammation[J]. Mol Biol,2010,44(3):343-357
[10] Uruno A,Yagishita Y,Yamamoto M. The Keap1-Nrf2 system and diabetes mellitus[J]. Arch Biochem Biophys,2015,566:76-84
[11] Zheng H,Whitman SA,Wu W,et al. Therapeutic potential of Nrf2 activators in streptozotocin-induced diabetic nephropathy[J]. Diabetes,2011,60(11):3055-3066
[12] Elango B,Dornadula S,Palanisamy R,et al. The emerging role of redox-sensitive Nrf2-Keap1 pathway in diabetes[J]. Pharmacol Res,2015,91:104-114
[13] 张镍,陈小罗,陈巧芬,等. 积雪草酸对糖尿病大鼠肾脏Nrf2-ARE信号通路的影响[J]. 江苏医药,2013,39(12):1381-1383
[14] Bataller R,Schwabe RF,Choi YH,et al. NADPH oxidase signal transduces angiotensin Ⅱ in hepatic cells and is critical in hepatic fibrosis[J]. J Clin Invest,2003,112(9):1383-1394
[15] 陈双江,王铮,姚英民,等. miRNA-106a在肝癌中的表达及其作用[J]. 陕西医学杂志,2014,43(2):139-142
[16] 陈凯,张承英,张建荣,等. 缬沙坦对糖尿病大鼠肾脏内质网应激及缬沙坦对糖尿病大鼠肾脏内质网应激及NF-κB炎症信号通路的影响[J]. 武警后勤学院学报:医学版,2015,24(9):685-689

