甲状腺实性结节微波消融术后部分相对特异的超声表现
张士宁,,
(1.暨南大学附属宝安妇幼保健院,广东 深圳 518132;2.佛山市中医院内分泌科,广东 佛山 528000;3.广州市增城区人民医院内分泌科,广东 广州 511300)
甲状腺结节为临床常见疾病,在成年人群中发病率约为5%~20%[1-2]。一旦发现甲状腺结节,常用超声检查和细针穿刺细胞学活检的方法初步明确甲状腺结节的性质[1-3]。对于使用这2种方法结果显示为良性结节的患者,部分选择了超声引导下的甲状腺结节微波消融治疗[4-5]。由于微波治疗甲状腺结节这项技术尚未完全普及,一些超声科医生对于甲状腺结节消融术后的超声图像改变认识不足,以至于在临床工作中评价甲状腺结节消融术后改变的时候,部分医疗机构存在着单纯以结节大小的改变为主作为评价标准的误区。由于微波消融范围一般超过肿物的实际范围,在患者复查超声时,短期内超声表现“结节”没有缩小或有增大,从而引起患者的误解,甚至产生纠纷。在中文数据库中检索,目前国内文献中还没有专门介绍甲状腺结节微波消融术后常见超声图像改变的文章。本文以实性结节为重点研究对象总结了我们课题组所进行的甲状腺结节微波消融术后短期内复查时相对特异的超声影像的变化。
1 资料与方法
1.1研究对象回顾分析了广州中医药大学金沙洲医院、广东省第二人民医院、解放军455医院等多家医疗机构提供的甲状腺结节微波消融术后的患者590例共851个结节,其中实性为主的结节135例。手术时间自2014年2月至2015年12月。所有患者都有细胞学检查和超声检查证明结节为良性病灶。大部分患者在医院住院治疗,部分患者在门诊行手术治疗。住院患者住院天数2~5 d不等,门诊患者观察2 h,无并发症后自行返回。所有病例在消融术中无特殊药物应用。
1.2方法本项研究临床图像及数据的采集以回顾性采集正常复诊患者术前、术后1个月和术后3个月病例超声图像为研究资料。超声机器采用迈瑞DC-3T彩色多普勒超声诊断仪,利用高频探头探测甲状腺及结节的大小和超声表现。结节的大小测量前后径、左右径和上下径(纵径)3个径线,消融后的结节采用同样的方法进行测量。由于消融后“结节”的边缘部分并非真正意义上的结节边缘,本次研究没有区分消融后的结节和结节周围组织消融后凝固性坏死带,2种统称消融后的结节,也就是说消融后的结节的范围包括原结节和周围坏死区[6]。微波消融机为南京康友KY-2100型冷循环微波消融机,使用KY2450B无菌一次性消融针。甲状腺结节消融参数:采用多点消融,每点的消融时间20~60 s,功率30~45 W,超声监视下进行消融。
1.3图像分析由2名影像学医生对甲状腺结节术前、术后图像进行评估和分类。根据术后1个月和3个月的超声图像资料,评估结节回声的变化。结节回声变化利用生物技术IMAGE J软件灰度测量功能进行量化,以相邻正常甲状腺组织为参考灰度,测量灰度值和甲状腺灰度值2种的比值作为相对灰度值。背景黑色作为图片质量审核基准,背景黑色运算值最小值0,最大值为1,最大值超过1者认为该图片质量不合格,放弃采用该图片。由于微波消融术后,甲状腺结节内部发生凝固性坏死,微波消融针的针道因温度瞬间超过100 ℃而导致周围组织碳化,在超声上显示为低回声背景下的点状或条状强回声。
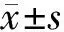
2 结果
2.1患者一般资料本组590例患者中,83例(14.1%)为男性患者,507例(85.9%)为女性患者。所有患者的中位数年龄37岁,年龄跨度13~87岁。结节横切面最大径线平均值2.1 cm,其中<1 cm的结节有314个(36.9%)、1~<3 cm的结节有462个(54.3%)、≥3 cm的结节有75个(8.8%)。甲状腺结节以多发为主,多发结节431例(73.1%),单发结节159例(26.9%)。本组患者复查周期设在术后1个月和3个月。长期随访的患者不在本项课题的研究范畴内。
2.2微波消融后病灶回声强度的变化以正常甲状腺组织背景为灰度基准,利用Image J 软件检测消融术后区域回声灰度值的变化,与甲状腺背景组织灰度值比较,得出相对值。所有实性结节或者实性为主的结节,测量结节中的实性部分,作为测量点。消融术前结节部位和甲状腺实质的灰度值之间的差异有统计学意义(P<0.05)。总体结节的灰度值<甲状腺实质部分,提示本次课题涉及的病例结节以低回声结节为主,等高回声结节占比较少。微波消融术后1个月和3个月复查,消融区域回声明显低于消融术前结节回声信号强度(P<0.05)。术后1个月和3个月结节灰度值差异无统计学意义(P>0.05)。见图1。

图1 不同时间点甲状腺结节相对灰度值比较
2.3消融后的结节体积对比变化微波消融术后,由于微波消融术后消融范围的长径约1.5~2 cm,消融后的范围常常大于实际病灶的范围,尤其消融直径<1 cm的病灶。术后1个月复查,超声扫描结节的消融范围对比术前结节总体缩小11%,其中354个结节较术前增大。消融范围和术前结节的体积两者之间比较差异无统计学意义(P>0.05)。术后3个月结节平均体积缩小约62.8%。而在消融的结节进针处,由于热量外溢,可以在超声图像中显示进针的三角形或条状正常组织消融区,本课题组暂时命名这种消融后的影像为“尾”征。“尾”征于207个结节消融后出现,对于识别消融后结节具有一定的意义。
2.4消融后针道的显示消融后针道在结节消融术后1个月和3个月的超声图像均可以显示,而在6个月复查时,消融针道大部分不能显示。沿进针消融方向,可以在消融区域看到平行的2条线状强回声,类似“轨道”表现。这种征象出现在456个实性结节微波消融后出现。在消融方向垂直方向,可以观察到类似环状或短线状强回声,分布于消融坏死区内。在所有结节术前检查中,均未发现类似回声表现。
3 讨论
本项研究探讨了甲状腺良性结节微波消融术后短期内复查时的超声表现,发现微波消融术后,甲状腺结节的消融范围在3个月时候明显体积缩小。而具有特征性的超声表现是微波消融术后出现消融区边缘进针部位出现“尾”征,消融术后消融区内超声可探及”轨道”样平行强回声。
微波用于甲状腺探索起源较早[7-9],随着器械改进,应用微波消融治疗甲状腺结节越来越广泛,一般要求患者术后定期复查。短期复查的患者,出现“结节”没有缩小甚至稍有增大[5],在临床工作中有可能引起患者的不理解,乃至于有发生纠纷的可能。而没有开展微波消融术的医院,有些超声影像学医生对消融后的影像了解不多,一旦出现申请单没有注明病史的病例,有可能造成误诊,因此,对于消融术后的超声表现有必要进一步认识。消融术后6个月的患者因结节缩小明显,习惯上接受以结节大小为基准的评判准则,结节明显缩小后,患者接受度增高,这时候在临床工作中极少出现医生和患者在疗效上的争议。因此,我们课题组主要研究了3个月内的甲状腺实性结节消融术后的相对特征的表现。
甲状腺结节临床常见,发病率各家报道不等,常见于女性患者[8]。微波消融术作为甲状腺结节的治疗手段之一,消融后结节产生凝固性坏死而达到治疗目的。由于消融针瞬间产热,局部温度急剧增高,在针周边可形成碳化带[10]。而碳化区域,在我们的病例观察消融区域中,该超声特征3个月复查时绝大多数还存在。此种征象,在我们的病例里面有456个实性结节微波消融出现。消融针道在超声的特征性表现是消融后的整体低回声区域出现”轨道”状强回声,沿消融方向分布。而所有结节术前检查中,均未发现类似回声表现。所以我们认为这是一种比较特征的消融术后的表现。而甲状腺结节消融后,沿针道非结节组织消融的“尾”征共出现于257个结节中,对于识别消融后结节具有一定的意义,可以认为相对特征之一。
甲状腺结节消融后常采用多普勒血流显像或超声造影进行复查,以观察结节内血流分布情况。由于热消融术具有阻断血流的作用,因此应用超声探测结节区域的血流作为观察消融是否完全的指标之一[11]。在消融完全的结节内,很难探测的血流信号[12]。短期内消融周边的血流会增多。有研究在动物肝内消融实验显示:消融病灶周围肝组织,肝小叶小静脉和中央静脉明显扩张,血管内膜遭到破坏;肝小叶窦状隙增宽、充血,肝细胞肿胀。中央静脉及Glisson鞘周围肝组织内出现炎症细胞聚集。提示在消融热量边缘区域,出现了血管扩张、炎细胞聚集的现象。而这些征象有可能被超声手段来探及到微小血流变化[13]。
总之,甲状腺肿物消融术后短期复查,实性部分消融区域回声信号强度变低,出现消融针道的“轨道”征,消融区域进针处出现热量外溢的“尾”征,是微波消融术后比较特异的超声表现,在临床复查的过程中有一定的价值。
参考文献:
[1] VAN GINHOVEN TM, MASSOLT ET, BIJDEVAATE DC, et al. Radiofrequency ablation of a symptomatic benign thyroid nodule[J]. Ned Tijdschr Geneeskd,2016, 160(0):D202.
[2] 刘娟,吴凤林,隋洋, 等. 超声引导下经皮激光消融甲状腺良性实性结节[J]. 南方医科大学学报, 2013, 33(10):1529-1532.
[3] DUKA E, DE MARCHI G, GIACCHERO R, et al.Image-guided thyroid nodule ablation: technical notes and critical appraisal[J]. Surg Technol Int,2014, 25:103-109.
[4] KORKUSUZ Y, KOHLHASE K, GRONER D, et al. Microwave ablation of symptomatic benign thyroid nodules: energy requirement per ml volume reduction[J]. Rofo,2016, 188(11):1054-1060.
[5] KORKUSUZ Y, MADER OM, KROMEN W, et al. Cooled microwave ablation of thyroid nodules: Initial experience[J]. Eur J Radiol,2016, 85(11):2127-2132.
[6] GAMBELUNGHE G, BINI V, STEFANETTI E, et al. Thyroid nodule morphology affects the efficacy of ultrasound-guided interstitial laser ablation: a nested case-control study[J]. Int J Hyperthermia,2014, 30(7):486-489.
[7] MAGIN RL, LU ST, MICHAELSON SM. Microwave heating effect on the dog thyroid gland[J]. IEEE Trans Biomed Eng ,1977, 24(6):522-529.
[8] 陈海燕,王志宏,左秀玲.超声引导下甲状腺细针穿刺在鉴别甲状腺结节良恶性中的临床应用[J].肿瘤基础与临床,2017,30(4):342-344.
[9] MILROY WC, MICHAELSON SM. Thyroid pathophysiology of microwave radiation[J]. Aerosp Med ,1972, 43(10):1126-1131.
[10] YANG YL, CHEN CZ, ZHANG XH. Microwave ablation of benign thyroid nodules[J]. Future Oncol,2014, 10(6):1007-1014.
[11] YUE W, WANG S, WANG B, et al. Ultrasound guided percutaneous microwave ablation of benign thyroid nodules: safety and imaging follow-up in 222 patients[J]. Eur J Radiol ,2013, 82(1):e11-e16.
[12] FENG B, LIANG P, CHENG Z, et al. Ultrasound-guided percutaneous microwave ablation of benign thyroid nodules: experimental and clinical studies[J] Eur J Endocrinol,2012, 166(6):1031-1037.
[13] 闫丽,周晓东,何光彬,等.激光消融正常活体兔肝的超声表现及影响因素[J].中华超声影像学杂志,2011, 20(4):348-350.

