毒死蜱和百菌清对斑马鱼早期发育阶段的联合毒性效应
李 健,杨桂玲,赵慧宇,王 强,朱朝华
(1.海南大学 热带农林学院,海南 海口 570228; 2.浙江省农业科学院 农产品质量与标准研究所,浙江 杭州 310021)
毒死蜱自1965年投入美国市场,广泛应用于农业生产和家庭害虫防治[1]。在农作物病虫害防治过程中,毒死蜱会进入农田土壤,并且通过渗透、排水等方式转移至地下水或河流,造成水体污染[2]。有研究报道,在相对集中的玉米种植区,河水中的毒死蜱浓度可达0.1 μg·L-1[3],大豆种植区地表水毒死蜱浓度最高达10.8 μg·L-1[4]。在美国和墨西哥的海洋沉积物、河流、湖泊、地下水、城市污水系统,甚至在雨水和空气中均能检测到毒死蜱残留[5-6]。在土耳其地中海沿岸,毒死蜱已成为环境中农药残留检出频率较高的品种[7]。由于毒死蜱在水中降解的速度缓慢,因此,其在水中的残留会对水生生物及其他生物造成潜在危害。赵颖等[8]研究表明,毒死蜱对黑鱼的96 h-LC50(半致死浓度)为0.101 mg·L-1,对斑马鱼成鱼的96 h-LC50为0.291 mg·L-1。徐吉洋等[9]研究表明,毒死蜱对大型溞的48 h-LC50为0.6 μg·L-1,对介形虫的48 h-LC50为2.86 μg·L-1。Furst等[10]通过内分泌干扰物筛选细胞培养实验证明毒死蜱具有雌激素作用,但目前还未见关于毒死蜱对斑马鱼幼鱼内分泌干扰效应的报道。
百菌清是由美国钻石碱公司于1963年开发出来的一种取代苯类杀菌剂,广泛用于蔬菜、水果、水稻等作物上的多种真菌病害防治[11]。由于其使用广泛,关于百菌清在土壤、水、沉积物等环境介质中的残留污染已有较多报道[12-13]。Sakkas等[14]研究表明,在英国沿海及地中海地区的码头、港湾等水体中,有相当浓度的百菌清残留,浓度在0.008~1.38 g·L-1。Caux等[15]研究表明,在加拿大的地表水和地下水中检测到百菌清残留,它在水中的半衰期小于2 h,但在30 d后还能检出,持留期较长。环境中大量残留的百菌清可能会对水生生物的生长、发育,以及群落结构等造成不利影响。有报道表明,百菌清对鲤鱼的48 h-LC50为110 μg·kg-1,对鲶鱼的48 h-LC50为386 μg·kg-1,对虹鱼的48 h-LC50为250 μg·kg-1。方琪等[16]报道,百菌清可以促进雄激素敏感细胞增殖;Zhang等[17]研究表明,百菌清对雌激素受体基因(ERα)有影响。但目前还未见关于百菌清对斑马鱼幼鱼内分泌干扰效应的报道。
随着不同种类农药的大量使用,农药复合污染问题受到越来越多的关注。尚艳芬等[18]对大量蔬菜样品进行检测发现,毒死蜱和百菌清两种农药常同时检出,且超标率较高。汪志威等[19]报道,在设施作物番茄和黄瓜上,毒死蜱和百菌清作为常用农药被大量使用。因此,毒死蜱和百菌清的毒性和内分泌干扰研究,对生态风险评估具有重要意义。本文以斑马鱼为模式生物,运用静态法和实时荧光定量PCR方法,研究毒死蜱和百菌清,及其二元组合对斑马鱼胚胎的急性毒性,和对斑马鱼幼鱼性腺轴相关基因的影响。
1 材料与方法
1.1 实验材料
95%毒死蜱原药,购自连云港市东金化工有限公司;98.2%百菌清原药,购自江阴苏利化学有限公司。RNA提取试剂盒(TakaRa MiniBEST Universal RNA Extraction Kit)、反转录试剂盒(PrimeScriptTMRT Master Mix)、去基因组DNA试剂盒(gDNA Eraser)和实时荧光定量PCR试剂盒(SYBR Premix Ex TaqTM),均购自大连Takara公司。
StepOnePlusTM Real-Time PCR仪,美国Applied Biosystems公司;智能光照培养箱,宁波江南仪器厂;Thermo Fresco 17台式离心机,德国Thermo Fisher公司。
实验用鱼为斑马鱼(Brachydaniorerio)野生型品系(AB型),由浙江省农业科学院生态监测中心提供。斑马鱼在恒定温度(27±1℃)、14 h∶10 h光/暗条件的循环水系统中培养。每天喂养2次新鲜孵化的丰年虾。实验前一天晚上,将雄性和雌性斑马鱼以2∶1的比例配对放入产卵缸,第二天早上开灯给予光照刺激,使其交配产卵。收集鱼卵,用系统水清洗,并在显微镜下观察。选取正常发育的胚胎,用于后续的暴露实验。
1.2 实验方法
1.2.1 斑马鱼胚胎急性毒性实验
急性毒性实验参照经济合作与发展组织(OECD)的标准[20]。采用静态法,设置8个浓度和1个空白对照组,空白组和实验组DMSO含量均为0.001%(体积分数),具体浓度设置见表1。以24孔板作为染毒容器,每孔放置1枚胚胎,每个浓度设置3个重复。将空白对照组和实验组分别置于(26±1)℃培养箱中培养96 h,光暗周期为14 h∶10 h。斑马鱼死亡判断依据:卵是否出现白色凝结,小鱼有无心率,血液是否流动。在此期间,每24 h观察斑马鱼胚胎的死亡情况并记录。
1.2.2 斑马鱼胚胎急性联合毒性实验
以毒死蜱和百菌清单剂对斑马鱼胚胎的96h-LC50为各自的毒性单位。采用等毒性配比,设置8个浓度和1个空白对照,每个浓度设置3个重复,每24 h观察斑马鱼胚胎的死亡情况,具体浓度设置见表1。
1.2.3 斑马鱼胚胎短期暴露及基因测定
根据毒死蜱和百菌清单剂的LC50,设置高、中、低3个浓度和1个空白对照,每个浓度设置3个重复,每个浓度随机挑选100枚正常发育的胚胎放入500 mL烧杯中。毒死蜱浓度设置为6.7、26.7、106.7 μg·L-1,百菌清浓度设置为1.1、4.4、17.6 μg·L-1,毒死蜱+百菌清联合暴露浓度设置为6.7 μg·L-1+1.1 μg·L-1、26.7 μg·L-1+4.4 μg·L-1、106.7 μg·L-1+17.6 μg·L-1。将实验组和对照组放入(26±1)℃培养箱中暴露96 h,光暗周期为14 h∶10 h,每24 h更换一次药剂。实验结束后,每个浓度随机挑选15条斑马鱼用于基因测定。
按照试剂盒说明书提取总RNA。用紫外分光光度法测定RNA的浓度和纯化质量。按照试剂说明书对RNA进行反转录。按照实时荧光定量PCR试剂盒说明书在冰上配制20 μL反应体系。反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;72 ℃延伸20 s。所用基因引物序列参考常菊花[21]的报道(表2)。
1.3 数据处理及统计分析
所有数据在SPSS 7.5平台上进行整理与分析,利用Origin 8.0软件制图。
联合毒性参照相加指数(additional index,AI)法[22]进行评定。AI>0时为协同作用,AI<0时为拮抗作用,AI=0时为相加作用。
2 结果与分析
2.1 急性毒性实验结果
如表3所示:毒死蜱对斑马鱼胚胎的96 h-LC50值为2.139 mg·L-1,据现行标准[23]属于中等毒性(1~10 mg·L-1),95%置信区间为0.921~16.327 mg·L-1;百菌清对斑马鱼胚胎的96 h-LC50值为0.353 mg·L-1,属于高毒性(0.1~1.0 mg·L-1),95%置信区间为0.247~0.402 mg·L-1。在整个实验周期内,对照组未见死亡。
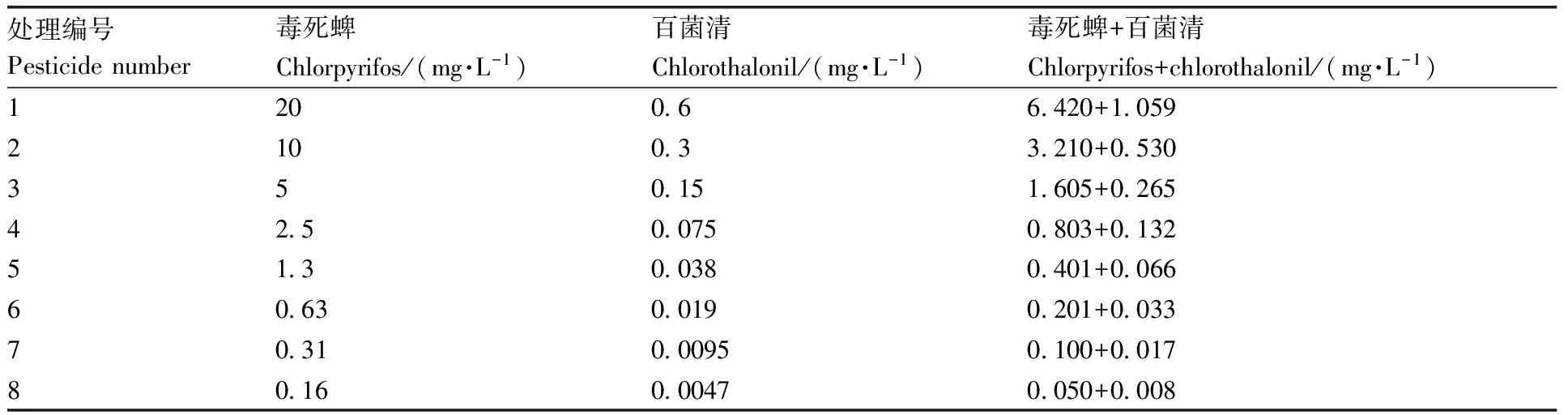
表1 毒死蜱和百菌清急性毒性实验浓度设置Table 1 Concentration of chlorpyrifos and chlorothalonil in acute toxicity experiment

表2 实时荧光定量PCR引物序列Table 2 Primers used for quantification of mRNA expression by real-time PCR

表3 毒死蜱和百菌清对斑马鱼的急性毒性Table 3 Acute toxicity of chlorpyrifos and chlorothalonil to zebrafish
2.2 联合毒性实验结果
如表4所示:毒死蜱对斑马鱼胚胎的96 h-LC50值为0.380 mg·L-1,95%置信区间为0.141~1.605 mg·L-1;百菌清对斑马鱼胚胎的96 h-LC50值为0.063 mg·L-1,95%置信区间为0.058~1.643 mg·L-1。采用相加指数法计算联合效应,AI值为1.82,表现出协同作用(AI>0)。在整个实验周期内,对照组未见死亡。
2.3 对斑马鱼幼鱼性腺轴相关基因表达的影响
如图1所示:低浓度(6.7 μg·L-1)毒死蜱下,斑马鱼体内的ERβ2基因的表达量显著(P<0.05)下调,为对照组的70%,其余基因未见明显变化;中浓度(26.7 μg·L-1)毒死蜱下,斑马鱼体内的VTG2、VTG1、ERβ1、ERβ2和ERα基因的表达量显著(P<0.05)上调,分别为对照组的2.5、16.5、8.3、14.8、5.0倍;高浓度(106.7 μg·L-1)毒死蜱下,斑马鱼体内的VTG2、ERβ2和ERβ1基因的表达量显著(P<0.05)上调,分别为对照组的2.4、3.0、2.5倍,其余基因未见明显变化。
如图2所示:低浓度(1.1 μg·L-1)百菌清下,斑马鱼体内的VTG1、VTG2、ERβ1和ERβ2基因的表达量显著(P<0.05)上调,分别为对照组的3.9、5.4、2.6、3.0倍,其余基因未见明显变化;中浓度(4.4 μg·L-1)百菌清下,斑马鱼体内的ERβ1基因的表达量显著(P<0.05)下调,为对照组的76%,其余基因未见明显变化;高浓度(17.6 μg·L-1)百菌清下,斑马鱼体内的ERβ1基因的表达量极显著(P<0.01)上调,为对照组的1.6倍,其余基因未见明显变化。
如图3所示:暴露于低剂量组(6.7 μg·L-1毒死蜱+1.1 μg·L-1百菌清),斑马鱼体内的VTG1、ERβ1、ERβ2和ERα基因的表达量显著(P<0.05)下调,分别为对照组的22%、44%、45%、46%,其余基因未见明显变化;暴露于中剂量组(26.7 μg·L-1毒死蜱+4.4 μg·L-1百菌清),斑马鱼体内的VTG1基因的表达量显著(P<0.05)下调,为对照组的54%,其余基因未见明显变化;暴露于高剂量组(106.7 μg·L-1毒死蜱+17.6 μg·L-1百菌清),斑马鱼体内的VTG2基因的表达量极显著(P<0.01)上调,为对照组的2.5倍,其余基因未见明显变化。
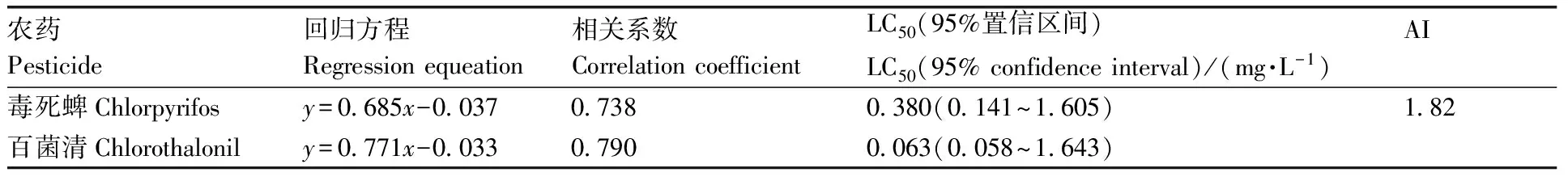
表4 毒死蜱和百菌清对斑马鱼联合染毒结果Table 4 Combined poisoning of chlorpyrifos and chlorothalonil to zebrafish
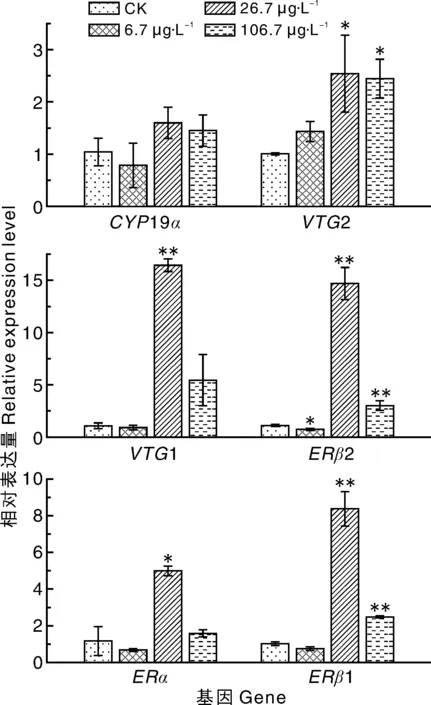
标“*”或“**”的表示与CK相比差异显著(P<0.05)或极显著(P<0.01)。下同。* or ** indicated significance between the treatment and CK at P<0.05 or P<0.01,respectively. The same as below.图1 不同浓度的毒死蜱对斑马鱼幼鱼性腺轴相关基因表达量的影响Fig.1 Effects of different concentrations of chlorpyrifos on gene expression of gonad of zebrafish larvae
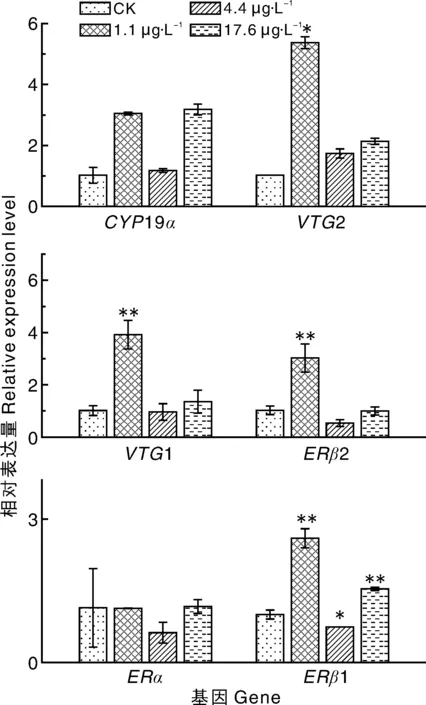
图2 不同浓度的百菌清对斑马鱼幼鱼性腺轴相关基因表达量的影响Fig.2 Effects of different concentrations of chlorothalonil on gene expression of gonad of zebrafish larvae
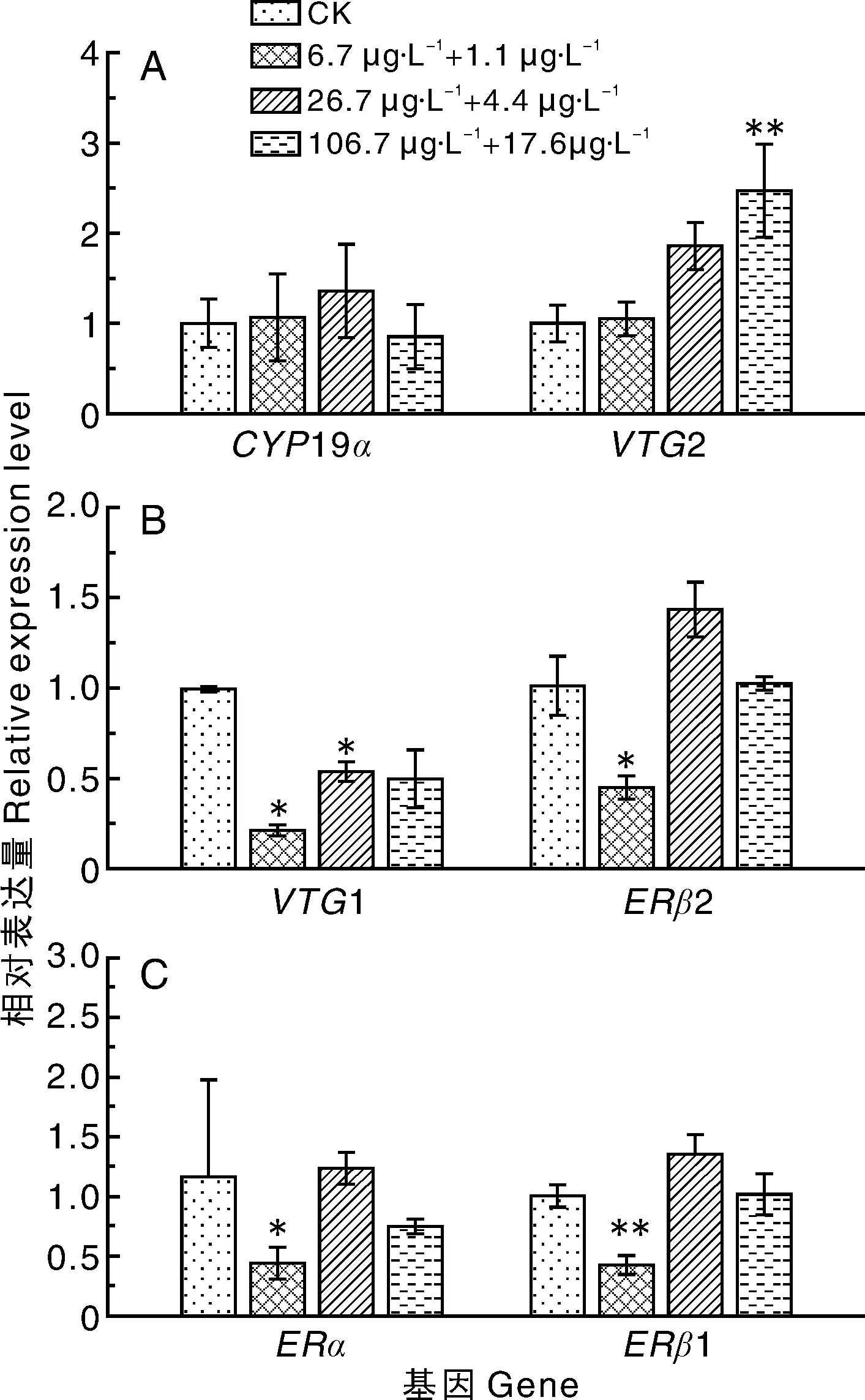
图3 不同浓度的毒死蜱+百菌清二元组合对斑马鱼幼鱼性腺轴相关基因表达量的影响Fig.3 Effects of different concentrations of chlorpyrifos+chlorothalonil on gene expression of gonad of zebrafish larvae
3 讨论
3.1 毒死蜱、百菌清二元联合暴露急性毒性增强
本研究发现,毒死蜱单剂对斑马鱼胚胎的96 h-LC50值为2.139 mg·L-1,表现为中毒。赵颖等[8]研究表明,毒死蜱对斑马鱼成鱼的96 h-LC50为0.291 mg·L-1。本研究中,百菌清单剂对斑马鱼胚胎的96 h-LC50值为0.353 mg·L-1,表现为高毒。周军英等[24]研究表明,百菌清对斑马鱼成鱼的48 h-LC50为0.009 mg·L-1。对比可知,斑马鱼成鱼较胚胎对毒死蜱和百菌清更为敏感,可能的原因是胚胎期卵膜起到了保护作用,卵膜阻止了外来大分子的穿透进入。杨亚洲等[25]的研究同样表明,毒死蜱对稀有鮈鲫胚胎和成鱼的96 h-LC50值分别为7.59 mg·L-1和0.027 2 mg·L-1,成鱼较胚胎对毒死蜱更敏感。
毒死蜱+百菌清联合暴露时,毒死蜱的96 h-LC50值为0.38 mg·L-1,百菌清的96 h-LC50值为0.063 mg·L-1,分别为单独暴露时的5.63和5.60倍。相加指数法计算结果显示,毒死蜱和百菌清联合暴露对斑马鱼胚胎表现为协同作用。可能的原因是:当两种类型的农药在斑马鱼体内同时存在时,有机磷酸酯类农药首先会与p450酶系结合,导致分子活化,然后阻止p450酶系与百菌清结合和降解[26-27]。
3.2 毒死蜱对斑马鱼幼鱼具有雌激素内分泌干扰效应
性激素对斑马鱼的第二性征和生长发育具有重要作用,性激素水平及平衡的改变可能影响生殖过程和后代的生殖能力。CYP19α属于细胞色素p450家族,它催化斑马鱼体内雄激素(如睾酮和雄烯二酮)转化为雌激素,是斑马鱼体内雌激素生物合成中的限速酶[28]。斑马鱼体内雌激素受体存在ERα和ERβ两种类型,其中雌激素受体ERβ存在异型体,分别为ERβ1和ERβ2。雌激素与受体(ERα、ERβ1和ERβ2)结合发挥作用。卵黄蛋白原(VTG)是一种环境雌激素暴露的生物标志物,为鱼类胚胎和幼体早期阶段发育提供营养来源[29]。
人乳腺癌细胞(MCF-7)是内分泌干扰物体外筛选实验的常用细胞。Furst等[10]的研究表明,毒死蜱对乳腺癌成纤维细胞(MCF-7BUS)的增殖和ER反式(转)的激活有影响,且其作用是E2(17-β雌二醇) 最大作用的25%~36%,表明毒死蜱对MCF-7BUS细胞存在雌激素作用。Grünfeld等[30]验证了毒死蜱对MCF-7BUS 细胞ERα和ERβ稳态水平的影响,发现使用毒死蜱可轻微刺激并提高ERβmRNA水平(P=0.006)。在本研究中:低浓度毒死蜱下,斑马鱼体内的ERβ2基因表达与对照组相比显著下调;中浓度毒死蜱下,斑马鱼体内的VTG2、VTG1、ERβ1、ERβ2和ERα基因表达与对照组相比显著上调;高浓度毒死蜱下,斑马鱼体内的VTG2、ERβ2和ERβ1基因表达与对照组相比显著上调。表明毒死蜱对斑马鱼幼鱼具有雌激素内分泌干扰效应,与前人研究结果一致。
3.3 百菌清对斑马鱼幼鱼具有雌激素内分泌干扰效应
本研究中:低浓度百菌清下,斑马鱼体内的VTG1、VTG2、ERβ1和ERβ2基因表达与对照组相比显著上调;中浓度百菌清下,斑马鱼体内的ERβ1基因表达与对照组相比显著下调;高浓度百菌清下,斑马鱼体内的ERβ1基因表达与对照组相比显著上调。低浓度的百菌清对斑马鱼幼鱼性腺轴基因的促进作用最为明显,说明百菌清对斑马鱼幼鱼具有雌激素内分泌干扰效应。这与Zhang等[17]运用体外双荧光素酶报告基因测试方法,证明百菌清对ERα基因有亲和力,且百菌清具有潜在的雌激素干扰效应的结论一致。
3.4 毒死蜱+百菌清联合暴露与单独暴露相比,对斑马鱼幼鱼的雌激素干扰效应降低
联合暴露条件下,低剂量组斑马鱼体内的VTG1、ERβ1、ERβ2基因表达与对照组相比显著下调,中剂量组斑马鱼体内VTG1基因与对照组相对比显著下调,高剂量组VTG2基因相比照组显著上调。这说明,二元联合暴露与单独暴露相比,对斑马鱼雌激素内分泌的干扰效应降低。传统毒理学认为,毒物到一定剂量时所引发的效应,高剂量会大于低剂量,这种线性的剂量-效应关系是进行生态风险评价的标准。然而对于内分泌干扰物而言,其暴露于低剂量(即其在接近甚至低于无可见有害作用水平或对应的安全剂量)时可引起生物学效应,存在非单调剂量-效应关系,其曲线呈现U型或倒U型等,从而使暴露于低剂量EDCs所产生的生物学效应可能大于等于高剂量所产生的效应[31]。从实验结果来看,毒死蜱基因表达-剂量效应关系表现为倒U型,百菌清基因表达-剂量效应关系表现为U型,所以,联合暴露时,毒死蜱的倒U型与百菌清的U型可能形成互补关系,造成对斑马鱼幼鱼的雌激素干扰效应降低,但具体的干扰机制仍须作进一步研究。
参考文献(References):
[1] JUBERG D R, GEHEN S C, COADY K K, et al. Chlorpyrifos: weight of evidence evaluation of potential interaction with the estrogen, androgen, or thyroid pathways[J].RegulatoryToxicologyandPharmacology, 2013, 66 (3): 249-263.
[2] 吴长兴, 赵学平, 吴声敢,等. 丘陵地区水稻田使用毒死蜱对水体的污染及其生态风险[J]. 生态与农村环境学报, 2011, 27 (3): 108-112.
WU C X, ZHAO X P, WU S G, et al. Pollution of water body by chlorpyrifos used in paddy rice field in hilly areas and its ecological risk[J].JournalofEcologyandRuralEnvironment, 2011, 27(3): 108-112. (in Chinese with English abstract)
[3] FERENCZI J, AMBRUS, WAUCHOPE R D, et al. Persistence and runoff losses of 3 herbicides and chlorpyrifos from a corn field in the Lake Balaton watershed of Hungary[J].JournalofEnvironmentalScienceandHealth,PartB, 2002, 37(3): 211-224.
[4] MARINO D, RONCO A. Cypermethrin and chlorpyrifos concentration levels in surface water bodies of the Pampa Ondulada, Argentina[J].BulletinofEnvironmentalContaminationandToxicology, 2005, 75(4): 820-826.
[5] READMAN J W, KWONG L L W, MEE L D, et al. Persistent organophosphorus pesticides in tropical marine environments[J].MarinePollutionBulletin, 1992, 24(8): 398-402.
[6] ZAMORA C, KRATZER C R, MAJEWSK M S, et al. Diazinon and chlorpyrifos loads in precipitation and urban and agricultural storm runoff during January and February 2001 in the San Joaquin River basin, California[EB/OL].[2018-01-230]. http://www.docin.com/p-1582755921.html.
[7] TUNCEL S G, ÖZTAS N B, ERDURAN M S. Air and groundwater pollution in an agricultural region of the Turkish Mediterranean coast[J].JournaloftheAir&WasteManagementAssociation, 2008, 58(9): 1240-1249.
[8] 赵颖, 姚苏梅, 刘毅华,等. 毒死蜱对我国南方稻区水域中12种淡水鱼的毒性[J]. 生态毒理学报, 2014, 9(6): 1181-1188.
ZHAO Y, YAO S M, LIU Y H, et al. Toxic effects of chlorpyrifos on different species of freshwater fish in Southern China[J].AsianJournalofEcotoxicolog, 2014, 9(6): 1181-1188. (in Chinese with English abstract)
[9] 徐吉洋, 张文萍, 李少南,等. 毒死蜱对六种淡水节肢动物的毒性与风险评价[J]. 生态毒理学报, 2014, 9(3): 563-568.
XU J Y, ZHANG W P, LI S N, et al. Toxicity and risk of chlorpyrifos to six species of freshwater arthropods[J].AsianJournalofEcotoxicolog, 2014, 9(3): 563-568. (in Chinese with English abstract)
[10] FURST A, HOEPKER A C, FRANCIS M B. Quantifying hormone disruptors with an engineeredbacterial biosensor[J].ACSCentralScience, 2017, 3(2): 110.
[11] 吴祥为. 百菌清重复施用在土壤中的残留特征及其土壤生态效应[D]. 杭州:浙江大学, 2014.
WU X W. Residue characteristics and ecological effects of chlorothalonil after its repeated application in soil[D]. Hangzhou: Zhejiang University, 2014.
[12] KWON J W, ARMBRUST K L. Degradation of chlorothalonil in irradiated water/sediment systems[J].JournalofAgriculturalandFoodChemistry, 2006, 54(10): 3651-3657.
[13] ZHANG Z Y, LIU X J, YU X Y, et al. Pesticide residues in the spring cabbage (Brassicaoleracea, L. var.capitata) grown in open field[J].FoodControl, 2007, 18(6): 723-730.
[14] SAKKAS V A, LAMBROPOULOU D A, ALBANIS T A. Study of chlorothalonil photodegradation in natural waters and in the presence of humic substances[J].Chemosphere, 2002, 48(9): 939-945.
[15] CAUX P Y, KENT R A, FAN G T, et al. Environmental fate and effects of chlorothalonil: a Canadian perspective[J].CriticalReviewsinEnvironmentalScienceandTechnology, 1996, 26(1): 45-93.
[16] 方琪, 马彦博, 张思远,等. 农药内分泌干扰效应研究进展[J]. 生态毒理学报, 2017, 12(1): 98-110.
FANG Q, MA Y B, ZHANG S Y, et al. Research progress in endocrine disrupting effects of pesticides[J].AsianJournalofEcotoxicolog, 2017, 12(1): 98-110. (in Chinese with English abstract)
[17] ZHANG Q, Ji C, YAN L, et al. The identification of the metabolites of chlorothalonil in zebrafish (Daniorerio) and their embryo toxicity and endocrine effects at environmentally relevant levels[J].EnvironmentalPollution, 2016, 218: 8-15.
[18] 尚艳芬, 赵海香, 史文礼,等. 蔬菜中农药残留快速检测与色谱法检测结果的比较分析[J]. 农药, 2009, 48(1): 39-41.
SHANG Y F, ZHAO H X, SHI W L, et al. Comparison between the determination results of pesticide residues in vegetable of rapid bioassay and chromatography[J].Agrochemicals, 2009, 48(1): 39-41. (in Chinese with English abstract)
[19] 汪志威, 李非里, 何岸飞,等. 百菌清和毒死蜱在大棚番茄中的分布与降解特征[J]. 农业环境科学学报, 2011, 30(6): 1076-1081.
WANG Z W, LI F L, HE A F, et al. The distribution and degradation of chlorthalonil and chlorpyrifos in tomatoes in greenhouse[J].JournalofAgro-EnvironmentScience, 2011, 30(6): 1076-1081. (in Chinese with English abstract)
[20] OECD/OCDE. OECD guidelines for the testing of chemicals: fish embryo acute toxicity (FET) test[EB/OL]. (2013-07-26)[2018-01-23]. http://www.oecd-ilibrary.org/docserver/download/9713161e.pdf?expires=1522118534&id=id&accname=guest&checksum=3F4630185EB59373E16DFD5470930D0E.
[21] 常菊花. 丁草胺对斑马鱼的内分泌干扰效应研究[D]. 南京:南京农业大学, 2012.
CHANG J H. Endocrine disruping effects of butachlor on zebrafish (Daniorerio)[D]. Nanjing: Nanjing Agricultural University, 2012.
[22] 修瑞琴, 许永香, 傅迎春,等. 水生毒理联合效应相加指数法[J]. 环境化学, 1994, 13(3): 269-271.
XIU R Q, XU Y X, FU Y C, et al. Additive index of coeffects for aquatic toxicology[J].EnvironmentalChemistry, 1994, 13(3): 269-271. (in Chinese with English abstract)
[23] 胡秀彩, 边延峰, 周捷,等. 四种药物对斑马鱼急性毒性试验[J]. 水产养殖, 2012, 33(1): 43-47.
HU X C, BIAN Y F, ZHOU J, et al. Acute toxicity of four pesticides to zebrafish(Brachydaniorerio)[J].JournalofAquaculture, 2012, 33(1): 43-47. (in Chinese with English abstract)
[24] 周军英, 王香兰, 梁霞,等. 中国长江三角洲流域百菌清水生生物基准研究[J]. 生态毒理学报, 2015, 10(5):141-149.
ZHOU J Y, WANG X L, LIANG X, et al. Aquatic life criteria for chlorothalonil in the Yangtze River Delta Region of China[J].AsianJournalofEcotoxicolog, 2015, 10(5): 141-149. (in Chinese with English abstract)
[25] 杨亚洲, 蔡磊明, 孟智启,等. 毒死蜱对稀有鮈鲫不同生命阶段的毒性效应[J]. 农药学学报, 2014, 16(1): 78-83.
YANG Y Z, CAI L M, MENG Z Q, et al. Toxicity effects of chlorpyrifos to different life stages of Chinese rare minnow (Gobiocyprisrarus)[J].ChineseJournalofPesticideScience, 2014, 16(1): 78-83. (in Chinese with English abstract)
[26] MARTIN T, OCHOU O G, VAISSAYRE M, et al. Organophosphorus insecticides synergize pyrethroids in the resistant strain of cotton bollworm,Helicoverpaarmigera(Hübner) (Lepidoptera: Noctuidae) from West Africa[J].JournalofEconomicEntomology, 2003, 96(2): 468-474.
[27] GUO D, WANG Y, QIAN Y, et al. Joint acute and endocrine disruptive toxicities of malathion, cypermethrin and prochloraz to embryo-larval zebrafish,Daniorerio[J].Chemosphere, 2017, 166: 63-71.
[28] SAWYER S J, GERSTNER K A, CALLARD G V. Real-time PCR analysis of cytochrome P450 aromatase expression in zebrafish: gene specific tissue distribution, sex differences, developmental programming, and estrogen regulation[J].GeneralandComparativeEndocrinology, 2006, 147(2): 108-117.
[29] 陈家长, 王泽镕, 裘丽萍,等. 西维因对雄性罗非鱼(GIFTOreochromisniloticus)内分泌干扰效应的研究[J]. 生态毒理学报, 2012, 7(6): 627-632.
CHEN J Z, WANG Z R, QIU L P, et al. Research on endocrine disrupting effect of carbaryl on male tilapia(GIFTOreochromisniloticus)[J].AsianJournalofEcotoxicolog, 2012, 7(6): 627-632. (in Chinese with English abstract)
[30] GRÜNFELD H T, BONEFELD-JORGENSEN E C. Effect ofinvitroestrogenic pesticides on human oestrogen receptor α and β mRNA levels[J].ToxicologyLetters, 2004, 151(3): 467-480.
[31] 楼钦钦, 田密, 秦占芬,等. 内分泌干扰物的非单一剂量-效应研究进展[J]. 生态毒理学报, 2013, 8(3): 295-305.
LOU Q Q, TIAN M, QIN Z F, et al. Research progress in non-monotonic dose-response of endocrine disruptors[J].AsianJournalofEcotoxicolog, 2013, 8(3): 295-305. (in Chinese with English abstract)

