瑞舒伐他汀对急性脑缺血再灌注大鼠脑含水量及海马区MG的影响
冯 涛
目前临床上最常见脑血管疾病(cerebrovascular disease,CVD)是急性脑梗死,其发病率占CVD约70%。近些年来随着影像技术及神经介入技术的广泛应用,急性脑梗死超早期血管再通、缺血再灌注对脑组织半暗带区域(Ischemic Penumbra,IP)神经元功能的恢复具有重要意义。脑缺血再灌注损伤也成为急性脑梗死后脑损伤常见病理过程。
脑缺血再灌注过程中,脑组织由缺血性改变转变为高灌注,血脑屏障的破坏,细胞内钙超载及兴奋性氨基酸(EAA)毒性作用,过度的免疫炎症反应,导致脑组织明显发生毒性水肿、神经元变性、功能丧失。小胶质细胞(microglia,MG)是脑内的主要免疫应答细胞,对维持脑内环境稳定具有重要意义。当脑内环境发生改变时,MG快速活化激活,分泌大量神经炎性因子,导致脑内自身免疫反应,对神经元产生毒性作用,加剧脑细胞水肿及神经元的损伤。
他汀类药物通过抑制三羟基三甲基戊二酰辅酶A还原酶(HMG-CoA),具有降低VLDL-C与LDL-C,升高HDL-C的作用。近些年来更多的基础及临床研究发现,他汀类药物具有独立影响血脂减轻免疫炎症反应,抑制MG过度表达的多效性作用。目前有关他汀类药物对MG表达影响研究较少,机制不完全清楚。本研究通过观察急性脑缺血再灌注损伤后大鼠脑含水量、海马区MG的表达和海马区神经元病理改变,以及给与瑞舒伐他汀干预后的变化,探讨他汀类药物脑保护作用机制。
1 材料与方法
1.1 材料
1.1.1 动物及分组 挑选雄性健康SD大鼠96只,清洁级,体重(210±20)g,郑州大学医学院实验动物中心供。实验SD大鼠在造MCAO模型前3 d带回实验室。避免刺激,实验室温度保持21~26 ℃,湿度适宜。自由进食水。随机将96只SD大鼠平均分正常大鼠为A组,假模型组为B组,模型组为C组,干预组为D组,每组分为24 h、72 h、7 d、14 d时间点,造模前禁食水。
1.1.2 药物与试剂 大鼠MCAO栓线购于北京沙东生物技术有限公司 。Ox42(MG的标志)抗体、SP9001试剂盒 、DAB试剂盒购于北京中杉生物工程公司 。多聚甲醛由天津市科密欧化学试剂有限公司提供。磷酸二氢钠由汕头市光华化学厂提供。采用德国Lecia显微照像系统采集图像,应用日本奥林巴斯光学显微镜。瑞舒伐他汀钙(瑞旨片,山东鲁南贝特制药有限公司),规格:5 mg/片,生产批号:H20080240。
1.2 方法
1.2.1 制备大鼠MCAO模型 SD大鼠大脑中动脉缺血再灌注(MCAO)模型采用改良Zea Longa[1,2]线栓法制备。实验前大鼠被禁食12 h、禁水4 h。腹腔注射10%水合氯醛(350 mg/kg)进行麻醉,备皮,消毒,铺巾,左颈正中旁切口,切开皮肤,分离皮下、肌肉组织及迷走神经。游离左颈总动脉(CCA),颈外动脉(ECA),颈内动脉(ICA),采用微型动脉夹夹闭CCA和ECA近心端,ECA远心端线扎,从ECA将线栓[线栓头直径(0.32±0.02) mm]插入ICA进颅方推进18~20 mm,到达大脑中动脉分叉处,放松微型动脉,局部缝合皮肤,外露栓线末端。2 h后线栓拔出4 mm行再灌注。
1.2.2 动物处理 正常大鼠组为雄性健康SD大鼠。假模型组大鼠仅在禁食12 h、禁水4 h、麻醉后切开皮肤,分离皮下组织后局部缝合皮肤。模型组即为MCAO大鼠,在造模型后给予生理盐水2 ml灌胃。干预组是在MCAO后即给于瑞舒伐他汀钙2 mg/kg(2 ml溶液)灌胃。各组大鼠实验结束用10%水合氯醛(350 mg/kg)腹腔注射深度麻醉,从左心室加压生理盐水灌洗、灌注4%多聚甲醛溶液固定,取脑,4%多聚甲醛液固定24 h,脱水,浸蜡,石蜡包埋,制石蜡冠状切片(厚度4 μm)。
1.2.3 指标检测
1.2.3.1 脑含水量测定 应用干湿重方法对大鼠脑含水量进行测定,脑含水量(%)=(脑湿重-脑干重) /脑湿重×100%。
1.2.3.2 免疫组织化学染色(SP法)步骤 采用二甲苯对石蜡冠状切片进行脱蜡2次,酒精脱蜡2次,蒸馏水清洗2次,柠檬酸修复液高温修复,低温维持,室温冷却。采用3%H2O2去离子水孵育,PBS液冲洗后滴加山羊血清封闭液,采用内源性生物素进行封闭。滴加一抗OX42抗体(1∶100稀释)4 ℃过夜。室温复温,PBS液冲洗,滴生物素二抗工作液,PBS液冲洗后滴辣根酶液,孵育,PBS液冲洗后滴加DAB显色剂,苏木素复染,水冲洗后混合液脱色,采用低到高浓度酒精脱水、封片。高倍镜(×400)下对大鼠海马区MG进行观测,阳性细胞呈现棕黄色染色改变,采集图像,分析阳性区平均积分光密度值。
1.2.3.3 HE染色步骤 石蜡冠状切片置烤箱30 min后脱蜡、复水、苏木素染色、分化、返蓝、复染、脱水、二级透明、封片,高倍镜(×400)下对大鼠海马区神经元进行观测。
2 结 果
2.1 大鼠脑含水量改变结果 A、B各组四个时间点通过干湿重法测定脑含水量无明显改变(P>0.05),D、C组大鼠在MCAO后24 h时脑含水量开始升高,72 h明显增加,7 d达到高峰,14 d明显下降,与A、B组进行比较分析,差异明显,具有统计学意义(P<0.05),D组24 h、72 h脑含水量与C组进行比较,脑含水量下降不明显,差异不明显,无统计学意义(P>0.05),7 d与14 d脑含水量与C组进行比较,脑含水量明显降低,差异明显,具有统计学意义(P<0.05),(见表1)。
2.2 大鼠海马区MG(OX42)的表达 A、B、C、D组大鼠各个时间点海马区MG均有表达。A、B组四个时间点通过免疫组化法测定MG的表达差异不明显(P>0.05)。D、C组大鼠在MCAO后24 h时MG表达开始增多,72 h表达增多明显,7 d表达达到高峰,14 d表达下降明显,与A、B组进行分析比较,差异具有统计学意义(P<0.05)。D组MG表达在4 h、72 h与C组分析比较,MG表达减少不明显,差异明显无统计学意义(P>0.05),MG表达在7 d与14 d与C组分析比较,MG表达减少明显减少,具有统计学意义(P<0.05),(见表2)。
2.3 大鼠海马区神经元HE染色结果 通过高倍镜对大鼠海马区神经元观察发现A、B组大鼠神经元在镜下未见明显的神经元变性坏死及空泡现象细。胞整齐排列,胞膜、胞核完整,胞浆清晰。C、D组大鼠神经元在镜下可见明显的神经元变性坏死及空泡现象。视野下细胞的数目明显减少,细胞排列及其不整齐,胞膜结构不完整、胞核浓缩,出现浑浊的胞浆,可见大量的神经元变性坏死,出现空泡现象。D组与C组相比,神经元数目明显增多,神经元变性程度及空泡现象明显减轻(见图1~图4)。
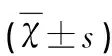
表1 四组大鼠脑含水量比较
注:与C组相比*P>0.05;与C组相比**P<0.05
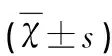
表2 四组大鼠海马区OX42平均积分光密度值
注:与C组相比*P>0.05;与C组相比**P<0.05

图1 A组海马区神经元HE染色(×400)
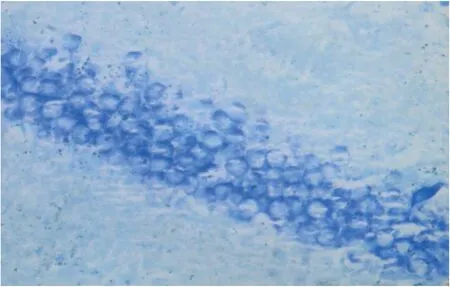
图2 B组海马区神经元HE染色(×400)

图3 C组海马区神经元HE染色(×400)

图4 D组海马区神经元HE染色(×400)
3 讨 论
急性脑梗死是临床上最常见的脑血管疾病,其致死率、致残率极高。脑内氧与葡萄糖储备量少,对缺血、缺氧敏感。完全中断3~5 min血流即可导致脑神经元不可逆损伤。已有资料研究发现[3],在急性脑梗死早期梗死区与IP区基本相同;3~4.5 h后一半的IP区再次转变为不可逆梗死区;6~8 h后IP区消失,全部转为不可逆梗死区[4]。因此及早开通脑内闭塞的动脉,对改善脑缺血半暗带(ischemic penumbra,IP)区域神经元的功能非常重要[5]。脑缺血再灌注对神经元也造成明显的损伤,即脑缺血再灌注损伤。脑缺血再灌注损伤的病理生理基础为炎症反应、氧自由基的大量生成、兴奋性氨基酸(EAA)毒性、神经元胞内钙超载、血脑屏障损伤、线粒体衰减、细胞抗凋亡基因及凋亡基因的失衡、脑水肿、小胶质细胞大量活化等[3]。其中炎症反应的标志是小胶质细胞激活[6],导致血管内皮细胞通透性增高,加剧缺血区缺血缺氧,刺激更多的氧自由基及缩血管物质生成等,加速缺血坏死区范围[7]。因此控制脑缺血再灌注过程中的炎症反应,抑制小胶质细胞的过度激活,可以保护神经元,降低脑缺血再灌注损伤程度,成为临床上治疗缺血性脑血管病新的治疗方法[8,9]。
他汀类药物多效性是指除了其降脂作用外的作用,主要有减轻免疫炎症反应,抑制血管紧张素Ⅱ受体,减少血管内皮素(ET)分泌,抑制金属基质蛋白酶活性,并具有抑制血小板活化等作用。研究表明[10]他汀类药物的多效性是其抑制胆固醇生物合成通路中间产物异戊二烯类的合成,上调一氧化氮合酶(eNOS)水平,提高一氧化氮(NO)活性,改变血管内皮功能,减少核转录因子kB表达,降低炎症因子C反应蛋白的水平[11],抗血管内膜炎症,稳定及固定动脉粥样硬化斑块,是他汀类药物广泛应用于临床上治疗心脑血管疾病治疗病理生理的基础。
他汀类药物抗炎可能与其抑制P-selectin、细胞粘附分子-1(VCAM-1)、E-selectin等表达,下调内皮素-1(endothelin-1)和血栓调节蛋白(thrombomodulin),抑制基质金属蛋白酶(MMP-2、MMP-9)与炎性反应因子激活等,抑制以 NF-κB 为核心炎症反应通路来发挥作用[12]。本实验通过瑞舒伐他汀对急性脑缺血再灌注损伤大鼠脑含水量及海马区小胶质细胞影响结果发现,瑞舒伐他汀能明显减轻急性脑缺血再灌注损伤大鼠脑含水量,抑制小胶质细胞的过度表达,减轻炎症反应。对大鼠海马区神经元HE染色也表明瑞舒伐他汀干预后神经元损伤明显减轻,凋亡细胞及空泡明显减轻,残存神经元数目比未经瑞舒伐他汀干预的大鼠明显增多。充分表明瑞舒伐他汀能明显降低急性脑缺血再灌注损伤,具有脑保护作用。
[参考文献]
[1]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[2]谢惠芳,徐如祥,陈中灿. 线栓法制作大鼠局灶性脑缺血再灌注损伤模型的改进[J]. 中华神经医学杂志,2007,6(4):340.
[3]杨佳丹,董 志. 脑缺血再灌注损伤的病因学研究进展[J]. 中国康复医学杂志,2006,21(10):935-938.
[4]李建章. 神经科医师手册[M]. 北京:人民卫生出版社,2010.161-183.
[5]Hata R,Maeda K,Hermann D,et al. Evolution of brain infarction after transient focal cerebral ischemia in mice[J]. J Cereb Blood Flow Metab,2000,20(6):937-946.
[6]雷万龙,袁群芳,张怀波,等. 慢性局灶性脑缺血区小胶质细胞/吞噬细胞呈持续性反应[J]. 中国病理生理杂志,2002,18(3):295-298.
[7]雷万龙,袁群芳,张怀波,等. 脑缺血性半影区胶质细胞和神经元重组的形态学观察[J]. 中山医科大学学报,2002,23:29-32.
[8]Chen B,Liao WQ,Xu N,et al. Adiponectin protects against cerebral ischemia- reperfusion injury through anti-inflammatory action [J ]. Brain Res,2009,1273(3):129-137.
[9]李 军,娄季宇,杨霄鹏. 雌激素对大鼠脑缺血再灌注损伤脑组织NF-κB、iNoS表达和细胞凋亡的影响[J]. 中国实用神经疾病杂志,2009,18:15-16.
[10]Lanfs U,Liao JK. Isoprenoid metabolism and the pleiot ropic effects of statins[J]. Curr Atheroscler Rep,2003,5(5):372-378.
[11]Veillard NR,Mach F. Statins:the new aspirin[J]. Cell Mol Life Sci,2002,59(11):1771-1786.
[12]金卫篷,王 彬,赵子龙,等. 阿托伐他汀对颅脑损伤大鼠内皮祖细胞和神经功能的影响[J]. 天津医药,2013,41(5):465-467.

