茵栀黄口服液对非酒精性脂肪性肝炎大鼠肝脂肪变的保护作用研究*
刘晓琳,信丰智,杨蕊旭,赵泽华,周达,潘勤,范建高
NAFLD包括单纯性非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)[1-2]。虽然前者可通过饮食控制和运动锻炼来逆转,但NASH有进展为肝硬化和肝细胞癌的风险[3]。茵栀黄口服液的主要成分是茵陈、栀子、黄芩和金银花的提取物,具有清热解毒、退黄、降酶的功效[4-6]。茵栀黄口服液在临床上被广泛用于自身免疫性肝炎和新生儿黄疸等疾病的治疗[7]。有研究报道,在四氯化碳诱导的急性肝损伤小鼠和卡介苗联合脂多糖诱导的免疫性肝损伤小鼠,茵栀黄口服液均可有效地降低血清转氨酶和胆红素水平[8-10]。本研究旨在观察茵栀黄口服液对蛋氨酸胆碱缺乏(methionine and choline deficient,MCD)饮食诱导的NASH大鼠血清学和肝组织病理学变化的改善情况。
1 材料与方法
1.1 动物模型的制备 30只6周龄SD大鼠购自上海斯莱克实验动物有限责任公司,标准饲料和MCD饲料购自江苏南通特洛菲饲料科技有限公司,茵栀黄口服液由华润三九医药股份有限公司提供。将30只大鼠随机分为对照组、MCD组和茵栀黄组,每组10只,饲养于上海睿太莫斯生物科技有限公司,动物房恒温(24℃±2℃)、恒湿(50%±5%),动物自由进食水。在动物房适应性饲养1 w,给予对照组大鼠标准饲料、给予其余两组大鼠MCD饲料喂养。在第4 w末,分别给予MCD组和茵栀黄组大鼠生理盐水和茵栀黄口服液灌胃(15 ml·kg-1),1 次 /d,持续至第8 w末,期间每周测量体质量。在第8 w末,将大鼠隔夜禁食后称质量,给予戊巴比妥钠麻醉,采用眼底静脉丛取血法采集血液,静置凝固后,3000 g离心10 min,收集血清,分装后置于-80℃冰箱保存。同时,迅速剪下完整的肝脏,称取肝质量,切取0.5×0.5×0.5 cm大小的肝组织,置于10%福尔马林溶液中固定,剩下的肝组织置于液氮中冻存。
1.2 肝组织病理学检查 根据NAFLD活动度积分(NALFD activity score,NAS)和纤维化评分对大鼠肝组织病理学特征进行评分,其中包括肝细胞脂肪变(0~3分)、小叶内炎症(0~3分)、肝细胞气球样变(0~2分)和肝纤维化(0~4分)。当NAS<3分,排除NASH,NAS>4分确诊为 NASH,NAS=3或4分,为临界NASH[11]。
1.3 血清生化指标检测 使用全自动生化分析仪检测。
1.4 统计学分析 计量资料以±s表示,采用单因素方差分析,两两比较采用SNK检验;计数资料采用卡方检验。应用SPSS 16.0软件进行数据分析,应用GraphPad Prism 6.0软件进行统计学作图。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠体质量和肝指数比较 MCD饲料喂养大鼠体质量逐渐降低(图1A)。至第8 w末,MCD组大鼠体质量为(155.8±3.1)g,显著低于对照组的(487.2±6.5)g,而茵栀黄口服液灌胃对MCD大鼠体质量无显著的影响(图1B);在第8 w末,MCD组大鼠肝指数为(5.09±0.19)%,显著高于对照组的【(2.92±0.06)%,P<0.05】;茵栀黄治疗组大鼠肝指数为(4.47±0.18)%,显著低于 MCD 组(P<0.05),但仍高于对照组(P<0.05,图 1C),提示茵栀黄口服液可显著改善MCD大鼠肝指数水平。
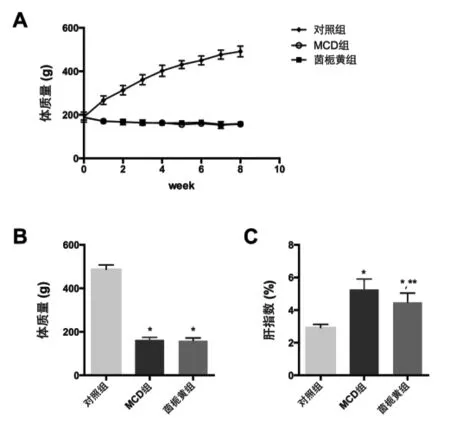
图1 各组大鼠体质量和肝指数变化比较
2.2 各组大鼠肝组织病理学变化的比较 在第8 w末,MCD组大鼠肝组织肝细胞呈大泡性脂肪变和炎症细胞浸润,而茵栀黄处理组大鼠肝组织病变明显缓解;MCD组大鼠肝组织出现轻度肝纤维化,而茵栀黄组肝纤维化程度减轻。MCD组大鼠肝脏脂肪变评分都为3分,气球样变评分都为2分,小叶内炎症明显,因此MCD组大鼠都被诊断为NASH。与MCD组比,茵栀黄灌胃组大鼠肝脏脂肪变评分改善,肝细胞气球样变评分显著降低,小叶炎症评分显著降低(表1)。MCD组NAS积分显著升高,而茵栀黄灌胃组则明显降低)。MCD组肝纤维化评分显著升高,而茵栀黄组显著低于MCD组(图2)。

图2 各组大鼠肝组织病理学表现
表1 各组大鼠肝组织病理学评分(±s)比较

表1 各组大鼠肝组织病理学评分(±s)比较
与对照组比,①P<0.05;与 MCD 组比,②P<0.05
?
2.3 各组大鼠血清生化指标比较 因为本研究使用的动物模型为营养缺乏模型,不具有临床NAFLD患者典型的血脂血糖代谢紊乱表现,所以在该研究中尚未发现茵栀黄口服液对血脂和血糖的显著改善作用(表2),提示茵栀黄口服液可以显著降低MCD大鼠血清转氨酶水平,而对血脂和血糖的影响可能需要高脂诱导的动物模型来证实。
3 讨论
本研究采用MCD饮食诱导NASH大鼠模型,探讨了茵栀黄口服液对于肝脂肪变大鼠的治疗作用,发现茵栀黄口服液可以减轻MCD处理大鼠肝指数,改善NASH的肝脏脂肪变、肝细胞气球样变、小叶炎症和纤维化,同时降低NASH大鼠血清ALT和AST水平。
表2 各组大鼠血生化指标(±s)比较

表2 各组大鼠血生化指标(±s)比较
与对照组比,①P<0.05;与 MCD 组比,②P<0.05
?
现代药理学的多项研究结果提示,茵栀黄的主要成分茵陈可促进胆汁酸分泌和排泄,主要用于治疗黄疸[12];栀子苷具有凉血解毒、促进胆汁分泌和活血化瘀的作用[13];黄芩中的黄芩苷可以抑制脂质过氧化反应,促进胆囊收缩[14];金银花自古被誉为清热解毒的良药,其中的黄酮可以抗病毒、抗氧化、减轻肝细胞损伤[15]。因此,茵栀黄口服液可以促进胆汁的分泌和排泄,直接参与酶的激活进而影响糖类、脂肪和蛋白质的代谢,同时促进肝脏再生、维持肝细胞的完整性,使其免遭脂质过氧化物的损伤[16]。
肝脏脂肪变、气球样变和小叶炎症(伴或不伴纤维化)是非酒精性脂肪性肝病最典型的病理学特征。我们首次发现茵栀黄口服液可以使MCD诱导大鼠的肝脏脂肪变程度减轻,提示该药物对于NASH的肝脏脂肪变具有一定的治疗疗效,这是在其他研究中尚未有报道的。另外,我们的研究也首次发现了茵栀黄口服液可以使MCD大鼠的肝细胞气球样变出现一定程度的减轻。同时,与我们的研究结果类似,来自南方医科大学的团队研究发现,茵栀黄口服液可以显著改善肝内胆汁淤积大鼠肝脏炎症细胞浸润和坏死性改变,提示茵栀黄口服液可以显著改善肝病大鼠的肝内炎症[17]。我们的研究发现茵栀黄口服液可减轻MCD诱导大鼠的肝脏小叶内炎症,提示该药也可以用于治疗NASH的肝内炎症。有文献报道茵栀黄口服液可以用于辅助治疗新生儿胆道闭锁,减少患儿肝纤维化的发生[18],而目前尚未有茵栀黄口服液对NAFLD诱导的肝纤维化治疗有效的报道。我们的研究发现,茵栀黄口服液缓解MCD诱导大鼠的肝脏纤维化的效果非常显著,给予MCD诱导大鼠茵栀黄口服液灌胃后,其肝脏纤维化程度几乎可恢复至正常,提示该药物对NASH大鼠肝脏纤维化病变有一定的治疗效果。
已有临床研究发现,茵栀黄口服液可以改善脂肪肝以及NAFLD患者的血清学指标[6,19]。与这两项研究结果类似,我们也观察到茵栀黄口服液可以显著改善MCD诱导大鼠血清ALT和AST水平,但是我们没有观察到该药对大鼠血清糖脂代谢指标(包括 TC、TG、HDL、LDL和 FBG)有影响。原因可能是因为我们采用的MCD诱导大鼠模型为蛋氨酸和胆碱缺乏的动物模型,虽然可见明显的肝细胞脂肪变和肝内炎症,但其体质量显著下降,不具有临床NAFLD患者能量过剩状态以及胰岛素抵抗和血脂紊乱的特征,所以无法完全模拟临床NAFLD患者的代谢紊乱状态。研究发现茵栀黄口服液可以调控炎症介质和抑制氧化应激,临床上已经被广泛地用来治疗新生儿黄疸[20],但是我们的研究没有观察到其对血清TBIL的显著改善作用,可能与我们使用的MCD诱导大鼠模型和治疗时间短有关。本研究使用MCD饲料喂养的大鼠不是典型的胆汁淤积动物模型,所以不具备显著的胆红素水平升高的表现,给予MCD诱导大鼠茵栀黄口服液灌胃治疗后,可看到动物血清TBIL水平下降,但与其他组比无统计学意义。因临床上使用中药治疗的疗程一般较长,因此延长治疗时间可能会使MCD诱导大鼠血清胆红素下降。
综上所述,我们的研究发现,茵栀黄口服液可以改善MCD诱导的NASH大鼠的肝脏脂肪变、气球样变、小叶炎症和肝纤维化,降低NASH大鼠血清转氨酶水平,但未能证实茵栀黄口服液对NASH大鼠血脂和血糖有显著的影响,后续研究可以通过高脂饲料诱导的大鼠模型来进一步探索和验证茵栀黄口服液对NAFLD动物糖脂代谢的影响。
【参考文献】
[1]Younossi ZM,Koenig AB,Abdelatif D,et al.Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence,incidence,and outcomes.Hepatology,2016,64(1):73-84.
[2]赵泽华,范建高.2016年美国肝病年会非酒精性脂肪性肝病深度报道. 实用肝脏病杂志,2017,20(1):21-24.
[3]Fan JG,Kim SU,Wong VW.New trends on obesity and NAFLD in Asia.J Hepatol,2017,67(4):862-873.
[4]赵文霞,张丽慧.合理应用中成药治疗非酒精性脂肪性肝病.实用肝脏病杂志,2017,20(2):132-134.
[5]李红山,冯琴,胡义扬,等.脂联素及其受体在脂肪肝病理机制中的意义及中药干预作用.中华肝脏病杂志,2009,17(11):826-830.
[6]刘晓琳,范建高.2017年亚太地区肝病年会非酒精性脂肪性肝病研究报道.实用肝脏病杂志,2017,20(3):Ⅲ.
[7]Yoon M,Kim MY.The anti-abgiogeni herbal composition Ob-X from morus alba,melissa officinalis,and artemisia capillaries obesity in genetically obese ob/obmice.Pham Biol,2011,49(6):614-619.
[8]Chen X,Krakauer T,Oppenheim JJ,et a1.An injectable multicomponentchinese herbal medicine,is apotentinhibitorof T-cellactivation.J Altern ComplementMed,2004,10(3):519-526.
[9]Liu LL,Gong LK,Wang H,et al.Baicalin protects mouse from concanavalin A-induced liver injury through inhibition of cytokine production and hepatocyte apoptosis.Liver Int,2007,27(4):582-591.
[10]闻淑军.茵栀黄口服液治疗非酒精性脂肪肝的临床疗效研究.世界中西医结合杂志,2015,13(11):1212-1214.
[11]Kleiner DE,Brunt EM,Natta MV,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease.Hepatology,2005,41(6):1313-1316.
[12]Hutton EK,Hassan ES.Late vs early clamping of the umbilical cord in full-term neonates:systematic review and metaanalysis of controlled trials.J Am Med Asso,2014,297(11):124l-1252.
[13]Liang H,Zhang L,Wang H,et al.Inhibitory effect of gardenoside on free fatty acid-induced steatosis in HepG2 hepatocytes.Int J Mol Sci,2015,16(11):27749-27756.
[14]Dong Q,Chu F,Wu C,et al Scutellaria baicalensis georgi extract protects against alcohol-induced acute liver injury in mice and affects the mechanism of ER stress.Mol Med Rep,2016,13(4):3052-3062.
[15]Wang MY,Srinivasan M,Dasari S.Antioxidant activity of yichun blue honeysuckle(YBHS) berry bounteracts CCl4-induced toxicity in liverinjury modelofmice.Antioxidants (Basel),2017,6(3):1-11.
[16]Zeng J,Wang SJ,Li YM,et al.Yinzhihuang oral liquid in the treatmentofneonataljaundice:a meta-analysis.Pharm Biol,2017,55(1):554-559.
[17]Ou QQ,Qian XH,Li DY,et al.Yinzhihuang attenuates ANIT-induced intrahepatic cholestasis in rats through up-regulation of mrp2 and bsep expressions.Pediat Res,2016,79(4):589-595.
[18]李腾,齐利峰,于爱真.茵栀黄口服液辅助治疗新生儿胆道闭锁21 例疗效研究.中国药业,2014,15(16):109-111.
[19]Gao Y,Song LX,Jiang MN,et al.Effects of traditional Chinese medicine on endotoxin and its receptors in rats with non-alcoholic steatohepatitis.Inflammation,2008,31(2):121-132.
[20]Chen SP,Tian LL,Liu FL.Clinical observation of Yinzhihuang oral liquid on prevention of the premature infantile jaundice.Chin J Integrat Med,2009,15(4):299-302.

