儿童难治性癫痫18F-FDG PET/CT皮层下结构影像学分析
范 岩,佟正灏,张建华,邸丽娟,张旭初,付占立,王彦福,陈立新,王荣福
(北京大学第一医院核医学科,北京 100034)
大脑皮层与皮层下结构存在广泛而复杂的神经网络通讯,皮层病变可导致皮层下结构发生功能性变化;其中较为常见的是交叉性小脑机能联系不能(crossed cerebellar diaschisis, CCD),主要表现为大脑皮层病变对侧小脑出现血流、代谢抑制。CCD可由多种原因引起,以脑血管病最常见[1]。癫痫患者皮层下结构(纹状体、丘脑、小脑)可出现血流或代谢异常[2-3]。目前国内外对于儿童癫痫群体皮层下改变的系统研究尚少。本研究观察儿童难治性癫痫患者18F-FDG PET/CT皮层下结构影像学表现,探寻其机制、特点以及对于评估癫痫病灶的意义。
1 资料与方法
1.1 一般资料 回顾性分析2014年3月—2017年7月我院接受脑部18F-FDG PET/CT 检查的611例难治性癫痫患儿,男392例,女219例,年龄5个月~14岁,平均(5.4±3.6)岁。排除标准:①年龄>14岁;②PET/CT未发现脑部代谢异常。
1.2 仪器与方法18F-FDG由原子高科股份有限公司提供,放化纯度>95%。显像仪器为Philips Gemini GXL PET/CT扫描仪。显像前患儿禁食4~6 h,测量血糖、身高、体质量,控制血糖水平<6.7 mmol/L。给药前嘱患儿安静休息,并进行视听封闭,直到检查结束,对不能配合患儿同时给予水合氯醛镇静剂(0.5 ml/kg体质量)。静脉注射18F-FDG 3.7 MBq/kg体质量,45~60 min后采集脑部图像。PET扫描采集1个床位,10分钟/床位,矩阵128×128。应用CT数据进行衰减校正,CT扫描电压120 kV,电流100 mA,扫描层厚2 mm。图像重建成轴位、冠状位、矢状位断层图像,并获得PET与CT融合图像。
1.3 图像分析 由2名副主任医师及以上职称核医学医师共同阅片,意见不一致时参考第3名核医学医师(副主任医师及以上职称)意见决定,分析患儿大脑皮层代谢异常区域,同时观察皮层下结构(基底核、丘脑及小脑)影像学改变。选用16色色阶观察PET图像。异常判断标准:大脑皮层病变影像分析以对侧和/或相邻皮层为参照,皮层放射性分布明显低于或高于参照区,色阶差≥2个色阶时判断为异常;对皮层下结构主要行双侧对比分析,当放射性摄取不对称、一侧显著低于或高于对侧、且色阶差≥2个色阶时,判断为异常。
1.4 分组 根据年龄将患儿分为3组:低龄组(≤3岁)226例、中龄组(>3~<7岁)180例、大龄组(≥7岁)205例;根据皮层异常累及脑叶数,将单侧大脑皮层代谢异常患儿分为轻度组(皮层代谢异常区域累及1~2个脑叶)和重度组(皮层代谢异常区域累及≥3个脑叶)。
1.5 大脑皮层与皮层下结构代谢异常改变状态一致性分析 大脑皮层代谢异常可表现为减低和增高,分别观察大脑皮层下结构代谢改变状态与皮层异常状态的一致性。
1.6 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,计数资料以率(%)表示。采用χ2检验比较不同组别大脑皮层下结构代谢异常的发生率。P<0.05为差异有统计学意义。
2 结果
611例中,525例(525/611,85.92%)单侧大脑皮层发现异常代谢灶,86例(86/611,14.08%)双侧大脑皮层代谢异常。29例(29/611,4.75%)大脑皮层病灶表现为高代谢,582例(582/611,95.25%)大脑皮层病灶表现为代谢减低。
工作室的成立是来自专业的发展情况和教师的专业方向,再来学生可以自己选择工作室,所以各种实践项目紧贴着行业和专业的发展方向,教师在项目中不断引进新的项目,使得教学内容的更新速度得到提高。此时,项目成为一种检验教学成果的利器,有效地扩大了项目化教学的范围。
611例中,190例(190/611,31.10%)大脑皮层下结构代谢发生改变,基底核64例、丘脑113例、小脑105例,发生率分别为10.47%(64/611)、18.49%(113/611)和17.18%(105/611);其中187例单侧大脑皮层代谢异常,3例双侧大脑皮层代谢异常。大脑皮层下结构代谢异常在大脑皮层单侧病变患儿中的发生率为35.62%(187/525),远高于双侧大脑皮层异常患儿(3.49%,3/86)。不同年龄组大脑皮层下结构代谢异常发生率差异无统计学意义(P均>0.05),见表1。
从国内外的实践来看,高校人才培养的协同创新主要分为内部和外部两个方面。内部协同主要是指高校内部各部门、各专业之间知识、技能以及资源等的共享,没有形成学校与学校之间的资源共享;外部协同主要是指产学研的创新合作,特别是高校和单一企业之间的深度融合,没有形成基于行业的协同共建。共享型人力资源管理平台的构建,就是要解决复杂的多主体之间的对接矛盾,优化企业需求与高校人才培养之间的关系。

表1 各年龄组难治性癫痫患儿大脑皮层下结构代谢异常发生率比较[例(%)]
525例单侧大脑皮层代谢异常中,轻度组247例(247/525,47.05%),重度组278例(278/525,52.95%),重度组大脑皮层下结构代谢异常发生率明显高于轻度组(P均<0.001;表2、图1);基底核(61/63,96.83%)、丘脑(105/109,96.33%)代谢异常主要出现在同侧,而小脑(95/102,93.14%)代谢异常改变以对侧为主。
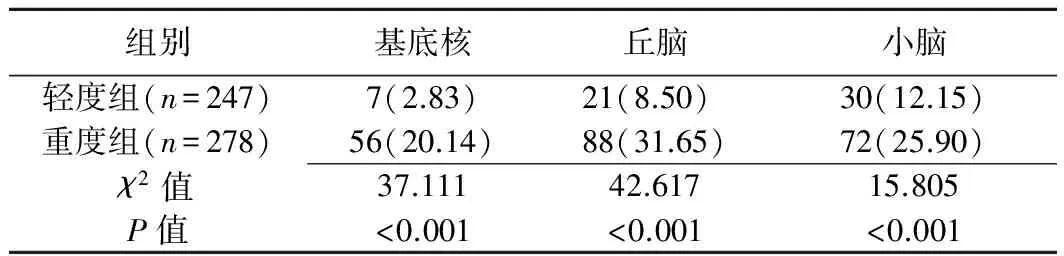
表2 不同程度难治性癫痫单侧大脑皮层病变患儿皮层下代谢异常发生率的比较[例(%)]
大脑皮层病灶表现为高代谢的29例患儿中,10例出现皮层下代谢改变,包括基底核4例、丘脑5例及小脑8例;除1例患儿表现为对侧小脑代谢减低外,其他皮层下改变均呈代谢增高,与皮层代谢状态一致(图1、2)。另外大脑皮层病灶代谢减低的582例患儿中,皮层下结构代谢均呈减低表现。
3 讨论
本组190例伴皮层下结构代谢异常,而不同年龄组大脑皮层下结构代谢异常比较差异无统计学意义(P均>0.05),提示大脑皮层与皮层下结构的神经通讯网络在婴儿出生后不久就已基本形成。研究[1,11]发现,人类神经传导纤维束尚需要逐步发育成熟,故与成人相比,儿童皮质-皮层下通路损害后恢复较好。癫痫患者皮层癫痫灶同侧丘脑、基底核(如纹状体)及对侧小脑出现代谢异常,与神经通路的传导特点有关[12]。皮质-脑桥-小脑(cortical-ponts-cerebellum, CPC)纤维束起源于额顶叶皮质,经同侧脑桥下行至对侧小脑,CPC通路受损,导致CCD,即一侧大脑皮层损伤时,对侧小脑功能和代谢减低。本研究中,皮层下结构代谢异常发生的部位和侧别符合上述特点,与既往研究[12-14]结果相似。有学者[5]报道病程较长的颞叶、额叶癫痫及继发性癫痫患者皮层下结构更易出现代谢改变,并发现继发全身性发作的癫痫患者丘脑代谢减低更为明显,提示丘脑可能是参与癫痫继发全身发作的重要结构。青浩渺等[15]发现颞叶癫痫患者术前基底核和丘脑代谢减低可能是颞叶切除手术疗效不佳的危险因素;而CCD的发生取决于幕上血流减低区域的位置及血流减低程度[16]。本研究中重度组患儿大脑皮层下结构代谢异常发生率明显高于轻度组,提示皮层损伤范围越大,神经投射路径和网络传导受到的影响越明显,故皮层下结构异常代谢改变可间接提示皮层病变的受累范围。
大脑皮层下结构包括基底核、丘脑、间脑、脑干、小脑等神经组织,大脑皮层与皮层下存在着广泛而密切的联系网络和信息环路[1]。多项研究[2-4]发现大脑皮层病理改变可伴发皮层下组织结构功能和代谢变化,可能是由于皮层神经元损伤,引起神经投射路径和神经网络传导部位继发性神经组织血流减慢,从而导致远隔部位功能减低[5-6];这种改变常见于脑血管病和癫痫患者[1,7]。目前对于儿童患者的相关研究较少。影像学方法是观察皮层下结构功能性改变的有效手段,如PET、SPECT、MRI及CT灌注成像[7-9]。18F-FDG PET可观察脑内葡萄糖代谢水平,无创且敏感度较高,已成为术前定位致痫灶的主要手段之一。研究[10]发现,采用18F-FDG PET/CT观察皮层下结构功能代谢改变具有独特优势。

图1 患儿女,2岁5个月,癫痫病程2年 18F-FDG PET/CT示右侧额、顶、颞叶多发葡萄糖代谢减低区(箭头),左侧小脑代谢减低(箭) 图2 患儿女,7岁4个月,癫痫病程3个月,Rasmussen脑炎 18F-FDG PET/CT示左侧大脑半球大范围葡萄糖代谢增高病灶(箭头),左侧基底核、左侧丘脑、右侧小脑代谢增高(箭)
在18F-FDG PET中,大脑皮层病灶在癫痫发作期表现为代谢增高,在发作间期则为代谢减低。有学者[11,17]发现少数癫痫患者患侧皮层的对侧小脑半球可呈葡萄糖高代谢。本组中大脑皮层病灶与皮层下结构代谢异常状态表现一致,29例大脑皮层病灶代谢增高患儿中,10例皮层下结构代谢异常,除1例对侧小脑代谢减低外,其他皮层下结构改变均呈代谢增高;分析原因,可能是皮层病灶处于频繁放电期,代谢增高,通过神经通路下传的激动也同样增多。本组1例右侧额叶出现高代谢灶,而左侧小脑表现为代谢减低,该患儿基底核和丘脑的代谢未见异常,其原因尚不清楚。
水下机器人的LiFi通信数据如图10所示,由示波器显示可知,在时隙频率为 100 kHz 时水下联调时发射端(示波器通道2)与接收端(示波器通道1)的信号输出波形对比。可以发现,接收端的脉冲与发射端相应的脉冲一致,无延迟和丢包的现象。实验表明水下机器人之间的协调作业通过LIFI通信不仅能够避免因干扰带来的数据丢失和错误的问题,还能够提高信号传输的效率和安全性。
本研究的局限性:采用肉眼观察和色阶参照法分析皮层下各结构图像结果依靠读片医师的经验,可能存在偏倚;未针对不同脑叶、癫痫发作类型、起病年龄、病程及病理类型等多种因素对皮层下结构代谢可能产生的影响作进一步分析。
[参考文献]
[1] Poretti A, Boltshauser E. Crossed cerebro-cerebellar diaschisis. Neuropediatrics, 2012,43(2):53-54.
[2] Graffeo CS, Snyder KA, Nasr DM, et al. Prognostic and mechanistic factors characterizing seizure-associated crossed cerebellar diaschisis. Neurocrit Care, 2016,24(2):258-263.
[3] Ahn HS, Kim KK. Two cases of crossed cerebellar diaschisis with or without thalamic lesion on brain MRI in status epilepticus. J Epilepsy Res, 2014,4(2):74-77.
[4] 崔瑞雪,牛娜,张颖,等.18F-FDG PET显像鉴别阿尔茨海默病与额颞叶痴呆临床价值.中国现代神经疾病杂志,2014,14(3):214-221.
[5] Benedek K, Juhász C, Muzik O, et al. Metabolic changes of subcortical structures in intractable focal epilepsy. Epilepsia, 2004,45(9):1100-1105.
[6] 王潇,程敬亮,张勇.交叉性小脑神经机能联系不能的相关研究及最新进展.磁共振成像,2016,7(5):388-395.
[7] 刘静怡,曹杰,张吴琼,等.交叉性小脑神经机能联系不能发病机制及临床常见相关疾病.中风与神经疾病杂志,2017,34(6):572-573.
[8] 王茂雪,张志强,王正阁,等.磁敏感加权成像观察特发性全面癫痫患者皮层下核团铁含量改变.中国医学影像技术,2012,28(5):852-855.
[9] Huang YC, Weng HH, Tsai YT, et al. Periictal magnetic resonance imaging in status epilepticus. Epilepsy Res, 2009,86(1):72-81.
[10] 梁英魁,川玲,赵文锐,等.脑内原发淋巴瘤致交叉性小脑神经机能联系不能的18F-FDG PET/CT表现.中国医学影像技术,2009,25(2):294-296.
[11] Shamoto H, Chugani HT. Glucose metabolism in the human cerebellum: An analysis of crossed cerebellar diaschisis in children with unilateral cerebral injury. J Child Neurol, 1997,12(7):407-414.
[12] Sperling MR, Gur RC, Alavi A, et al. Subcortical metabolic alterations in partial epilepsy. Epilepsia, 1990,31(2):145-155.
[13] Ferilli MAN, Brunetti V, Costantini EM, et al. Left hemispheric status epilepticus with crossed cerebellar diaschisis. J Neurol Neurosurg Psychiatry, 2018,89(3):311-312.
[14] 张旭,张亚锐,胡莹莹,等.(18)F-FDG PET/CT对脑转移瘤所致交叉性小脑神经机能联系不能的研究.中山大学学报(学科学版),2013,34(6):938-942.
[15] 青浩渺,崔瑞雪,窦万臣,等.颞叶癫痫患者术前颞叶外低代谢与手术疗效的相关性分析.中华核医学与分子影像杂志,2015,35(1):18-21.
[16] Sommer WH, Bollwein C, Thierfelder KM, et al. Crossed cerebellar diaschisis in patients with acute middle cerebral artery infarction: Occurrence and perfusion characteristics. J Cereb Blood Flow Metab, 2016,36(4):743-754.
[17] 牛娜,崔瑞雪,张颖,等.脑电监测在癫痫患者间期皮层和皮层下高代谢灶判读中的研究.协和医学杂志,2015,6(1):18-23.

