甲状腺乳头状癌淋巴结转移的超声影像组学特征与侵袭性蛋白质的相关性
周世崇,童宇洋,黄云霞,刘桐桐,周 瑾,余锦华,郭 翌,汪源源,李佳伟,常 才,陈 敏
1.复旦大学附属肿瘤医院超声诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学电子工程系,上海 200433;
3.上海市医学图像处理与计算机辅助手术重点实验室,上海 200433
近年来兴起的影像组学认为,肿瘤基因的异质性表现为外在的异质特征,异质性越大则预后越差[1]。通过高通量地从放射影像中提取大量高级定量影像学特征,由人工智能系统进行异质特征评估,最终可掌握肿瘤的恶性进展情况[2-3]。本课题组基于甲状腺乳头状癌(papillary thyroid carcinoma,PTC)的超声影像学资料开发了一套预测PTC淋巴结转移的超声影像组学系统[4],临床验证准确率达73.1%。淋巴结转移是肿瘤细胞侵袭性的临床表现,而肿瘤细胞的侵袭性来自肿瘤基因表达和蛋白质功能。因此,本研究尝试分析现有超声影像组学体系的异质影像学特征与肿瘤组织内侵袭性蛋白质之间的关系,以阐明影像组学异质影像学特征的分子生物学基础。
1 资料和方法
1.1 临床资料
收集2017年10月—2017年12月于复旦大学附属肿瘤医院接受手术的患者。入组条件:术前于复旦大学附属肿瘤医院行超声检查,并留有图像;无论超声或CT提示有无淋巴结转移,均行可疑区域颈部淋巴结清扫;术后获取病理结果证实为单灶性PTC。超声检查由不同年资的主治医师完成。癌灶大小以超声检查时相应的病灶测量大小为准,测量3个径线。按世界卫生组织(World Health Organization,WHO)标准[5],最大径线≤10 mm的PTC为甲状腺乳头状微癌(papillary thyroid microcarcinoma,PTMC),最小径线>10 mm的PTC为非PTMC。收集患者的年龄、性别及术后淋巴结病理结果。
1.2 影像组学分析方法
在原有超声影像组学预测PTC淋巴结转移系统研究的基础上[4],经过100次自举法和十折交叉验证后,选出50个拥有最好表现的特征,组成最优特征集。十折交叉验证,即将全部入组病例的超声图像随机分成10份,其中9份作为训练集,1份作为验证集,随机100次,取结果的平均值。将最优特征集输入支持向量机(support vector machine,SVM)分类器中,采用径向基函数(radial basis function,RBF)作为核函数,通过交叉验证后建立基于单图甲状腺肿瘤超声图像的淋巴结转移预测模型。将其制作成界面软件,只要输入患者相关资料及超声图像,即可得到预测结果(图1)。使用影像组学方法预测的人员事先不被告知病例的分组结果,即不知道具体的淋巴结转移情况。得到预测结果后,计算各项特征在两组病例中的表达。
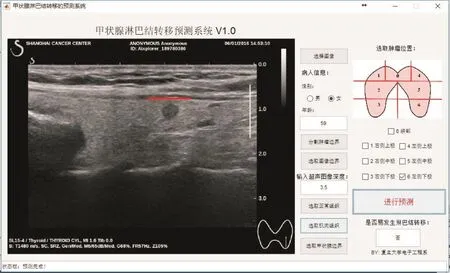
图 1 PTC淋巴结转移预测系统界面
1.3 蛋白质组学分析方法
30例病例均取约1 mm×1 mm×1 mm大小的病灶组织块,使用相对和绝对定量的等量异位标签法(isobaric tags for relative and absolute quantitation,iTRAQ)进行蛋白质定量检测。首先,从样本中提取蛋白质,进而酶解为肽段,然后使用iTRAQ试剂标记肽段并等量混合,通过高pH反相液相色谱(high-pH reversedphase liquid chromatography,high-pH-RPLC)进行预分离,通过液相色谱串联质谱(liquid chromatography coupled with tandem mass spectrometry,LC-MS/MS)分析,得到样本全部蛋白质。将所得蛋白质与TGCA数据库中已有数据进行比对,检测高突变率蛋白质的分布情况。进一步使用DAVID、UNIPORT、Cytoscape等蛋白质组学软件,从biological process、cellular component、biological pathway、molecular function、protein domain、site of expression等多方面筛选PTC侵袭性蛋白质(图2)。然后,采用COSMIC和Node分析检验这些蛋白质的分布及关系(图3),将病灶组织中获得的具有表达差异的蛋白质作为侵袭性蛋白质。
细胞命运决定和细胞骨架锚定功能蛋白含量较为突出,表明这两个生物过程在肿瘤的发生发展过程中发挥重要作用,提示肿瘤发生转移的性状。

图 2 生物过程分析结果

图 3 Node分析探明差异蛋白质产生的结点,表明多种蛋白质相互之间的关联性
1.4 统计学处理
将影像组学的50条特征表达次数与差异的侵袭性蛋白质表达次数进行Person相关性分析,P<0.05为差异有统计学意义。相关系数:0.8~1.0,表示极强相关;0.6~0.8,表示强相关;0.4~0.6,表示中等程度相关;0.2~0.4,表示弱相关;0~0.2,表示极弱相关或无相关。
2 结果
入组30例患者,年龄28~65岁。病理学检查结果均为PTC,均为单灶性,无周围组织侵犯。病理证实淋巴结转移15例,>1 cm者11例,≤1 cm者4例;病理证实无淋巴结转移15例,>1 cm者7例,≤1 cm者8例。影像组学预测结果见表1,准确率为96.7%,灵敏度为100%,特异度为93.3%。影像组学的50条特征在淋巴结转移组有47项呈现高表达,另有3项在两组间表达一致。

表 1 影像组学预测淋巴结转移的结果(n)
30例病灶组织经iTRAQ质谱分析,转移组获得3 462种蛋白质,无转移组获得1 947种蛋白质,两者共同表达1 014种蛋白质,全部蛋白质4 395种(图4)。针对全部蛋白质,从多方面反复筛选,最终确认与PTC侵袭性相关的蛋白质有11种,两组间表达差异有统计学意义(P<0.05)。这些蛋白质包括神经钙黏蛋白(N-cadherin)、ZEB1、β-连环蛋白(β-catenin)、 基质细胞衍生因子 1(stromal cell-derived factor 1,SDF1)、Snail 1、PTEN、血管内皮生长因子(vascular endothelial growth factor,VEGF)、SOX2、细胞间黏附分子1(intercellular cell adhesion molecule 1,ICAM1)、c-MET、TIPM3、SLUG。
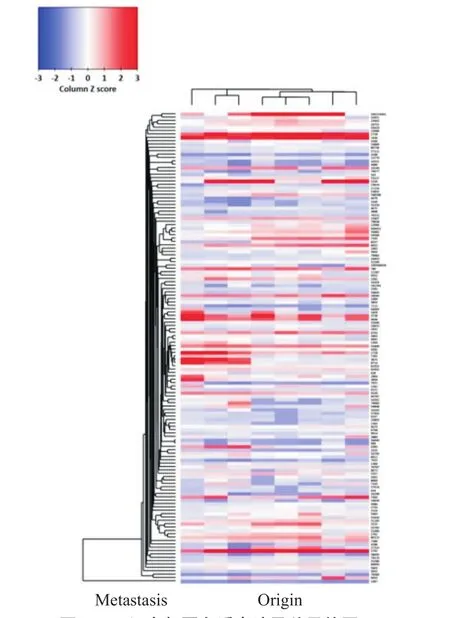
图 4 两组全部蛋白质表达及差异热图
Person相关性分析显示,11种蛋白质中与47项特征之间,4种蛋白质(N-cadherin、ZEB1、β-catenin和SDF1)与19项特征呈极强相关;5种蛋白质(N-cadherin、ZEB1、β-catenin、SDF1和VEGF)与23项特征呈强相关(表2)。

表 2 侵袭性蛋白质与影像组学特征相关性分析的结果
3 讨论
近年来PTC在我国呈高发趋势[6],引起广泛关注。PTC淋巴结转移与否,对决定临床治疗方案和手术范围选择[7-8]具有重要意义。目前,PTC术前淋巴结评估主要依赖超声。超声对侧颈部转移淋巴结的诊断率较高,而对于中央区转移淋巴结,因为受位置和组织特征的影响,检出率仅为50%[7,9]。因此,术前超声无法有效判断中央区淋巴结的转移情况。
影像组学通过计算机提取图像特征进行人工智能判断,已在多项研究中被证明可预测淋巴结转移[4,10],且准确率明显提高。尽管人们普遍认为影像异质性与基因异质性相互关联,且针对病灶组织的基因异质性已有报道[11-12],但采用预测淋巴结转移的影像组学方法对基因异质性进行研究尚未见报道。基因通过蛋白质才能实现其功能,因此本研究期望能在预测PTC淋巴结转移的影像组学特征与侵袭性相关蛋白质之间寻找到相关性。
本课题组建立的影像组学体系中,所选取的最优特征集是通过提取训练集的淋巴结转移和无转移两组病灶超声图像特征后,经由机器学习,用统计学方法筛选所得,在两组间表达有显著差异。研究结果显示,30例PTC病灶的预测准确率为96.7%,表明影像组学特征基本可体现PTC的淋巴结转移情况,两者具有一致性。针对入组病例的蛋白质质谱分析结果,获得11种侵袭性蛋白质,经蛋白质组学统计验证,两组间表达有显著差异,提示解析同一组病例验证的影像组学特征与侵袭性蛋白质表达之间的关系是有可能的。
本研究结果显示,4种蛋白质与19项特征呈极强相关,5种蛋白质与23项特征呈强相关。提示这些蛋白质对应的基因很可能就是影像组学异质特征的基础,这些蛋白质在很大程度上影响肿瘤的生长形态和模式,外在表现为人工智能可识别的图像特征。
本研究有几个重要问题尚未解决。首先,获取侵袭性蛋白质的病灶组织并非来自影像组学预测系统的训练集,只是经过验证可体现出异质特征,因此两者从根源上存在一定的区别。其次,本研究仅通过统计学方法证实影像组学特征与筛选获得的病灶侵袭性蛋白质之间有较好的相关性,并没有从RNA、组织学及细胞功能学角度证实这些蛋白质是否真正可调控PTC病灶的侵袭性。因此,虽然初步结果令人振奋,还需深入研究予以证实。
今后,本课题组将根据一个较大数量的训练集提取最优特征,构建影像组学评估淋巴结转移的系统,进而针对训练集的病灶组织进行蛋白质的提取筛选,然后针对筛选获得的蛋白质进行功能研究,从而获得更加令人信服的证据。
[参 考 文 献]
[1] CAMPBELL P J, YACHIDA S, MUDIE L J, et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer [J]. Nature, 2010, 467(7319): 1109-1113.
[2] LAMBIN P, RIOS-VELAZQUEZ E, LEIJENAAR R, et al. Radiomics: extracting more information from medical images using advanced feature analysis [J]. Eur J Cancer,2012, 48(4): 441-446.
[3] 郭 翌, 周世崇, 余锦华, 等. 影像组学的前沿研究与未来挑战 [J]. 肿瘤影像学, 2017, 26(2): 81-90.
[4] 周世崇, 刘桐桐, 周 瑾, 等. 影像组学在甲状腺癌应用的初步研究 [J]. 肿瘤影像学, 2017, 26(2): 102-105.
[5] DELELLIS R A, LLOYD R D, HEITZ P U, et al. WHO:Pathology and Genetics. Tumours of endocrine organs[M]. Lyon: IARC press, 2004.
[6] CHEN W Q, ZHENG R S, ZHANG S W, et al. Cancer incidence and mortality in China, 2013 [J]. Cancer Lett,2017, 401(8): 63-71.
[7] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer [J]. Thyroid, 2016, 26(1): 1-133.
[8] 中国抗癌协会甲状腺癌专业委员会(CATO). 甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版) [J]. 中国肿瘤临床, 2016, 43(10): 405-411.
[9] 李小毅. 2015年美国甲状腺学会《成人甲状腺结节与分化型甲状腺癌诊治指南》解读: 外科部分 [J]. 中国癌症杂志, 2016, 26(1): 13-18.
[10] HUANG Y Q, LIANG C H, HE L, et al. Development and validation of a radiomics nomogram for preoperative prediction of lymph node metastasis in colorectal cancer[J]. J Clin Oncol, 2016, 34(18): 2157-2164.
[11] LI H, ZHU Y, BURNSIDE E S, et al. MR imaging radiomics signatures for predicting the risk of breast cancer recurrence as given by research versions of MammaPrint, Oncotype DX, and PAM50 Gene Assays [J]. Radiology, 2016,281(2): 382-391.
[12] SEGAL E, SIRLIN C B, OOI C, et al. Decoding global gene expression programs in liver cancer by noninvasive imaging[J]. Nat Biotechnol, 2007, 25(6): 675-680.

