体素内不相干运动扩散加权成像在肝癌介入治疗预后中的价值
朱 正,赵心明,周纯武,欧阳汉,王 爽,王 倩,史 卓
国家癌症中心/中国医学科学院北京协和医学院肿瘤医院影像诊断科,北京 100021
原发性肝细胞肝癌(hepatocellular carcinoma,HCC)恶性程度高[1],治疗效果欠佳。经动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)目前被认为是一种有效安全的延长患者生存期的方法。影响肝癌患者预后的因素很多,患者的年龄、性别、Child-Puch分级及治疗方法等临床相关因素,以及肿瘤大小、有无门静脉瘤栓等肿瘤自身因素均与肝癌预后相关[2-6]。MRI中的体素内不相干运动扩散加权成像(intravoxel incoherent motion diffusion weighted imaging,IVIM-DWI)作为功能学成像,可测量活体内组织扩散和灌注信息,并进行定量分析[7],有望从肿瘤的凋亡情况判断其预后。本研究的主要目的是研究影响肝癌患者TACE治疗的临床及IVIM-DWI指标因素,为预测肝癌TACE患者预后提供客观的MRI依据。
1 材料和方法
1.1 研究对象
收集2014年9月30日—2017年9月30日期间,于北京协和医院肿瘤医院明确诊断为原发性肝癌的初治并拟行TACE治疗的资料完整的患者,肿瘤呈单结节型或巨块型,分期为T1-3N0M0。入组标准如下:① 年龄18~80岁的患者;② 无MRI检查禁忌证(如幽闭恐惧症、造影剂过敏及心脏起搏器等)。排除标准:① 患者不同意进行IVIM-DWI序列检查;② 肿瘤最大径(maximal tumor diameter,MTD)<2.0 cm;③ 肝功能分级Child-Puch C级;④ 患者无法配合完成随访。所有入组患者需在TACE治疗前2周内行肝脏MRI平扫、IVIM-DWI扫描及多期动态增强扫描,并在TACE治疗后4~6周再次进行IVIM-DWI检查,此后定期通过MRI或CT随访观察。TACE治疗前最终入组90例。本研究方案获得北京协和医院肿瘤医院伦理委员会批准,全部患者均于检查前签署知情同意书。
1.2 仪器与方法
使用GE Discovery MR 750 3.0 T MR扫描仪,8通道体部相控阵线圈。检查前患者均需禁食4 h及训练呼吸(均匀自由呼吸及呼气末屏气)。MRI扫描序列包括:屏气横轴位T1WI双回波序列;横轴位T2WI脂肪抑制序列;呼吸触发横轴面IVIM-DWI。扫描参数:回波时间(echo time,TE)为60.8 ms,重复时间(repetition time,TR)为3 529 ms,矩阵为128×160,视野(field of view,FOV)为28 cm×34.0 cm~32.0 cm×40.0 cm,层厚/层间隔=5 mm/0.5 mm。共选用12个b值(0、10、20、50、100、150、200、400、600、800、1 000和1 200 s/mm2),b值为0~200 s/mm2时采集次数为2次,b值为400~1 000 s/mm2时采集次数为3次。横轴位屏气3D肝脏加速容积采集序列(liver acquisition with volume acceleration-extended volume,LAVA-XV)多期动态增强扫描:使用高压注射器经手背静脉注入对比剂钆喷酸葡胺(gadolinium diethylene- trianmine pentaacetic acid,Gd-DTPA),剂量为0.2 mL/kg,速率为2.5 mL/s,随后采用同样速率注入20 mL 0.9%NaCl溶液冲管。于注射对比剂后20 s开始采集,于注射对比剂后20、60、120及180 s分别采集肝脏动脉期、门静脉早期、门静脉晚期及延迟期图像。
1.3 图像后处理
所有患者进行基线IVIM-DWI检查和TACE治疗1次后IVIM-DWI检查。将全部IVIM-DWI原始数据导入GE公司AW4.6工作站,利用Functool软件对IVIM图像进行后处理。选择单指数模型处理[8],生成标准表现扩散系数(apparent diffusion coefficient,ADC)图,计算ADC值;选择双指数模型处理[9],生成纯扩散系数D(pure molecular diffusion,D)、伪扩散系数D*(pseudo-diffusion coeffcient,D*)及灌注系数f(perfusion fraction,f)参数图,并进行计算[7]。结合T2WI脂肪抑制图像及动态增强图像,将感兴趣区(region of interest,ROI)置于病灶含实性成分最多的扩散受限信号最明显区域的层面,尽量避开出血、坏死区域;手动绘制ROI,同一病灶的所有数据均需测量3次,并计算平均值。
1.4 治疗方法
所有患者均行TACE治疗。采用Seldinger方法,经股动脉将导管选择插入肝癌肿瘤供血动脉,根据肝内病灶部位、大小、数目,选择性应用如下药物:注射用盐酸吡柔比星,规格:10 mg/支,20~40 mg;注射用羟基喜树碱,规格:5 mg/支,20~30 mg;碘化油注射液,规格:含碘480 ng/mL,10 mL/支;明胶海绵颗粒栓塞剂,规格:>100 mg/支,颗粒直径150~350 μm。其中TACE治疗1次者41例(45.6%),2次者24例(26.7%),3次者5例(5.6%),4次者3例(3.3%),5次及以上者17例(18.9%)。
1.5 随访
自2014年9月30日起,分别对90例患者的无进展生存期(progress-free survival,PFS)随访6~25个月。PFS以患者接受首次TACE治疗的日期为起点,以月为单位计算,随访终点为疾病进展或死亡,至统计日仍存活者作为截尾值处理。
1.6 统计学处理
采用SPSS 13.0软件进行统计学分析。计量资料以x+s表示,采用独立样本t检验、配对样本t检验和方差分析。分类资料的检验用χ2检验。各组患者评价终点为疾病进展或死亡,应用寿命表计算各组患者的累积生存率,以Kaplan-Meier生存曲线和Log-Rank检验比较各组患者的生存时间。应用多因素Cox回归分析,曲线间用对数秩检验,P<0.05为差异有统计学意义。
2 结果
2.1 基本临床资料
患者共90例,其中男性73例,女性17例,年龄27~76岁,中位年龄53岁;病变长径为(5.74±3.42)cm。88例患乙型肝炎,2例患丙型肝炎。伴有瘤栓12例,无瘤栓78例。Child-Puch评分A级89例(其中5分者77例、6分者12例),B级1例。TACE治疗1次者41例(45.6%),2次者24例(26.7%),3次者5例(5.6%),4次者3例(3.3%),5次及以上者17例(18.9%)。其中70例(77.8%)甲胎蛋白(alpha fetoprotein,AFP)升高。治疗前AFP值(8 902.05±32 993.02)μmol/L,治疗后AFP值(4 616.13±19 193.78)μmol/L,差异无统计学意义(P=0.071)。治疗前ALT值(44.90±55.87)U/L。
2.2 Cox多因素回归分析
将性别、年龄、病变长径、瘤栓有无、AFP及ALT值6个临床指标,治疗前ADC、D、D*、f值,以及治疗后ADC、D、D*、f值8个IVIM-DWI定量指标进行多因素分析,得出性别、年龄、治疗前D*值、治疗前f值及治疗后D*值共5个指标的肝癌TACE治疗后的PFS差异有统计学意义(P性别=0.030,P年龄=0.005,P治疗前D*<0.001,P治疗前f值=0.007,P治疗后D*<0.001,表1),即男性、高龄、高治疗前D*值、高治疗前f值及高治疗后D*值的患者预后差。
2.3 影响原发性肝癌TACE治疗的生存分析
除性别外,其余指标均为连续性变量,以中位数为分界值,即年龄、治疗前D*值、治疗前f值和治疗后D*值4个指标分别以53岁、14.1×10-3mm2/s、23.63%和11.9×10-3mm2/s为界值,使用Kaplan-Meier生存曲线,绘制相应的生存曲线。采用对数秩检验,发现年龄(图1)及治疗前D*值(图2)2个指标预测预后的差异有统计学意义。即高龄组(>53岁)、高治疗前D*值(>14.1×10-3mm2/s)者预后更差(P高龄组=0.027,P治疗前D*=0.003)。而性别、治疗前f值及治疗后D*值3个指标的生存曲线差异无统计学意义(P性别=0.301,P治疗前f值=0.075,P治疗后D*=0.334)。
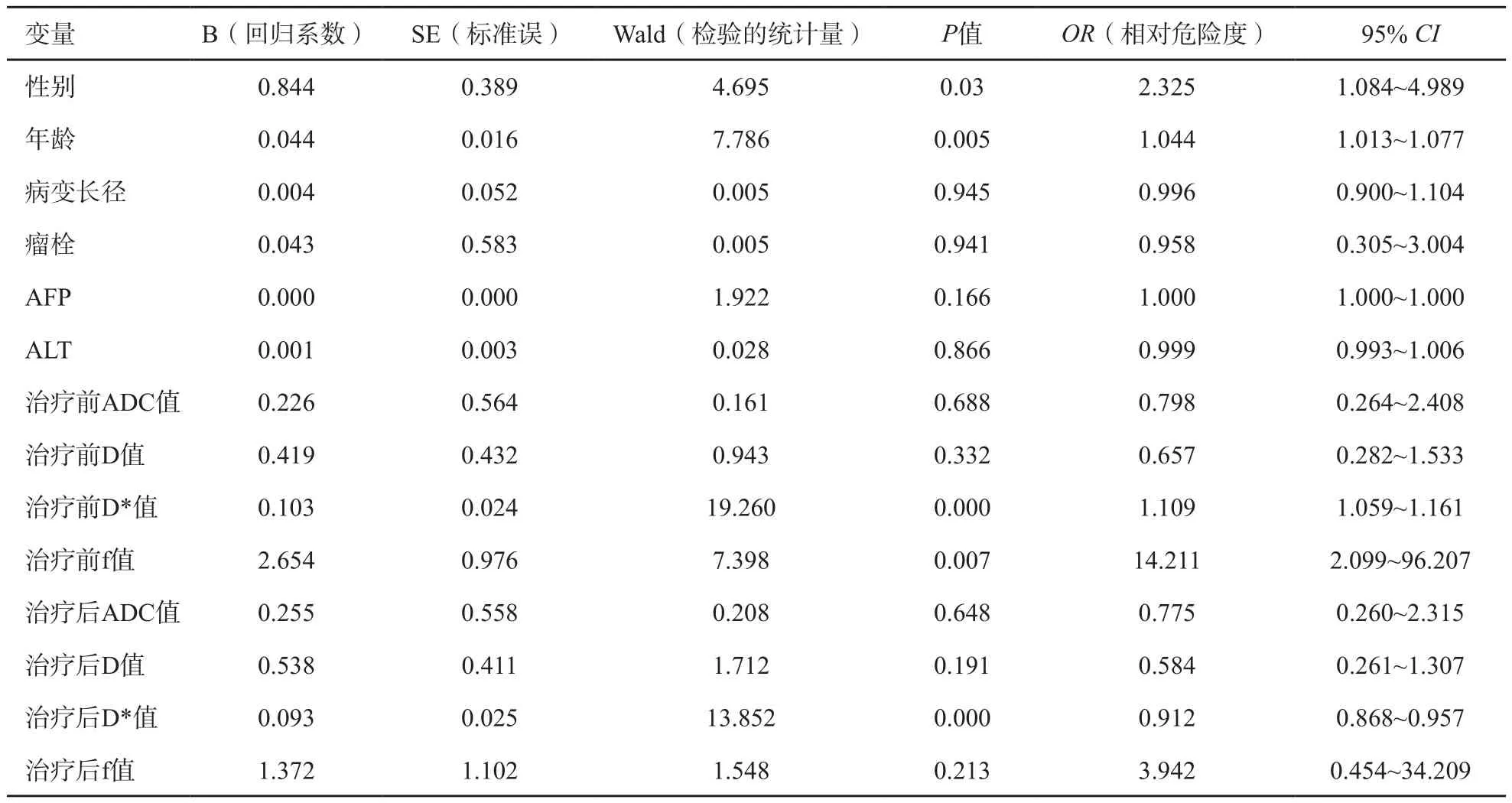
表1 影响肝癌TACE治疗预后的临床及IVIM-DWI指标的Cox多因素分析

图 1 高龄组与低龄组患者的Kaplan-Meier生存曲线
3 讨论
目前原发性HCC的预后受多种因素影响,其评价尚无统一标准,不同学者选取的指标和侧重点不同,导致了结果的差异性[9-18]。本研究结果显示,在评估的14个指标中,性别、年龄、治疗前D*值、治疗前f值及治疗后D*值共5个指标的肝癌TACE治疗后的PFS差异有统计学意义,而年龄、治疗前D*值是独立影响因素。
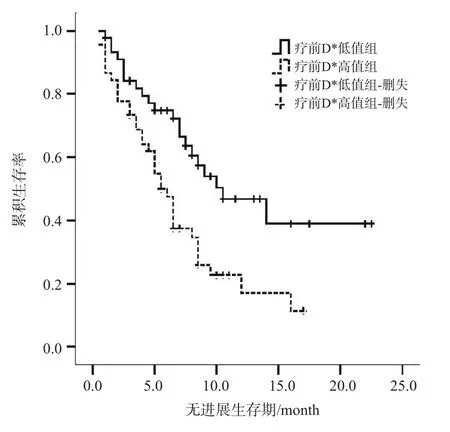
图 2 治疗前D*值高值组与低值组的Kaplan-Meier生存曲线
本研究首次提出治疗前D*值是HCC患者TACE治疗的独立预后因素,即治疗前D*值(>14.1×10-3mm2/s)高者预后更差。D*值与毛细血管网的微循环灌注相关,主要反映组织毛细血管流速,从而反映肿瘤灌注情况,并为临床治疗提供定量信息。本研究中治疗前、治疗后D*值均是预后的影响因素,但仅治疗前D*值是预后的独立影响因素,即患者治疗前通过MR功能学定量指标可预测其预后,优于本研究中ADC值的预测能力。TACE治疗后1个月的ADC比值是HCC独立预后因素(P<0.001)[19]。治疗前ADC值亦可预测非可切除肝癌的预后,治疗前ADC值高者预后差[13]。而Kim等[18]通过分析20例HCC患者,认为ADC值可预测肝癌同步放化疗的预后,低ADC值者预后差。不一致的原因,可能与两项研究的入组病例及治疗方式不同有关。但本研究中ADC值在肝癌TACE治疗的PFS预测中差异无统计学意义,可能与ROI测量方式不同有关。同时,年龄在本研究中亦是HCC预后的独立影响因素,即年龄>53岁者预后更差。Chedid等[14]的研究亦显示,老年男性、分化差的肿瘤患者预后更差。
部分研究表明,性别是肝癌预后的独立影响因素,女性较男性预后好,这可能与激素受体相关[15]。本研究显示,性别及治疗前f值、治疗后D*值与预后相关,但不是预后的独立影响因素。分析原因,可能是因为男女例数相差较多(男∶女=73∶17)。f值是指在体素中毛细血管容积占整个组织容积的比值,与正常或未成熟毛细血管的微血管密度有关,某种程度上可以反映血管生成的速度,亦与HCC预后相关。
D值较单指数模型ADC值而言,能相对较真实地反映组织中水分子的扩散状态。Woo等[16]的研究显示,D值较ADC值区分高级别与低级别HCC更准确,因此D值可以作为从影像角度间接反映病理分级而预测预后的因素。Wu等[17]通过30例HCC患者发现,TACE早期治疗后24~48 h的D比值是预测PFS的独立预后因素,而本研究中D值并非预后因素,可能与扫描机型不同、ROI勾画及b值选取不同相关。Kim等[18]通过研究20例HCC患者同步放化疗PFS,发现ADC值预测的最佳诊断界值为1.008×10-3mm2/s,且其在PFS生存分析中差异有统计学意义(P<0.001),低ADC值者预后差。Wu等[17]的研究显示,TACE早期治疗后24~48 h的ADC比值是预测PFS的独立预后因素。Vandecaveye等[19]的研究显示,TACE治疗后1个月的ADC比值是预测肝癌PFS的独立预后因素(P<0.001)。但本研究中ADC值在HCC的PFS预测中差异并无统计学意义。
大多数学者认为,AFP、肿瘤大小、门静脉瘤栓是影响肝癌预后的独立危险因素[20]。Qu等[11]的研究显示,高Child-Pugh分级、肿瘤体积大、门静脉瘤栓及远处转移是肝癌的独立预后因素。Chedid等[14]的研究显示,肿瘤大小、微血管浸润以及肝硬化是肝癌的独立预后因素。但亦有研究显示,AFP不是小肝癌预后的独立影响因素[3],大小亦不是单发无血管侵犯肿瘤的独立预后因素[21]。本研究结果显示,有无门静脉瘤栓的Cox因素分析中,差异无统计学意义(P>0.05)。推测其原因,可能是入组患者中仅12例伴有瘤栓,而78例无瘤栓,差异较大。
本研究b值的选取比大多数研究更多[20-21]。Woo等[16]按照Koh等[22]推荐的8个b值(0、25、50、75、100、200、500和800 s/mm2)更适用于临床扫描而非科研扫描。Ichikawa等[21]的研究亦采用12个b值,与本研究相同,而部分研究选取的b值更多,为16个[22-24]。Colagrande等[25]的研究显示,增强前与增强后的ADC值及IVIM指标差异无统计学意义,即增强扫描造影剂等对ADC值、IVIM检查的影响差异无统计学意义。Woo等[16]注射造影剂后在增强扫描序列进行IVIM扫描,而本研究在平扫序列进行IVIM扫描。
本研究的局限性如下:样本量较小,需要在进一步研究;未测量治疗前、后IVIM指标变化的△值是否对结果产生影响。同时,IVIMDWI中ROI为实性区域扩散受限最明显区域,未将坏死、出血等区域包含在内,而部分研究是将肿瘤的最大横截面作为测量层面。最后,本研究中患者的TACE治疗方法亦不完全不同,部分患者使用碘油及吡柔比星或羟基喜树碱剂量略低,或许会对预后产生一定影响。
综上所述,年龄及治疗前D*值是肝癌TACE治疗预后的独立影响因素。即高龄(>53岁)、高治疗前D*值(>14.1×10-3mm2/s)者预后更差。
[参 考 文 献]
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] ZHU K, CHEN J, LAI L, et al. Hepatocellular carcinoma with portal vein tumor thrombus: treatment with transarterial chemoembolization combined with sorafenib-a retrospective controlled study [J]. Radiology, 2014, 272(1): 284-293.
[3] GIANNINI E G, MARENCO S, BORGONOVO G, et al. Alpha-fetoprotein has no prognostic role in small hepatocellular carcinoma identified during surveillance in compensated cirrhosis [J]. Hepatology, 2012, 56(4):1371-1379.
[4] LV Y, WANG W, JIA W D, et al. High preoparative levels of serum periostin are associated with poor prognosis in patients with hepatocellular carcinoma after hepatectomy[J]. Eur J Surg Oncol, 2013, 39(10): 1129-1135.
[5] TANDON P, GARCIA-TSAO G. Prognostic indicators in hepatocellular carcinoma: a systematic review of 72 studies[J]. Liver Int, 2009, 29(4): 502-510.
[6] YEH J H, HUNG C H, WANG J H, et al. Modifiable prognostic factors of hepatocellular carcinoma in patients with non-surgical treatment [J]. PLoS One, 2015, 10(12):e0144893.
[7] LE BIHAN D, BRETON E, LALLEMAND D, et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging [J]. Radiology, 1988,168(2): 497-505.
[8] LEMKE A, LAUN B, SIMON D, et al. An in vivo verification of the intravoxel incoherent motion effect in diffusion-weighted imaging of the abdomen [J]. Magn Reson Med, 2010, 64(6): 1580-1585.
[9] LI J, WANG L, CONG N, et al. Efficacy of sorafenib for advanced hepatocellular carcinoma and prognostic factors[J]. Hepatogastroenterology, 2014, 61(132): 954-957.
[10] CHENG J, WANG W, ZHANG Y, et al. Prognostic role of pre-treatment serum AFP-L3% in hepatocellular carcinoma:systematic review and meta-analysis [J]. PLoS One,2014, 9(1): e87011.
[11] QU Q, WANG S, CHEN S, et al. Prognostic role and significance of paraneoplastic syndromes in hepatocellular carcinoma [J]. Am Surg, 2014, 80(2): 191-196.
[12] SCHUTTE K, TIPPELT B, SCHULZ C, et al. Malnutrition is a prognostic factor in patients with hepatocellular carcinoma(HCC) [J]. Clin Nutr, 2015, 34(6): 1122-1127.
[13] DONG S, YE X D, YUAN Z, et al. Relationship of apparent diffusion coeffcient to survival for patients with unresectable primary hepatocellular carcinoma after chemoembolization[J]. Eur J Radiol, 2012, 81(3): 472-477.
[14] CHEDID A, RYAN L M, DAYAL Y, et al. Morphology and other prognostic factors of hepatocellular carcinoma [J].Arch Pathol Lab Med, 1999, 123(6): 524-528.
[15] VILLA E, MOLES A, FERRETTI I, et al. Natural history of inoperable hepatocellular carcinoma: estrogen receptors’status in the tumor is the strongest prognostic factor for survival [J]. Hepatology, 2000, 32(2): 233-238.
[16] WOO S, LEE J M, YOON J H, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of hepatocellular carcinoma: correlation with enhancement degree and histologic grade [J]. Radiology, 2014, 270(3): 758-767.
[17] WU L, XU P, RAO S, et al. ADCtotal ratio and D ratio derived from intravoxel incoherent motion early after TACE are independent predictors for survival in hepatocellular carcinoma [J]. J Magn Reson Imaging, 2017, 46(3): 820-830.
[18] KIM K A, PARK M S, JI H J, et al. Diffusion and perfusion MRI prediction of progression-free survival in patients with hepatocellular carcinoma treated with concurrent chemoradiotherapy [J]. J Magn Reson Imaging, 2014,39(2): 286-292.
[19] VANDECAVEYE V, MICHIELSEN K, DE KEYZER F,et al. Chemoembolization for hepatocellular carcinoma:1-month response determined with apparent diffusion coefficient is an independent predictor of outcome [J].Radiology, 2014, 270(3): 747-757.
[20] LEWIN M, FARTOUX L, VIGNAUD A, et al. The diffusion-weighted imaging perfusion fraction f is a potential marker of sorafenib treatment in advanced hepatocellular carcinoma: a pilot study [J]. Eur Radiol, 2011, 21(2):281-290.
[21] ICHIKAWA S, MOTOSUGI U, HERNANDO D, et al.Histological grading of hepatocellular carcinomas with intravoxel incoherent motion diffusion-weighted imaging:inconsistent results depending on the fitting method [J].Magn Reson Med Sci, 2018, 17(2): 168-173.
[22] KOH D M, COLLINS D J, ORTON M R. Intravoxel incoherent motion in body diffusion-weighted MRI: reality and challenges [J]. AJR Am J Roentgenol, 2011, 196(6):1351-1361.
[23] KAKITE S, DYVORNE H A, LEE K M, et al.Hepatocellular carcinoma: IVIM diffusion quanti fication for prediction of tumor necrosis compared to enhancement ratios[J]. Eur J Radiol Open, 2016, 3: 1-7.
[24] HECTORS S J, WAGNER M, BESA C, et al. Intravoxel incoherent motion diffusion-weighted imaging of hepatocellular carcinoma: Is there a correlation with flow and perfusion metrics obtained with dynamic contrastenhanced MRI? [J]. J Magn Reson Imaging, 2016, 44(4):856-864.
[25] COLAGRANDE S, MAZZONI L N, MAZZONI E,et al.Effects of gadoxetic acid on quantitative diffusion-weighted imaging of the liver [J]. J Magn Reson Imaging, 2013,38(2): 365-370.

