补肾活血方保护FSGS小鼠足细胞的实验研究*
左春霞,张勉之,贾胜琴
局灶节段性肾小球硬化(FSGS)是一种常见、难治的肾小球病,最终可导致终末期肾病(ESRD)。大量研究提示其起病机制的关键环节是各类原因引起的肾脏足细胞受损[1]。因而,目前防治FSGS的中心问题是保护足细胞正常的数量和功能。目前单独应用西药治疗FSGS不能取得确切满意的疗效,并且长期使用西药不良反应大、经济负担重,所以中药治疗可能成为FSGS治疗的重要途径之一。张大宁教授[2]根据多年临床实践,将补肾活血中药组方广泛应用于肾脏病的临床治疗中,可补肾气、活血化瘀。在本课题中系统分析了补肾活血法组方调节FSGS模型小鼠足细胞特异性蛋白分子骨架蛋白desmin、肾母细胞瘤wt1和裂孔膜蛋白nephrin,并探讨该组方针对FSGS足细胞产生保护作用的内在机制。
1 材料与方法
1.1 实验动物与分组 选用24只雄性且清洁级的BALB/c小鼠,6~8 周龄,体质量 22~26 g,尿蛋白均阴性,购自军事医学科学院动物实验中心。采用随机数字表法随机分为3组,即正常对照组(n=5)、模型组(n=10)以及治疗组(n=9)。
1.2 试剂和药物制备 阿霉素从美国Sigma公司购得,制成1 mg/mL的溶液[用生理盐水(广州利泰制药股份有限公司生产)配制];天津药物研究院制备补肾活血组方醇提液,将从天津太平大药房购得的五味子、茵陈蒿、生黄芪、川芎、大黄炭、大黄、丹参、五灵脂以及半枝莲等草药,用天津百世化工有限公司购买的90%乙醇经过3 h加热回流之后,先后提取2次,并将提取液进行合并,在静置之后实施过滤,并将乙醇减压回收,浓缩获得浸膏,置于-20℃环境下留存待用[3]。从美国Santa Cruz公司购得的免疫荧光封闭液、一抗山羊抗鼠nephrin等,从北京中山生物技术公司购得二抗兔抗山羊多克隆抗体,从日本Takara公司购得总RNA提取试剂盒、电泳琼脂糖以及M-MLV逆转录酶,从美国Bio-Rad公司购得PCR扩增仪,及台式高速离心机以及凝胶成像系统,从上海生工生物公司购得引物并合成。
1.3 构建动物模型[4]将3组小鼠先进行常规适应性喂养,时间为7 d,然后针对模型组和治疗组实施尾静脉注射ADR 10 mg/kg,而空白对照组则是注射同样体积的生理盐水;在7 d之后,考马斯亮蓝法验证尿白蛋白显著增多者纳入实验。针对治疗组使用10μL/(g·d)补肾活血组方进行灌胃,并在每周按照所测到的体质量作出适当的剂量调整,而模型组以及空白对照组则是灌胃同样体积纯净水。每日给药1次,时间固定为上午10点,持续6周。中间因有死亡,予以剔除。在实验结束的时候,模型组与治疗组都各自剩下6只小鼠,而空白对照组则没有变化。
1.4 标本收集和处理 在实验即将结束之前以电子天平对所有小鼠进行体质量称量,并将血、尿等收集起来,以高效液相色谱法完成尿肌酐以及尿白蛋白的浓度测定,同时求解到24 h尿蛋白排泄率(UAER)和尿白蛋白/肌酐比值(UACR),公式为:
UAER=尿白蛋白(mg/L)×24 h尿量(L)
UACR=尿白蛋白(mg/L)×尿量(L)/[尿肌酐(mmol/L)×尿量(L)]。
采用腹腔注射戊巴比妥钠的方式对小鼠实施麻醉处理,将左肾取下来,并对肾皮质进行分离,切下前段1/3组织固定在中性福尔马林里面,持续时间为24h,然后实施脱水、包埋以及切片(3μm),并进行苏木精-伊红(HE)、高碘酸-甲烷氨银(PASM)常规染色;中段1/3以包埋剂实施包埋,然后进行冰冻切片,通过免疫荧光完成检测;剩下1/3则放到液氮里面,置于-80℃冰箱当中冷冻,实施PCR检测。
1.5 观察肾组织形态 石蜡包埋之后3μm切片,然后进行常规脱蜡处理,实施HE、PASM常规染色,在光镜之下对肾组织形态具体变化情况进行观察,然后进行轻度复染,待脱水与透明处理之后,以中性树胶实施封片。
1.6 免疫荧光染色 通过间接免疫荧光法针对肾组织当中对应的nephrin表达情况进行检测。将冰冻切片从-80℃取出后-20℃放置15 min,然后在室温环境下静置15 min,冷冻甲醛并进行10 min穿透固定,以TBST反复2次清洗,在2%牛血清白蛋白当中以室温环境封闭1 h,然后添加一抗,于4℃冰箱当中过夜保存。在等渗盐溶液当中添加Tris-HCl缓冲液(T BST),清洗3次,每次10 min,然后在二抗当中孵育,于室温环境之下避光静置1 h,接着是以4',6-二脒基-2-苯基吲哚(DAPI)染核,之后是以TBST清洗3次,每次10 min,以水溶性封片剂进行封片处理,放到荧光显微镜之下观察其中nephrin表达情况。
1.7 Wt1、desmin mRNA表达检测 以Trizol试剂盒于肾脏组织里面提取到总mRNA,以紫外分光光度仪完成mRNA含量与纯度水平的检测。以逆转录试剂盒实施逆转录,获得cDNA,放到琼脂凝胶里面进行电泳,待凝胶成像之后将GAPDH当成内参,实施Image J分析,以扩增片段与GAPDH之间的灰度比来显示产物数量,完成半定量处理。在逆转录方面使用两步反转法:在70℃环境下静置10 min,置于冰上2 min;添加Rnase与M-MLV之后,放到42℃环境下留存1 h,置于70℃环境下10 min,放到冰上静置。PCR环境:在94℃条件下变性30 s,在60℃环境下退火处理,时间为30 s,在72℃环境下进行延伸,时间为1 min。引物序列具体可见表1。

表1 目的基因及内参照基因引物序列Tab.1 Primer sequence of target gene and internal refenrence gene
1.8 统计学分析 以SPSS 17.0软件进行统计分析,以均数±标准差(x±s)表示,组间比较采用单因素分析,组间两两比较采用LSD法,两两对比是以LSD-t检验为主,P<0.05代表差异有统计学意义。
2 结果
2.1 一般情况分析 在开展实验过程当中,模型组与治疗组都表现出不同程度的摄食与尿量降低、活动迟缓、精神不振、体表水肿以及毛色不光泽等现象,其中的模型组症状更加显著。
2.2 3组体质量、血清白蛋白(ALB)、尿蛋白定量和UACR对比 补肾活血法组方治疗组体质量、血浆ALB 高于模型组(P<0.01);补肾活血法组方治疗组UAER、UACR 显著高于模型组(P<0.01),见表 2。
2.3 肾组织形态学变化
2.3.1 HE染色结果 观察6周末3组肾组织,空白对照组基本正常,肾小球毛细血管开放完好,未见硬化。模型组小鼠的肾小球系膜基质出现显著性增生,并呈现出纤维化,有一些肾小球血管袢与肾小球囊出现粘连现象。治疗组小鼠系膜基质所呈现出的纤维化程度较低,具体可见图1。
2.3.2 逆转录-聚酶链反应(PASM)染色结果 空白对照组肾组织肾小球的形态、结构基本正常,模型组见肾小球基底膜增厚,节段性硬化,治疗组病变减轻,见图2。

表2 3组ALB、体质量、尿蛋白定量和UACR对比(x±s)Tab.2 Comparison of body weight,ALB,UAER and UACR in three groups(x±s)
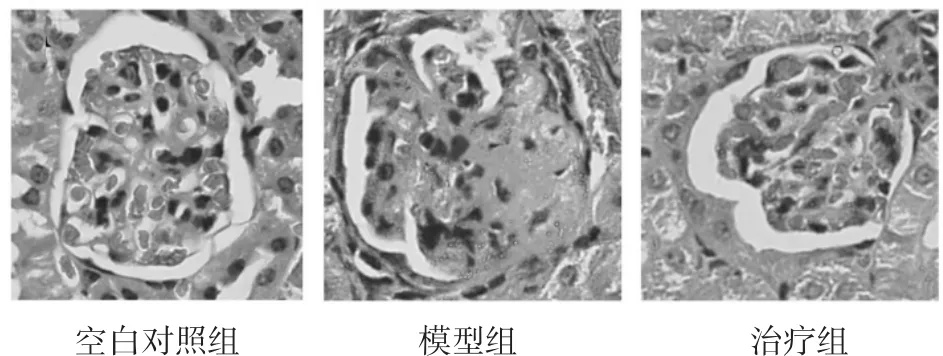
图1 3组HE染色比较(×400)Fig.1 Pathological changes of renal tissues in three groups(×400)
2.4 免疫荧光结果 nephrin免疫荧光表达情况:对照组足细胞的Nephrin因子沿毛细血管紧密分布;其在FSGS组表达明显减弱,散布不均,且局部表达缺失;在肾小球毛细血管区域,较模型组,治疗组的nephrin表达也明显增加,具体可见图3。
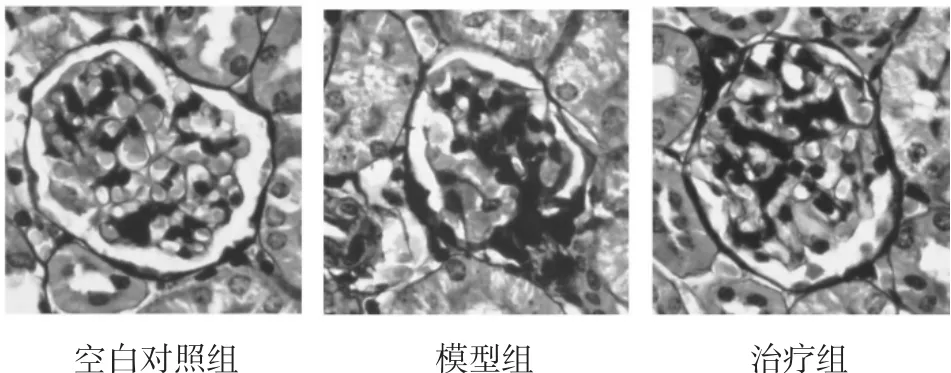
图2 3组PASM染色比较(×400)Fig.2 Pathological changesof renal tissuesin threegroups(×400)
2.5 RT-PCR结果 在模型组小鼠当中,其wt1表达程度比对照组与治疗组低,而desmin mRNA表达程度则比对照组与治疗组高,其中的差异具备显著性(P<0.01),可见图 4。3 组 desmin、wt1 与 GAPDH的PCR条带光密度比值,可见表3。
3 讨论
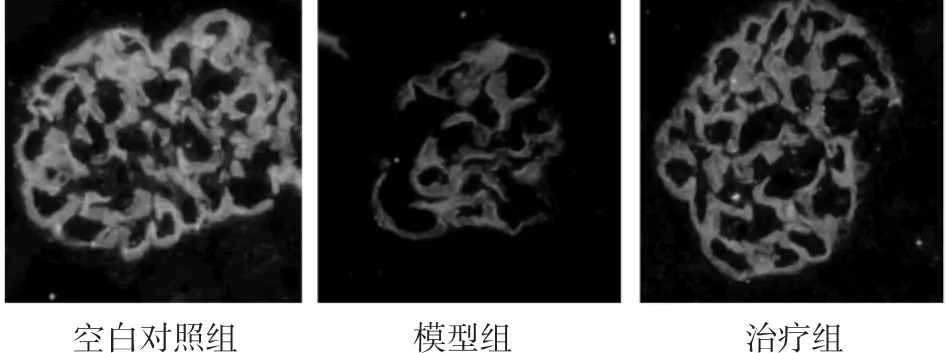
图2 3组nephrin阳性表达情况(免疫荧光×200)Fig.3 The positive expressionsof nephrin in three groups(immunofluorescence×400)
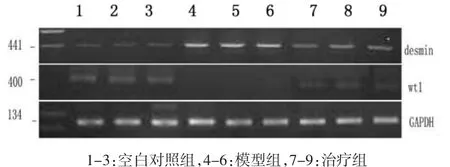
图4 3组desmin、wt1 mRNA表达的变化Fig.4 Renal mRNA expressionsof desmin and wt1 in three groups

表3 3组desmin、wtl mRNA和GAPDH条带光密度比值对比(x±s)Tab.3 The mRNA expression of desmin and wt1 in three groups(x±s)
盐酸阿霉素能抑制细胞周期各个阶段DNA及RNA的合成,产生巨大的细胞毒作用[5],它可作用于肾小球滤过膜发生蛋白尿。大量的蛋白尿间接刺激肾小球系膜细胞增殖和系膜基质增多,形成肾小球硬化[6]。另外,阿霉素及其代谢产物导致足细胞足突融合和足细胞减少,导致蛋白尿,发展为肾小球硬化,形成与人类FSGS类似的病变[7]。本实验用阿霉素诱导产生经典的足细胞损伤的FSGS动物模型。
3.1 Wt1在FSGS模型中的表达及意义 近年来的相关研究结果显示,wt1和部分肾小球疾病蛋白尿形成、发展有关联。毛细血管内皮细胞、基底膜及足细胞3部分组成肾小球滤过膜。滤过膜的机械屏障及电荷屏障功能异常,可发展为大量蛋白尿[8]。研究表明,作为足细胞功能当中的一项关键调节因子,wt1降低之后可能会引发新月体肾小球肾炎以及硬化症状。Ohtaka等[9]研究发现,FSGS受损的足细胞wt1的表达会减弱。本研究通过HE染色和PASM染色可见模型组肾小球基质增生,出现纤维化表现,通过RT-PCR研究了wt1的表达,发现wt1在模型组肾组织的表达显著减少,说明wt1缺失与FSGS密切相关。
3.2 nephrin在FSGS模型中的表达及意义 研究表明,足细胞损伤可表现为nephrin表达变化[10]。袁军等[11]报道在阿霉素诱导的肾病动物实验中,nephrin表达的降低与蛋白尿的产生具有相关性。有文献研究报道,在FSGS情况下,nephrin表达水平与正常对照组相比有明显降低,且nephrin的表达量与24 h尿蛋白定量呈负相关[12]。本课题研究发现:FSGS模型组UARE、UACR高于空白对照组,ALB低于空白对照组,由此推断模型组nephrin在肾小球足细胞中表达降低,肾小球基底膜受损,导致大量蛋白尿。同时实验还进行了nephrin免疫荧光以及基因表达分析,结果显示模型组nephrin表达显著性降低;从HE染色和PASM染色看到了,与空白对照组和治疗组比,模型组的肾小球基质增生伴纤维化程度明显严重,因而推断肾组织nephrin的表达数量减少可能与FSGS的发生相关。
3.3 desmin在FSGS模型中的表达及意义 正常生理情况下,desmin仅少量存在于足细胞中。足细胞损伤,其细胞骨架混乱,在足细胞desmin大量表达[13]。有研究报道,FSGS肾组织内desmin表达较正常明显增强,与尿蛋白呈正相关,与内生肌酐清除率呈负相关,在足细胞受损FSGS蛋白尿的发生机制以及肾功能衰退的病程中desmin扮演关键作用[14]。本课题研究显示:模型组desmin mRNA明显超过空白对照组,而尿蛋白也有显著性提升。由此可见,模型组出现了严重足细胞损伤现象,导致肾小球滤过屏障被损坏,由此渗出蛋白尿,desmin表达水平和足细胞破坏之间具备密切关联。
3.4 补肾活血组方治疗FSGS内在机制分析 补肾活血法是由张大宁教授首先提出的。他在多年的临床实践中总结,包括FSGS在内的大多肾病患者均存在不同程度的“肾虚与血瘀”,“补肾活血法”其理论核心为肾虚血瘀论,认为肾小球系膜细胞的增殖、ECM的积聚是由于久病肾虚、久病血瘀所至,以补肾活血法为依据的组方中药具有补肾、活血、软坚的功效,改善肾虚血瘀的病理变化,使机体的阴阳平衡、邪去正存[15]。另外,FSGS病程长,多应用激素治疗,如果长时间服用则容易出现阴虚火旺,所以辨证多为气阴两虚,且兼有虚火与癖血,属于典型的本虚标实。在临床治疗中应做到虚实兼顾[16]。综上所述,补肾活血化瘀法是FSGS治疗的主线。补肾活血方依据中医补肾活血法原理,以“肾虚血瘀证”的表现作为基础而拟定,在实践当中以温阳、补肾、益气、活血、行气以及滋阴等方法进行培本、扶正、活血以及祛邪。根据现代药理学实验可知,通过使用大剂量黄芪[17]以及五味子[18]可显著减轻肾损害的临床症状,减少蛋白尿。丹参、川芎、五灵脂等可抑制血小板凝聚,改善微循环,达到抗凝、抗变态反应和抗炎等功效[19]。茵陈蒿、半枝莲有抗炎、抗病毒作用功效,且具有抑制抗原抗体复合物产生的作用。补肾活血组方多味中药安全合理配伍能改善内环境,增强机体免疫功能,利于损伤肾组织得到修复。
在本次实验当中所得到的结果和模型组对比,以补肾活血方进行为期6周时间的治疗之后,小鼠的精神活动状态以及进食情况等都出现一定改善,同时体质量以及ALB都有所增加,而UARE、UACR则有所降低。通过HE与PASM常规染色能够发现,治疗组小鼠的纤维性沉积有显著性减弱;肾小球当中的nephrin荧光强度有所上调;通过PCR检测到wt1 mRNA表达增多,desmin mRNA表达有所降低。由此可见,补肾活血方可以有效调节FSGS状态下足细胞desmin、wt1以及nephrin表达水平,保护了受损的足细胞,使尿蛋白减少,从而起到了减轻FSGS进展的作用。
参考文献:
[1]杜 华.益肾活血方对FSGS大鼠模型足细胞损伤的保护作用及其机制研究[D].北京:北京中医药大学,2017.
[2] 焦 剑.国医大师张大宁教授治疗慢性肾炎的经验[J].天津中医药,2016,33(6):321-324.
[3] 刘 苗,张勉之,谭小月,等.复方五味子醇提液对糖尿病肾病的治疗作用及机制[J].天津医药,2011,39(6):557-559,580.
[4] 贾胜琴,谭小月,阎丽娜,等.补肾活血方对阿霉素肾病小鼠肾小球足细胞 nephrin 表达的影响[J].天津医药,2013,41(5):471-474,516.
[5] Abo-Salem OM.The protective effect of aminoguanidine on doxorubicin induced nephropathy in rat[J].Biochem Mol Toxicol 2012,276(1):1-9.
[6]NISTIC ÒP,CAPONE I,PALERMO B,et al.Chemotherapy enhances vaccine-Induced antitumor immunity in melanoma patients[J].Int JCancer 2009,124(1):130-139.
[7]Zhao Q,Wan YG,Sun W,et al.Effectsof huangkuicapsuleon renal inflammatory injury by intervening p38MAPK signaling pathway in rats with adriamycin-induced nephropathy[J].Zhongguo Zhong Yao Za Zhi,2012,37(19):2926-2934.
[8]Kim YH,Goyal M,Kurnit D,et al.Podocyte depletion and glomerulosclerosis have a direct relationship in the PANtreated rat[J].Kidney Int,2001,60(3):957-968.
[9] Ohtaka A,Ootaka T,Sato H.Significance of early phenotypicchange of glomerular podocytes detected by Pax2 in primary focalsegmental glomerulosclerosis[J].Am JKindey Dis,2002,39(3):475-485.
[10]Mundel P,Reiser J.Proteinuria:anenzymaticdiseaseofthepodocyte[J].Kidney Int,2010,77(7):571-580.
[11]袁 军,鲁艳芳.温阳活血利水方对阿霉素肾病大鼠肾小球足细胞 nephrin 表达的影响[J].临床肾脏病杂志,2012,12(6):281-285.
[12]左春霞,谭小月,张勉之.五味子复方减轻阿霉素肾病小鼠蛋白尿的实验研究[J].天津中医药,2014,31(1):33-35.
[13]肖 军,钟新生,郑小利,等.肾衰Ⅲ号方对阿霉素诱导损伤足细胞 nephrin、desmin 表达的影响[J].中国中医药科技,2017,24(3):278-281.
[14]张碧丽,李志军,宋兰云,等.Desmin蛋白与局灶节段性肾小球硬化的相关性研究[J].临床儿科杂志,2009,27(1):76-78.
[15]张勉之.国医大师张大宁治疗慢性肾脏疾病的临床体会[A].中国中西医结合学会肾脏疾病专业委员会.中国中西医结合学会肾脏疾病专业委员会2015年学术年会资料汇编[C].中国中西医结合学会肾脏疾病专业委员会,2015:3.
[16]邓宏韬,时蔡林,王国斌,等.补气活血益肾法治疗局灶节段肾小球硬化 43 例临床观察[J].新中医,2006,38(11):25-27.
[17]李 青,许陵冬,江 燕,等.黄芪甲苷对肾小管上皮细胞诱导单核细胞分化的影响[J].临床肾脏病杂志,2016,16(9):557-561.
[18]周海燕,孟昭阳.浅析五味子的临床效用[J].光明中医,2015,30(3):642-643.
[19]王宝玉,董荣芬,单振友,等.加味抵当汤治疗缺血中风134例临床观察[J].中国医药学报,1998,13(2):34-36.

