基于cAMP-CREB-BDNF信号通路探讨交泰丸抗抑郁的作用机制*
雒明池 ,梁 如 ,高树明,李 琳 ,高 杉
抑郁症是一种极度危害人类身心健康的常见精神疾病,常伴有严重的并发症,严重危害人们的健康[1]。世界卫生组织(WHO)已将其列为十大严重疾病之一[2]。抑郁症的高发病率、高致残率、高复发率迫切要求研究者加速对其发病机制的研究以及开发疗效更好的抗抑郁药物[3]。近年来多靶点作用机制逐渐成为抑郁症研究的热点和焦点,研究者发现细胞信号转导理论更适合阐明抗抑郁药物的多靶点作用机制。目前,与抗抑郁药物作用机制相关的细胞信号转导通路主要涉及cAMP-PKA-CREBBDNF通路、NO-cGMP-PKG通路、丝裂原活化蛋白激酶(MAPK)通路、IP3/Ca2+DAG/PKC 通路等[4]。第二信使分子cAMP和cGMP成为了现代中医药研究者关注的热点之一。美国生物学家Goldberg[5]于1975年提出了“阴阳学说与cAMP和cGMP双向生物调节关系的假说”,并推论cAMP与cGMP的双向控制系统能统一许多不同生物调节现象的原理,即阴阳学说的基本原理所在,这个理论被国内中医学者认同[6]。
中医古方交泰丸,由黄连:肉桂配伍组成,黄连味苦性寒入心经,可以清降心火以下交肾水;肉桂味辛性热入肾经,可以温升肾水以上济心火,两药一寒一热,一阴一阳,共奏交通心肾,调神定志之功,临床上常用于治疗失眠,更年期综合症[8-9]。但近代有研究表明交泰丸具有抗抑郁作用,如钱哲等[10]研究表明交泰丸能够通过调节脂多糖(LPS)诱导的小鼠模型的单胺能反应及抗炎作用来缓解治疗小鼠的抑郁样改变。西医学研究也证实,黄连中所含的小檗碱具有抗抑郁作用[11-12]。肉桂所含的桂皮醛可以可用作改善抑郁症和焦虑症症状的辅助疗法[13]。本研究将基于cAMP-CREB-BDNF信号通路探讨交泰丸抗抑郁的作用机制。
1 材料与方法
1.1 实验动物 健康SD大鼠,雄性,体质量140~160 g。由北京维通利华实验动物技术有限公司提供,动物合格证编号:SCXK(京)2012-0001。饲养于天津中医药大学实验动物中心,实验前适应性喂养1周。
1.2 实验药品与制备 黄连、肉桂饮片(均购自安徽省亳州市药材总公司中西药公司)。阳性对照药物:盐酸氟西汀(百优解),礼来苏州制药有限公司,批号:4482A。交泰丸制备工艺参考课题组前期研究[14]。
1.3 实验仪器与试剂 万能粉碎机(浙江屹立工贸有限公司,QE-100克)、超低温冰箱(中国Haier公司);开场行为观察箱、Digibehave双画面动物行为视频分析系统2.1版、水合氯醛、Mouse/Rat cAMP Parameter Assay Kit试剂盒(美国R&D公司)、10×PBS(上海生工生物工程股份有限公司)、蛋白酶抑制剂(德国罗氏试剂公司)、Human/Mouse/Rat Phospho-CREB(S133)DuoSet ICELISA试剂盒(美国R&D 公司)、Total BDNF Quantikine ELISA Kit试剂盒(美国R&D公司)、PDE-GloTM Phosphodiesterase Assay(美国 Promega公司)、p-CREB抗体(英国Abcam公司)等。
1.4 实验分组与给药 将开场实验行为比较接近的大鼠72只,随机分为6组,分别为空白对照组、模型组、阳性药对照组(盐酸氟西汀,7.5 mg/kg)和交泰丸低(生药 0.75 g/kg)、中(生药 1.5 g/kg)、高(生药3 g/kg)剂量组,每组12只,分笼饲养。大鼠抑郁模型的建立采用慢性温和不可预知性应激刺激(CUMS),具体操作参考课题组前期研究[14],刺激主要包括禁食24 h;禁水24 h,夹尾持续2 min;昼夜颠倒;振荡2 min;4℃冷水游泳5 min。
1.5 检测指标
1.5.1 大鼠海马组织中 cAMP、p-CREB、BDNF、PDE含量以及大鼠血浆中cAMP的含量测定 严格按照cAMP试剂盒说明书操作分别测定大鼠血浆及海马组织中cAMP的浓度;按照p-CREB试剂盒、BDNF试剂盒、PDE活性试剂盒测定大鼠海马组织中p-CREB、BDNF的含量及PDE的活性。
1.5.2 大鼠海马、皮质中BDNFmRNA表达含量测定 参考前期实验研究方法[15],根据试剂盒说明,采用Qiagen RNeasy Mini kit试剂盒分别提取大鼠海马、皮质中mRNA,测定mRNA浓度。逆转录合成cDNA:按照反转录试剂盒说明冰上操作,合成cDNA于-80℃保存备用。荧光定量PCR实验:应用ABI®7500实时荧光定量PCR仪分析软件测定BDNFmRNA的表达。反应以β-actin和GAPDH作为内参,引物序列见表1。
1.5.3 大鼠海马组织p-CREB阳性细胞的表达分析 取大鼠海马组织石蜡包埋切片,将切片置于3%H2O2溶液中室温10 min灭活内源性酶,热修复抗原,滴加一抗(兔抗大鼠 IgG,1∶100),4 ℃孵育 48 h,磷酸盐缓冲溶液(PBS)清洗,滴加生物素化山羊抗兔IgG,37 ℃,20 min。采用 S-P(Streptavidin-perosidase)法染色及DAB显色。在大鼠海马CA1、CA3区,高倍镜(×400)下随机选取5个视野,拍照后用Image-Pro Plus6.0专业图像分析软件进行定量分析,测定区域面积(Area)及积分光密度值(IOD)。计算阳性细胞表达的平均光密度(AOD),以此评价大鼠海马组织中P-CREB阳性细胞表达情况。AOD=IOD/Area×100%。
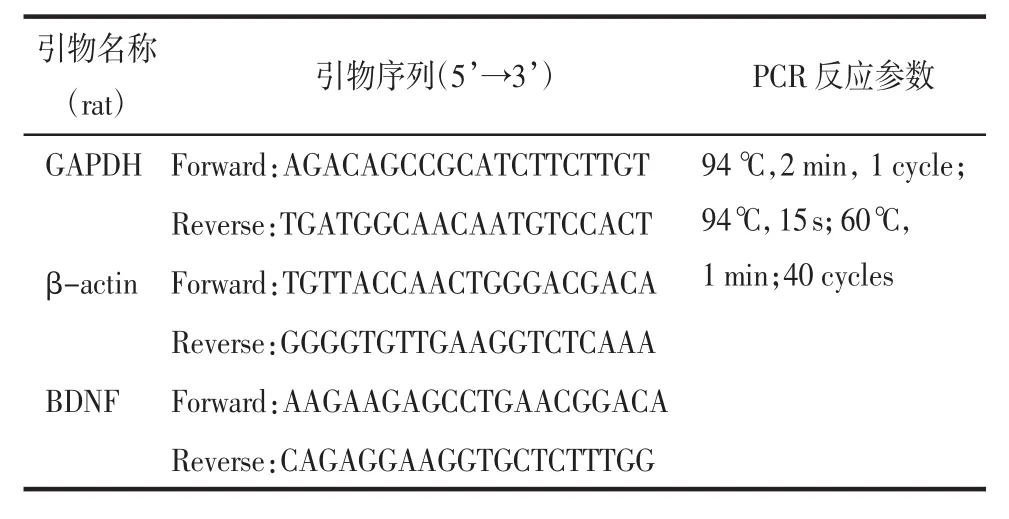
表1 RT-PCR引物序列及反应参数Tab.1 RT-PCR primer sequenceand reaction parameters
1.6 统计方法 实验数据以均数±标准差(x±s)表示,使用SPSS19.0软件进行数据统计分析。组间比较使用单因素方差分析(One-Way ANOVA)法,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 交泰丸对CUMS大鼠血浆和海马组织中cAMP含量的影响 模型组大鼠血浆和海马组织中cAMP含量均明显降低,与空白对照组比较有统计学差异(P<0.01)。阳性药对照组、交泰丸低、中、高剂量组均能够不同程度地升高大鼠血浆中和海马组织中cAMP的含量,与模型组比较具有统计学差异(P<0.05 或 P<0.01)。见表 2。
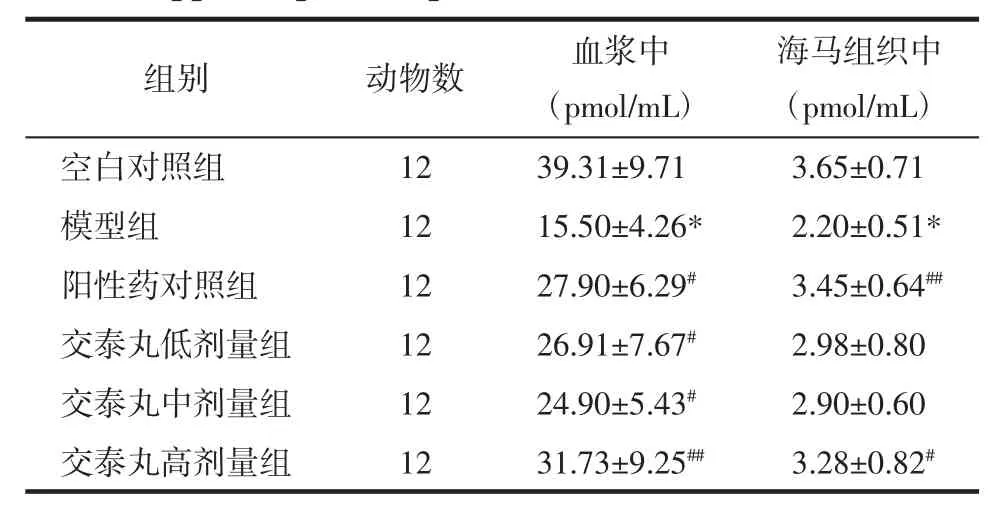
表2 交泰丸对CUMS大鼠脑海马组织和血浆中cAMP含量的影响(x±s)Tab.2 Effect of Jiaotaipill on the contents of cAMPin the hippocampusand plasma of CUMSrats(x±s)
2.2 交泰丸对CUMS大鼠海马组织中p-CREB、BDNF含量以及PDE活性影响 模型组大鼠海马组织中p-CREB、BDNF的含量明显下降,与空白对照组比较有统计学差异(P<0.01)。阳性药对照组、交泰丸低、中、高剂量组均能够不同程度地升高大鼠海马组织中p-CREB、BDNF的含量,与模型组比较有统计学差异(P<0.05 或 P<0.01)。模型组大鼠海马组织中PDE活性明显升高,与空白对照组比较有统计学差异(P<0.01)。阳性药对照组、交泰丸低、中、高剂量组均能够不同程度地降低大鼠海马组织中PDE的活性,其中阳性药对照组、交泰丸中、高剂量组与模型组比较具有统计学差异(P<0.05或P<0.01)。见表 3。
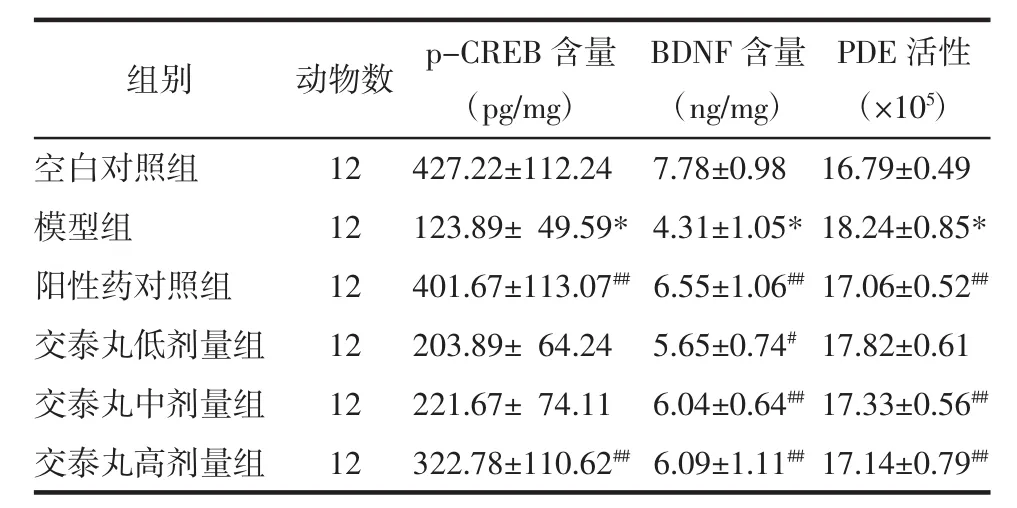
表3 交泰丸对CUMS大鼠海马组织中p-CREB、BDNF含量以及PDE活性的影响(x±s)Tab.3 Effect of Jiaotaipill on the contentsof p-CREB and BDNF and the activity of PDE in thehippocampusof CUMSrats(x±s)
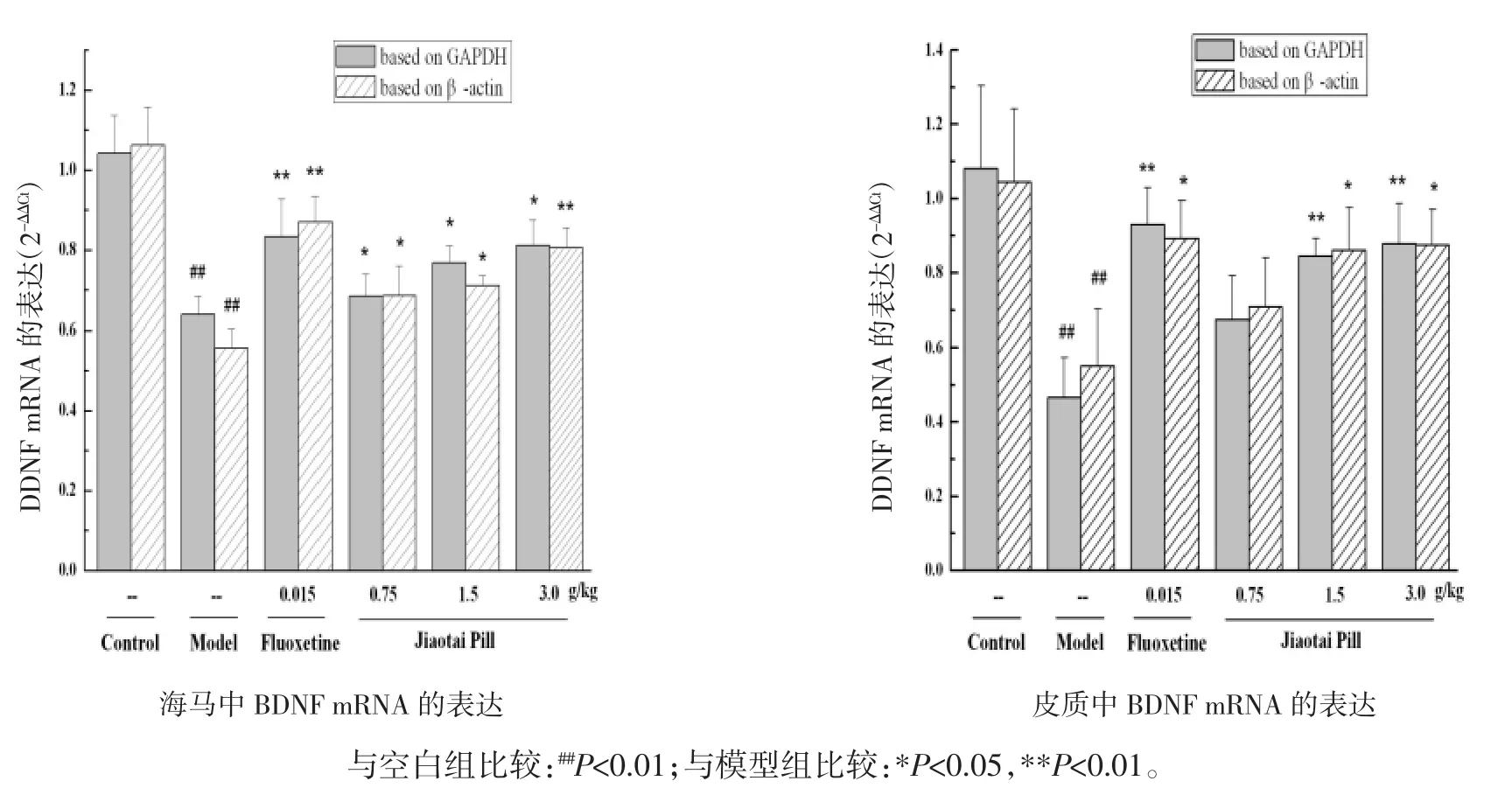
图1 交泰丸对CUMS大鼠海马、皮质中BDNF mRNA表达的影响Fig.1 Effect of Jiaotaipill on theexpression of BDNF mRNA in the hippocampusand cortex of CUMSrats
2.3 交泰丸对CUMS大鼠海马、皮质中BDNF mRNA表达的影响 以GAPDH作为内参引物时,模型组大鼠海马、皮质中BDNFmRNA表达显著降低,与空白对照组比较有统计学差异(P<0.01)。阳性药对照组、交泰丸低、中、高剂量组均能够不同程度地上调大鼠海马、皮质中BDNF mRNA的表达水平,与模型组比较具有统计学差异(P<0.05或P<0.01)。以β-actin作为内参引物时,模型组大鼠海马、皮质中BDNF mRNA表达显著降低,与空白对照组比较有统计学差异(P<0.01)。阳性药对照组、交泰丸低、中、高剂量组均能够不同程度地上调海马、皮质中BDNFmRNA的表达水平,与模型组比较具有统计学差异(P<0.05 或 P<0.01)。见图 1。
2.4 交泰丸对CUMS大鼠海马组织p-CREB阳性细胞表达影响 在大鼠脑内海马组织CA1区中,模型组大鼠p-CREB阳性细胞表达显著降低,与空白对照组比较有显著性差异(P<0.01)。阳性药组、交泰丸低、中、高剂量组均能够不同程度地上调海马组织中p-CREB细胞的表达水平,与模型组比较具有统计学差异(P<0.05 或 P<0.01)。在大鼠脑内海马组织CA3区中,模型组大鼠p-CREB阳性细胞表达显著降低,与空白对照组比较有统计学差异(P<0.01)。阳性药组、交泰丸低、中、高剂量组均能够不同程度地上调海马组织中p-CREB细胞的表达水平,与模型组比较具有统计学差异(P<0.05 或 P<0.01)。见图2。
3 讨论
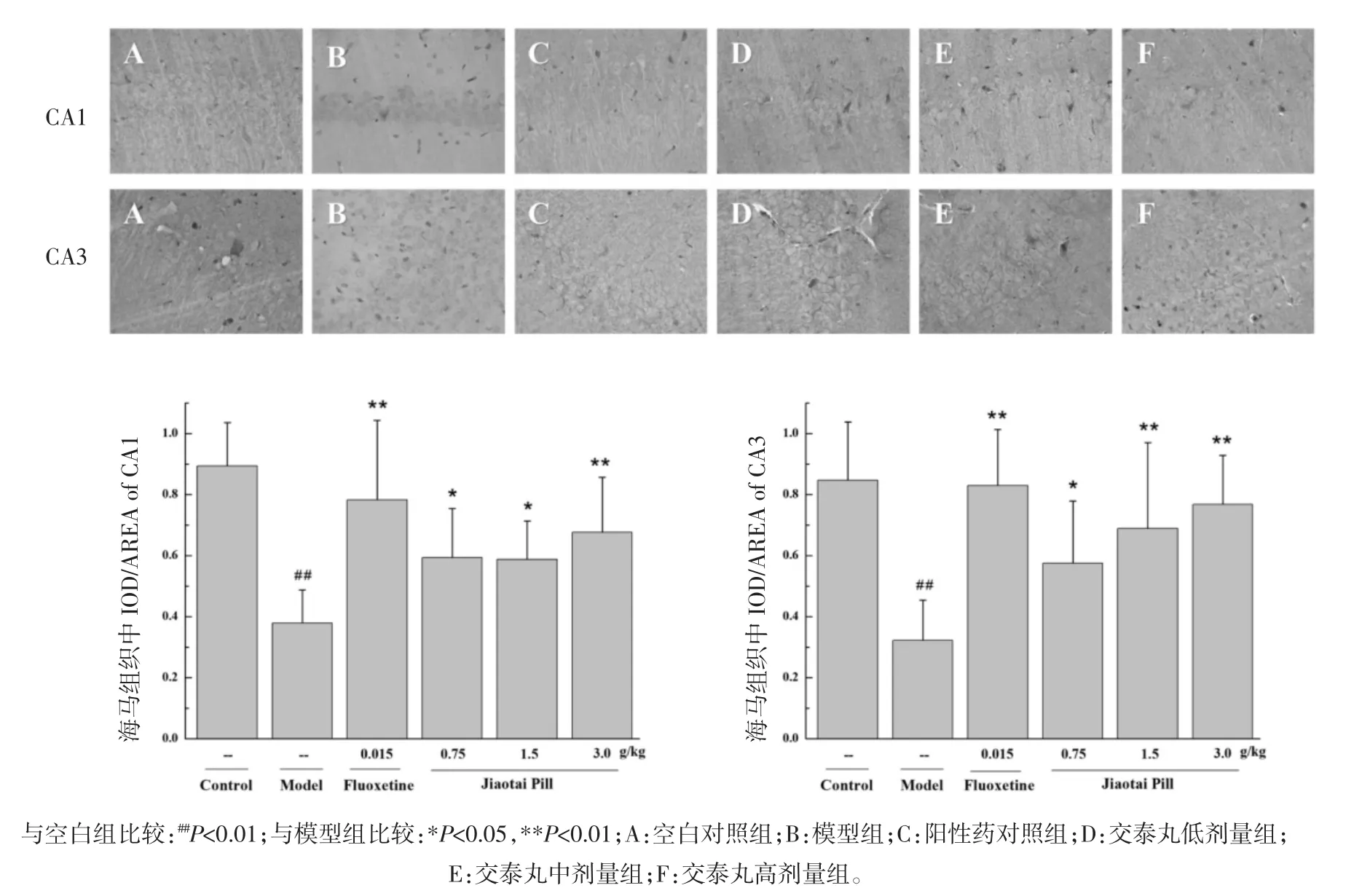
图2 交泰丸对CUMS大鼠脑内海马组织p-CREB阳性细胞表达影响(×400)Fig.2 The effect of Jiaotaipill on the expression of p-CREB positive cellsin the hippocampusof CUMSrats(×400)
本研究中采用CUMS建立大鼠抑郁症模型,此模型所展现出来的行动减少,兴趣缺乏以及快感缺失等抑郁状态,被认为与临床诊断为抑郁症的患者所展现出的精神运动改变、兴趣和快感的丧失有着密切的关系[16],是与临床实际最为贴切、最具代表性的抑郁症模型,有研究表明其相当于现代生活中3周左右的社会生活压力[17]。CUMS模型最早由Katz等提出,它被用于评估抗抑郁症药物的疗效,临床上几乎所有对于抑郁症有效的药物均可以在不同程度上逆转CUMS模型中抑郁样改变,据此说明该动物模型具有较好的预测性,而本课题组前期的研究[14]也表明交泰丸能够逆转CUMS大鼠的抑郁样改变。
目前cAMP-CREB-BDNF细胞信号转导通路是研究最早、最为深入的抗抑郁药物信号转导通路之一,经早期研究显示自杀死亡的抑郁症患者前额皮质cAMP含量有所降低,重症抑郁症患者尸体解剖研究显示其脑内海马CREB磷酸化水平均明显下降[18]。cAMP-CREB-BDNF信号转导通路被认为是抑郁症神经元再生关键性环节之一,与大脑的空间记忆以及学习功能相关[19]。在抑郁治疗过程中,CREB不仅能增强颗粒细胞神经元的整合和功能的可塑性,且可直接调控BDNF的合成及转录,BDNF是调节神经元活动最重要基因之一[20],参与轴突再生、树突生长和突触可塑性的调节,促进海马神经再生,从而发挥抗抑郁的作用。PDE作为抑制剂工具可通过上调cAMP-CREB-BDNF信号转导通路而起到改善认知功能、抗焦虑及抗抑郁的作用[21]。研究中通过检测抑郁症大鼠海马组织及血浆中cAMP的含量变化和大鼠海马中p-CREB、BDNF含量的变化,以及大鼠海马组织中BDNFmRNA的表达情况。结果发现交泰丸干预治疗抑郁症大鼠后,大鼠海马组织及血浆中的cAMP和海马组织中p-CREB、BDNF含量均明显上升,进一步研究显示在大鼠海马、皮质中BDNF mRNA均出现高表达,同时降低了PDE活性明显降低,逆转了CUMS大鼠海马组织CA1、CA3区的改变。综上说明交泰丸可通过调节cAMP-CREB-BDNF细胞信号传导通路的表达来达到抗抑郁的目的。
参考文献:
[1]Kessler RC,Berglund P,Demler O,et al.The epidemiology of major depressive disorder:results from the national comorbidity survey replication(NCS-R)[J].JAMA,2003,289(23):3095.
[2] Cui YH,Yang Y,Ni ZY,et al.Astroglial kin 4.1 in the lateral habenala drives hearonal bursts in depression[J].Nature,2016.doi:10.1038/natnre25752.
[3] Kulkarni SK,Dhir A.Current investigational drugs for major depression[J].Expert Opin Investig Drugs,2009,18(6):767-788.
[4] Fisar Z,Hroudová J.Intracellular signalling pathways and mood disorders[J].Folia Biol:praha,2010,56(4):135-148.
[5]Goldberg ND,Haddox MK,Nicol SE,et al.Biologic regulation through opposinginfluencesof cyclic GMPand cyclic AMP:the Yin Yanghypothesis[J].Adv Cyclic Nucleotide Res,1975,(5):307-330.
[6] 印会河,张伯讷.中医基础理论[M].北京:人民卫生出版社,1989:27-29.
[7] 于春泉,王 怡,高 杉,等.交泰丸不同配比抗抑郁作用的实验研究[J].中国实验方剂学杂志,2012,18(6):225-228.
[8] 于泽胜,潘 晔,宋彦奇,等.交泰丸对利血平诱导小鼠抑制模型的影响[J].天津中医药,2016,33(12):740-744.
[9] 张 敏,于春泉.交泰丸抗抑郁作用的研究进展[J].天津中医药,2012,29(1):101-104.
[10]Zhe Q,Sulei W,Weiwei T,et al.Effects of Jiaotaiwan on depressive-like behavior in mice after lipopolysaccharide administration[J].Metab Brain Dis,2017,32(2):415-426.
[11]Kulkarni SK,Dhir A.On the mechanism of antidepressant-like actionof berberinechloride[J].Eur JPharmacol,2008,589:163-172.
[12]Peng WH,Lo KL,Lee YH.Berberine produces antidepressant-like effectsintheforced swimtestand inthetail suspensiontestinmice[J].Life Sci,2007,81:933-938.
[13]Sohrabi R,Pazgoohan N,Seresht HR,et al.Repeated systemic administration of the cinnamon essential oil possesses anti-anxiety and anti-depressant activities in mice[J].Iranian Journal of Basic Medical Sciences,2017,20(6):708.
[14]杨 帅,潘 晔,宋彦奇,等.交泰丸对抑郁大鼠行为学及脑内单胺类神经递质的影响[J].中草药,2016,47(23):4218-4223.
[15]Gao S,Cui YL,Yu CQ,et al.Tetrandrineexertsantidepressant-like effects in animal models:role of brain-derived neurotrophic factor[J].Behavioural Brain Research,2013,238(1):79-85.
[16]Willner P.Validity,reliability and utility of the chronic mild stress model of depression:a 10-year review and evaluation[J].Psychopharmacology,1997,134(4):319.
[17]Cryan JF,Holmes A.The ascent of mouse:advances in modelling human depression and anxiety[J].Nature Reviews Drug Discovery,2005,4(9):775-790.
[18]Li YF,Huang Y,Amsdell SL,et al.Antidepressant-and anxiolyticlike effects of the phosphodiesterase-4 inhibitor rolipramon behavior depend on cyclic AMPresponseelement binding rotein-mediated neurogenesis in the hippocampus[J].Neuropsychopharmacology,2009,34(11):2404-2419.
[19]Bach ME,Barad M,Son H,et al.Age-related defects in spatial memory arecorrelated with defects in thelate phaseof hippocampal long-term potentiation in vitro and are attenuated by drugs that enhancethecAMPsignalingpathway[J].Proceedingsof the National Academy of Sciences of the United States of America,1999,96(9):5280.
[20]Ernfors P,Bengzon J,Kokaia Z,et al.Increased levels of messenger RNAs for neurotrophic factors in the brain during kindling epileptogenesis[J].Neuron,1991,7(1):165-176.
[21]Fujimaki K,Morinobu S,Duman RS.Administration of a cAMP phosphodiesterase 4 inhibitor enhances antidepressant-induction of BDNF mRNA in rat hippocampus[J].Neuropsychopharmacology,2000,22(1):42-51.

