不同大豆品种在萌发期对干旱胁迫的生理响应及抗旱性评价
赵振宁,赵宝勰
(白银市农业科学研究所, 甘肃 白银 730900)
随着全球性气候变暖,干旱缺水已经成为发展农业生产的主要限制因素。我国有45%的国土面积处于西部干旱或者半干旱地区,该地区降水量少、年内分配不均、空气干燥、地表蒸发量大,给主要农作物生产带来了严峻的挑战[1]。大豆(Glycinemax(L.) Merr)是我国重要的粮油兼用作物,营养价值高,是人类食物中植物蛋白质的主要来源。同时,大豆也是耗水量较大的作物,生育期内水分亏缺影响大豆正常生长发育及产量形成。因此,筛选大豆抗旱种质资源、培育抗旱节水品种被认为是发展干旱半干旱地区大豆生产的有效措施。
国内学者们在大豆不同生长发育时期抗旱性评价方面做了大量的工作,并筛选出一批抗旱种质资源[2-7]。种子萌发是植物整个生活史中的关键阶段,也是进行抗旱性研究的重要时期,萌发期遭遇干旱胁迫会影响出苗,最终造成产量损失。目前,萌发期抗旱性评价主要采用室内PEG溶液模拟干旱法,该方法具有周期短、容量大、重复性强以及受其它环境因子影响小等优点[8],已广泛应用于小麦(TriticumaestivumL.)[9-10]、玉米(ZeamaysL.)[11-12]、水稻(OryzasativaL.)[13-14]及大豆[15-16]等主要农作物萌发期抗旱性评价研究中。王利彬等[17]研究发现利用15% PEG-6000对大豆品种萌发期抗旱性鉴定指标影响明显,并在该浓度下将91份大豆种质资源划分为耐旱、较耐旱、中间型、干旱较敏感型以及干旱敏感型5大类;肖佳雷等[5]采用20% PEG-6000对78份大豆种质进行萌发期抗旱鉴定,筛选得到黑河53、合丰45、合丰48、绥农22及绥农30等5份抗旱种质;舒英杰等[18]以抗旱性不同的3个大豆品种为材料进行大豆发芽期耐旱性鉴定,认为室内采用PEG-6000浸种法模拟干旱胁迫鉴定大豆发芽期耐旱性的适宜浓度为20%~25%。可以看出,上述研究中所使用的PEG浓度(渗透压)不尽一致,即便在同一作物中也有所不同。因此,筛选出稳定、可靠的PEG处理浓度、建立切实可行的评价体系是进行萌发期抗旱评价的首要工作。
本试验通过分析不同浓度PEG-6000对3个大豆品种萌发相关指标的影响,确定了用于抗旱评价的最佳浓度,并在该浓度下研究了PEG-6000模拟干旱胁迫对不同大豆品种生理生化指标的影响,最后采用隶属函数法对3个品种的抗旱性进行综合评价,以期为大豆种质萌发期抗旱性鉴定评价体系建立以及抗旱新品种选育提供一定的理论基础。
1 材料与方法
1.1 试验材料培养与处理
大豆品种黄豆(野生种)、晋豆19、郑9007种子由甘肃省农业科学院国家农作物种质资源平台-甘肃子平台提供。挑选大小均匀一致、籽粒饱满的干净大豆种子,用0.5%次氯酸钠溶液消毒10 min,其间不断晃动,蒸馏水冲洗三遍后用无菌滤纸吸干,播于底部覆有双层无菌滤纸的直径为15 cm的培养皿中,每皿30粒,分别加入12%、14%、16%、18%及20%的PEG-6000溶液25 mL,并以无菌蒸馏水作为对照,置于温度为25℃、湿度为(65±2)%的智能人工气候培养箱(RTOP-150B,浙江托普仪器有限公司)中进行萌发试验。每个处理设3次重复,每天称重并补充蒸发的蒸馏水以维持溶液渗透势的恒定。
1.2 测定方法
1.2.1 生长指标的测定 胚芽长度超过种子长度时视为发芽,第3 d开始每天统计发芽种子数。发芽率(%)=(发芽试验期间全部正常发芽数/供试种子数)×100%,发芽势(%)=(第4 d正常发芽的种子粒数/供试种子数)×100%。萌发试验第7 d,每个培养皿随机抽取10株测量胚根长。
1.2.2 生理指标的测定 分别取经18%的PEG-6000溶液和蒸馏水培养7 d的胚根,蒸馏水冲洗干净后吸干水分用于测定SOD、POD及CAT活性、可溶性糖、可溶性蛋白、脯氨酸及丙二醛含量。其中,超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法[19],以抑制NBT光化还原50%所需酶量为1个酶活单位(U·g-1FW);过氧化物酶(POD)活性采用愈创木酚法测定[19],以每分钟OD值变化0.01为1个酶活单位(U·min-1·g-1FW);过氧化氢酶(Catalase, CAT)活性测定采用紫外分光光度计法[20],以每分钟OD值变化0.01为1个酶活性单位(U·min-1·g-1FW);可溶性糖含量测定采用蒽酮比色法测定[20];可溶性蛋白含量测定采用考马斯亮蓝染色法测定[20];脯氨酸含量的测定采用Troll等方法[21];丙二醛(MDA)含量采用硫代巴比妥酸比色法测定[22]。
1.3 数据处理
采用Microsoft Excel 2013和Origin8.5软件进行数据处理和绘图,采用SPSS 16.0统计分析软件对数据进行方差分析及最小显著差异性检验(Duncan’s新复极差法,P<0.05)。参照裴帅帅等[23]的方法进行基于隶属函数法的综合评价,首先计算各指标的相对值(PEG处理与正常条件下的比值),然后计算其隶属函数值,并求其平均值作为抗旱性评价的依据。隶属函数计算公式为:
U(Xi)=(Xi-Xmin)/(Xmax-Xmin)
(1)
U(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
(2)
其中,Xi为某一指标第i个品种的相对值;Xmin为某一指标的最小值;Xmax为某一指标的最大值。如果某一指标与抗旱性为正相关,用(1)式计算,反之,则用(2)式。
2 结果与分析
2.1 不同浓度PEG处理对3个大豆品种种子萌发相关指标的影响
随着PEG浓度的不断增加,3个大豆品种的相对发芽势、相对发芽率以及相对胚根长都呈现不同程度的下降趋势(表1)。在PEG浓度12%~14%之间时,3个大豆品种的相对发芽势、相对发芽率、相对胚根长均无显著差异(P>0.05),当PEG浓度增加到16%时,3个品种的相对发芽势和相对胚根长仍无显著差异(P>0.05),但黄豆和郑9007的相对发芽率显著高于晋豆19(P<0.05)。当浓度在18%~20%之间时,3个品种之间的相对发芽势、相对发芽率以及相对胚根长均差异显著(P<0.05)。由此可见,在18% PEG模拟干旱胁迫下,3个品种的萌发相关指标的差异明显。

表1 不同浓度PEG-6000处理对3个大豆品种萌发及胚根生长的影响
注:不同小写字母表示各品种间的差异达到显著水平(P<0.05),下同。
Note: Different small letters meant significant difference among treatments at 0.05 level. The same below.
2.2 PEG模拟干旱胁迫对3个大豆品种抗氧化酶活性的影响
SOD、POD和CAT是植物体内重要的抗氧化酶,其中SOD可以催化超氧阴离子(O2·)转化为过氧化氢(H2O2),POD和CAT将H2O2转化为H2O,它们在植物体清除过量ROS的生物过程中发挥着关键作用[24]。从图1中可以看出,在18% PEG-6000处理使3个大豆品种的SOD、POD及CAT活性发生了显著变化,在正常环境(CK)下,3个品种胚根SOD、POD及CAT活性均处于较低水平,18% PEG-6000处理下,3个品种(黄豆、晋豆19和郑9007)胚根SOD活性分别上升为CK的5.41、3.54和4.30倍,POD活性上升为CK的2.13、1.58和1.52倍,CAT活性上升为CK的2.64、2.41和1.98倍。通过多重比较发现,18% PEG-6000处理下3个品种胚根中SOD活性大小依次为黄豆>郑9007>晋豆19,其中黄豆与晋豆19和郑9007相比差异显著(P<0.05),而晋豆19和郑9007相比差异不显著(P>0.05);3个品种POD和CAT活性大小依次为黄豆>晋豆19>郑9007,其中,黄豆与郑9007和晋豆19相比差异显著(P<0.05),而郑9007和晋豆19相比差异不显著(P>0.05)。由以上结果可知,尽管18% PEG-6000使3个品种SOD、POD及CAT活性发生了明显变化,且黄豆在干旱胁迫下3种抗氧化酶活性的增长倍数明显高于晋豆19和郑9007,说明黄豆与晋豆19和郑9007相比可能具有更强的抗旱能力。
2.3 PEG模拟干旱胁迫对3个大豆品种渗透调节物质含量的影响
植物体内可溶性糖、可溶性蛋白及脯氨酸是重要的渗透调节物质,可以降低细胞的渗透势,保护细胞膜结构的完整性,在干旱逆境条件下这类物质可以提高植物的抗逆能力,也是评价植物抗旱性的重要生化指标[25-26]。由图2可知,3个大豆品种在正常条件(CK)下的可溶性糖、可溶性蛋白及脯氨酸含量相对稳定,品种间的差异不明显,在18% PEG处理下,3个大豆品种(黄豆、晋豆19和郑9007)可溶性糖含量分别上升为CK的2.84、2.60和2.56倍,可溶性蛋白含量上升为CK的2.13、1.42和1.10倍,脯氨酸含量上升为CK的10.98、6.74和8.90倍。相比而言,在18% PEG-6000处理下,3个品种可溶性糖、可溶性蛋白的积累量从大到小依次为黄豆>晋豆19>郑9007,脯氨酸的积累量从大到小依次为黄豆>郑9007>晋豆19,可以看出,在干旱胁迫下,黄豆与晋豆19、郑9007相比积累了更多的渗透调节物质,可能具有较强的抗旱性。
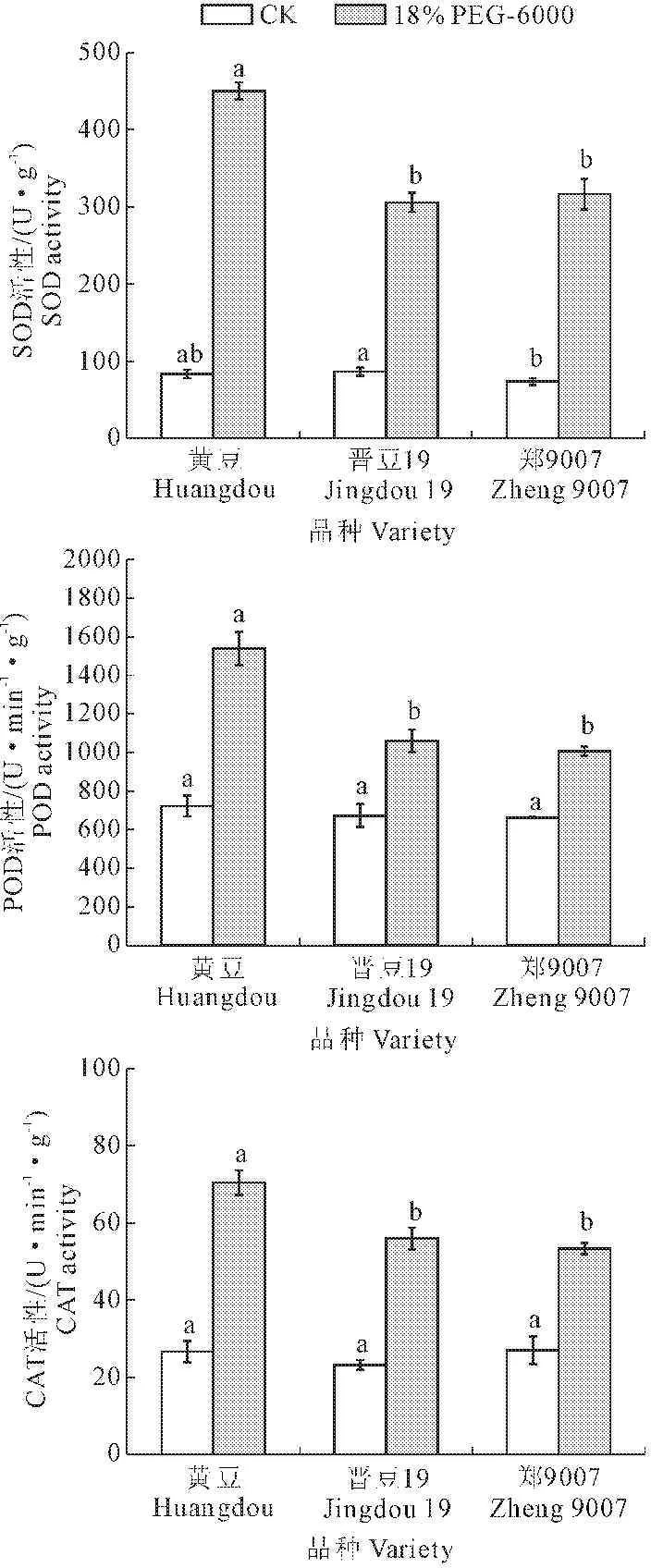
图1 PEG胁迫对三个大豆品种萌发期SOD、POD及CAT活性的影响
Fig.1 Effect of PEG stress on activities of SOD, POD and CAT of three soybean varieties during germination
2.4 PEG模拟干旱胁迫对3个大豆品种丙二醛含量的影响
在正常生长环境中,植物体内活性氧的产生与清除处于动态平衡状态,当植物遭受胁迫环境时这种平衡会被打破,导致H2O2、超氧阴离子(O2·)等活性氧(ROS)大量积累,并造成膜质过氧化产物MDA大量生成[27]。从图3中可以看出,正常条件下3个品种的MDA含量处于较低水平,但品种之间存在显著差异,在18% PEG-6000处理下,3个品种MDA含量分别升高为CK的1.59、3.24倍和2.85倍,胁迫下的MDA含量从小到大依次为黄豆<晋豆19<郑9007,可见在干旱胁迫下,黄豆的膜脂受伤害程度明显小于晋豆19和郑9007。


图2 PEG胁迫对三个大豆品种萌发期渗透调节物质含量的影响
图3 PEG胁迫对三个大豆品种萌发期丙二醛含量的影响
Fig.3 Effect of PEG stress on contents of MDA of three soybean varieties during germination
2.5 PEG模拟干旱胁迫下3个大豆品种耐受性指标隶属函数值及综合评价
抗旱性是复杂的数量遗传性状,单一指标评价品种抗旱能力存在片面性,通过计算各指标的相对值,进而计算隶属值,取某一品种各指标的隶属值的平均值进行综合抗旱评价,结果发现,黄豆、晋豆19和郑9007的抗旱性强弱依次为黄豆>郑9007>晋豆19,由此可见,大豆野生种黄豆的抗旱能力远远大于育成品种晋豆19和郑9007,利用野生种黄豆进行大豆抗旱遗传改良具有可行性。

表2 3个大豆品种耐旱指标隶属函数值及综合评价
3 讨 论
干旱是影响作物生长发育的常见非生物胁迫因素,因干旱造成的作物产量损失等于其它胁迫造成的产量损失之和[7]。在全球气候变化的背景下,研究大豆的抗旱性鉴定评价技术,对于筛选抗旱种质、培育节水品种以获高产稳产有重要意义。相比而言,提高大豆在萌发期的抗旱能力可以有效提高大豆在播种后的出苗率,可以有效提高干旱半干旱地区的大豆产量。目前,关于大豆萌发期抗旱性评价研究多使用室内PEG溶液模拟干旱胁迫,存在鉴定评价指标和PEG浓度不统一的问题。本研究中18% PEG-6000溶液处理能够区分3个品种之间的差异,可作为大豆萌发期抗旱性评价的PEG处理浓度。
大豆抗旱性的遗传基础复杂,依靠单一的萌发指标难以评价其抗旱能力,采用多个形态及生理指标进行综合评价可反映品种真实的抗旱水平[7]。SOD、POD及CAT在植物抵御干旱逆境反应中发挥着关键作用[28]。本研究发现,在18% PEG-6000干旱胁迫下,3个大豆品种SOD、POD及CAT活性与CK相比明显升高,同时,黄豆SOD、POD和CAT活性明显高于晋豆19和郑9007(P<0.05),但晋豆19和郑9007之间差异不显著(P>0.05),说明大豆野生种黄豆相比而言可能具有较强的抗旱能力,这与综合评价结果一致。渗透调节也是植物应对干旱胁迫的重要机制,干旱胁迫下,渗透调节物质含量的增加有助于维持细胞膨压,将水势维持在一定的水平,使细胞的正常生理代谢得以正常进行,脯氨酸等渗透调节物质对细胞内的ROS有直接的清除作用[29-30]。本研究中,干旱胁迫使3个品种的可溶性糖、可溶性蛋白以及脯氨酸含量均明显增加,这与许兴[31]、李树华[32]等的研究结果一致。在3个大豆品种中,黄豆的可溶性糖、可溶性蛋白及脯氨酸含量明显高于晋豆19和郑9007,说明黄豆的抗旱性较强。MDA是细胞膜脂过氧化的产物,其含量的高低在一定程度上反映了植物在干旱胁迫下的受伤害程度,3个品种的MDA含量从小到大为黄豆<晋豆19<郑9007,说明黄豆在干旱胁迫下的受伤害程度较小,可能具有较强的抗旱能力。
隶属函数分析提供了一条在多指标测定基础上对材料特性进行综合评价的途径,将它应用于抗旱育种的选择,可以大大提高抗旱性筛选的可靠性,已经广泛应用于农作物抗逆性综合评价[33-36]。通过对3个品种的萌发指标及生理生化指标进行隶属函数分析,最终确定了3个品种抗旱能力为黄豆>郑9007>晋豆19,黄豆的综合隶属函数值为0.997,而晋豆19和郑9007分别为0.176和0.219,可见大豆野生种黄豆的抗旱能力远远高于其它2个品种,可以利用这一种质资源进行大豆抗旱遗传改良,培育抗旱节水的大豆新品种。
参考文献:
[1] 吕 妍,王让会,蔡子颖.我国干旱半干旱地区气候变化及其影响[J].干旱区资源与环境,2009,23(11):65-71.
[2] 吴 伟,陈学珍,谢 皓,等.干旱胁迫下大豆抗旱性鉴定[J].分子植物育种,2005,3(2):188-194.
[3] 李贵全,张海燕,季 兰,等.不同大豆品种抗旱性综合评价[J].应用生态学报,2006,17(12):2408-2412.
[4] 王 敏,杨万明,侯燕平,等.不同类型大豆花荚期抗旱性形态指标及其综合评价[J].核农学报,2010,24(1):154-159.
[5] 肖佳雷,李 炜,来永才,等.黑龙江省春大豆种质资源芽期抗旱鉴定与筛选[J].作物杂志,2012(1):142-145.
[6] 王兴荣,张彦军,苟作旺,等.大豆种质资源抗旱性综合评价[J].干旱地区农业研究,2015,33(5):17-23.
[7] 祁旭升,刘章雄,关荣霞,等.大豆成株期抗旱性鉴定评价方法研究[J].作物学报,2012,38(4):665-674.
[8] 鞠 乐,齐军仓,成禄艳,等.大麦种子萌发期对干旱胁迫的生理响应及其抗旱性评价[J].西南农业学报,2013,26(1):93-98.
[9] 景蕊莲,昌小平.用渗透胁迫鉴定小麦种子萌发期抗旱性的方法分析[J].植物遗传资源学报,2003,4(4):292-296.
[10] 周国雁,隆文杰,雷涌涛,等.PEG处理下小麦种子萌发期的性状变化与品种抗旱性级别划分[J].西南农业学报,2015,28(6):2348-2354.
[11] 董志强,贾秀领,张丽华,等.玉米种子萌发期抗旱性鉴定方法及不同杂交种抗旱性比较研究[J].华北农学报,2012,27(1):178-183.
[12] 余贵海,起雪宏,王正启,等.14个玉米杂交种萌发期抗旱性评价[J].西南农业学报,2016,29(7):1499-1505.
[13] 敬礼恒,陈光辉,刘利成,等.水稻种子萌发期的抗旱性鉴定指标研究[J].杂交水稻,2014,29(3):65-69.
[14] 田又升,谢宗铭,吴向东,等.水稻种质资源萌发期抗旱性综合鉴定[J].干旱地区农业研究,2015,33(4):173-180.
[15] 王燕平,王晓梅,侯国强,等.室内模拟干旱对大豆萌发性状的影响及抗旱性评价[J].核农学报,2014,28(6):1133-1141.
[16] 周玉丽,朱 平,胡能兵,等.不同大豆品种发芽期耐旱性评价及耐旱种质筛选[J].大豆科学,2015,34(4):616-623.
[17] 王利彬,刘丽君,裴宇峰,等.大豆种质资源芽期抗旱性鉴定[J].东北农业大学学报,2012,43(1):36-43.
[18] 舒英杰,周玉丽,时侠清,等.大豆种子发芽期耐旱性鉴定的适宜PEG-6000浓度筛选[J].大豆科学,2015,34(1):56-59.
[19] 张志良,瞿伟菁.植物生理学实验指导(第3版)[M].北京:高等教育出版社,2003.
[20] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[21] Troll W, Lindsley J. A photometric method for the determination of proline[J]. Journal of Biological Chemistry, 1955,215(2):655-660.
[22] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[23] 裴帅帅,尹美强,温银元,等.不同品种谷子种子萌发期对干旱胁迫的生理响应及其抗旱性评价[J].核农学报,2014,28(10):1897-1904.
[24] Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions[J]. Plant Physiology, 2006,141:2391-2396.
[25] Rizhsky L, Liang H, Shuman J, et al. When defense pathways collide. The response of Arabidopsis to a combination of drought and heat stress[J]. Plant Physiology, 2004,134(4):1683-1696.
[26] Mahajan S, Tuteja N. Cold, salinity and drought stresses: an overview[J]. Archives of biochemistry and biophysics, 2005,444(2):139-158.
[27] 杜润峰,郝文芳,王龙飞.达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应[J].草业学报,2012,21(2):51-61.
[28] 聂石辉,齐军仓,张海禄,等.PEG6000模拟干旱胁迫对大麦幼苗丙二醛含量及保护酶活性的影响[J].新疆农业科学,2011,48(1):11-17.
[29] 王 娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学报,2001,18(4):459-465.
[30] 周 婵,杨允菲,李建东.松嫩平原两种趋异类型羊草对干旱胁迫的生理响应[J].应用生态学报,2002,13(9):1109-1112.
[31] 许 兴,郑国琦,邓西平,等.水分和盐分胁迫下春小麦幼苗渗透调节物质积累的比较研究[J].干旱地区农业研究,2002,20(1):52-56.
[32] 李树华,许 兴,米海莉,等.水分胁迫对牛心朴子植株生长及渗透调节物质积累的影响[J].西北植物学报,2003,23(4):592-596.
[33] 陈荣敏,杨学举,梁凤山,等.利用隶属函数法综合评价冬小麦的抗旱性[J].河北农业大学学报,2002,25(2):7-9.
[34] 严明建,黄文章,胡景涛,等.应用隶属函数法鉴定水稻的抗旱性[J].杂交水稻,2009,24(5):76-79.
[35] 杨进文,朱俊刚,王曙光,等.用GGE双标图及隶属函数综合分析山西小麦地方品种抗旱性[J].应用生态学报,2013,24(4):1031-1038.
[36] 祁旭升,王兴荣,许 军,等.胡麻种质资源成株期抗旱性评价[J].中国农业科学,2010,43(15):3076-3087.

