不同脂肪源对细鳞鲑生长、脂质代谢及抗氧化性能的影响
刘 洋 高 坚 曹小娟 尹家胜 刘红柏
(1. 中国水产科学研究院黑龙江水产研究所, 哈尔滨 150070; 2. 华中农业大学水产学院, 武汉 430070)
脂肪是水产动物维持其生命活动必需的营养物质。饲料脂肪是水产动物重要的能量和必需脂肪酸的来源, 也是脂溶性维生素的媒介体[1,2]。鱼油富含n-3系列高不饱和脂肪酸(n-3 HUFA), 一直是水产饲料的主要脂肪源。近年来, 由于水产养殖业的迅猛发展和高脂饲料的广泛应用, 致使鱼油的需求量持续增大, 价格不断攀升, 严重的影响了水产养殖业的健康可持续发展。因此, 寻找合适的替代脂肪源是水产饲料行业急需解决的产业问题[3]。植物油产量巨大、来源稳定且价格相对低廉, 是鱼油最可能的替代品之一。很多研究也证明了大豆油、菜籽油和棕榈油等植物油在水产饲料中具有较好的效果[4—6]。然而包括植物油在内的绝大多数的潜在替代脂肪源虽可有效的提供能量, 满足鱼类的生长需求, 却因缺乏n-3 HUFA而不具有理想的必需脂肪酸组成, 因而会显著影响鱼类的健康状态、鱼体脂肪酸组成和营养价值[2]。有研究显示,以葵花籽油为脂肪源的饲料投喂大西洋鲑(Salmo scalar)会导致其心血管功能紊乱及应激状态下死亡率增高[7]。不同的棕榈油替代水平对虹鳟(Oncorhynchus mykiss)的生长和饲料效率均没有明显影响, 但显著影响了鱼体脂类的代谢、降低了鱼肉中n-3 HUFA的含量[8]。因此, 鱼油的适宜替代水平、替代时间及如何最大程度降低替代品对鱼肉品质的负面影响应是鱼油替代技术关注的重点。
鲑鳟鱼类是世界上仅次于鲤科鱼类、罗非鱼的第三大养殖类群, 也是国际高端水产贸易品种和欧美发达国家主要的消费种类[9]。鲑鳟鱼类属典型的冷水性鱼类, 一般对脂类有较高的需求和利用能力, 且可以将C18 PUFA转化成HUFA, 是研究鱼油替代技术的理想种类。但不同种类对脂肪的利用方式和能力也存在较大差别, 如虹鳟在21%的脂肪水平下获得较好的生长[10], 褐鳟(Salmo trutto)在脂肪含量29%时获得更好的生长[11], 大西洋鲑则可以利用高达40%左右的脂肪水平[12]。对必需脂肪酸(EFA)而言, 虹鳟为18: 3n-3和n-3 HUFA, 而18: 2n-6和18: 3n-3对大麻哈鱼(Oncorhynchus kisutch)都具有必需脂肪酸的效果[13—15]。
细鳞鲑(Brachymystax lenok)隶属于鲑科细鳞鲑属, 是我国珍稀名贵的土著冷水性鱼类[16]。目前,细鳞鲑的全人工繁育技术已获成功, 黑龙江、辽宁、山东、山西等多省和地区开展了规模化的人工养殖, 取得了较为可观的经济和社会效益[17]。然而细鳞鲑营养与饲料的研究仍十分有限, 关于细鳞鲑的脂肪需求虽已有少量研究[18], 但未见不同脂肪源对细鳞鲑生长和生理机能影响的报道。本文通过研究不同脂肪源对细鳞鲑生长、脂代谢及抗氧化性能的影响, 旨在评价细鳞鲑对不同脂肪源的利用效果和差异, 筛选出适宜的替代脂肪源, 优化饲料配方和投喂策略。
1 材料与方法
1.1 实验饲料
实验基础饲料以脱脂鱼粉和豆粕为主要蛋白源, 玉米淀粉和糊化淀粉为糖源。在基础饲料中添加鱼油(FO)、菜籽油(CO)、棕榈油(PaO)及大豆油(SO), 共配制4种实验饲料(蛋白和脂肪水平分别为47%和12%)[18,19]。其中, 鱼油购自日本Riken Vitamin公司, 棕榈油购自上海益海嘉里食品营销有限公司, 菜籽油和大豆油则是通过压榨自制获得。每组饲料中均加0.02%的2, 6-二叔丁基对甲酚(BHT)作为抗氧化剂。所用固体原料混合前先粉碎, 过60目筛, 微量成分采取逐级扩大法添加。精确称量不同的油脂, 加入到预混好的所有粉状物中, 充分混匀后挤压制成直径为2 mm的颗粒, 阴凉通风处干燥后, 保存在–20℃冰箱中保存待用。饲料配方和饲料脂肪酸组成分别见表 1和表 2。
1.2 饲养管理
本实验在北京市怀柔区一渡河鱼场的流水圆形培育池中进行(鱼池直径2 m)。实验用细鳞鲑幼鱼来自中国水产科学研究院黑龙江水产研究所渤海冷水鱼试验站。实验鱼在流水圆形培育池中驯养4周以上, 驯养期间, 每天饱食投喂北京汉业科技有限公司生产的鲑鳟鱼商品饲料(粗蛋白49.17%,粗脂肪16.26%)。实验开始前, 挑选规格一致、健康的幼鱼, 随机分成4组, 每组3个重复, 每个重复25尾, 分别饲养于直径为80 cm的圆形网箱中, 每个流水圆形培育池放置3个网箱。实验期间, 每天饱食投喂2次, 水流速度控制在0.4—0.5 m/s, 溶解氧大于6 mg/L, 水温13—17℃, 水深30 cm, 自然光周期,实验持续52d。
1.3 样品采集
实验结束时, 将鱼饥饿24h后, 对每个网箱中的鱼进行称重和计数, 用于计算增重率、特定生长率和成活率等指标。从每个网箱中随机抽取4尾鱼进行样品采集(每个处理共12尾)。实验鱼经麻醉(MS222, 200 mg/L)后, 应用2.5mL一次性注射器尾静脉采血, 室温静置4h后, 4000 r/min离心15min, 取上清液, 置于液氮中保存, 同时采集肝脏和肌肉保存于液氮中, 采集的样品用于血清生化、组织粗成分分析、脂肪酸组成分析、抗氧化酶测定及基因表达分析。
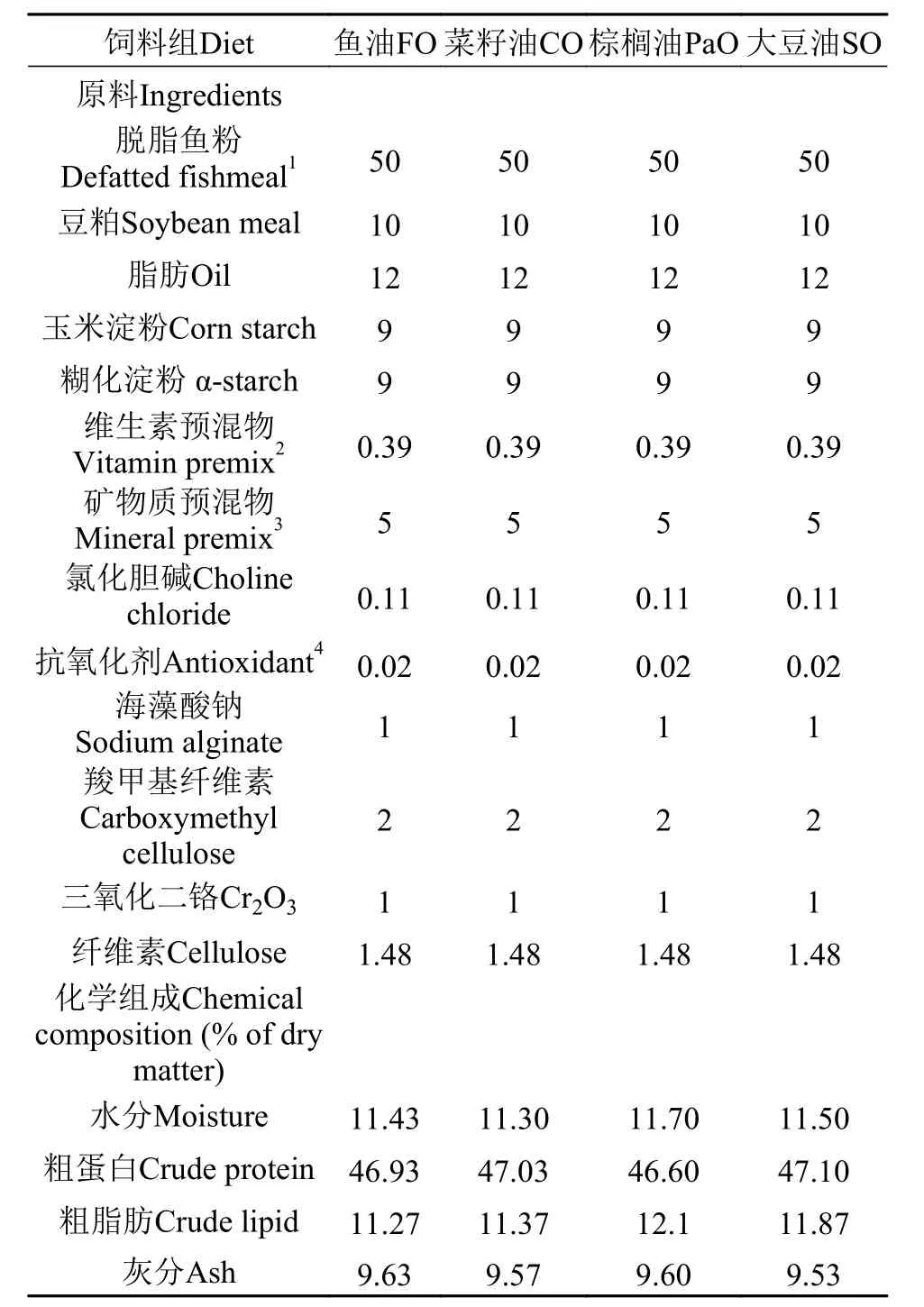
表 1 实验饲料配方及生化组成Tab. 1 Formulation and chemical composition of the experimental diets
1.4 样品分析
粗成分分析饲料和鱼体的干物质、粗蛋白、粗脂肪和灰分的测定参照AOAC[20]的方法进行。干物质在105℃烘箱烘至恒重, 通过失重法测定; 粗蛋白采用凯氏定氮法测定; 粗脂肪采用索氏抽提法测定; 灰分在550℃马福炉中焚烧3h, 通过失重法测定。
脂肪酸分析脂肪酸分析参照Bligh和Dyer[21]的方法进行, 然后采用固相萃取小柱(Sep-Pak Silica Cartridges; Waters Corp. Milford, MA)分离中性和极性脂肪, 并测得其含量。实验饲料和组织的脂肪酸组成分析采用气相色谱(Agilent Technologies Inc., SantaClara, California, USA; column:OmegawaxTM320)参照Teshima等[22]的方法进行。
血清生化及抗氧化酶测定血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL), 肝脏过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GPx)和活性氧(ROS)含量均采用南京建成生物与工程研究所试剂盒测定。详细步骤参见试剂盒说明书。TBARS值的测定是根据Burk等[23]的方法进行的。
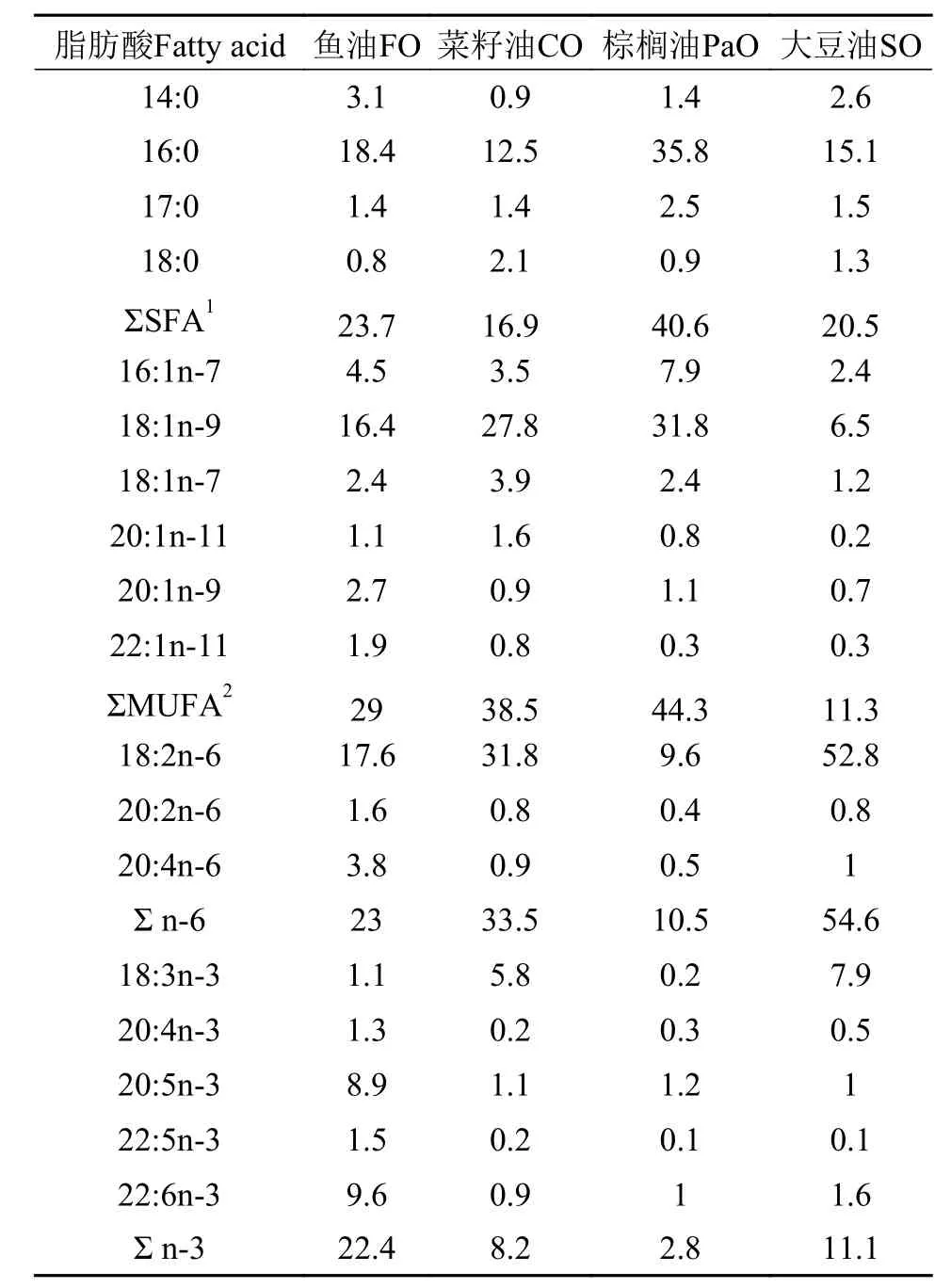
表 2 实验饲料脂肪酸组成(%总脂肪酸)Tab. 2 The fatty acid composition of experimental diets (% of total fatty acids)
基因表达总RNA利用Takara公司的RNAiso Plus试剂盒(Takara Co. Ltd, Tokyo Japan)进行提取。提取的总RNA样品进行琼脂糖凝胶电泳检测, 观察电泳条带, 将具有清晰的28S、18S和5S条带的RNA在Nanodrop 2000进行浓度及260 nm和280 nm下吸光度A值的检测, 并计算A260/A280的值。将此值在1.9—2.0之间, 浓度在130 ng/μL以上的RNA为模板, 利用Takara公司的PrimeScript™ II 1st Strand cDNA Synthesis Kit试剂盒进行逆转录反应。在PCR仪上进行反转录反应, 条件为: 37℃15min, 85℃ 5s。反应结束后将逆转录得到的cDNA稀释5倍, 于–20℃保存备用。
实时荧光定量PCR (qPCR)是利用特定基因引物来检测特定基因表达水平的方法。qPCR分析使用SYBR Green I fluorescence kit试剂盒(Bio-Rad,Hercules, CA, USA)在Mini Opticon real-time detector分析检测仪(BIO-RAD, Hercules, CA USA)上进行。反应体系总体积为20 μL, 包括: 10 μL SYBR®Green Real-time PCR Master Mix, 5 μL cDNA模板,2 μL引物(上下游引物各1 μL, 浓度为10 mmol/L)和3 μL H2O。引物见表 3。qPCR反应条件为: 95℃预变性30s; 95℃ 5s, 57℃ 30s, 72℃ 30s, 共40个循环。每个反应设3个重复。在qPCR分析之前, 对每对引物进行检测, 保证每条基因的扩增效率均在100%左右。相对表达水平采用2–ΔΔCt方法进行计算(Livak and Schmittgen 2001)。本实验选取β-actin作为内参基因, 其在各实验组细鳞鲑肝脏中的表达水平均无显著性差异。
1.5 数据分析
增重率(WG)、特定生长率(SGR)、摄食率(FR)、饲料效率(FE)及肝体指数(HSI)按下列公式计算:
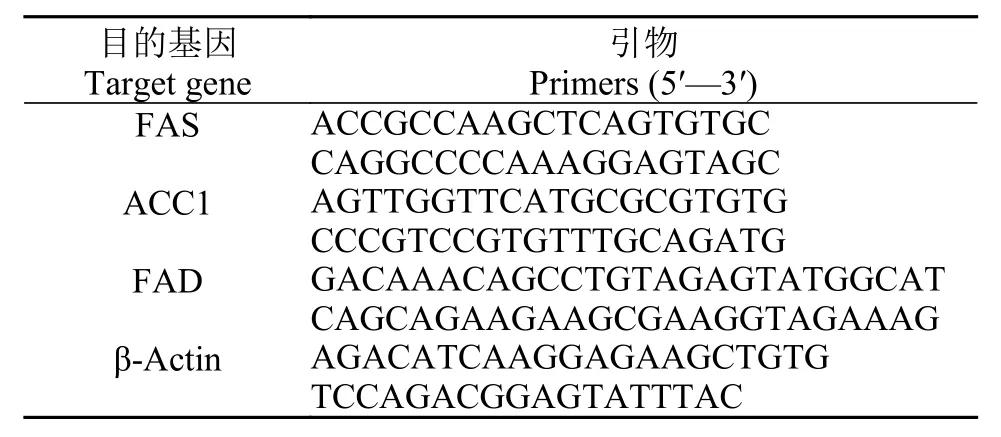
表 3 实时荧光定量PCR特异性引物Tab. 3 Specific primers for PCR used in the real-time fluorescent quantitation experiments
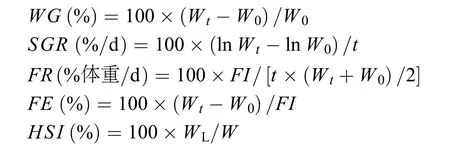
上述公式中的Wt(g)和W0(g)分别表示实验结束和实验开始时鱼体湿重,WL(g)表示肝脏湿重,t为实验天数,FI(g)为干物质摄食量。
应用统计软件Statistica 6.0进行统计分析。实验结果经过单因素方差分析(one-way ANOVA)后进行多重比较(Duncan’s multiple range tests), 显著性水平设为P<0.05。
2 结果
2.1 生长与饲料利用
如表 4所示, 各实验组的成活率均达98%以上,无显著差异(P>0.05)。各处理组细鳞鲑的摄食率无显著差异(P>0.05), 而增重率、特定生长率和饲料效率均以鱼油和大豆油组最高, 棕榈油组次之, 菜籽油组最低, 其中大豆油组与鱼油组无显著差异(P>0.05), 而棕榈油组和菜籽油组显著低于鱼油组(P<0.05)。
2.2 肌肉粗成分分析
如表 5所示, 不同脂肪源对细鳞鲑幼鱼肌肉水分、粗蛋白、粗脂肪和灰分均无显著影响(P>0.05)。
2.3 肌肉脂肪酸组成
表 6所示为不同脂肪源饲料对细鳞鲑幼鱼背肌的脂肪酸组成。结果显示鱼体肌肉脂肪酸组成明显的反映了实验饲料的脂肪酸组成。各组肌肉的脂肪酸都含有大量的16:0、18:1n-9、18:2n-6和22:6n-3。鱼油组的总n-3系列脂肪酸、EPA和DHA含量显著高于其他处理组(P<0.05), 棕榈油组的16:0和18:1n-9含量显著高于其他处理组(P<0.05),大豆油组18:2n-6含量显著高于其他处理(P<0.05),而菜籽油组的18:3n-3含量显著高于其他处理组(P<0.05)。
2.4 血清生化
如表 7所示, 投喂以大豆油为脂肪源的细鳞鲑幼鱼血清中甘油三酯含量显著高于其他处理组, 鱼油组为最低(P<0.05), 鱼油组总胆固醇含量显著高于其他处理组(P<0.05), 棕榈油的高密度脂蛋白含量显著低于其他处理组(P<0.05), 各处理组低密度脂蛋白含量没有显著差异(P>0.05)。
2.5 肝脏脂肪代谢相关基因表达
如图 1所示, 细鳞鲑幼鱼肝脏中ACC1、FAS和Δ6 Fad的mRNA表达水平受到饲料脂肪源的显著影响(P<0.05)。与鱼油组相比, 各植物油组的ACC1和FAS的mRNA表达量明显下调, 而Δ6 Fad的mRNA表达量则明显上调(P<0.05), 各植物油组之间没有显著差异(P>0.05)。

表 4 不同脂肪源对细鳞鲑幼鱼生长和饲料利用的影响Tab. 4 Effects of different dietary lipid sources on the growth performance and feed utilization of juvenile Brachymystax lenok (Mean±SE)
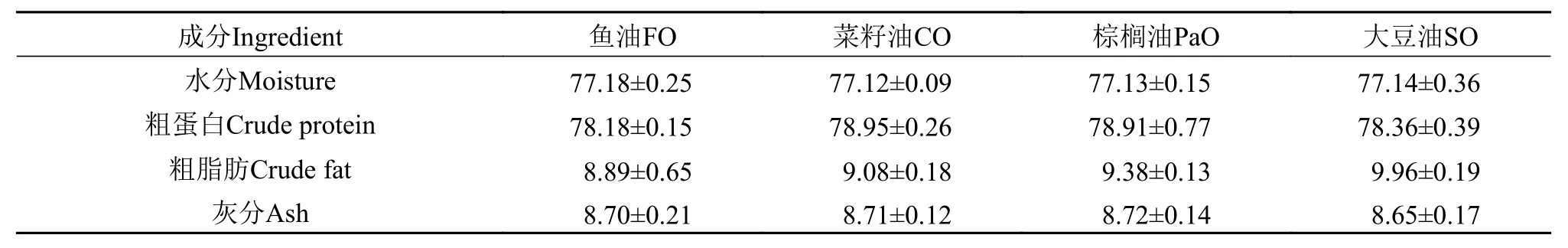
表 5 不同脂肪源对细鳞鲑幼鱼肌肉粗成分分析的影响Tab. 5 Effect of different dietary lipid sources on the crude components of muscle (dry-weight basis) in juvenile Brachymystax lenok(Mean±SE)
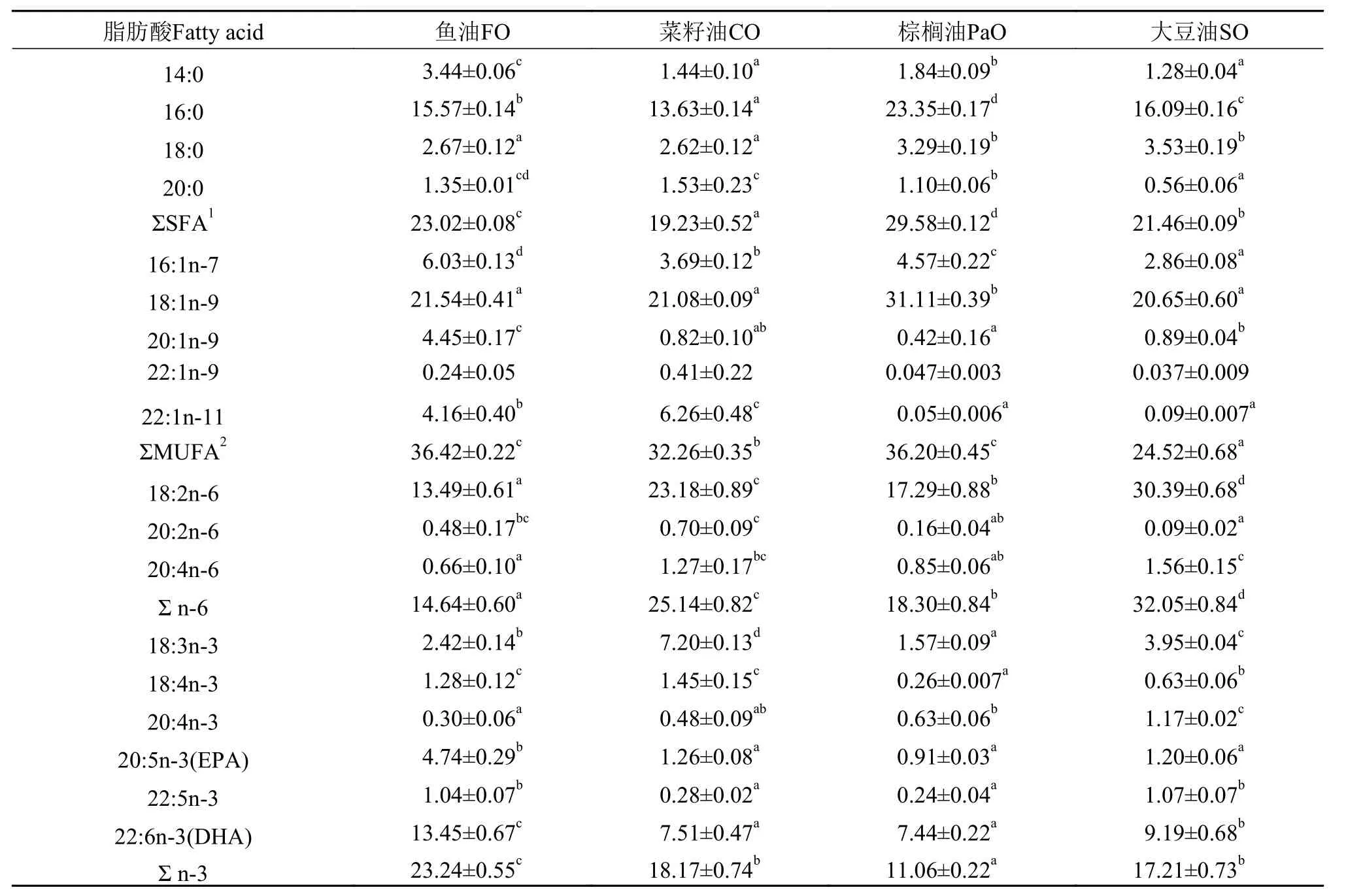
表 6 不同脂肪源对细鳞鲑幼鱼肌肉脂肪酸(%总脂肪酸)组成的影响Tab. 6 Effects of different dietary lipid sources on the fatty acid compositions of muscle lipid in juvenile Brachymystax lenok (% of total fatty acids, Mean±SE)

表 7 不同脂肪源对细鳞鲑幼鱼血清生化指标的影响Tab. 7 Effects of different dietary lipid sources on the biochemistry composition of serum in juvenile Brachymystax lenok (mmol/L,Mean±SE)
2.6 肝脏抗氧化酶活性和TBARS值
表 8所示为投喂不同脂肪源饲料的细鳞鲑幼鱼肝脏抗氧化酶含量。结果显示, 鱼油组和大豆油组的肝脏ROS含量显著高于菜籽油组(P<0.05); 各处理组的SOD和CAT含量无显著差异(P>0.05); 鱼油组和菜籽油组的MDA含量显著低于其他处理组(P<0.05); 大豆油组的GPx含量显著高于其他处理组(P<0.05); 鱼油组的TBARS值最高, 其次为大豆油组, 菜籽油和棕榈油组最低(P<0.05)。
3 讨论
3.1 生长与饲料利用
许多研究表明植物油可以部分甚至完全替代鱼油而不影响鱼类的生长[4,24]。本实验研究结果显示, 经过52d的投喂, 各处理组细鳞鲑的增重率达85%以上、成活率接近100%, 表明细鳞鲑幼鱼对各种脂肪源即鱼油、菜籽油、棕榈油和大豆油均表现出较好的吸收和利用能力。各处理组细鳞鲑的摄食率无显著差异, 但增重率、特定生长率和饲料效率均以鱼油和大豆油组最高, 棕榈油组次之, 菜籽油组最低, 其中大豆油组与鱼油组无显著差异(P>0.05), 而棕榈油组和菜籽油组显著低于鱼油组(P<0.05)。不同脂肪源对细鳞鲑生长影响的原因可能与细鳞鲑对不同脂肪酸的利用能力及由此导致的饲料转化率的差异有关。鲑鳟鱼类起主要作用的必需脂肪酸是n-3系列高不饱和脂肪酸, 并具有将18: 3n-3转化为n-3 HUFA的能力[25,26]。与其他鲑鳟鱼类相类似, 细鳞鲑能够很好的利用大豆油, 投喂含有大豆油的饲料在增重率上与鱼油组没有显著差异(P<0.05)。而大豆油不仅富含亚油酸(18:2n-6), 还含有丰富的n-3系列脂肪酸亚麻酸(18:3n-3),这可能是大豆油替代鱼油对细鳞鲑和其他鲑鳟鱼类具有良好效果的原因。棕榈油含有丰富的棕榈酸、油酸和亚油酸, 能够替代鱼油而不影响虹鳟和大西洋鲑的生长[4,27], 但在本实验中, 投喂棕榈油的细鳞鲑在生长性能显著低于鱼油组(P<0.05), 这可能是由于棕榈油中不含亚麻酸, 亚油酸含量低于大豆油以及细鳞鲑对棕榈油的利用能力较差造成。需要指出的是, 虽然棕榈油组生长性能低于大豆油组, 但却未达到显著性水平, 提示棕榈油仍然是细鳞鲑饲料潜在替代脂肪源的选择之一。许多研究表明以菜籽油投喂虹鳟、大西洋鲑、大鳞大麻哈(Onlorhyncus tshawytscha)、褐鳟对生长、饲料转化和成活都没有产生负面的影响[28—31]。但在本实验中投喂菜籽油的细鳞鲑在生长和饲料利用方面均不如鱼油和大豆油组。这可能与本实验中的脂肪水平、菜籽油中的亚油酸和亚麻酸含量, 以及细鳞鲑对菜籽油的利用效率有关。
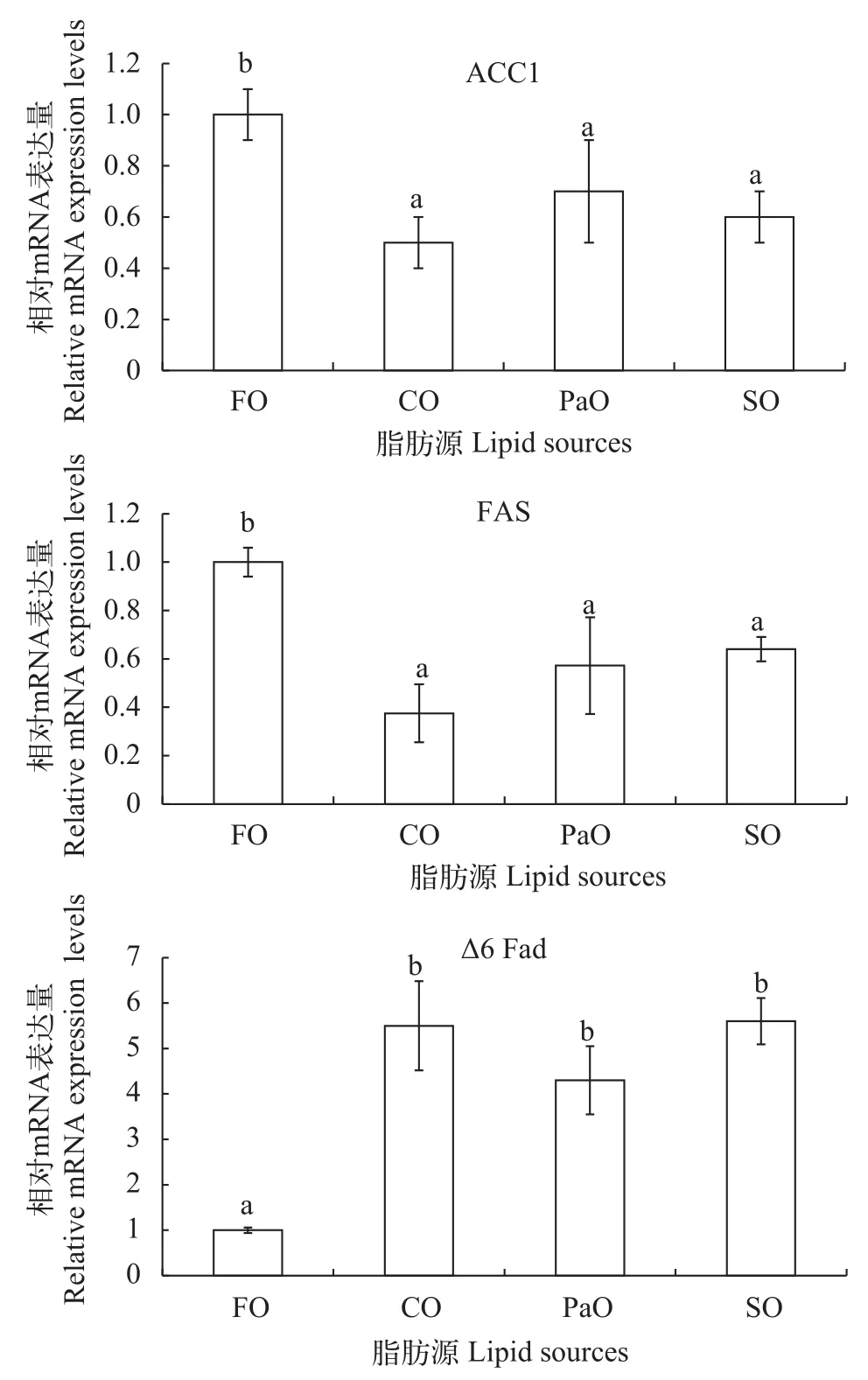
图 1 饲料脂肪水平对细鳞鲑肝脏脂肪代谢相关基因表达的影响Fig. 1 Effects of different dietary lipid sources on the mRNA expressions levels of the related genes involved in fatty acid metabolism in the liver of juvenile Brachymystax lenok
3.2 脂质代谢
在本实验中由于养殖时间较短, 投喂鱼油和植物油的细鳞鲑肌肉脂肪含量仅呈现出升高趋势并没有达到显著性的水平。血清生化指标可以及时准确的反映鱼体的生理状态。与鱼油相比, 植物油脂导致了细鳞鲑血清中甘油三酯含量的显著升高以及胆固醇含量的显著降低, 这也与淡水生活史阶段大西洋鲑的研究结果相一致[32]。导致这一结果的原因可能与饲料的脂肪酸组成有关。研究表明20:5n-3具有降低甘油三酯合成和分泌的功能[33], 这可能是摄食鱼油的细鳞鲑血清甘油三酯含量较低的原因。与鱼油相比, 植物油含有较高水平的植物甾醇, 而植物甾醇能够影响胆固醇的吸收和代谢[34],这可能是摄食植物油的细鳞鲑血清胆固醇含量降低的主要原因。
许多研究表明, 多种鱼类肌肉的脂肪酸组成与饲料的脂肪酸组成紧密相关[35]。本研究中投喂植物油为脂肪源的饲料导致细鳞鲑总n-3系列脂肪酸、EPA和DHA含量显著降低。这也与虹鳟[4]、大西洋鲑[36]和褐鳟[31]等鲑鳟鱼类的研究结果相一致。摄食含18:2n-6较多的饲料(大豆油和菜籽油)肌肉中的20:4n-6含量较其他组高, 但摄食亚油酸含量更为丰富的大豆油组和菜籽油组之间却没有呈现出显著差异, 说明细鳞鲑虽可以利用一定的18:2n-6, 但转化能力有限。然而, 摄食大豆油的细鳞鲑可以明显提升肌肉中的DHA含量, 表明细鳞鲑可以更好的利用18:3n-3, 这也应是摄食大豆油的细鳞鲑生长性能接近鱼油组的主要原因。
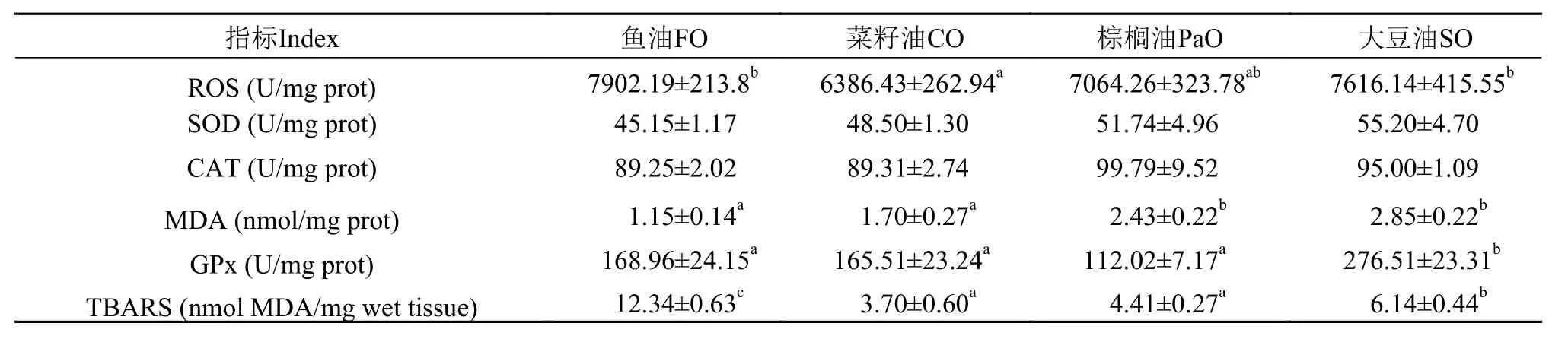
表 8 不同脂肪源对细鳞鲑幼鱼肝脏抗氧化酶活性和TBARS值的影响Tab. 8 Effects of different dietary lipid sources on the activities of anti-oxidant enzymes and TBARS value in the liver of juvenile Brachymystax lenok (Mean±SE)
肝脏是鱼类脂质代谢的主要器官, 因此, 我们也研究了不同脂肪源对肝脏主要脂质代谢酶mRNA表达量的影响。乙酰辅酶A羧化酶(ACC1)和脂肪酸合成酶(FAS)是脂肪酸合成过程中的主要限速酶,而脂肪酸去饱和酶(Δ6 Fad)在LC-PUFA的生物合成中发挥重要作用, 18:2n-6和18:3n-3都需要Δ6 Fad的催化作用转化为18:3n-6和18:4n-3才能完成后续的反应[37]。本研究中鱼油组的ACC1和FAS表达量都显著高于各植物油组, 而Δ6 Fad表达量显著低于各植物油组, 也进一步证明直接摄食富含DHA的鱼油更能促进细鳞鲑肌肉中n-3HUFA的积累, 而以植物油为脂肪源的细鳞鲑则需利用Δ6 Fad的去饱和作用合成HUFA。这也与其他鲑鳟鱼类的研究结果相类似, 与摄食鱼油相比, 摄食植物油也显著提高了大西洋鲑和虹鳟肝脏中 Δ6 Fad活性[38,39]。
3.3 抗氧化性能
活性氧(reactive oxygen species, ROS) 是需氧细胞在代谢过程中产生的一系列活性氧簇, 包括超氧自由基(O2)、过氧化氢(H2O2)和羟自由基(-OH)等[40]。低浓度时, ROS可能对一些过程是有益的或甚至是必不可少的, 如对微生物的防御, 促进吞噬细胞活性。相反, 高剂量与/或ROS清除不足会导致引发严重新陈代谢失调并最终使动物健康状态受损[41]。抗氧化酶是衡量机体健康与否的重要指标。抗氧化酶活力升高一方面能说明机体受到了一定的刺激; 同时另一方面也说明, 机体对外界刺激的反应能力很强, 通过提高酶的活力保护机体免受更深的损伤[42]。在本实验中, 除菜籽油组略低外,鱼油组、棕榈油组和大豆油组细鳞鲑肝脏的ROS水平没有显著差异, 表明投喂植物油对细鳞鲑没有造成明显的氧化损伤。但与鱼油组相比, 投喂植物油的细鳞鲑肝脏抗氧化酶活力多呈现升高的趋势, SOD、CAT虽没有显著差异, 但大豆油组的GPx和MDA水平及棕榈油组的MDA水平显著高于鱼油组。这一结果表明, 虽然投喂大豆油和棕榈油还没有造成细鳞鲑ROS水平的明显升高及氧化损伤, 但对细鳞鲑产生了一定程度的应激, 而细鳞鲑则通过提高抗氧化酶的活力来保护机体免受氧化损伤。大豆油和棕榈油的抗氧化酶活力最高, 且生长性能与鱼油组也最接近, 表明大豆油和棕榈油具有更好的提高鱼体抗氧化水平的能力, 这可能也与它们都富含天然抗氧化剂维生素E有关。
4 结论
菜籽油和棕榈油对细鳞鲑的生长性能产生一定的负面作用, 而鱼油和大豆油对细鳞鲑幼鱼的生长和鱼体粗成分的影响没有显著差异, 可作为细鳞鲑幼鱼的脂肪源。细鳞鲑具有将18:3n-3转化为22:6n-3的能力, 但转化18:2n-6的能力有限, 因此n-3系列脂肪酸是细鳞鲑起主要作用的必需脂肪酸。植物油会导致细鳞鲑肌肉n-3 HUFA含量显著降低,从而影响细鳞鲑的营养价值。
参考文献:
[1] Eya J C, Yossa R, Ashame M F,et al. Effects of dietary lipid levels on growth, feed utilization and mitochondrial function in low-and high-feed efficient families of rainbow trout (Oncorhynchus mykiss) [J].Aquaculture, 2013,214(416-417): 119—128
[2] Tocher D R. Metabolism and functions of lipids and fatty acids in teleost fish [J].Reviews in Fisheries Science,2003, 11(2): 107—184
[3] Sprague M, Walton J, Campbell P J,et al. Replacement of fish oil with a DHA-rich algal meal derived fromSchizochytriumsp. on the fatty acid and persistent organic pollutant levels in diets and flesh of Atlantic salmon(Salmo salarL.) post-smolts [J].Food Chemistry, 2015,185(8): 413—421
[4] Caballero M J, Obach A, Rosenlund G,et al. Impact of different dietary lipid sources on growth, lipid digestibility, tissue fatty acid composition and histology of rainbow trout,Oncorhynchus mykiss[J].Aquaculture, 2002,214(1-4): 253—271
[5] Twibell R G, Ostrand S, Gannam A L,et al. Evaluation of lipid sources in diets fed to bull trout,Salvelinus confluentus[J].Aquaculture Nutrition, 2016, 22(3): 675—682
[6] Feng J, Qin Z B. Effect of four dietary lipids on the performance of growth and body composition in pacific salmon,Oncorhynchuy[J].Acta Hydrobiologica Sinica,2006, 30(3): 256—261 [冯健, 覃志彪. 4种不同脂肪源对太平洋鲑生长和体组成的影响. 水生生物学报, 2006,30(3): 256—261]
[7] Bell J G, Mcvicar A H, Park M T,et al. High dietary linoleic acid affects the fatty acid compositions of individual phospholipids from tissues of Atlantic salmon(Salmo salar): association with stress susceptibility and cardiac lesion [J].Journal of Nutrition, 1991, 121(8): 1163—1172
[8]Fonseca-madrigal J, Karalazos K, Campbell P J,et al. Influence of dietary palm oil on growth, tissue fatty acid compositions, and fatty acid metabolism in liver and intestine in rainbow trout (Oncorhynchus mykiss) [J].Aquaculture Nutrition, 2005, 11(4): 241—250
[9] FAO. The state of world fisheries and aquaculture [M].Rome: FAO. 2008, 1—99
[10] Luzzana U, Serrini G, Moretti V M,et al. Effect of expanded feed with high fish oil content on growth and fatty acid composition of rainbow trout [J].Aquaculture International, 1994, 2(4): 239—248
[11] Arzel J, Cardinal M, Cornet J,et al. Effect of dietary lipid on growth performance and body composition of brown trout (Salmo trutta) reared in seawater [J].Aquaculture,1994, 123: 361—375
[12] Hemre G I, Sandnes K. Effect of dietary lipid level on muscle composition in Atlantic salmonSalmo salar[J].Aquaculture Nutrition, 1999, 5(1): 9—16
[13] Castell J D, Sinnhuber R O, Lee D J,et al. Essential fatty acids in the diet of rainbow trout (Salmo gairdneri):physiological symptoms of EFA deficiency [J].Journal of Nutrition, 1972, 102(1): 87—92
[14] Takeuchi T, Watanabe T. Effect of excess amounts of essential fatty acids on growth of rainbow trout [J].Bulletin of Japanese Society of Scientific Fisheries, 1979, 45:1517—1519
[15] Yu T C, Sinnhuber R O. Effect of dietary ω3 and ω6 fatty acids on growth and feed conversion efficiency of coho salmon (Oncorhynchus kisutch) [J].Aquaculture, 1979,16(1): 31—38
[16] Dong C Z, Jiang Z F. Inner Cold Water Fisheries in China[M]. Harbin: Heilongjiang Science and Technology Press.2008, 53—56 [董崇智, 姜作发. 中国内陆冷水性鱼类渔业资源. 哈尔滨: 黑龙江科学技术出版社. 2008,53—56]
[17] Mou Z B, Li Y F, Xu G F,et al. A technique of artificial reproduction and culture in manchurian troutBrachymystax lenok[J].Chinese Journal of Fisheries, 2013, 26(1):15—18 [牟振波, 李永发, 徐革锋, 等. 细鳞鱼全人工繁育技术的研究. 水产学杂志, 2013, 26(1): 15—18]
[18] Xu G, Wang Y, Han Y,et al. Growth, feed utilization and body composition of juvenile Manchurian trout,Brachymystax lenok(Pallas) fed different dietary protein and lipid levels [J].Aquaculture Nutrition, 2015, 21(3): 332—340
[19] Lee S M, Kim K D, Park H G,et al. Protein requirement of juvenile Manchurian troutBrachymystax lenok[J].Fisheries Science, 2001, 67(1): 46—51
[20] AOAC. Official Methods of Analysis of the Association of Official Analytical Chemists [M]. 15th edn. Association of Official Analytical Chemists, Arlington. 1990
[21] Bligh E G, Dyer W J. A rapid method for total lipid extraction and purification [J].Canadian Journal of Biochemistryand Physiology, 1959, 37: 911—917
[22] Teshima S, Kanazawa A, Yamashita M. Effects of dietary phospholipids on lipid transport in the juveniles prawn [J].Nippon Suisan Gakkaishi, 1986, 52: 159—163
[23] Burk R F, Trumble M J, Lawrence R A. Rat hepatic cytosolic GSH-dependent enzyme protection against lipid peroxidation in the NADPH microsomal lipid peroxidation system [J].Biochimica et Biophysica Acta, 1980,618(1): 35—41
[24] Bell J G, McEvoy J, Tocher D R,et al. Replacement of fish oil with rapeseed oil in diets of Atlantic salmon(Salmo salar) affects tissue lipid compositions and hepatocyte fatty acid metabolism [J].Journal of Nutrition,2001, 131(5): 1535—1543
[25] Morais S, Monroig O, Zheng X,et al. Highly unsaturated fatty acid synthesis in Atlantic salmon: characterization of ELOVL5-and ELOVL2-like elongases [J].Marine Biotechnology, 2009, 11(5): 627—639
[26] Owen J M, Adron J A, Middleton C,et al. Elongation and desaturation of dietary fatty acids in turbotScophtalmus maximusL., and rainbow trout,Salmo gairdneriirich [J].Lipids, 1975, 10(9): 528—531
[27] Bell J G, Henderson R J, Tocher D R,et al. Substituting fish oil with crude palm oil in the diet of Atlantic salmon(Salmo salar) affects muscle fatty acid composition and hepatic fatty acid metabolism [J].Journal of Nutrition,2002, 132(2): 222—230
[28] Dosanjh B S, Higgs D A, Plotnikoff M D,et al. Preliminary evaluation of canola oil, pork lard and marine lipid singly and in combination as supplemental dietary lipid sources for juvenile fall chinook salmon (Oncorhyncus tshawytscha) [J].Aquaculture, 1988, 68(4): 325—343
[29] Greene D H S, Selivonchick D P. Effects of dietary vegetable, animal and marine lipids on muscle lipid and hematology of rainbow trout (Oncorhynchus mykiss) [J].Aquaculture, 1990, 89(2): 165—182
[30] Hertrampf J W, Piedad-Pascual F. Handbook on Ingredients for Aquaculture Feeds [M]. Kluwer Academic Publishing, Dordrecht, The Netherlands. 2000, 573
[31] Turchinia G M, Mentastia T, Frøylandb L,et al. Effects of alternative dietary lipid sources on performance, tissue chemical composition, mitochondrial fatty acid oxidation capabilities and sensory characteristics in brown trout(Salmo truttaL.) [J].Aquaculture, 2003, 225(1):251—267
[32] Jordal A E O, Lie O, Torstensen B E. Complete replacement of dietary fish oil with a vegetable oil blend affect liver lipid and plasma lipoprotein levels in Atlantic salmon (Salmo salarL.) [J].Aquaculture Nutrition, 2007,13(2): 114—130
[33] Frøyland L, Madsen L, Vaagenes H,et al. Mitochondrion is the principal target for nutritional and pharmacological control of triglyceride metabolism [J].Journal of Lipid Research, 1997, 38(9): 1851—1858
[34]Orzechowski A, Ostaszewski P, Jank M,et al. Bioactive substances of plant origin in food-impact on genomics [J].Atheosclerosis, 2002, 10: 1—219
[35] Sargent J R, Tocher D R, Bell J G. The lipids [A]. In:Halver J E, Hardy R W (Eds.), Fish Nutrition. 3rd edn.[M]. San Diego: Academic Press. 2002, 181—257
[36] Waggbø R, Sandnes K O, Sandvin,et al. Chemical and sensory evaluation of fillets from Atlantic salmon (Salmo salar) fed three levels of n-3 polyunsaturated fatty acids at two levels of vitamin E [J].Food Chemistry, 1993,46(4): 361—366
[37] Leaver M J, Bautista J M, Bjornsson B T,et al. Towards fish lipid nutrigenomics: current state and prospects for fin-fish aquaculture [J].Reviews in Fisheries Science,2008, 16(suppl.): 73—94
[38] Zheng X Z, Tocher D R, Dickson C A,et al. Effects of diets containing vegetable oil on expression of genes involved in highly unsaturated fatty acid biosynthesis in liver of Atlantic salmon (Salmo salar) [J].Aquaculture, 2004b,236(1-4): 467—483
[39] Seiliez I, Panserat S, Kaushik S,et al. Cloning, tissue distribution and nutritional regulation of a delta 6-desaturase-like enzyme in rainbow trout [J].Comparative Biochemistry and PhysiologyPart B: Biochemistry & Molecular Biology, 2001, 130(1): 83—93
[40] Nordberg J, Arnér E S. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system [J].Free Radical Biology Medicine, 2001, 31(11): 1287—1312
[41] Zhang H, Mou Z, Xu L,et al. Dietary lipid level induced antioxidant response in manchurian trout,Brachymystax lenok(Pallas) larvae [J].Lipids, 2009, 44(7): 643—654
[42] Han Y Z, Jiang Z Z, Ren T J,et al. Effects of oxidized fish oil blended with palm oil on antioxidant capacity and histology of Japanese sea bass (Lateolabrax maculatus)juvenile [J].Journal of Fishery Sciences of China, 2010,17(4): 798—806 [韩雨哲, 姜志强, 任同军, 等. 氧化鱼油与棕榈油对花鲈肝脏抗氧化酶及组织结构的影响. 中国水产科学, 2010, 17(4): 798—806]

