侵蚀退化地植被恢复过程中芒萁对土壤可溶性有机碳的影响
任寅榜,吕茂奎,江 军,谢锦升,2,*
1 福建师范大学地理科学学院湿润亚热带山地生态国家重点实验室培育基地,福州 350007 2 福建师范大学地理研究所,福州 350007
土壤可溶性有机碳(DOC)是土壤活性有机碳的重要组成部分,在整个土壤形成过程和生物地球化学循环中起着重要的作用,常作为评价土地利用方式对土壤有机碳影响的一个敏感指标[1]。以往有关土壤DOC的研究主要集中在不同植被类型、土地利用方式、环境因子和土壤理化性质等对其的影响方面[2- 7]。而林下植被作为森林生态系统的重要组成部分,不仅能够保持水土、改良土壤、促进营养元素循环,且对土壤DOC的影响也不容忽视。侵蚀退化土地在植被恢复过程中,林下植被的地表覆被使土壤结构得到显著改善,土壤的抗侵蚀性明显加强,并使土壤的理化性质和微生物性质发生了一定的变化,从而影响了土壤DOC的组分和含量[8]。
红壤侵蚀区的生态恢复主要以马尾松林为主,芒萁作为酸性红壤区特有的林下植被,对侵蚀区植被的生态恢复发挥着重要的作用。去除与不去除林下植被芒萁的对比试验结果显示,去除芒萁不仅改变了土壤微环境和土壤生物的食物网结构,而且降低了凋落物的分解速率[9],对土壤N、P、K等养分元素和pH值都有显著的影响[10]。保留芒萁则增加了地表生物量,降低了地表裸露比例,地下生物量比重超过50%,细根生物量和根系分泌物显著增加[11- 13],有利于土壤有机碳的积累。然而,侵蚀红壤退化地植被恢复过程中林下植被对土壤DOC的作用目前尚未清楚。本文通过对比分析红壤侵蚀区植被恢复过程中,林下有无芒萁覆盖地土壤DOC含量及其与地下根系生物量、地上植被淋溶液DOC含量的关系,试图阐明植被恢复过程中马尾松林下植被芒萁对土壤DOC的影响及其机理,研究结果将对红壤侵蚀区生态恢复与重建技术如植物种的选择和林下植被管理具有重要意义。
1 材料与方法
1.1 研究区概况
研究区位于福建省西南部汀江上游的长汀县河田镇(25°33′—25°48′N,116°18′—116°31′E),属中亚热带典型季风气候区,年均气温17.5—19.2℃,极端最高气温与最低气温分别为39.8℃和-7.8℃。年均降雨量和蒸发量分别为1730mm与1403mm。年均日照时数1924.6h,年均无霜期260d,≥10℃积温为4100—4650℃[14]。河田镇属长汀县最大的河谷盆地,四周被低山高丘所环抱,中部地势开阔,平均海拔400m左右,土壤主要为燕山运动早期形成的中粗粒花岗岩发育的红壤,抗蚀抗冲性较差,地带性植被(常绿阔叶林)破坏殆尽,现有植被主要以马尾松(Pinusmassoniana)次生林和人工林为主,林下植被以芒萁(Dicranopterisdichotoma)为主。河田镇是全国极强度水土流失区之一,许多地方表土层丧失殆尽,植被恢复困难,据2003年土壤侵蚀遥感资料显示,河田镇的水土流失面积为13586.83hm2,己经占到全镇总土地面积的46.68%[15]。
1.2 样地设置
采用“时空代换”法,在河田镇选择土壤母岩均为花岗岩的未进行植被恢复的样地(Y0)、2001年(Y10)和1981年进行了植被恢复的样地(Y30)(表1)组成植被恢复年限序列。Y10和Y30植被恢复前土壤的本底条件与Y0基本一致,均为A层土壤流失殆尽,B层出露。
选择Y0,Y10,Y30的马尾松林,在每个马尾松林设置2种试验处理:即林下芒萁覆盖地(马尾松+芒萁)与林下裸露地(马尾松)。在每个试验样地分别设立3个20m×20m的标准样方(共18个标准样方),对芒萁覆盖地和裸露地进行本底和生物量调查。
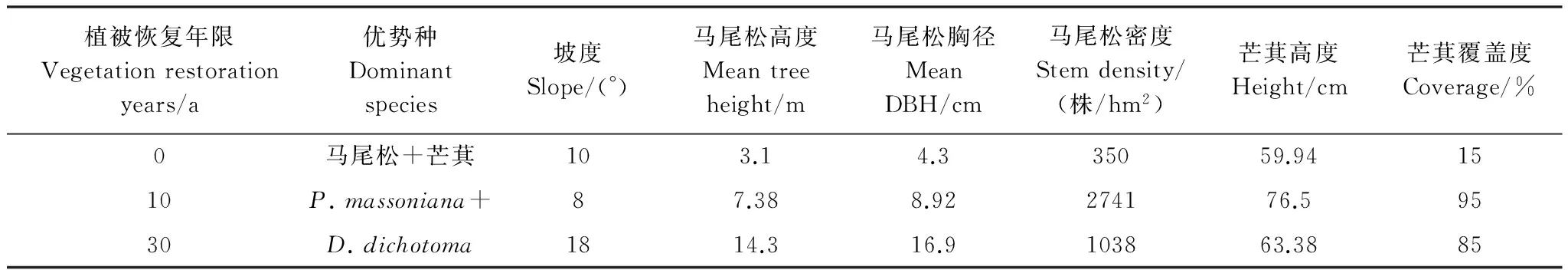
表1 样地基本概况
1.3 研究方法
1.3.1 土壤样品采集及处理
2011年12月下旬,在每个标准样方内,根据随机、等量、多点混合的原则,用内径5cm的取土钻按0—10,10—20,20—40,40—60,60—80,80—100cm分层取土,取样在芒萁覆盖区与裸露区分别进行,遵循最邻近原则,即选取了芒萁覆盖区的取样点后,就以其边界的裸露区作为取样点。为了使取样更具代表性,所有土样均由多点混合而成,每个土层的样品由5个取样点的土壤样品合成1份混合土样,每个处理取3个重复的混合土样,每个恢复年限的试验地共36份混合土样,总共108份混合土样。取回的新鲜土壤样品迅速冷藏,取部分土壤拣去石砾、植物根系与大于2mm的碎屑,然后在室内通风条件下风干,风干土样再进行研磨过0.149mm土壤筛,用于土壤理化性质、总有机碳等的测定;剩下过2mm土壤筛的新鲜土壤样品存于4℃冰箱中,用于土壤可溶性有机碳,微生物生物量碳的测定。
1.3.2 生物量测定
地上生物量测定:将标准样地分成4个10m×10m的亚样方,采用卷尺测量出每个亚样方内芒萁的高度,然后随机选择其中一个亚样方,用割草刀齐地割取样方内所有芒萁枝叶,并将芒萁新鲜枝叶和枯枝叶分开,同时收集洒落地表的芒萁枯落物,用电子秤称出芒萁枝叶与枯落物的鲜重,再从中选取部分样品,同样称鲜重后置于自封袋中,带回实验室在65℃烘箱中烘干,计算出含水率和芒萁地上部分生物量,另保留一部分样品用于植物淋溶实验。马尾松地上新鲜生物量采用马尾松异速生长方程(表2)[16],根据调查每个试验样地所得的胸径、树高等数据,计算出马尾松叶、枝、干、皮的生物量[15];马尾松枯落物通过收集每个亚样方地表枯落物,同样选取部分生物量带回实验室处理,计算出生物量;同时用高枝剪在每个亚样方收集马尾松的鲜叶,与马尾松枯落物一并用于植物淋溶实验。
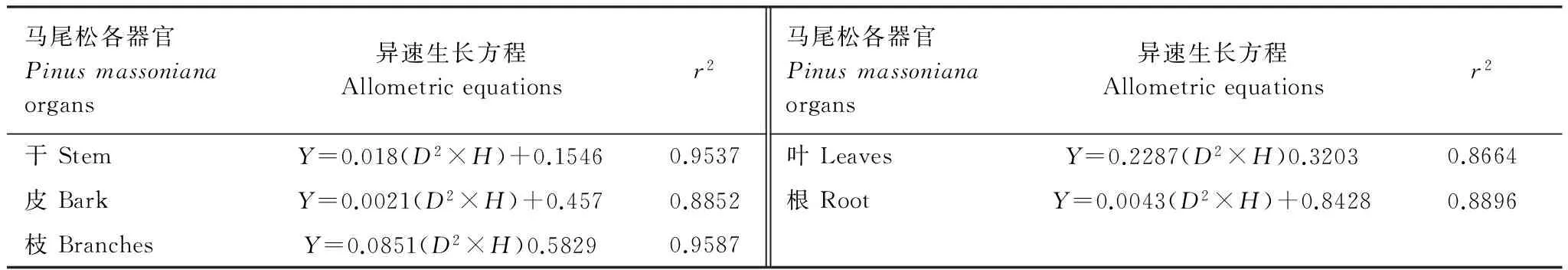
表2 马尾松异速生长方程
Y:生物量 Biomass (kg);D:胸径 Diameter at breast height (cm);H:树高 Tree height (m)
地下生物量测定:芒萁覆盖地区域,首先清理掉亚样方被割光芒萁地上茎叶的地表残留枯落物,然后挖取1m深的土壤剖面,以20cm×20cm的面积为标准,按土层0—10,10—20,20—40,40—60,60—80,80—100cm分层切割出单位面积的土块,装入写好标签的塑料袋中带回实验室。将每个土块浸泡于水中,待土块溶解后用土壤筛洗出土块里面的植物根系,并分别挑出每一土层芒萁、马尾松的根系以及杂根,装入信封中,置于65℃烘箱中烘干,得到根系干重,再根据土方面积,计算出芒萁与马尾松地下细根生物量;林下裸露地区域,去除裸露地表面枯落物,然后以同样方法得到马尾松地下细根生物量。
1.3.3 芒萁和马尾松叶片DOM的淋溶
叶片淋溶分别称取相当于10g干重的芒萁马尾松混合鲜叶、芒萁马尾松混合枯落物、马尾松鲜叶和马尾松枯落物样品(混合叶片样品按照芒萁和马尾松不同恢复年限的叶片生物量比例取样),装入PVC管(内径58mm、高11cm、底部放置微孔滤膜和玻璃纤维)中,置于布氏漏斗之上,漏斗下方放置玻璃瓶收集淋溶液,然后用200mL去离子水匀速淋洗PVC管内植物样品,待淋溶完之后用0.45μm微孔滤膜过滤,同时用压力为-0.09MPa的循环水真空泵进行抽滤处理,抽出的滤液置于尿杯中。
1.3.4 分析方法
土壤有机碳含量采用土壤元素分析仪(Elementar Vario EL III,德国)测定;滤出液的DOC样品用总有机碳分析仪(岛津TOC-VCPH,日本)测定淋溶液中DOC浓度;土壤可溶性有机碳的测定采用:准确称量10g过2mm土壤筛的新鲜土样,放入容积为50mL的一次性离心管中,加入40mL去离子水,先手动摇晃至水土充分混合,之后在往复震荡机上震荡30min,并在4000r离心机上离心10min,将上清液倒入装有孔径为0.45μm滤膜的过滤器中,同时用压力为-0.09MPa的循环水真空泵进行抽滤处理,抽出的滤液置于尿杯中,用总有机碳分析仪测定浸提液中DOC浓度;微生物生物量碳的测定采用氯仿熏蒸法,同样采用总有机碳分析仪测定K2SO4浸提液的有机碳浓度,MBC换算系数为0.38[17]。
1.4 数据分析
采用SPSS 19.0软件进行统计分析,运用最小显著差数法﹙LSD﹚进行同一恢复年限不同土层间基本理化性质差异的显著性检验,独立样本t检验方法进行同一土层不同处理间的理化性质差异的显著性检验(α=0.05)。运用Pearson相关系数评价不同因子之间的相关关系,细根生物量和土壤DOC储量的关系用Origin 9.0进行拟合。相关图表均用Origin 9.0软件完成。图表中数据为平均值±标准差。
2 结果与分析
2.1 土壤可溶性有机碳的分布特征及其占总有机碳的比例
红壤侵蚀区植被恢复过程中,林下芒萁覆盖地土壤DOC含量在各个土层均大于裸露地,且在0—20cm土层极显著大于裸露地(P<0.01),说明芒萁覆盖增加了土壤DOC的含量。在不同植被恢复时期,土壤DOC含量均随土层深度的增加而降低,Y30的下降率大于Y0和Y10(图1)。土壤DOC储量在林下芒萁覆盖地的各个土层之间差异显著(P<0.05),而在林下裸露地各个土层之间差异不显著(P>0.05)。在Y0、Y10、Y30中,表层(0—20cm)土壤DOC储量芒萁覆盖地分别是裸露地的1.86倍、1.76倍和2.16倍,深层(20—100cm)土壤DOC储量芒萁覆盖地分别是裸露地的1.28倍、1.08倍和1.30倍,说明芒萁覆盖对土壤表层DOC储量的影响大于深层土壤(表3)。不同植被恢复时期各试验地土壤DOC占SOC的比例均在1%以下(图2)。在垂直土层分布上,林下芒萁覆盖地与裸露地土壤DOC占SOC的比例均随土层深度的增加而升高。在所有土层,不同植被恢复时期林下裸露地DOC占SOC的比例均高于芒萁覆盖地,在Y0、Y10、Y30中,林下裸露地土壤DOC占SOC的比例分别是林下芒萁覆盖地的2.01倍、1.54倍和1.24倍。
2.2 芒萁地上生物量淋溶液DOC对土壤DOC的影响
林下芒萁覆盖地(马尾松+芒萁)鲜叶和枯落物叶片淋溶液DOC含量在不同植被恢复时期均显著高于裸露地(马尾松)(P<0.01)。不同植被恢复时期,芒萁覆盖地枯落物淋溶液DOC含量高于鲜叶(P<0.01)(图3),但马尾松地上鲜叶生物量显著大于枯落物,因此,芒萁覆盖地和裸露地的鲜叶淋溶液DOC储量显著大于枯落物淋溶液DOC(P<0.01)(表4)。芒萁生长过程中,枯落物不易分解,其枯落物生物量显著大于鲜叶。在林下芒萁覆盖作用下,枯落物生物量增加,鲜叶生物量增加不明显;在Y0、Y10、Y30中,林下芒萁覆盖地枯落物淋溶液DOC储量分别是裸露地的6.23倍、8.76倍和13.29倍,而鲜叶淋溶液DOC储量分别是裸露地的2.26倍、1.08倍和1.06倍(表4),说明芒萁覆盖增加了地表生物量,提高了叶片淋溶液DOC储量,且芒萁枯落物淋溶液对土壤DOC的影响更大。

图1 土壤DOC浓度垂直变化特征Fig.1 Contents of soil dissolved organic carbon in the vertical section大写字母表示不同处理间的相互比较,小写字母表示不同土层间的相互比较,相同字母差异不显著,不同字母则有显著差异(P<0.05);Y0:未恢复地 Without vegetation restoration; Y10:10年植被恢复地 Vegetation restoration for 10 years; Y30:30年植被恢复地 Vegetation restoration for 30 years
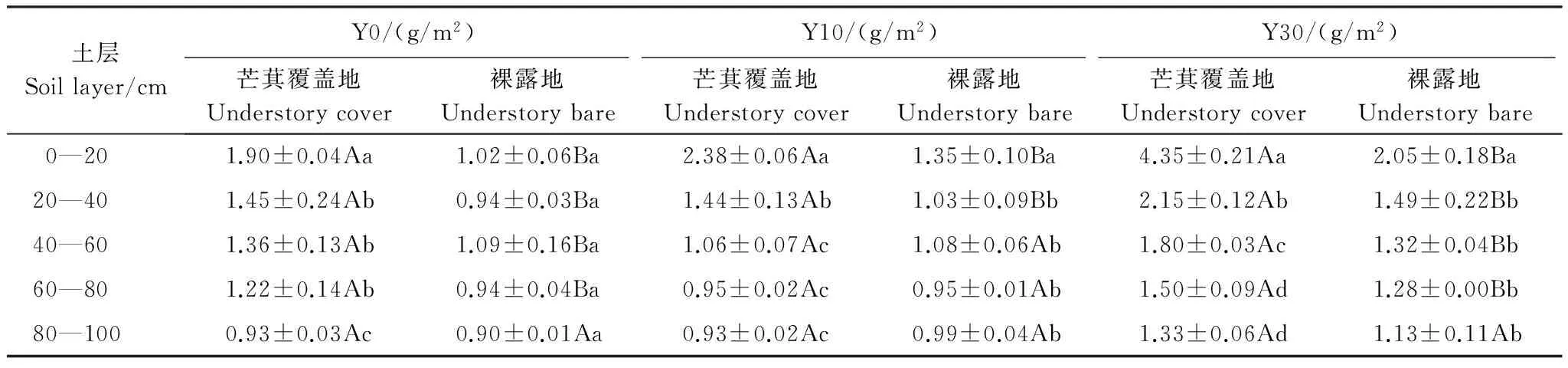
土层Soillayer/cmY0/(g/m2)Y10/(g/m2)Y30/(g/m2)芒萁覆盖地Understorycover裸露地Understorybare芒萁覆盖地Understorycover裸露地Understorybare芒萁覆盖地Understorycover裸露地Understorybare 0—201.90±0.04Aa1.02±0.06Ba2.38±0.06Aa1.35±0.10Ba4.35±0.21Aa2.05±0.18Ba20—401.45±0.24Ab0.94±0.03Ba1.44±0.13Ab1.03±0.09Bb2.15±0.12Ab1.49±0.22Bb40—601.36±0.13Ab1.09±0.16Ba1.06±0.07Ac1.08±0.06Ab1.80±0.03Ac1.32±0.04Bb60—801.22±0.14Ab0.94±0.04Ba0.95±0.02Ac0.95±0.01Ab1.50±0.09Ad1.28±0.00Bb80—1000.93±0.03Ac0.90±0.01Aa0.93±0.02Ac0.99±0.04Ab1.33±0.06Ad1.13±0.11Ab
Y0:未恢复地 Without vegetation restoration; Y10:10年植被恢复地 Vegetation restoration for 10 years; Y30:30年植被恢复地 Vegetation restoration for 30 years; 大写字母表示不同处理间的相互比较,小写字母表示不同土层间的相互比较,相同字母差异不显著,不同字母则有显著差异(P<0.05)
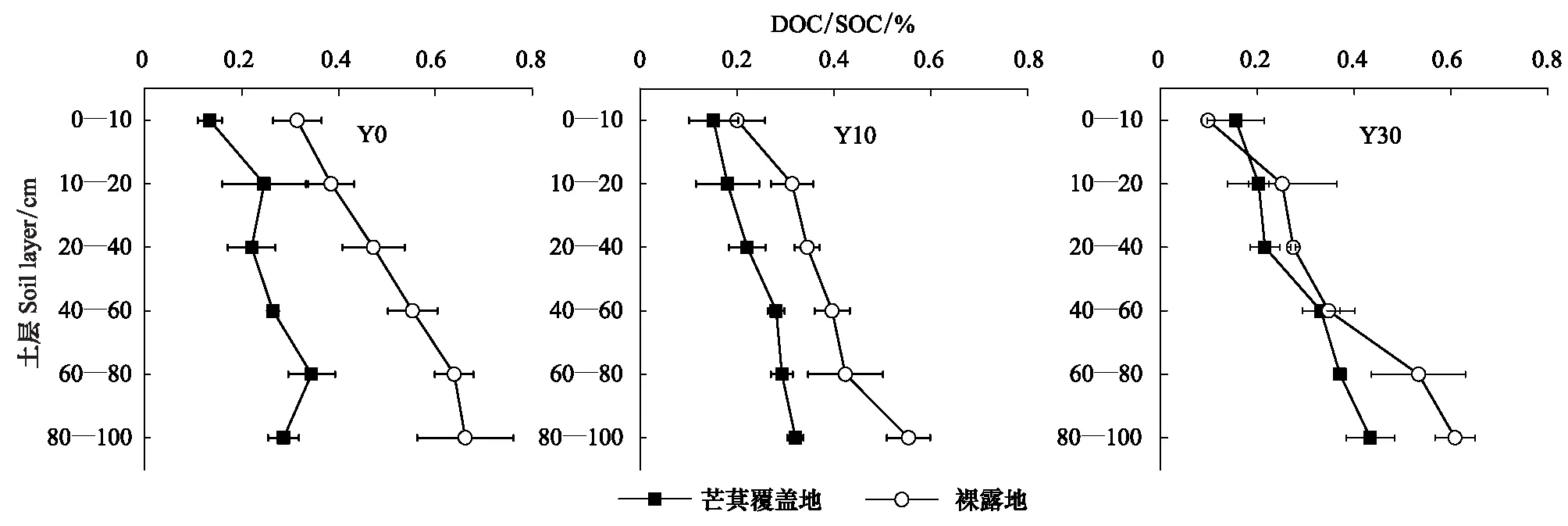
图2 土壤DOC占SOC的比例Fig.2 Soil dissolved organic carbon accounts for organic carbon ratioDOC:可溶性有机碳 Dissolved organic carbon; SOC:土壤有机碳 Soil organic carbon
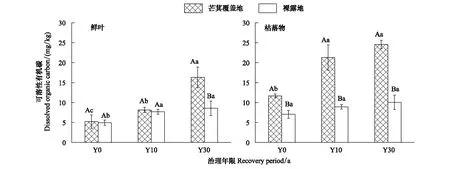
图3 叶片淋溶液DOC浓度变化特征Fig.3 Contents of leaf leachates dissolved organic carbon大写字母表示不同处理间的相互比较,小写字母表示不同恢复年限间的相互比较,相同字母差异不显著,不同字母则有显著差异(P<0.05)
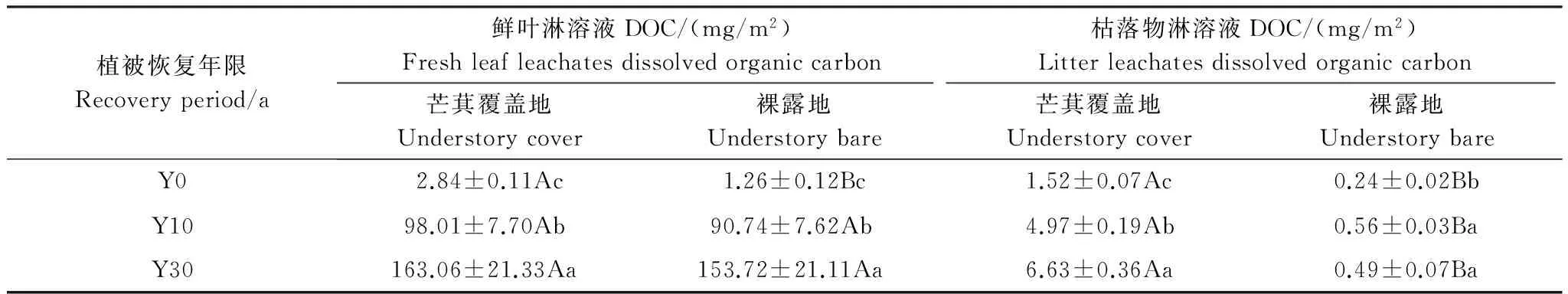
植被恢复年限Recoveryperiod/a鲜叶淋溶液DOC/(mg/m2)Freshleafleachatesdissolvedorganiccarbon枯落物淋溶液DOC/(mg/m2)Litterleachatesdissolvedorganiccarbon芒萁覆盖地Understorycover裸露地Understorybare芒萁覆盖地Understorycover裸露地UnderstorybareY02.84±0.11Ac1.26±0.12Bc1.52±0.07Ac0.24±0.02BbY1098.01±7.70Ab90.74±7.62Ab4.97±0.19Ab0.56±0.03BaY30163.06±21.33Aa153.72±21.11Aa6.63±0.36Aa0.49±0.07Ba
大写字母表示不同处理间的相互比较,小写字母表示不同恢复年限间的相互比较,相同字母差异不显著,不同字母则有显著差异(P<0.05)
2.3 芒萁地下细根生物量对土壤DOC的影响
林下芒萁覆盖地和裸露地土壤细根生物量在不同植被恢复时期均随土层深度增加而减少(图4)。在Y0、Y10、Y30中,林下芒萁覆盖地表层细根生物量分别是深层的7.56倍、3.45倍和3.59倍,而林下裸露地表层细根生物量分别是深层的5.78倍、4.55倍和5.72倍,说明在植被恢复初期芒萁覆盖增加了土壤表层的细根生物量,随植被恢复时间的增长,芒萁根系向土壤深层延伸,增加深层土壤根系生物量。t检验表明,芒萁覆盖地的细根生物量显著高于裸露地(P<0.01),且深层土壤细根生物量也具有显著差异性(P<0.05)。说明芒萁覆盖极大增加了土壤各土层的细根生物量,细根提供更多底物参与土壤物质与养分循环,从而影响土壤各土层DOC的周转与积累。
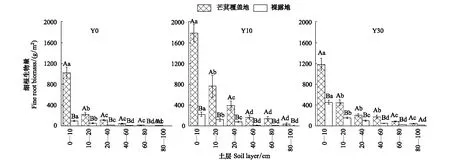
图4 细根生物量垂直变化特征Fig.4 Characteristics of fine root biomass in the vertical section大写字母表示不同处理间的相互比较,小写字母表示不同土层间的相互比较,相同字母差异不显著,不同字母则有显著差异(P<0.05)
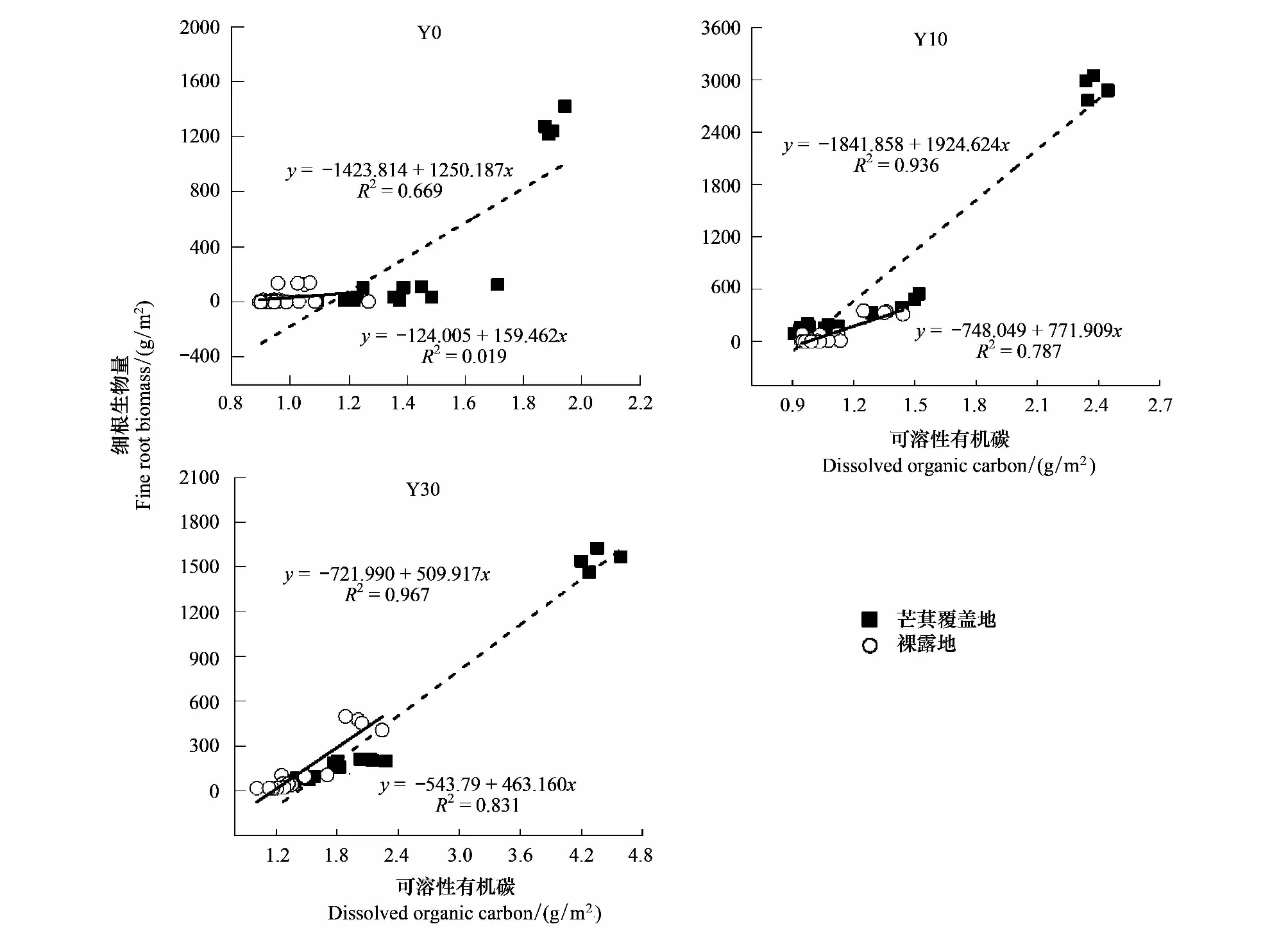
图5 细根生物量与土壤DOC的相关性分析Fig.5 Correlation between fine root biomass and soil dissolved organic carbon
2.4 细根生物量及叶片淋溶液DOC与土壤DOC的关系
皮尔逊相关分析发现,林下芒萁覆盖地土壤DOC储量与细根生物量的垂直变化呈显著的正相关关系(P<0.05)(图5),且随植被恢复年限的增加相关性显著增加;而林下裸露地在Y0中,土壤DOC与细根生物量无显著的相关性,Y10和Y30的相关性均小于芒萁覆盖地;说明林下芒萁根系的垂直分布对土壤DOC储量有显著的影响,且在植被恢复初期的贡献率更大。不同植被恢复时期,芒萁覆盖地鲜叶和枯落物淋溶液DOC与0—20、80—100cm土层的土壤DOC均呈极显著的正相关关系(P<0.01)(表5);林下裸露地土壤DOC与鲜叶淋溶液DOC呈显著正相关(P<0.01),与枯落物淋溶液DOC无显著相关性;说明林下芒萁覆盖地相对于裸露地枯落物淋溶液对土壤DOC储量的影响大于鲜叶;且在深层土壤,地下细根生物量相对于裸露地差异不明显,土壤DOC的来源可能是叶片淋溶液DOC在迁移过程中,受到该层矿物质的大量吸附得以储存。
2.5 芒萁对土壤微生物生物量碳和微生物熵的影响
不同植被恢复时期,林下芒萁覆盖地土壤微生物生物量碳(MBC)含量在不同土层均显著大于裸露地(P<0.05)。随植被恢复年限的延长,表层土壤MBC含量增加幅度显著大于深层(P<0.05),说明林下芒萁对土壤表层MBC含量的影响大于深层(图6)。各试验地,林下芒萁覆盖地土壤微生物熵均高于裸露地,说明相对于林下裸露地,芒萁覆盖为土壤微生物提供了丰富的碳源,促进了微生物的生长和繁殖。土壤微生物熵随土层深度的增加而降低,且Y0下降幅度大于Y10和Y30。林下芒萁覆盖地与裸露地土壤微生物熵随植被恢复年限的延长而增加,且覆盖地与裸露地差异性逐渐缩小(图7)。

表5 叶片淋溶液DOC与土壤DOC的相关性分析
**表示极显著相关(P<0.01)
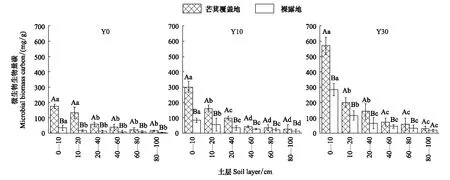
图6 土壤MBC浓度垂直变化特征Fig.6 Contents of soil microbial biomass carbon in the vertical section大写字母表示不同处理间的相互比较,小写字母表示不同土层间的相互比较,相同字母差异不显著,不同字母则有显著差异(P<0.05)
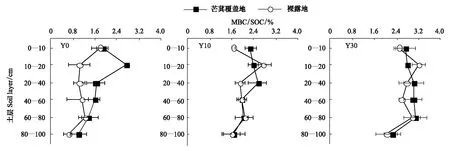
图7 土壤微生物熵垂直变化特征Fig.7 The change of soil microbial quotient in the vertical sectionMBC:微生物生物量碳 Microbial biomass carbon; SOC:土壤有机碳 Soil organic carbon
3 讨论
红壤侵蚀区植被恢复过程中林下芒萁覆盖地和裸露地土壤DOC的储量在空间和时间分布上差异显著,芒萁覆盖地土壤DOC储量高于裸露地,且随植被恢复年限的延长差异更显著。土壤DOC主要来源于地上植被叶片淋溶液DOC、新近凋落物、根系周转和分泌物以及微生物代谢[7]。土壤未分解层(Oi)输出的DOC量是分解层(Oa)和半分解层(Oe)之和的1.5倍[18],因此新近凋落物的添加引起土壤可溶性有机质的显著增加[19]。林下芒萁生长区域相比于裸露地立地条件好,地表温度下降,土壤水分蒸发减少,容重下降,含水率增加,地表植被覆盖率增加,凋落物生物量输入更为丰富。土壤中约80%的DOC来源于叶片淋溶液,特别是新近凋落物层[20- 21],穿透雨使易溶解物质迅速淋溶到土壤中,使土壤DOC含量显著增加[22]。穿透雨DOC浓度受树冠层结构和组成的影响,林冠结构越复杂,穿透雨中DOC浓度则越高[23]。在林下芒萁覆盖地,芒萁生物量厚实,增加了地表植物覆盖度,从而使芒萁覆盖地叶片淋溶液DOC含量大于裸露地。有研究发现芒萁淋溶液DOC浓度和结构显著高于多数乔木植物叶片淋溶液,林下芒萁叶片会释放更多的DOC[20,24]。穿透雨淋溶过程中,鲜叶和枯落物淋溶液DOC含量对土壤DOC储量的贡献也不同,叶片在凋落前有显著地氮磷养分回收,鲜叶在转向凋落物过程中,DOC流失较快,因此鲜叶的DOC含量大于枯落物[25]。但芒萁覆盖区,地上凋落物生物量显著大于芒萁鲜叶,因此芒萁枯落物淋溶液DOC含量对土壤DOC储量的贡献更大。当穿透雨通过土壤腐殖质层后,渗透水中DOC浓度提高,但渗透水由腐殖质层向矿质土层渗透时,DOC浓度降低,这主要与微生物的降解作用、土壤铁铝氧化物或氢氧化物、粘土矿物的吸附作用以及多价阳离子与DOC络合生成难溶沉淀物有关[26],其中土壤铁铝氧化物或氢氧化物、粘土矿物的吸附作用被认为是最主要的[27]。林下芒萁覆盖地0—20cm土层DOC储量显著大于20—100cm各个土层,主要是因为渗透液DOC在迁移过程中,受到矿物质的大量吸附得以保留于土壤表层。随着植被恢复年限的增加,芒萁覆盖地深层土壤DOC的储量逐渐增强,且被土壤吸附后能够较长时间的储存。可见,林下芒萁对土壤DOC的积累起着重要作用。
植物光合作用能够将光合产物的5%—25%通过根系分泌过程传输到土壤环境中,而其中的50%—75%是以可溶性有机物的形式存在;植物根系分泌包括氨基酸、有机酸以及糖等有机物质,这些有机物构成了土壤DOC的主要成分[28]。此外,植物的细根通过死亡与周转,改善土壤理化性质,影响土壤微环境和生物过程,因此地下的根系生物量是土壤DOC的重要来源。林下芒萁覆盖区域,密布成网的芒萁根系使土壤容重下降,芒萁根系碳的利用效率增强,进而促进侵蚀区马尾松林植被根系的大面积延伸,地下生物量显著增加,生物量的枯死物与分泌物是土壤DOC另一个重要的来源。相对于裸露地,芒萁覆盖区域地下根系生物量对土壤DOC的贡献更加明显。根系垂直分布直接影响土壤各层次DOC数量[29],林下芒萁根系在土壤表层的分布大于深层,土壤表层DOC含量也显著大于深层,且芒萁覆盖地土壤DOC储量的垂直下降幅度大于裸露区。随着植被恢复年限的增长,马尾松林分郁密度增加,林下喜阳性植物芒萁生物量减少。30年植被恢复样地各个土层的DOC储量最高,而芒萁地下生物量低于10年植被恢复样地,说明在植被恢复初期芒萁根系能够提供更多底物参与土壤物质与养分循环,对土壤DOC的储量贡献更大。
土壤活性有机碳的分配比例比活性有机碳总量更能反映土壤有机碳的状况[30],土壤可溶性有机碳占土壤总有机碳的比率亦是反映土壤碳稳定性的指标[31]。研究发现含量较高的土壤有机碳会减少胶体的吸附位点,从而阻碍土壤DOC的进一步吸附[32],在去除土壤部分有机碳后,土壤DOC的吸附量会增加[33]。林下芒萁覆盖地土壤DOC的分配比率小,表明土壤有机碳活性低、稳定性好。土壤的铁铝氧化物和粘土矿物能够有效的吸附土壤DOC,是保存土壤有机碳的重要机制,研究表明土壤黏粒含量与土壤DOC吸附能力呈显著正相关关系[34]。不同土地利用类型下,不同层次土壤溶解性有机碳的分配比例从上到下均表现出上升趋势,与溶解性有机碳随渗透水迁移分不开[35]。这与我们的研究结果一致,这可能与深层矿质土壤对DOC吸附能力较强,渗透水DOC随土壤水分迁移而被深层土壤固持。因此,土壤DOC随土层深度的增加,DOC的分配比率呈现出上升趋势。
土壤微生物是维持土壤质量的重要组成部分,直接参与土壤有机质分解和养分循环,能够快速反应生态系统过程的变化[36]。植被恢复过程中,植物可以有效的改变土壤物理性状,植物根系分泌物和枯落物残体增加土壤碳源,影响土壤物质循环,促进土壤养分积累,为微生物生长提供充足的物质来源,从而促进了微生物的繁殖[37]。林下芒萁覆盖地地上叶片生物量和地下生物量相对于单一的马尾松林下裸露地,植物多样性增加,同时增加了不同形态学特征(密度、结构)、不同化学特征(质量、数量)下资源输入的变异度,芒萁覆盖地地上叶片淋溶液DOC、凋落物残体、地上细根生物量分泌物促进了土壤DOC的积累,为土壤中不同种类的微生物生长繁殖提供不同的营养物质,微生物碳源利用率增加,促进了微生物对DOC的同化,因此林下芒萁覆盖地微生物熵高于林下裸露地。随着植被恢复年限的延长,林下芒萁生物量减少,但土壤微生物熵增大,林下芒萁覆盖地和裸露地微生物熵的差异性缩小,这可能是植被恢复前期芒萁生物量所积累的DOC为植被恢复后期的微生物提供了更多养分来源。同时,MBC含量的增加也是侵蚀红壤恢复过程中土壤DOC储量增加的重要影响因素之一。
参考文献(References):
[1] Tobiašová E. The effect of organic matter on the structure of soils of different land uses. Soil and Tillage Research, 2011, 114(2): 183- 192.
[2] Chantigny M H. Dissolved and water-extractable organic matter in soils: a review on the influence of land use and management practices. Geoderma, 2003, 113(3/4): 357- 380.
[3] 徐秋芳, 姜培坤. 不同森林植被下土壤水溶性有机碳研究. 水土保持学报, 2004, 18(6): 84- 87.
[4] 李新华, 郭洪海, 朱振林, 董红云, 杨丽萍, 张锡金. 不同秸秆还田模式对土壤有机碳及其活性组分的影响. 农业工程学报, 2016, 32(9): 130- 135.
[5] Ide J I, Ohashi M, Takahashi K, Sugiyama Y, Piirainen S, Kortelainen P, Fujitake N, Yamase K, Ohte N, Moritani M, Hara M, Finér L. Spatial variations in the molecular diversity of dissolved organic matter in water moving through a boreal forest in eastern Finland. Scientific Reports, 2017, 7: 48102.
[6] Sawicka K, Monteith D T, Vanguelova E I, Wade A J, Clark J M. Fine-scale temporal characterization of trends in soil water dissolved organic carbon and potential drivers. Ecological Indicators, 2016, 68: 36- 51.
[7] Kalbitz K, Solinger S, Park J H, Michalzik B, Matzner E. Controls on the dynamics of dissolved organic matter in soils: a review. Soil Science, 2000, 165(4): 277- 304.
[8] Nilsson M C, Wardle D A. Understory vegetation as a forest ecosystem driver: evidence from the northern Swedish boreal forest. Frontiers in Ecology and the Environment, 2005, 3(8): 421- 428.
[9] Zhao J, Wan S Z, Li Z A, Shao Y H, Xu G L, Liu Z F, Zhou L X, Fu S L.Dicranopteris-dominated understory as major driver of intensive forest ecosystem in humid subtropical and tropical region. Soil Biology and Biochemistry, 2012, 49: 78- 87.
[10] Liu Z F, Wu J P, Zhou L X, Lin X B, Fu S L. Effect of understory fern (Dicranopterisdichotoma) removal on substrate utilization patterns of culturable soil bacterial communities in subtropicalEucalyptusplantations. Pedobiologia, 2012, 55(1): 7- 13.
[11] 刘迎春, 刘琪璟, 汪宏清, 马泽清, 徐雯佳. 芒萁生物量分布特征. 生态学杂志, 2008, 27(5): 705- 711.
[12] Kume A, Satomura T, Tsuboi N, Chiwa M, Hanba Y T, Nakane K, Horikoshi T, Sakugawa H. Effects of understory vegetation on the ecophysiological characteristics of an overstory pine,Pinusdensiflora. Forest Ecology and Management, 2003, 176(1/3): 195- 203.
[13] 杜忠, 蔡小虎, 包维楷, 陈槐, 潘红丽. 林下层植被对上层乔木的影响研究综述. 应用生态学报, 2016, 27(3): 963- 972.
[14] 谢锦升, 杨玉盛, 杨智杰, 黄石德, 陈光水. 退化红壤植被恢复后土壤轻组有机质的季节动态. 应用生态学报, 2008, 19(3): 557- 563.
[15] 谢锦升. 生态恢复过程中碳贮存、能量及养分循环的变化[D]. 福州: 福建农林大学, 2002.
[16] 韩立立, 谢锦升, 曾宏达, 胥超, 何圣嘉, 杨玉盛. 百喜草治理对退化红壤生态系统碳库及分配的影响. 亚热带资源与环境学报, 2013, 8(1): 33- 40.
[17] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 228- 230.
[18] Michalzik B, Matzner E. Dynamics of dissolved organic nitrogen and carbon in a Central European Norway spruce ecosystem. European Journal of Soil Science, 1999, 50(4): 579- 590.
[19] Kalbitz K, Meyer A, Yang R, Gerstberger P. Response of dissolved organic matter in the forest floor to long-term manipulation of litter and throughfall inputs. Biogeochemistry, 2007, 86(3): 301- 318.
[20] 康根丽, 杨玉盛, 司友涛, 尹云锋, 刘翥, 陈光水,杨智杰. 米槠人促更新林与杉木人工林叶片及凋落物溶解性有机物的数量和光谱学特征. 生态学报, 2014, 34(8): 1946- 1955.
[21] Klotzbücher T, Kaiser K, Stepper C, Van Loon E, Gerstberger P, Kalbitz K. Long-term litter input manipulation effects on production and properties of dissolved organic matter in the forest floor of a Norway spruce stand. Plant and Soil, 2012, 355(1/2): 407- 416.
[22] 吕茂奎, 谢锦升, 江淼华, 罗水金, 曾少娟, 纪淑蓉, 万菁娟, 杨玉盛. 米槠常绿阔叶次生林和杉木人工林穿透雨和树干径流可溶性有机质浓度和质量的比较. 应用生态学报, 2014, 25(8): 2201- 2208.
[23] 吕茂奎, 谢锦升, 林廷武, 江淼华, 张浩, 王恩熙, 邱曦, 蒲晓婷, 杨玉盛. 降雨对米槠次生林和杉木人工林林冠可溶性有机碳迁移的影响. 水土保持学报, 2014, 28(5): 134- 138.
[24] 康根丽, 杨玉盛, 司友涛, 刘翥, 杨智杰. 马尾松与芒萁鲜叶及凋落物水溶性有机物的溶解特征和光谱学特征. 热带亚热带植物学报, 2014, 22(4): 357- 366.
[25] Tateno R, Takeda H. Nitrogen uptake and nitrogen use efficiency above and below ground along a topographic gradient of soil nitrogen availability. Oecologia, 2010, 163(3): 793- 804.
[26] Kalbitz K, Kaiser K. Contribution of dissolved organic matter to carbon storage in forest mineral soils. Journal of Plant Nutrition and Soil Science, 2008, 171(1): 52- 60.
[27] Dalva M, Moore T R. Sources and sinks of dissolved organic carbon in a forested swamp catchment. Biogeochemistry, 1991, 15(1): 1- 19.
[28] Rasmann S, Turlings T C J. Root signals that mediate mutualistic interactions in the rhizosphere. Current Opinion in Plant Biology, 2016, 32: 62- 68.
[29] Berger T W, Neubauer C, Glatzel G. Factors controlling soil carbon and nitrogen stores in pure stands of Norway spruce (Piceaabies) and mixed species stands in Austria. Forest Ecology and Management, 2002, 159(1/2): 3- 14.
[30] Zhao M X, Zhou J B, Kalbitz K. Carbon mineralization and properties of water-extractable organic carbon in soils of the south Loess Plateau in China. European Journal of Soil Biology, 2008, 44(2): 158- 165.
[31] 朱志建, 姜培坤, 徐秋芳. 不同森林植被下土壤微生物量碳和易氧化态碳的比较. 林业科学研究, 2006, 19(4): 523- 526.
[32] Trumbore S E, Schiff S L, Aravena R, Elgood R. Sources and transformation of dissolved organic carbon in the Harp Lake Forested catchment: the role of soils. Radiocarbon, 1992, 34(3): 626- 635.
[33] Shen Y H. Sorption of natural dissolved organic matter on soil. Chemosphere, 1999, 38(7): 1505- 1515.
[34] Kothawala D N, Roehm C, Blodau C, Moore T R. Selective adsorption of dissolved organic matter to mineral soils. Geoderma, 2012, 189- 190: 334- 342.
[35] 宇万太, 马强, 赵鑫, 周桦, 李建东. 不同土地利用类型下土壤活性有机碳库的变化. 生态学杂志, 2007, 26(12): 2013- 2016.
[36] Oladele S O, Adeyemo J A. Land use influences microbial biomass carbon, organic carbon and nitrogen stock in a tropical acric luvisols of southwestern Nigeria. Brazilian Journal of Biological Sciences, 2016, 3(6): 413- 423.
[37] Spohn M, Klaus K, Wanek W, Richter A. Microbial carbon use efficiency and biomass turnover times depending on soil depth-implications for carbon cycling. Soil Biology and Biochemistry, 2016, 96: 74- 81.

