46例肥胖者肠道肠杆菌菌群与内毒素的调查研究
孙 丽 张诗海
细菌脂多糖(lipopolysaccharide,LPS)或细菌内毒素(endotoxin,ET)是革兰阴性细菌细胞壁上的特有结构,其成分主要是O-特异性链、核心多糖和类脂A三部分组成。1~2岁期间肠道菌群基本形成,并在一生当中保存相对稳定[1]。正常菌群的种类、数量和分布是一种动态的相对稳定,受年龄、人种、膳食结构、生活习惯等因素的影响而不同。肥胖症患者肠道内内毒素产生菌过度增长是否是其肥胖发生的重要原因之一,本文研究如下:
1 资料与方法
1.1 标本来源 收集2015年1月22日-2016年12月16日本医院住院病人和门诊体检者的粪便标本30 g。入选标准为BMI>30和血清内毒素(LPS)的含量大于5 pg/mL(最低检测下线)的肥胖症患者。
1.2 内毒素测定 采用MB-80微生物快速动态检测系统及试剂盒(北京金山川科技发展有限公司),用动态浊度法对患者血清进行检测。取静脉血2 mL,离心1000 rpm,l min,制备出待测血清备用。
1.3 粪便细菌菌落计数及培养 称取0.5 g粪便加入50 mL磷酸盐缓冲液(PBS)震荡均匀,其作为10-2稀释度,再用PBS稀释到10-10备用,分别取0.1 mL前述备用稀释液,用涂菌棒涂羊血琼脂、SS、麦康凯、沙保罗、四号琼脂,以及肠杆菌显色培养基。分别做需氧菌、厌氧菌和真菌培养,挑选菌落最清楚的一个浓度计算菌量。每克标本的菌落数(CFU/g)=0.1×适当稀释级特征菌落数(为3个复样的均数)×稀释倍数。
1.4 菌株鉴定 全部菌株均使用Viteck2系统进行鉴定。菌株生化鉴定质控标准菌株为ATCC25922,ATCC25923,ATCC27853,ATCC700603均来购自安徽省临床检验中心。
1.5 大肠埃希菌16SrDNA PCR及电泳 ①挑取大肠埃希菌落放入LB培养液中增菌,富集细菌,用革兰阴性菌DNA提取试剂盒(北京卓诚惠生生物科技有限公司)。②引物及PCR体系:通用引 物R1:5’-AGAGTTTGATCCTGGCTCAG-3’,R2:5’-GGCTACCTTGTTACGACTT-3’;PCR体系:10 X PCR Buffer (含Mg离 子)5模板DNA 50 ng,用ddH2O补充到50体系。③反应程序:94 ℃,1 min,94 ℃,1 min,50℃,1 min,72℃,1.5 min,30个循环;72 ℃ 2 min,25 ℃,5min,PCR扩增产物1%琼脂糖电泳检测。
1.6 内毒素质控 用革兰阴性菌脂多糖质量控制品(购于北京金山川科技发展有限公司)进行室内质量控制,注意批号的更换时导入新的标准曲线。
1.7 统计学方法 采用Logistic多因素分析LPS所测的值与肠道菌落计数之间的相关性。
2 结 果
2.1 内毒素检测结果 46例肥胖者肠道菌群血浆标本内毒素含量最高为37.26 pg/mL,最低7.009 pg/mL;以50 pg/mL为阳性临界值时,血浆内毒素含量检测均在正常范围内。
2.2 细菌培养结果 46例肥胖者粪便培养出大肠埃希菌42例(占91%),非大肠埃希菌4例(占9%)。46例肥胖者粪便同时培养出2种肠杆菌的6例(13%),男女各半。42例肥胖者粪便同时培养出大肠埃希菌和肠球菌的2例(4%),男女各1例。42例肥胖者粪便培养出酵母菌的为2例(4%),均为女性。LPS所测的值与肠道菌落计数大小趋势呈正相关(r=0.93,P<0.001)。见图1。
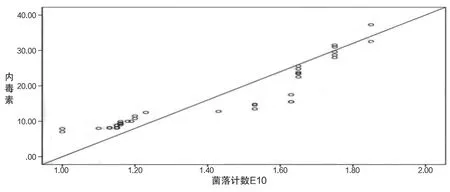
图1 46例肥胖者粪便LPS值与肠道菌落计数的关系图
2.3 大肠埃希菌16SrDNA PCR电泳结果 46例肥胖者粪便培养出大肠埃希菌16SrDNA PCR电泳结果显示,在琼脂糖相当于Marker的1500bp处出现PCR的扩增产物条带。见图2。

图2 46例肥胖者粪便培养出大肠埃希菌16SrDNA PCR电泳结果
3 讨 论
人体肠道菌群(Intestinal nom)栖息着大约30属细菌,超过1000多种细菌,其总重量大约1.5千克,细菌总数达1012~1014,编码的基因数量至少是人体自身基因的100倍[2]。肠道细菌在促进食物消化、合成蛋白质和维生素等营养物质、抵御外来致病菌侵入以及增强机体免疫能力等方面有着重要作用。肠道菌群通过多种机制参与机体的能量代谢、维持机体的能量平衡,包括促进肠道微绒毛的生长、不能被消化的膳食纤维等的酵解、肽类或蛋白质的无氧酵解、结合胆汁酸的生物转化、草酸盐复合物的降解及一些维生素的合成。
肠道菌群与人体共同进化,为宿主提供其自身不具备的酶和生化代谢通路。肠道菌群通过与人体和外界环境相互作用,影响人体的营养、免疫和代谢[3]。肠道细菌是影响肥胖和脂肪蓄积的环境因素[4]。肠道细菌结构和功能变化引起肥胖部分作用是通过增加吸收食物中的能量实现的,尤其是降解食物中的多糖,基因分析发现,肥胖小鼠肠道细菌富含降解糖类等的能量摄入相关的基因[5]。肠道细菌能合成大量糖苷水解酶,将植物多糖转变为单糖、短链脂肪酸(short chain fatty acids,SCFAs)、乙酸、丙酸、丁酸。世界卫生组织(WHO)根据BMI 将通常说的“肥胖”分为超重和肥胖两个层次,超重是指25≤BMI<30[6],肥胖是BMI>30。本次实验中大肠埃希菌VITEK2鉴定和16SrDNA PCR电泳结果一致,可以认为鉴定结果正确。肠杆菌容易产生内毒素,而肠道中乳酸杆菌和粪便双歧杆菌等不易产生内毒素,红酒可以改变菌群分布[7]。
综上所述,在小鼠实验中证实[8]由饮食导致的肥胖者其内毒素升高,而本实验证实其肠道菌群中肠杆菌多是大肠埃希菌为主,辅以阴沟肠杆菌、肺炎克雷伯菌、肠球菌和酵母菌,其菌量多少与LPS大小趋势一致。
参考文献
[1] Palmer C, Bik EM, DiGiulio DB, et al.Development of the human infant intestinal microbiota. PLoS Biol,2007,5:26.
[2] Qin J, Li R, Raes J, et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature,2010,464:59~65.
[3] Neish AS. Microbes in gastrointestinal health and disease. Gastroenterology,2009,136:65~80.
[4] Backhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A 2004,101:15718~15723.
[5] Turnbaugh PJ, Backhed F, Fulton L, et al. Dietinduced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell Host Microbe,2008,3:213~223.
[6] Obesity: preventing and managing the global epidemic. Report of a WHO consultation: World Health Organ Tech Rep Ser. 2000;894:i-xii,1~253.
[7] Moreno-Indias I, Sanchez-Alcoholado L,Perez-Martinez P, et al. Red wine polyphenols modulate fecal microbiota and reduce markers of the metabolic syndrome in obese patients. Food Funct,2016,7:1775~1787.
[8] Collins KH, Paul HA, Reimer RA, et al.Relationship between inflammation, the gut microbiota, and metabolic osteoarthritis development:studies in a rat model. Osteoarthritis Cartilage,2015,23:1989~1998.

