探讨半枝莲醇提物对小鼠细胞色素P450酶和谷胱甘肽S-转移酶活性的影响
杜晓翔 陈必成
温州医科大学附属第一医院药学部,浙江温州 325000
半枝莲是我国传统中草药之一,属唇形科黄芩属的干燥全草,味辛、平。其化学成分主要包括黄酮类、二萜类、生物碱以及多糖等,具有清热解毒、抵抗炎症、增强免疫力等功效。半枝莲主要成分黄酮类化合物具有治疗心血管疾病的作用,可以清除人体内产生的自由基,同时抑制细胞凋亡,延缓衰老[1-5]。我国曾有学者研究发现,黄酮类化合物具有抗肿瘤和治疗癌症的作用,可用于治疗胃癌、直肠癌、肺癌、淋巴癌等。细胞色素P450家族为人体内一类重要物质,主要参与内源性物质及外源性物质(药物、环境化合物等)的代谢过程,主要分布于内质网和线粒体内膜上[6-8]。研究表明,植物药物中的活性成分可以影响细胞色素P450酶的活性,从而调控体内药物代谢过程。谷胱甘肽S-转移酶是药物代谢反应中十分重要的一种药物代谢转移酶,其作用是催化外源物质的代谢,促进内源性化合物例如胆红素、短链脂肪酸等的分解。因此,本研究选取传统中草药半枝莲作为研究对象,选取40只SD小鼠随机分为试验组(低剂量组、中剂量组、高剂量组)和对照组,每组各10只。试验组使用不同剂量半枝莲醇提物对小鼠进行灌胃,对照组使用等量生理盐水,连续灌胃5 d,第6天处死小鼠,采集肝脏组织,观察半枝莲醇提物对于小鼠细胞色素P450和谷胱甘肽S-转移酶活性的影响。通过本次研究,我们期望可以观察到半枝莲提取物对于药物代谢酶的影响,深入了解其药物作用机制,为今后临床用药提供一定的参考作用。
1 资料与方法
1.1 试验材料
1.1.1 试验动物与分组 40只成年雄性SD小鼠,体重均为200 g,所有大鼠均购自上海杰思捷实验动物有限公司。将40只小鼠随机分为4组,分别为对照组(10只)和试验组(30只)。试验组根据半枝莲醇提物灌胃剂量设立低剂量组(10只)、中剂量组(10只)和高剂量组(10只)。
1.1.2 试验器材和药品 旋转蒸发仪、循环水真空泵、电加热套、超速离心机、漩涡震荡仪、匀浆机、电子分析天平、恒温水浴摇床、酶标仪、紫外可见光分度计等。
半枝莲购自亳州百川药业,咪达唑仑、氯唑沙宗购自Sigma公司,谷胱甘肽S-转移酶试剂盒购自南京建成生物工程研究所,蛋白浓度测定试剂盒购自北京索莱宝科技有限公司。
1.2 试验方法
制备半枝莲醇提物,将半枝莲粉碎准确称量后加入10倍体积乙醇,静置1 h,提取半枝莲活性物质后浓缩,真空干燥回收干燥产物,准确称量其产物含量,得到半枝莲醇提物。试验组分别按照每天1 g/kg、5 g/kg、10 g/kg剂量进行灌胃,分别为低剂量组(1 g/kg)、中剂量组(5 g/kg)、高剂量组(10 g/kg)。 对照组小鼠给予等量生理盐水灌胃。小鼠室温饲养,自由饮水,需在试验环境下适应5 d及以上,每日早晨7点进行灌胃,保证正常饮食,第5天给药后禁食过夜。连续给药5 d,第6天采用颈椎脱臼法处死小鼠,提取肝脏组织,使用咪达唑仑、氯唑沙宗作为药物探针进行体外代谢,研究半枝莲醇提物对小鼠细胞色素P450酶活性的影响,利用蛋白浓度测定试剂盒检测细胞色素P450酶含量,利用谷胱甘肽S-转移酶试剂盒测定谷胱甘肽S-转移酶活性。
1.3 观察指标
观察并记录细胞色素P450酶含量,计算方法和公式根据Omura and Sato关于细胞色素P450含量的测定,为细胞色素 P450(nmol·mg/protein)=[(A450-A490)×1000]/(91×被测样品蛋白浓度)。 根据体外代谢药的产率计算酶活性。谷胱甘肽S-转移酶活性根据试剂盒说明书进行测定。
1.4 统计学分析
采用SPSS 19.0统计学软件进行统计分析,计量资料以均数±标准差(x±s)表示,采用 t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 半枝莲醇提物对小鼠细胞色素P450含量及活性的影响
与对照组相比,试验组低剂量组细胞色素P450含量和活性不存在差异(P>0.05),而中剂量组和高剂量组小鼠细胞色素P450含量和活性出现显著下降的趋势(P<0.05)。 见表 1。
表1 不同组别小鼠细胞色素P450含量和活性情况比较(±s)
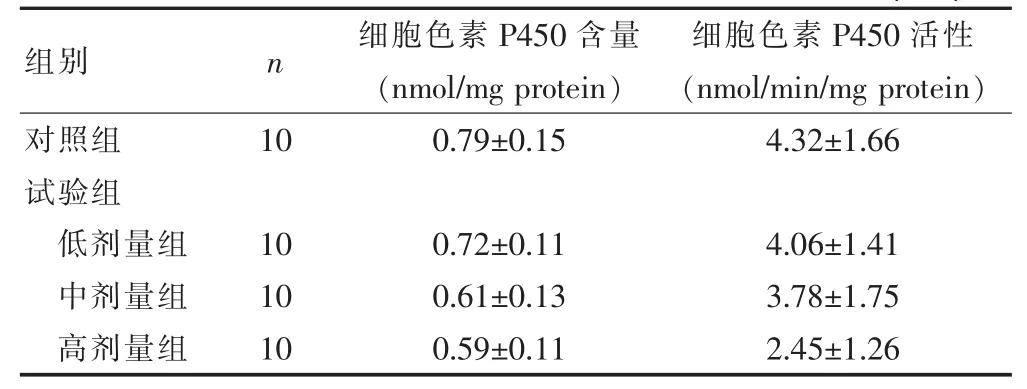
表1 不同组别小鼠细胞色素P450含量和活性情况比较(±s)
组别 n 细胞色素P450含量(nmol/mg protein)细胞色素P450活性(nmol/min/mg protein)对照组试验组低剂量组中剂量组高剂量组100.79±0.154.32±1.66 10 10 10 0.72±0.11 0.61±0.13 0.59±0.11 4.06±1.41 3.78±1.75 2.45±1.26
2.2 半枝莲醇提物对小鼠谷胱甘肽S-转移酶活性的影响
与对照组相比,试验组小鼠谷胱甘肽S-转移酶活性无显著性差异(P>0.05),但中剂量组和高剂量组活性出现下降趋势。见表2。

表2 不同组别小鼠谷胱甘肽S-转移酶活性的情况比较(x±s)
3 讨论
中国地域广阔,物种丰富,是中草药的发源地,据统计目前中国大约存在有12 000种的药用植物,在中草药研究方面,我国也拥有着丰富的经验,结合现代医学技术,中草药在临床上的应用越来越广泛,也得到了广大患者和医师的认可。半枝莲作为我国传统中草药之一,是马唇形科黄芩属多年生草本植物。全草均可入药,性寒味酸,富含多种维生素、微量元素及氨基酸等成分,具有清热解毒、活血祛瘀、消肿止痛、凉血解毒,清热利湿、抗癌等功效[9-13]。细胞色素P450和谷胱甘肽S-转移酶均与体内药物代谢过程有关,因此,本研究通过给予小鼠不同剂量半枝莲醇提物,观察其对小鼠细胞色素P450酶活性和谷胱甘肽S-转移酶活性的影响,从而为今后半枝莲在临床上的应用提供一定的参考作用。
在本研究中,通过比较对照组小鼠和不同剂量半枝莲醇提物组细胞色素P450酶含量和酶活性的影响,结果显示:与对照组相比,试验组低剂量组细胞色素P450含量和活性不存在差异(P>0.05),而中剂量组和高剂量组小鼠细胞色素P450含量和活性出现显著下降的趋势(P<0.05)。表明半枝莲醇提物可以抑制小鼠细胞色素P450酶活性,也说明半枝莲提取物可以在一定程度上影响特定药物代谢酶活性,并且半枝莲浓度越高,抑制作用越大。此结果也与朱慧贤等[14]的研究结果一致。细胞色素P450酶可以调节肝脏对内源性物质和外源性物质的代谢过程,其出现抑制后可以诱导全身药物代谢过程异常现象,最终导致严重的毒性反应,危害患者的生命安全[15-18]。高浓度的半枝莲可以极大程度地抑制细胞色素P450酶的活性,促进前致癌物及毒性物质的活化过程,有研究表明,药物代谢性相互作用引起的药物不良反应有超过95%均由细胞色素P450酶引起。因此在临床使用时需要充分考虑其不良影响。本研究还分析了半枝莲醇提物对谷胱甘肽S-转移酶活性的影响,结果发现:与对照组相比,试验组小鼠谷胱甘肽S-转移酶活性没有出现显著差异(P>0.05),但中剂量组和高剂量组活性出现了下降的趋势。该结果说明半枝莲可以通过影响药物代谢酶谷胱甘肽S-转移酶活性来影响药物代谢过程。谷胱甘肽S-转移酶可以降低外源性化合物的毒性,具体作用机制是催化葡萄糖醛酸苷形成,加速葡萄糖醛酸苷和谷胱甘肽及其代谢产物结合,形成水溶性代谢产物[19]。有文献报道,谷胱甘肽S-转移酶还可以保护蛋白质、核酸等遗传物质成分,降低癌症的发病率[20]。众所周知,致癌物是间接致癌物,其自身无致癌特性,但是在体内经过酶的活化作用,最终转变成为亲电子性终致癌物。谷胱甘肽-S-转移酶可以催化亲电子化合物和内源性谷胱甘肽结合,从而保护遗传物质的稳定,降低癌症的发病率。另一方面,对于已经代谢形成的致癌物质,在谷胱甘肽-S-转移酶的作用下,也可以转变形成可被机体代谢排出的水溶性物质,抑制致癌物质对机体的损伤作用。而本研究中发现了半枝莲醇提物会抑制该酶的活性,改变药物代谢过程,说明半枝莲醇提物会阻止需要谷胱甘肽-S-转移酶参与活化的物质的形成过程。
综上所述,半枝莲醇提物可以对小鼠细胞色素P450酶和谷胱甘肽S-转移酶活性起到一定的抑制作用,且浓度越高,抑制程度越大,提示临床使用半枝莲醇提物时需要考虑药物之间的相互作用,避免产生药物毒性。
[参考文献]
[1]张梅,韩松洋,葛圆圆,等.半枝莲提取物对人肺癌A549细胞的凋亡作用及其对凋亡相关基因表达的影响[J].陕西中医,2016,37(6):756-758.
[2]周凌凌,胡筱希,丁霞.半枝莲提取物抗乙肝病毒体外实验研究[J].中药材,2015,38(5):1042-1045.
[3]陈志成,史仁杰.半枝莲提取物对人大肠癌细胞系凋亡的影响[J].江苏医药,2013,39(2):141-144.
[4]石锐,郭素青,刘珊,等.半枝莲对白血病K562细胞VEGF表达的影响[J].中国实验血液学杂志,2016,24(5):1339-1342.
[5]陈红梅,谢翎.响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J].食品科学, 2016,37(2):45-50.
[6]王桂玲,房建强,边书芹,等.半枝莲中总生物碱的提取及抑菌作用的初步研究[J].中成药,2013,35(6):1315-1319.
[7]叶华,吴琼,郭蒙,等.半枝莲多糖对C26荷瘤小鼠血清Th1/Th2亚群细胞因子的影响[J].癌症进展,2013,11(1):68-81.
[8]范悦,吴晓光,赵泓翔,等.半枝莲黄酮对Aβ25-35引起的大鼠皮层星形胶质细胞NOS、HSP70及apoE异常表达的影响[J].中国病理生理杂志,2014,30(2):359-379.
[9]赵泓翔,郭可,崔亚迪,等.半枝莲黄酮对复合Aβ_(25-35)引起线粒体膜 Bcl-2、Bax、Bcl-xL 及 Bak 异常的干预作用[J]. 中国病理生理杂志,2014,30(12):2262-2266.
[10]逄亚楠,国锦,闫辉,等.半枝莲与白花蛇舌草及其药对石油醚部位成分分析及其抗子宫内膜癌细胞活性研究[J].中药材,2016,39(4):789-794.
[11]梁彩霞,曹英夕,张东,等.半枝莲中1个新克罗烷二萜化合物[J].中草药,2015,46(19):2843-2845.
[12]孙丽红,王海颖.参灵合剂对原发性肝癌小鼠抗肿瘤免疫反应的实验研究[J].中国中西医结合消化杂志,2015,23(5):311-314.
[13]郭可,吴晓光,缪红,等.半枝莲黄酮对复合Aβ所致大鼠皮层细胞凋亡抑制作用及线粒体凋亡通路的调节机制[J].中国医院药学杂志,2015,35(22):1994-1999.
[14]朱慧贤,谯凤英,胡思源,等.半枝莲总黄酮胶囊治疗急性咽炎肺胃实热证的Ⅱ期临床研究[J].现代药物与临床,2017,32(7):1259-1263.
[15]刘冬,宋竖旗,尹学来,等.中医药治疗膀胱癌用药规律分析[J].中医学报, 2017, 32(1):4-8.
[16]汪维佳,李照,华育晖,等.半枝莲不同极性提取物对人胚肾细胞体外活性的影响[J].实用肿瘤杂志,2016,31(3):228-231.
[17]Kan X,Zhang W,You R, et al.Scutellaria barbata D.Don extract inhibits the tumor growth through down-regulating of Treg cells and manipulating Th1/Th17 immune response in hepatoma H22-bearing mice[J].Bmc Complementary&Alternative Medicine,2017,17(1):41.
[18]Wu T,Wang Q,Jiang C,et al.Neo-clerodane diterpenoids from Scutellaria barbata with activity against Epstein-Barr virus lytic replication[J].Journal of Natural Products,2015,78(3):500-509.
[19]Dong Y.H2O2electrochemical sensor based on scutellaria barbata extract biosynthesized of gold nanoparticles[J].International Journal of Electrochemical Science, 2016,11(12):10919-10927.
[20]Li R,Song W,Qiao X,et al.Chemical profiling of Scutellaria barbata by ultra high performance liquid chromatography coupled with hybrid quadrupoleorbitrap mass spectrometry[J].Journal of Chinese Pharmaceutical Sciences,2015,24(10):635-646.

