结核菌脂阿拉伯甘露糖通过Notch1介导结核免疫逃避的实验研究
李 良
浙江省台州医院急救中心,浙江临海 317000
作为临床中一种极为常见的传染性疾病,结核病主要由结核分枝杆菌感染引起,有数据显示,全球受结核杆菌感染人数占1/3左右,每年死于结核杆菌感染的人数高达300多万。结核分枝杆菌的难治性以及耐药性与其具有独特的逃避人体细胞免疫机制有关[1]。结核菌脂阿拉伯甘露糖(lipoarabino-mannan,LAM)是结核分枝杆菌表面的一种具有特殊多糖结构的糖基磷脂酰肌醇(GPI),在结核分枝杆菌病表面大量表达。近年来研究表明LAM是导致巨噬细胞功能下降以及树突状细胞成熟水平降低的重要分子[2]。随着对巨噬细胞Notch信号通路的深入研究及模式识别受体(PRRs)和Notch分子信号的内在联系的揭示,引导我们对Notch通路是否在结核免疫中起着重要调控作用产生新的思考。而国外一些报道指出,Notch1受体激活可下调如 IL-6、IL-1β、IL-12、TNF-α、IFN-α、IFN-β等促炎性介质的分泌,然而在结核分枝杆菌病感染免疫上,国内外鲜有研究。因此,本研究使用LAM作为刺激因素,探讨Notch1分子信号通路是否参与LAM诱导的结核免疫逃避,从而为Notch1信号通路在结核免疫治疗中提供新的思路。
1 材料与方法
1.1材料
清洁级近交系 Balb/c小鼠 (H-2d,6~8周龄,雌性),体重(19±3)g,由长沙市天勤生物技术有限公司提供。结核菌脂阿拉伯甘露糖(LAM,MS-01)购自美国HT公司,Notch信号通路阻断剂GSI购自Calbiochem公司,一抗兔抗Notch1多克隆抗体(Rabbit anti-Notch1 polyclone IgG)、兔抗Beta-actin多克隆抗体(Rabbit anti-beta polyclone IgG),二抗 HRP-羊抗兔IgG多克隆抗体 (HRP-Goat polyclonal to Rabbit IgG)均购自Abcam公司。Trizol购自Invitrogen公司,Tarkra PrimeScriptRT reagent Kit逆转录试剂盒以及高保真Taq DNA聚合酶购自Tarkra公司。PCR引物均由大连宝生物设计合成。酶联免疫吸附试剂盒购自eBioscience公司,胎牛血清购自杭州四季青生物公司。
1.2 实验方法
1.2.1 实验分组以及干预 BALB/c小鼠随机分成三组,实验组小鼠分别腹腔注射结核菌脂阿拉伯甘露糖(lipoarabino-mannan,LAM)2 mL;Notch 信号通路抑制剂GSI(Calbiochem)+LAM 2 mL。对照组腹腔注射PBS 2 mL。5 d后颈椎脱位法处死,收集两组小鼠的腹腔巨噬细胞进行后续实验研究。
1.2.2 小鼠腹腔巨噬细胞的收集分离 颈椎脱位法处死小鼠,75%酒精浸泡5 min,于超净工作台内无菌操作。剪开小鼠腹部皮肤,使用无菌注射器吸取RPMI1640培养液,每只小鼠腹腔注射6 mL。轻柔拍打腹壁20 min后回抽出腹腔液置于灭菌离心管中。每只小鼠重复3次,充分回收腹腔液,注意回收时避免针头吸到肠系膜。1500 rad/min,离心10 min,弃上清,重复使用PBS洗涤细胞2次后换用含10%FBS的RPMI1640培养液重悬细胞。按4×106/L的细胞浓度接种至6孔板中补充10%FBS的RPMI1640培养液至3 mL每孔。37℃,5%CO2的细胞培养箱中孵育8 h后洗去悬浮细胞后继续培养,每2天常规换液1次。
1.2.3 半定量RT-PCR法测定小鼠腹腔巨噬细胞中的Notch1 mRNA水平 待细胞长至90%左右融合时用台盼蓝据染法判断细胞活性。弃上清,用4℃预冷的PBS洗涤两次,Trizol法提取细胞总RNA,测OD260/OD280,以比值大于1.8为合格样品。严格按照逆转录试剂盒相关说明对RNA进行提取,以2 μL为宜,逆转录成cDNA。Notch1引物以及内参Beta-actin引物由大连宝生物公司设计合成,引物序列见表1。
PCR反应要严格按照相关说明执行,其反应基本条件为:5×PrimeSTARTM Buffer 4 μL,dNTP Mixture 1.6 μL,Notch1 上、下游引物各 0.4 μL,模板 cDNA1 μL,PrimeSTARTM HS DNA Polymerase 0.2 μL,首先给予灭菌处理,然而加水稀释,构建20 μL反应体系,设置预变性处理温度,以94℃为宜,时间以4 min为宜,然后在95℃温度环境下进行变性50sec,当温度下降至60℃,退火60 sec,72℃环境下进行50 sec延伸处理,35循环后,在72℃温度下延伸处理,以10 min为宜。产物进行1%琼脂糖凝胶电泳分析。
1.2.4 Western Blot法测定小鼠腹腔巨噬细胞中受体Notch1表达水平 待细胞长至90%左右融合时,将培养液去除,给予PBS冰冲洗,反复冲洗3次,确保PBS液能够被完全吸出,刮除细胞,放置于1.5 mL EP管中进行保存,在4℃温度下进行离心处理,速率为3000 rad/min,以5 min为宜,将上清液去除。选取含有1 mmol/LPMSF的IP细胞裂解液,以500 μL为宜,将其在冰上给予预冷处理,然后加入沉淀,给予反复吹打。采用12000 rad/min离心速率在冰上裂解处理,以40 min为宜,离心处理15 min后,对蛋白浓度进行检测。分别制备10%分离胶以及5%的浓缩胶,实施聚丙酰胺凝胶电泳处理。对PVDF膜实施平衡预处理,将其放置在电转槽中,以250 mA恒流在冰水混合物中实施电转,时间为90 min。取出PVDF膜,将其放置入含有5%脱脂奶粉PBST缓冲液中,并予以封闭,以1 h为宜,采用PBST洗膜反复清洗,一般为3~4次,15 min/次。按1:500加入一抗孵育44℃过夜(Rabbit anti-Notch1 polyclone IgG,Abcam,ab27526),内参体系加入 (Rabbit anti-beta polyclone IgG,Abcam,ab8227)。 再次给予 3~4 次 PBST 洗膜,15 min/次。按照1:5000的比例在其中加入二抗,室温孵育2 h。给予PBST溶液反复冲洗,一般为3~4次,10 min/次,然后实施ECL发光对其进行鉴定,并对鉴定结果做出分析。以目的蛋白灰度值/内参Beta-actin比值作统计学分析。
1.2.5 ELISA法测定细胞上清液中IL-1β、INF-γ、IL-12炎性细胞因子水平 取小鼠腹腔巨噬细胞培养上清液50 μL,按照ABC-ELISA双抗体夹心法试剂盒说明书测定IL-1β、INF-γ、IL-12炎性细胞因子的浓度。
1.3 统计学方法
数据计算在统计学软件SPPSS18.0上进行处理,计数资料均用(%)表示,进行χ2检验,计量资料以均数±标准差(x±s)表示,采取 t检验,P<0.05 表示差异有统计学意义。

表1 RT-PCR引物
2 结果
2.1 LAM刺激小鼠腹腔巨噬细胞Notch1的转录情况
经腹腔注射LAM 5 d刺激后,两步法RT-PCR检测LAM刺激组和对照组小鼠腹腔巨噬细胞的Notch1 mRNA转录水平,以光密度比值Notch1 mRNA/Beta-actin mRNA衡量Notch1转录水平高低,LAM 刺激组(1.223±0.316)和对照组(0.771±0.320)间有显著性差异(t=4.5,P<0.05,n=20)。

图1 RT-PCR检测Notch1转录情况
2.2 LAM刺激小鼠腹腔巨噬细胞Notch1受体表达情况
Western Blot法检测小鼠腹腔巨噬细胞中Notch1受体表达情况,经LAM刺激组小鼠腹腔巨噬细胞表面Notch1受体表达显著高于对照组。两组Notch1/Beta-actin灰度值比值分别为:LAM刺激组 (0.842±0.188),对照组(0.535±0.219),差异有统计学意义(t=6.3,P<0.05,n=20)。

图2 Western Blot法检测Notch1蛋白表达情况
2.3 ELISA 法测定细胞上清液中 IL-1β、INF-γ、IL-12炎性细胞因子水平
培养小鼠腹腔巨噬细胞上清液炎症因子测定,LAM刺激组与LAM+GSI处理组对比,IL-1β、IL-12水平有显著性差异(P<0.05),而INF-γ水平两组间差异无显著性(P>0.05),见图 3~5。
3 讨论
在医学及医药技术高度发达的今天,结核病仍然是人类健康的主要威胁之一。之所以结核病难以控制以及耐药结核、难治性结核的发病率逐渐增高,与结核分枝杆菌独特的逃避人体免疫防御屏障有关[1,3]。其中最重要的机制便是结核分支杆菌逃避巨噬细胞杀灭的机制。
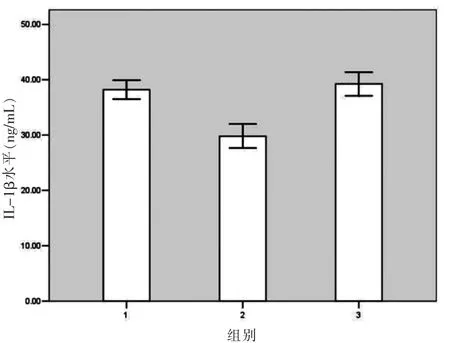
图3 小鼠腹腔巨噬细胞培养上清液中IL1-β浓度
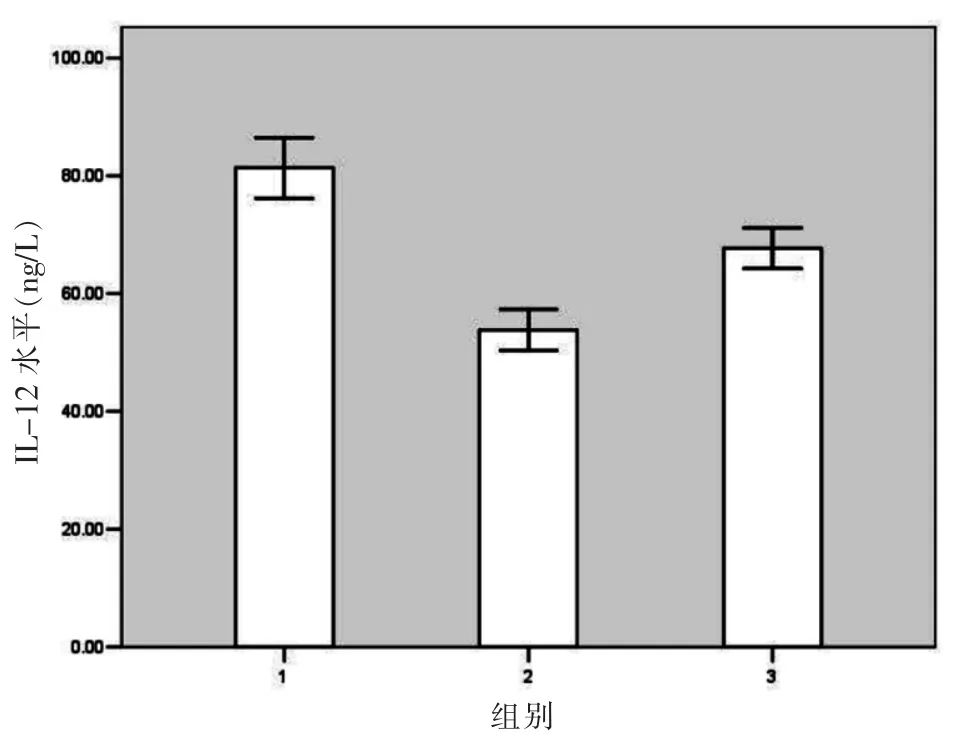
图4 小鼠腹腔巨噬细胞培养上清液中IL12浓度
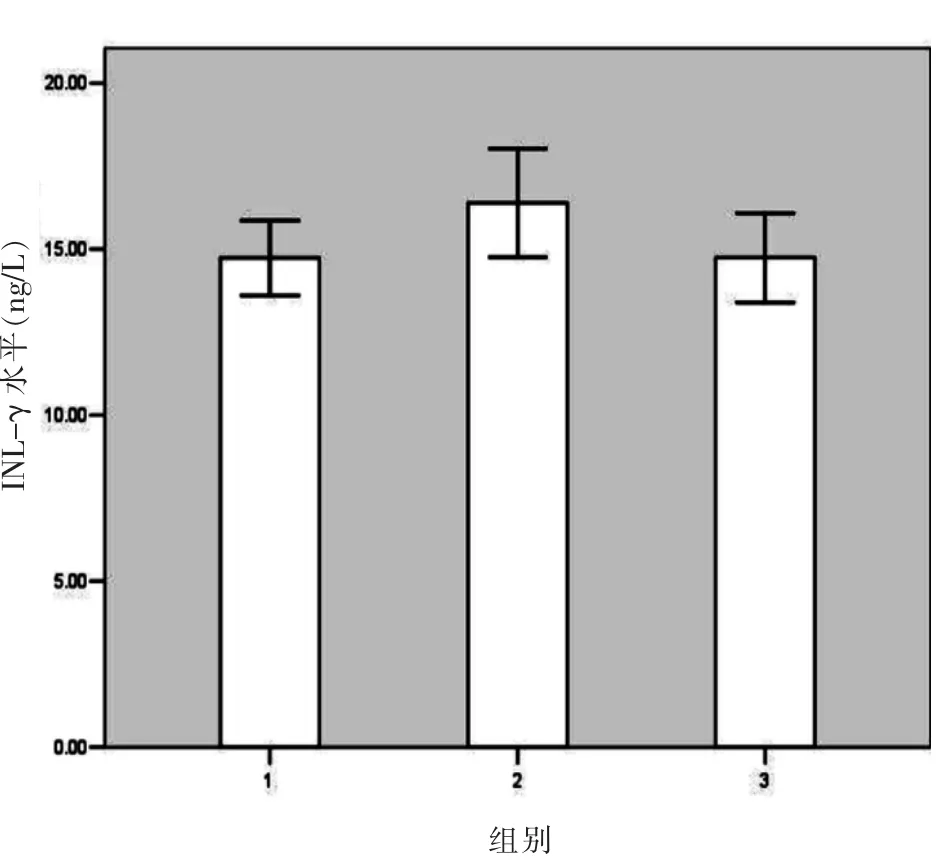
图5 小鼠腹腔巨噬细胞培养上清液中INF-γ浓度
目前已知的结核菌脂阿拉伯甘露糖(lipoarabinomannan,LAM),是结核分枝杆菌表面的一种具有特殊多糖结构的糖基磷脂酰肌醇(GPI),在结核分枝杆菌病表面大量表达。近年来,LAM作为菌阴结核的诊断方法以及结核的快速诊断方法逐渐被认可[4]。研究证实LAM是DC-SIGN的一个关键配基。当ManLAM实现与DC-SIGN的结合,能够直接对TLR信号途径产生作用,对树突状细胞成熟信号会产生一定的干扰[5,6]。
Notch受体广泛表达于哺乳动物中,是相当保守的细胞表面受体[7]。在巨噬细胞表面Notch1-4均有表达[8]。Notch1信号通路是一条特殊的信号转导途径,诸多研究表明Notch1信号通路跟模式识别受体有着密切的联系[9]。临床研究报道,配体激活Notch1后,胞内段细胞膜将会出现断裂现象,并逐渐向核内转移,进而活化部分 Su(H)/CBF1(CSL 蛋白)等核内转录因子[10,11],其能够有效调控下游因子,一方面能够调节细胞分化,另一方面能够对细胞发育产生一定的影响,导致组织器官生物学功能及性状发生变化[12]。然而Notch1受体在结核分枝杆菌免疫中的机制鲜有研究。本研究设计通过小鼠腹腔注射LAM,同时以腹腔巨噬细胞作为研究对象,观察LAM刺激后Notch1受体的表达情况以及在LAM调节炎症介质释放中的作用。本研究发现,LAM通过上调Notch1受体水平,抑制IL-1β、IL-12等炎症介质的释放。IL-1β是结核免疫反应中的重要炎症介质[13],而IL-12则是调控抗原反应性T细胞向Th1细胞分化的重要细胞因子,参与了结核分枝杆菌感染的细胞免疫[14],通过GSI阻断Notch1通路可抑制LAM诱导的 IL-1β、IL-12水平下降[15,16]。表明Notch1信号通路在LAM诱导的结核免疫逃避中扮演了重要的角色。然而,本研究同时也证实,Notch1通路不能改变LAM诱导的INF-γ分泌水平,结合Yasuda K等[17]研究,本文认为LAM并非通过下调INF-γ分泌水平来减弱巨噬细胞的吞噬功能,而是通过某种机制改变巨噬细胞对INF-γ的应答能力来减弱巨噬细胞的吞噬功能。
随着对Notch信号通路以及下游调控机制的深入研究[18],Notch1在结核免疫以及结核分枝杆菌病免疫逃避中的重要作用将逐渐被认识[19,20]。而基于Notch信号通路的治疗方法在不久的将来可能为潜伏结核感染(LTBI)患者或者难治性结核病患者提供新的治疗思路。
[参考文献]
[1]Jiang Y,Liu H,Wang X,et al.Conserved hypothetical protein Rv1977 in Mycobacterium tuberculosis strains contains sequence polymorphisms and might be involved in ongoing immune evasion[J].International Journal of Clinical&Experimental Pathology,2015,8(6):6891.
[2]Shui W,Petzold CJ,Redding A,et al.Organelle membrane proteomics reveals differential influence of mycobacterial lipoglycans on macrophage phagosome maturation and autophagosome accumulation[J].J Proteome Res,2011,10(1):339-348.
[3]Aliberti J,Bafica A.Anti-inflammatory pathways as a host evasion mechanism for pathogens[J].Prostaglandins Leukot Essent Fatty Acids,2005,73(3-4):283-288.
[4]Nanta S,Kantipong P,Pathipvanich P,et al.Diagnostic value of two rapid immunochromatographic tests for suspected tuberculosis diagnosis in clinical practice[J].J Med Assoc Thai,2011,94(10):1198-1204.
[5]Yang XN,Liu X J,Zhao L T,et al.Effects and mechanisms of Notch signaling pathway on immune imbalance in chronic obstructive pulmonary disease[J].Chinese Journal of Tuberculosis And Respiratory Diseases,2016,39(11):881.
[6]吴悦涵.结核分枝杆菌的分子免疫学进展[J].国外医学免疫学分册,2004,27(4):75-80.
[7]Boggiano C,Eichelberg K,Ramachandra L,et al. “The impact of mycobacterium tuberculosis,immune evasion on protective immunity:implications for TB vaccine design”-meeting report[J].Vaccine,2017,35(27):3433.
[8]Gupta A,Kaul A,Tsolaki A G,et al.Mycobacterium tuberculosis:Immune evasion,latency and reactivation[J].Immunobiology,2012,217(3):363-374.
[9]Saraav I,Singh S,Sharma S.Outcome of mycobacterium tuberculosis and Toll-like receptor interaction:Immune response or immune evasion?[J].Immunology&Cell Biology,2014,92(9):741-746.
[10]Jiang Y,Liu H,Wan K.MPT64 polymorphisms of Mycobacterium tuberculosis,strains suggest ongoing immune evasion[J].Tuberculosis,2014,94(6):712-714.
[11]Marino-Marmolejo EN,Bonifaz-P VE,Flores-Valdez MA,et al.Mycobacterium tuberculosis TLR2 agonists LprA,LM and Man-LAM induce notch1 and socs3 transcription[J].African Journal of Microbiology Research,2011,5(15):2168-2172.
[12]Png E,Alisjahbana B,Sahiratmadja E,et al.A genome wide association study of pulmonary tuberculosis susceptibility in Indonesians[J].Bmc Medical Genetics,2012,13(1):5.
[13]Li F,Gao B,Xu W,et al.The defect in autophagy induction by clinical isolates of mycobacterium tuberculosis is correlated with poor tuberculosis outcomes[J].Plos One,2016, 11(1):e0147810.
[14]Keiichi T,Takemasa T,Saburo Y,et al.Reactivation of immune responses against Mycobacterium tuberculosisby boosting with the CpG oligomer in aged mice primarily vaccinated with Mycobacterium bovis BCG[J].Immunity&Ageing I&A,2013,10(1):25.
[15]Folcik VA,An GC,Orosz CG.The basic immune simulator:An agent-based model to study the interactions between innate and adaptive immunity[J].Theoretical Biology and Medical Modelling,2007,4(1):1-18.
[16]Sen MK,Chakravorty S,Tyagi JS.Polymerase chain reaction to identify mycobacterium tuberculosis in patients with tuberculous lymphadenopathy[J].National Medical Journal of India, 2005,18(6):302-303.
[17]Yasuda K,Richez C,Maciaszek JW,et al.Murine dendritic cell typeⅠIFN production induced by human IgGRNA immune complexes is IFN regulatory factor(IRF)5 and IRF7 dependent and is required for IL-6 production[J].J Immunol,2007,178(11):6876-6885.
[18]Siddiqui KF,Amir M,Gurram RK,et al.Latency-associated protein acr1 impairs dendritic cell maturation and functionality:A possible mechanism of immune evasion by mycobacterium tuberculosis[J].Journal of Infectious Diseases,2014,209(9):1436-1445.
[19]Song EH,Osanya AO, Petersen CA,et al.Synthesis of multivalent tuberculosis and Leishmania-associated capping carbohydrates reveals structure-dependent responses allowing immune evasion[J].Journal of the American Chemical Society,2010,132(33):11428-11430.
[20]Dorhoi A,Reece ST,Kaufmann SH.For better or for worse:The immune response against Mycobacterium tuberculosis balances pathology and protection[J].Immunological Reviews, 2011,240(1):235-251.

