基于香豆素衍生物的反应型硫化氢荧光探针的合成与应用
侯鹏 董玉晶 刘磊 夏春辉 李爽

摘要:该文基于光诱导电子转移(PET)机制,利用H2S诱导探针分子结构中的2,4-二硝基苯醚水解,抑制PET过程,合成一种反应型H2S荧光探针。利用NMR和MS对探针1的结构进行表征。通过光谱学测试和生物学细胞实验证实,相对于其他测试物质(阴、阳离子及生物分子),它对H2S具有良好的选择性和灵敏度,可以在生理条件下检测H2S。当H2S加入到探针溶液后,溶液呈现出绿色荧光,在490nm荧光强度恢复75倍,当探针的浓度为10.0μmol/L时,其对H2S的检测限为3.0×10-8mol/L;同时,探针成功实现细胞内H2S的荧光成像,为其在生物学及医学中的实际应用奠定实验基础。
关键词:硫化氢:香豆素;荧光检测;探针
文献标志码:A
文章编号:1674-5124(2018)02-0056-06
0引言
硫化氢(H2S)作为生物体内重要的活性硫物种,在许多生理过程中发挥着重要的作用,如血管生成、神经调节、细胞凋亡等。研究表明,H2S已成为继一氧化氮和一氧化碳后第3个重要的生物信号分子,一些疾病包括老年痴呆、唐氏综合症、糖尿病以及肝硬化都会造成H2S含量的改变,生物体内内源性硫化氢在正常生理人血清中含量为30-100μmol/L,人脑中的含量高达160μmol/L;因此,有效监测H2S水平,可为疾病的早期诊断提供监察手段,定性及定量检测生物信号分子已经成为一个活跃和富有成果的研究领域。
目前,已报导的检测H2S方法包括电化学法、比色法、气相色谱法等。其中,荧光检测通过实现对生物客体中重要物种(离子、分子、DNA、蛋白质和细胞器等)分布和变化的实时检测,揭示生物学功能,已经成为了医学诊断和生物学研究中最有效的分析手段之一。荧光探针因廉价易得,具有细胞膜穿透性,合成技术可控,分子量小不容易干扰周围蛋白等生理环境,所以应用的领域最为广泛。为了阐明H2S水平对健康和疾病状态的影响,通过荧光方法在生物样品中选择性地跟踪H2S具有重要的意义。
本文设计的H2S荧光探针1,以2,4-二硝基苯基为识别基团,香豆素類染料为信号表达基团。在荧光探针1中,由于荧光团与2,4-二硝基苯基之间的光诱导电子转移(PET)过程,导致探针1的荧光被淬灭,所以探针1本身无荧光或发射出很弱的荧光。当加入待测物H2S后,由于硫化氢具有较强的亲核性,能与探针1发生亲核取代反应从而使识别基团2,4-二硝基苯基离去,体系内PET过程失效;同时,生成具有强烈绿色荧光的香豆素类染料3。通过反应前后荧光光谱的变化,可以建立一种检测硫化氢的分析方法。具体响应过程如图1所示,该过程为一种荧光增强型硫化氢荧光探针。
1实验部分
1.1仪器与试剂
Bruker AV400光谱仪(400mHz)和Bruker ultraflex II基质辅助时间飞行质谱(美国Bruker);LS45-荧光分光光度计(美国Perkin);UV2450型紫外-可见分光光度计(日本岛津)。
4-二乙胺基水杨醛,玛雅试剂公司;2,4-二硝基氟苯,安耐吉试剂有限公司;碳酸钾,天津市福晨化学试剂厂;二氯甲烷,天津市东丽区天大化学试剂厂;丙二腈,纯度99%,安耐吉试剂有限公司;三乙胺,二甲基亚砜,十六烷基三甲基溴化铵,上海国药试剂有限公司;碳酸钠,氟化钠,氯化钠,溴化钠,碘化钠,磷酸二氢钠,硝酸钠,醋酸钠,碳酸氢钠,硫酸钠,亚硫酸钠,次氯酸钠,氯化钙,氯化铜,氯化镁,氯化锌,硫氢化钠(HzS的来源),半胱氨酸,谷胱甘肽均购置于上海国药试剂有限公司。
1.2荧光探针1的合成
将4-二乙胺基水杨醛193mg(1mmol),2,4-二硝基氟苯220mg(1.2mmol)和碳酸钾170mg(1.2mmol),溶解在15mL乙腈溶液中。将反应液升温至85℃反应8h,反应结束后,降至室温,倒入100mL水中,用50mL二氯甲烷萃取,饱和氯化钠洗涤,有机层用无水硫酸钠干燥。40℃旋去溶剂,得到淡黄色液体为化合物2。将化合物2溶于15mL二氯甲烷溶液中,向反应液中加入丙二腈51mg(0.78mmol),三乙胺2滴,室温搅拌5h,反应结束后,用35mL二氯甲烷萃取,无水硫酸钠干燥,粗产物进行柱层析分离(石油醚:乙酸乙酯=2:1,填料硅胶),得到淡黄色固体即为荧光探针1(收率:67%)。1HnMR(400MHz,DMSO)δ8.92(d,J=2.6Hz,1H),8.47(dd,J=9.3,2.7Hz,1H),8.27(d,J=9.4Hz,1H),8.04(s,1H),7.24(d,J=9.3Hz,1h),6.96(d,J=9.5hz,1h),6.60(s,1h),3.52~3.42(m,4H),1.10(t,J=7.1hz,6H)。HRMS(EI)m/zcalcdfor[C20H17N5O5+H]+:408.1239,Found:408.1241。
1.3光谱性质测试
探针母液的配制:将适量探针溶解于少量的二甲基亚砜(DMSO)中,然后用含有3×10-3mol/L十六烷基三甲基溴化铵(CTAB)的PBS缓冲液配制成1.0×10-3mol/L的溶液,4℃冷藏备用。
被分析物质溶液的配制:将被分析物质Na2CO3、NaF,NaCl,NaBr,NaI,NaH2PO4,NaNO3,NaOAc,NaHCO3、Na2SO4,Na2SO3、NaCIO、Cys、GSH、CaCl2,CuCl2,MgCl2、ZnCl2、NaHS分别经二次水溶解,配制成1×10-2mol/L的溶液,4℃冷藏备用。
测试溶液的配制及荧光测试参数的设定:将0.03mL探针母液移取至含有3×10-3mol/LcTAB的PBS缓冲液的试管中,随后加入被分析物,定容至3.0mL,混合均匀,静置15min,进行光谱测试。激发光和发射光的狭缝宽度均为5.0nm,电压为700V。
1.4细胞培养及探针分子的荧光成像
将A549细胞(腺癌人类肺泡基底上皮细胞)置于10%胎牛血清和1%双抗的细胞培养基中,37℃和5%CO2的条件下孵育,实验前,将状态良好的细胞消化,接种至激光共聚焦的细胞培养皿内,37℃和5%CO2的条件下继续孵育12h,至细胞贴壁,进行探针分子在细胞内的荧光成像实验。第1组实验:细胞经缓冲溶液PBS反复漂洗后,向盛放细胞的培养皿中加入5.0μmol/L探针溶液,带细胞孵育30min后,用PBS缓冲液反复漂洗细胞,进行荧光成像实验。第2组实验:细胞经缓冲溶液PBS反复漂洗后,向盛放细胞的培养皿中加入30.0μmol/Lh2S溶液,带细胞孵育30min后,用PBS缓冲液反复漂洗细胞,继续向盛放细胞的培养皿中加入5.0μmol/L探针溶液,带细胞孵育30min后,用PBS缓冲液反复漂洗细胞,进行荧光成像实验。
2结果与分析
2.1荧光光谱研究
探针在pH7.4、含1.5mmol/LcTAB的50.0mmol/LPBS缓冲溶液中对H2S的响应情况如图2所示。基于光诱导电子转移机制,探针分子结构中的羟基被2,4-二硝基苯基保护,导致探针分子的荧光淬灭,因此单独的探针分子溶解在缓冲溶液中未呈现出荧光发射峰;然而,当加入H2S后,H2S将进攻探针分子结构中的酯键,释放出具有强烈荧光的香豆素染料3,此时PET机制受阻,溶液呈现出绿色荧光,随着滴加H2S浓度的增大(0,1,2,3,4,5,6,7,8,9,10,20,30,40,50,60,70μmol/L),探针溶液在490nm处呈现的荧光发射峰强度逐渐增强。当加入H2S的浓度为70μmol/L,此时探针溶液在490nm处的荧光强度可以恢复(F/F0)75倍(F:探针分子与H2S作用后的荧光强度,F0:探针分子的荧光强度)。从探针溶液在490nm处荧光发射峰的荧光强度与H2S浓度关系(图3)中可以看出,在0~7.0μmol/L之间,荧光强度与H2S浓度具有很好的线性关系,拟合后得到方程为y=9.2617+11.350x,线性相关系数为0.9987。根据IUPAC规定,信噪比S/N=3可以计算出探针分子1(10μmol/L)对H2S的检测限为3.0×10-8mol/L。由此表明文中制得的探针能够在水溶液中定性和定量检测H2S。对比探针溶液加入H2S前后的颜色变化,在紫外灯照射下,探针溶液颜色由无色变为绿色。
2.2选择性和干扰实验
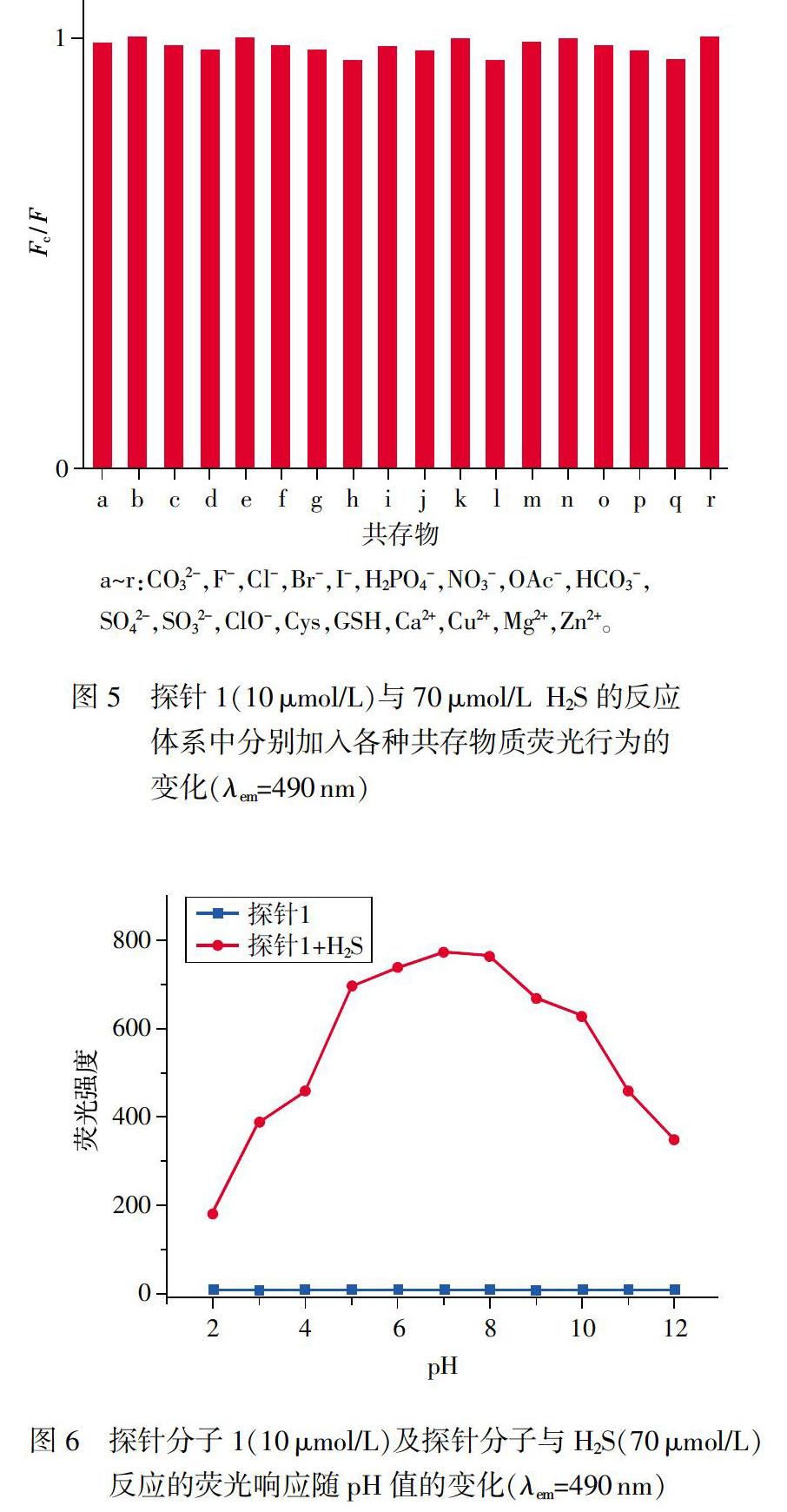
为了证明文中制备的探针分子对复杂检测环境中H2S的识别能力具有专一性,实验中对探针的选择性及抵抗其他物质干扰的能力进行了详细研究。实验中将生物环境中18种常见的阴、阳离子及生物分子和s2-分别加入到探针的溶液中,充分反应后,检测光谱变化。如图4所示,向探针1的溶液中分别加入等量的上述阴、阳离子及生物分子后,光谱行为显示加入H2S的探针溶液的荧光强度显著增强,溶液发出强烈的绿色荧光:而其他测试物质分别加入到探针溶液中,均没有引起探针溶液荧光的显著增强。同时,实验中分别将CO32-,F-,Cl-,Br-,I-,H2PO4-,NO3-,OAc-,HCO3-,SO42-,SO32-,CIO-,Cys,GSH,Ca2+,Cu2+,Mg2+,Zn2+作为共存物与H2S混合,观察加入的共存物质对探针与H2S二者反应体系荧光行为的干扰情况。结果显示,探针分子1对H2S的检测几乎没有受到共存物质的影响,表现出探针1具有较强的抵抗外界干扰并特异性识别H2S的能力。
2.3 pH的影响
反应型荧光探针的光学性质往往会受到检测环境的pH值影响,因此文中详细探究了不同pH条件下探针对H2S的检测能力,优化出探针能够检测H2S最佳的工作pH范围。实验中考察了探针分子在不同pH值环境中的荧光行为,在pH 2-12范围内,探针分子本身的荧光强度无明显变化,说明单独的探针未受pH改变的影响,具有良好的稳定性。同时考察了探针分子与H2S反应体系溶液的荧光强度随pH值不同的变化,如图6所示,当pH为2-5时,随着pH的增大反应溶液的荧光强度也迅速增强;当6-10时,溶液有明显的荧光增强,表明探针可以在较宽的pH区域对H2S进行检测;当反应体系的pH值继续增大,反应体系溶液的荧光强度逐渐降低。因此,实验中确定生理pH值7.4作为探针1与H2S反应体系的pH值。
2.4稳定性
实验中将探针溶解在含有1.5×10-3mmol/LCTAB的50.0mmol/L PBS缓冲溶液中,静置一段时间(40min),期间检测荧光强度,制得的探針溶液在室温下放置荧光强度无明显变化,具有良好的光稳定性。在探针溶液中加入70μmol/Lh2S后,检测490nm处的荧光强度随时间的变化,如图7所示。二者混合后,迅速反应,探针分子结构中的酯键受到H2S的进攻,释放出香豆素染料3,表现为490nm处的荧光强度迅速增强,大约15min反应达到平衡,同时,二者反应的产物在室温下也呈现出良好的光稳定性,转化成产物的荧光强度随时间变化基本恒定不变。由此表明,光学性能稳定的探针分子1适用于实际样品的H2S检测。
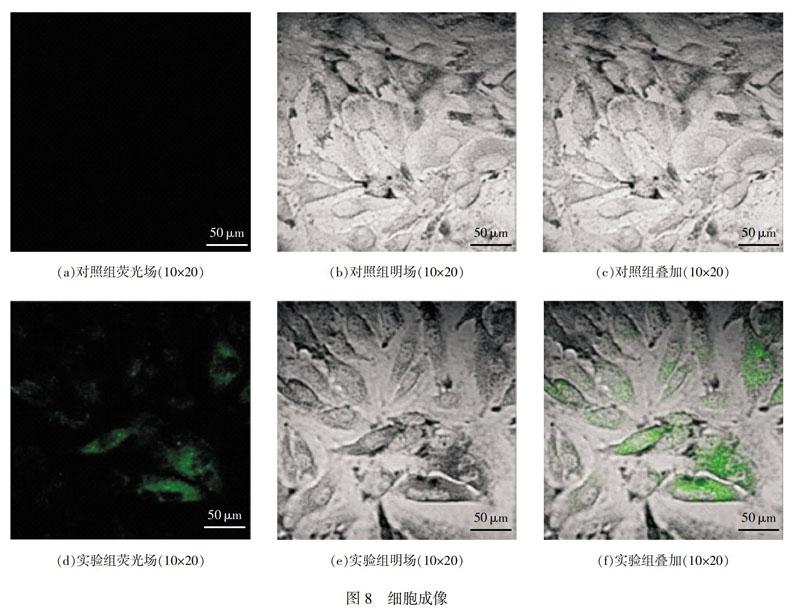
2.5细胞成像研究
实验中将A549细胞作为载体,考察探针分子在细胞中对H2S的检测能力,将状态良好的A549细胞首先置于H2S(30μmol/L)溶液,37℃培养30min,经缓冲液PBS冲洗3次后,再加入探针溶液(5.0μmol/L),孵育30min,经缓冲液PBS冲洗后,置于激光共聚焦显微镜下,可以观察到细胞呈现出强烈的绿色荧光信号。对照实验,将细胞处于探针溶液(5.0μmol/L)中37℃培养30min,经缓冲液PBS冲洗3次后,置于激光共聚焦显微镜下,细胞内几乎没有荧光发出。由此表明,文中制得的探针分子能够穿透细胞膜实现对细胞内H2S的光学响应,具有很好的生物学应用前景。
3结束语
本文以2,4-二硝基苯基为识别基团,香豆素类染料为信号表达基团,基于光诱导转移(PET)机制,合成了反应型H2S荧光探针。相对于其他测试物质(阴、阳离子及生物分子),该探针对H2S具有良好的选择性和灵敏度,可以在生理条件(pH 7.4)下检测H2S。当探针的浓度为10μmol/L时,其对H2S的检测限为3.0×10-8mol/L,在890nm荧光强度最大增强75倍,以上研究表明,探针在环境及生物学检测方面具有潜在的应用能力。

