急性内毒素血症对犬肝肾功能的影响
袁康文,李晓芬,殷红涛
摘要 [目的]研究急性内毒素血症对犬肝肾功能的影响。[方法]以5只健康的犬作研究对象,建立犬内毒素血症模型。分析注射前2.0 h、注射后0.5、1.0、2.0、4.0、6.0、24.0、36.0 h血清指标。[结果]各犬在给予LPS后20 min即有临床症状出现,至24.0 h稍有缓解;血清ALT、AST、BUN和CRE的活性均随时间的变化先升高后降低,其中血清ALT值自0.5 h开始呈现持续性升高,至6.0 h 逐渐下降的迹象,AST的活性变化显著(P<0.05);血清BUN值自0.5 h开始呈现持续性升高,至6.0 h 逐渐见下降迹象,Cre的含量变化显著;白蛋白先下降后上升,最后恢复正常,总蛋白也呈现先降低后上升的现象,但其在36.0 h时的含量高于正常值。[结论]该研究可为犬急性内毒素血症的早期预防、治疗以及疗效观察提供参考。
关键词 犬;内毒素;肝脏;肾脏
中图分类号 S858.292 文献标识码 A 文章编号 0517-6611(2018)06-0080-03
Effect of Acute Endotoxaemia on Hepatic and Renal Function of Dog
YUAN Kangwen1,LI Xiaofen2,YIN Hongtao2 (Mianyang Agricultural School,Mianyang,Sichuan 621000 )
Abstract [Objective]The aim is to study effect of acute endotoxaemia on hepatic and renal function of dog .[Method] Using 5 heathy dogs as test research object,endotoxaemia model of dog was established.Serum indexes were analyzed before injecting for 2.0 h,and after injecting for 0.5 h,1.0 h,2.0 h、4.0 h,6.0 h,24.0 h,36.0 h.[Result] Clinical symptoms of dog became to appear after injecting LPS for 20 min. Clinical symptoms relieved after 24.0 hours . Activity of ALT,AST,BUN and CRE increased firstly then decreased with temporal variation .Among them,ALT started to continuously elevate after injecting LPS for 0.5 hours,then decrease at 6.0 h.Activity variation of AST was significant(P<0.05);BUN started to continuously decrease after injecting LPS for 0.5 hours,then increase at 6.0 h.Activity variation of AST was significant(P<0.05);Cre content changed significantly. Albumin first increased then decreased,finally, returned to normal.Total protein also presented an first increasing then decreasing trend,content was higher than the normal value for 36.0 hours.[Conclusion]The research can provide reference for early prevention,treatment and observation of curative effect of acute endotoxaemia .
Key words Dog;Endotoxaemia;Liver;Renal
內毒素的化学本质为脂多糖(Lipopolysaccharide,LPS),LPS 是诱发炎症反应过程中主要的致病成分,它通过诱导体内单核巨噬细胞合成并释放多种炎症介质,参与机体的免疫反应。机体本身对内毒素有清除和解毒作用,但在严重感染或创伤应激情况下,机体的灭活与清除功能受损,或由于大量内毒素释放入血,则出现内毒素血症。内毒素血症在临床上比较常见,如严重创伤、烧伤、休克、重症感染等应激状态下,来自于感染部位的LPS大量进入体内,并引起炎症介质的大量合成、释放,使包括肝脏及肾脏等在内的多器官受累。由于内毒素血症在急性损伤的发生、发展中起着不可忽视的作用[1],故深入研究内毒素对动物各器官的影响及其致病机理具有重要意义。
现代医学研究大量资料表明,内毒素血症的发生与肝脏、肾脏的损伤密切相关。肝脏既是清除内毒素的场所,同时又是内毒素血症、休克过程中最易受损的器官之一。同时肾脏也是代谢产物及毒素排泄的主要途径,LPS亦可经肾小管重吸收后,使肾小管上皮细胞处在高浓度LPS微环境中,可能对肾小管上皮细胞结构和功能产生重要的影响,故LPS在急性肾损伤(AKI)发生、发展中起着一定的作用[2]。但目前研究大多数集中在人体肝脏和肾脏疾病,对动物尤其是对犬肝肾损伤研究很少。现如今对于犬很多疾病的发病原因、诊断、治疗研究都还有很多不足之处,尤其是对犬在内毒素上的耐受性研究更少,但此病发生的几率很大,如尿路感染、严重创伤、外感、多器官功能衰竭、感染等应激状态等;发病过程也很急;死亡率很大;所以需要认真对待犬的内毒素血症[3]。以往内毒素血症的研究多用鼠、兔作为模型,直接用犬作为模型的很少报道。该试验以犬为对象,前肢静脉注射LSP建立内毒素血症模型[4],分析注射前后血清中ALT、AST、ALB、TP、BUN和CRE等含量的动态变化,以此来了解犬感染内毒素后肝脏和肾脏的受损程度,从而为犬急性内毒素血症的早期预防、预后判断、治疗以及疗效观察提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物。5只健康、体重7~10 kg、8~11月龄雄性犬,常规饲养。
1.1.2 主要试剂。脂多糖(LPS):Escherichia coli 0111:B4(Sigma公司)配置浓度为1 mg/mL。
1.1.3 主要仪器。AUTOLAB 全自动生化分析仪(AMS公司,意大利),Abaoous junior血球分析仪(Abaous,奥地利)。
1.2 试验方法
1.2.1 全内毒素血症模型的建立。试验犬经适应性常规饲养后采血作为阴性对照,然后按0.075 mg/kg的剂量经前臂静脉注入LPS。
1.2.2 血样的采集。注射LPS 0.5、1.0、 2.0、4.0、6.0、12.0、24.0、36.0 h后分别采集犬的前肢静脉血,将全血分为2份,一份全血用EDTA抗凝剂抗凝,用于血常规的测定,一份3 000 r/min离心15 min分离血清,-20 ℃保存,用于血清酶的测定。
1.2.3 测定指标。试验过程中密切观察记录各犬的临床症状(体温、呼吸、精神状态、尿量等),以辅助检测病情的变化。采用Abaoous junior血球分析仪(Abaous,奥地利)测定全血中白细胞总数,采用全自动生化分析仪测定血清中ALT、AST、Alb、TP、BUN和Cre等酶的活性。
1.2.4 统计学处理。应用Excel(2003)软件整理数据并作图,所有数据均用平均数±标准差(±SD)表示,采用SPSS13.0统计软件对所得数据进行单因素方差分析,P<0.05认为差异有统计学意义,P<0.01认为差异有高度统计学意义[5]。
2 结果与分析
2.1 急性内毒素血症模型评价
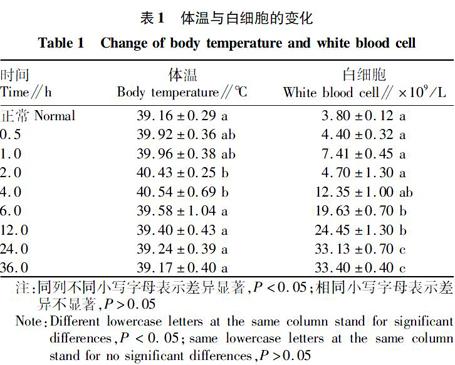
2.1.1 急性内毒素血症犬临床症状。试验前,5只犬临床检查健康,活动自如,精神良好,进食正常,体温正常,无病态。试验中,经前肢静脉注射LPS(0.075 mg/kg体重)后,犬均出现烦燥不安、嚎叫、呼吸加快等症状;而后20 min各犬精神沉郁,活动减少,逐渐卧地不起;在注射30 min后开始蜷缩萎糜,拒食,流涎;1.0 h后一些犬除有上述症状外还开始出现腹泻、呕吐症状;到6.0 h时呕吐、腹泻症状有所缓解,但是仍有流涎;24.0 h后症状都有所缓解,36.0 h时临床症状基本消失。在各观察时间内均无犬死亡。如表1所示,试验犬体温均在0.5 h后升高,6.0 h后才开始缓解,36.0 h后正常。
2.1.2 急性内毒血症犬白细胞计数结果。白细胞主要由中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞和单核细胞组成。在某些疾病如急性感染、严重的组织损伤、急性大出血、中毒和白血病等情况下白细胞数量增高[6]。有研究表明,细菌内毒素进入宿主体内以后,血流中占白细胞总数60%~70%的中性粒细胞数量迅速减少,这是因为细胞发生移动并粘附到组织毛细血管上。但1.0~2.0 h后,由内毒素诱生的中性细胞释放因子刺激骨髓释放其中的中性粒细胞进入血流,使其数量显著增加,还有部分不成熟的中性粒细胞也被释放出来。因此,白细胞数目在革兰氏阴性菌感染时常表现为先降低再升高。另外在严重感染时,白细胞总数不但不高,反而降低。
表1中为犬急性内毒素血症白细胞数量的变化。与正常时比较,注射LPS后2.0 h白细胞数明显下降(P<0.01),然后逐渐升高,24.0 h处在较高水平(P<0.05)。由以上临床症状、体温和白细胞计数表明,急性内毒素血症的模型基本建立成功。
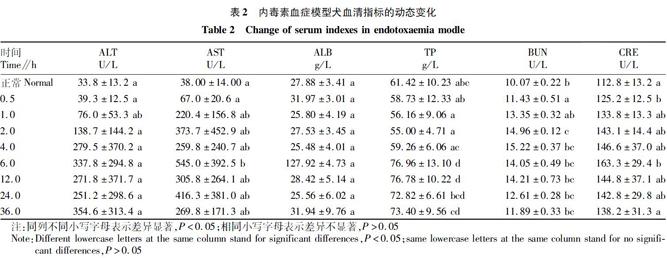
2.2 急性内毒素血症犬血清ALT的变化 谷丙转氨酶(又名谷氨酸转氨酶,简称GPT、ALT),肝细胞谷丙轉氨酶主要存在于肝细胞浆内,其细胞内浓度高于血清中的1 000~3 000倍。只要有1%肝细胞坏死,就可以使血清酶增高1倍。因此,ALT被世界卫生组织推荐为肝功能损害最敏感的检测指标。肝细胞或某些组织损伤或坏死,都会使血液中的谷丙转氨酶升高。
如表2所示,与注射前比较,注射LPS(0.075 mg/kg体重)0.5 h后,犬血清ALT水平就逐渐升高(P>0.05),表明内毒素血症已经开始对肝脏造成损伤。于6.0 h血清ALT水平达到最高(P>0.05),然后开始缓慢下降,至36.0 h血清ALT(P>0.05)未见恢复正常。对所得数据进行单因素方差分析,ALT与正常对照差异不显著。
2.3 急性内毒素血症犬血清AST的变化 谷草转氨酶(又名门冬氨酸转氨酶,简称GOT、AST),是转氨酶中比较重要的一种。它是医学临床上肝功能检查的指标,用来判断肝脏是否受到损害。正常情况下,谷草转氨酶存在于组织细胞中,其中心肌细胞中含量最高,其次为肝脏,血清中含量极少。谷草转氨酶主要存在于肝细胞线粒体内,当肝脏发生严重坏死或破坏时,才能引起谷草转氨酶在血清中浓度偏高。
如表2所示,与注射前比较,注射LPS(0.075 mg/kg体重)0.5 h后,犬血清AST水平逐渐升高(P<0.05),6.0 h时血清AST水平达到最高(P<0.01),对所得数据进行单因素方差分析,此时与正常对照相比差异极其显著。整个检测时间段内血清AST活性呈波动性变化。
2.4 急性内毒素血症犬血清ALB的变化 由于ALB(白蛋白)是肝实质细胞合成,是血浆中含量最多的蛋白质,占总蛋白的40%~60%。因此,可以作为医学临床上肝功能检查的指标,用来判断肝脏是否受到损害。
如表2所示,与注射前比较,注射后4.0 h时白蛋白水平降到最低,6.0 h时到达最高峰,36.0 h时基本恢复正常水平,差异显著(P<0.05)。
2.5 急性内毒素血症犬血清TP的变化 血清中总蛋白是球蛋白和白蛋白的总和,集中反应犬身体内总体的变化程度,可以通过观察犬急性内毒素血症的各时期总蛋白的变化来预测犬的疾病。
由表2可知,总蛋白在内毒素血症中2.0 h时达到最低,6.0 h到达最高值,36.0 h仍处于较高水平,差异显著(P<0.05)。
2.6 急性内毒素血症犬血清BUN的变化 血尿素氮(Blood urea nitngen,BUN)是蛋白质代谢的终末产物,主要经过肾小球滤过随尿排出,当肾实质受损时,肾小球滤过率降低,导致BUN浓度增加,测定尿素氮可以观察肾小球的滤过功能,用此指标评价内毒素血症模型[7]。
如表2所示,与注射前比较,LPS注射犬1.0 h后BUN水平就逐渐升高(P<0.05),在4.0 h后 BUN水平达到最高(P<0.01),然后开始下降,36.0 h趋于正常。
2.7 急性内毒素血症犬血清Cre含量的变化 肌酐(Cre)主要由肌肉代谢产生,极小部分来自食物。血清肌酐浓度实际上取决于肾的排泄功能的好环。由于肾的代偿能力很大,在肾疾病的初期,血肌酐浓度一般不升高,只有当肾小球滤过能力下降一半或更多时,血肌酐浓度才见增高,所以其灵效性较差。一旦出现肌酐增高,常提示预后严重。
如表2所示,各犬在注射LPS后各时间点血清肌酐值均高于注射前的正常值(P<0.05),在6.0 h后肌酐值显著高于正常值(P<0.01),表明内毒素血症组犬已存在肾功能损害。
3 讨论
内毒素血症是由于血液中或病灶内的细菌释放出大量内毒素至血液,或输入大量被内毒素污染的液体而引起的一种病理性表现,可以出现在多系统的多种疾病中,常导致全身炎症反应综合征、致死性的感染性休克、多器官功能衰竭等,病死率极高,是导致危重症的常见原因,是对疾病预后产生严重影响的重要因素,是危重症医学的重点研究课题[6]。其临床症状[8]主要决定于宿主对内毒素的抵抗力,突出表现为发热、白细胞数变化、出血倾向、心力衰竭、肾功能减退、肝脏损伤、神经系统症状以及休克等。因此,对内毒素血症的早期治疗、检测、防止其进一步发展对内毒素血症的预后非常重要。该试验的主要目的不在于对疾病的早期诊断,而是协助了解病情,估计预后,制定治疗措施,观察疗效[9]。一些其他因素,如各种病毒性肝炎、肝硬变、肝脓肿、肝结核、肝癌、脂肪肝、酒精肝以及某些药物等,均可引起不同程度的转氨酶升高;另外又如心功能不全、贫血、水肿、药物、输尿管梗阻等也都可影响肾功能试验的结果。因此,在试验检查结果分析时,必须结合临床资料、其他辅助检查综合分析,才能作出正确的判断。
3.1 LPS 对肝脏功能的影响 LPS可以通过多种因素造成肝细胞的损伤,研究其作用机制可以为防止内毒素血症肝损伤提供理论依据和临床思路[10]。内毒素对肝脏的直接损伤作用包括内毒素对肝脏能量代谢的影响[11]、内毒素对肝脏微循环的影响[12-13]、内毒素对肝脏枯否细胞的作用[14]。内毒素对肝脏的间接损伤作用是LPS与细胞膜上的受体结合后激活肝内外单核-巨噬細胞系统,通过丝裂原活化蛋白激酶通路、PKC通路、核因子KB(nuclear factor-KB,NF-KB)通路等,诱导细胞内肿瘤坏死因子(tumor necrosis factor,TNF)-ɑ、IL-1、NO等多种炎性介质大量生成,形成瀑布效应;也可吸引中性粒细胞进入肝内,并产生蛋白酶及超氧阴离子[15]。多种炎性介质共同构成炎性介质网络,协同作用于肝细胞。
该试验模型犬血清中的ALT和AST活性显著高于正常值,这一试验结果极为直观地反映内毒素对肝脏功能的损害。另外,在相关研究中发现内毒素可以通过在转录水平抑制肝细胞白蛋白mRNA的表达来抑制白蛋白的合成,此过程与细胞内信号传导通路p38和ERK激酶密切相关,进一步阐明感染时低白蛋白血症的分子机制[16],而该研究发现白蛋白的含量先不断减少在4 h时达最低,之后再慢慢恢复正常,进一步验证试验结果的正确性,由此提示我们在以后对犬的治疗过程中应注意白蛋白的补充,抑制白蛋白的减少,保持犬体内白蛋白的平衡。
3.2 LPS 对肾脏的影响
内毒素介导急性肾功能衰竭的机理十分复杂,尽管已进行过一些研究,但人们对这一问题的认识和理解仍不全面[17-18]。肾小球滤过率降低被认为是急性肾功能衰竭发生的中心环节,吴立夫等[19]认为内毒素介导急性肾功能衰竭的首要机理是内毒素使动物血液凝固性增高,进而导致大量肾小球微血栓的形成,后者严重阻塞肾小球毛细血管血流,从而使肾小球滤过率显著降低。内毒素可通过不同途径引起血小板黏附、聚集,并激活内、外源性凝血系统,导致弥漫性血管内凝血,在肾、肝、肺和心肌等各组织微血管中形成广泛性微血栓。由于肾小球内广泛形成的微血栓在阻断肾小球毛细血管血流的同时,也导致肾小管的缺血,这无疑是肾小管上皮细胞变性、坏死的重要原因之一。
该研究从血清肌酐、尿素氮含量2个不同的方面揭示急性内毒素血症导致肾功能衰竭的表现。肌酐、尿素氮都是机体代谢的终产物,并主要通过肾脏排出。试验模型犬的肌酐尿素氮在血中的浓度均极显著地升高,究其原因是肌酐和尿素氮随尿排出量均急剧减少,致使肌酐和尿素氮在血中蓄积,试验极为直观地反映内毒素对肾脏功能的损害。此外,动态观察还表明,内毒素介导的急性肾功能衰竭呈现明显的进行性变化,在整个试验观察期间所有肾功能指标无一例外地不断恶化。因此,试验取得的成果对内毒素性肾功能衰竭及其防治的研究重要具有意义。
参考文献
[1] 马学恩.家畜病理学[M].4版.北京:中国农业出版社,2007:223-230.
[2] 欧阳五庆.动物生理学[M].北京:科学出版社,2006:207-226.
[3]王今达.多脏器功能失常综合征与肠道内细菌及内毒素易位[J].中国危重病急救医学,1995,7(6):321-323.
[4] ROSE R,BANERJEE A,RAMAIAH S K.Characterization of a lipopolysaccharide mediated neutrophilic hepatitis model in Sprague Dawley rats [J].Appl Toxicol,2007,27(6):602-611.
[5] 明道绪.生物统计附试验设计[M].3版.北京:中国农业出版社,2008:22-23.
[6] 陆地.急性内毒素血症早期大鼠血糖变化与AMPK关系的研究[D].杭州:浙江大学,2009.
[7] 季红,朱晓云,殷国庆.猕猴早期内毒素血症肾脏内选择素的变化[J].东南大学学报,2005,24(1):25-27.
[8] 毛宝龄.急性呼吸窘迫综合征[M].北京:人民卫生出版社,2002:234.
[9] HEYMAN S N,ROSEN S,DARMON D,et al.Endotoxininduced renal failure:Ⅱ.A role for tubular hypoxic damage[J].Exp Nephrol,2000,8(4/5):275-282.
[10] 李英,刘宏杰,邹万盛,等.褪黑素对内毒素血症山羊肝功能损伤的影响[J].中国兽医学报,2009,29(1):86-88,116.
[11] HARGROVE D M,BAGBY G J,LANG C H,et al.Adrenergic blockade prevents endotoxin induced increases in glucose metabolism[J].Am J Physiol,1988,255(5 Pt 1):629-635.
[12] 华静,邱德凯.内毒素与肝脏微循环[J].胃肠病学,2005,10(1):48-50.
[13] ISHII K,ITO Y,KATTAGIRI H,et al.Neutrophil elastase inhibitor attenuates lipopoly saccharideinduced hepatic microvascular dysfunction in mice [J].Shock,2002,18(2):163-168.
[14] QIU D K,HUA J,LI J Q,et al.CDl4 expression on Kupffer cells during the course of carbon tetrachloridemediated liver injury[J].Chin J Digest Diseases,2005,6(3):137-141.
[15] 羅玉政,宋林学,龚建平.库普弗细胞在内毒素血症致肝损伤中的作用[J].国际消化病杂志,2006,26(5):351-353.
[16] 王新颖,李宁,李维勤,等.内毒素诱导大鼠肝细胞白蛋白表达下降的分子机制[J].中华外科杂志,2004,42(6):362-365.
[17] ZUROVSKY Y,GISPAAN I.Antioxidants attenuate endotoxininduced acute renal failure in rats[J].Am J Kidney Dis,1995,25(1):51-57.
[18] HEYMAN S N,DARMON D,GOLDFARB M,et al.Endotoxininduced renal failure:I.A role for altered renal microcirculation[J].Exp Nephrol,2000,8(4/5):266-274.
[19] 吴立夫,周建国.内毒素介导动物急性肾功能衰竭机理的试验研究[J].畜牧兽医学报,2005,36(3):283-287.

