基于NHS基团修饰的副溶血性弧菌免疫磁珠制备及其富集性能评价
刘阳,刘文侠,孙力军,施琦,邱妹,邓旗

摘要 [目的]制备NHS基团修饰的副溶血弧菌免疫磁珠并评价其富集性能。[方法]采用偶联率确定免疫磁珠最佳制备条件(磁珠粒径、偶联时间和抗体加入量),采用捕捉率确定免疫磁珠最佳富集条件(菌悬液pH、孵育时间和免疫磁珠加入量),并通过方法的特异性、灵敏度、精密度和稳定性评价免疫磁珠富集性能。[结果] 0.1 mL N2型NHS磁珠可与0.2 mL副溶血弧菌抗血清偶联2 h制备IMBVP,加入到副溶血弧菌菌悬液(pH 7.0~7.4)中孵育2 h,IMBVP最佳工作液体积为0.4 mL。该方法特异性好、灵敏度高(15 cfu/50 mL)、精密度高(批内变异系数和批间变异系数均在3%~6%)、稳定性好(准确度大于91%)。[结论]自制副溶血弧菌免疫磁珠富集性能好,方法工作效率高,成本低,为副溶血弧菌高效快速检测提供了可靠的富集手段。
关键词 NHS基团;副溶血弧菌;免疫磁珠;富集
中图分类号 S-3 文献标识码 A 文章编号 0517-6611(2018)06-0001-04
Preparation of Vibrio parahaemolyticus Immunomagnetic Beads Based on NHS Group and Evaluation of Enrichment Capacity
LIU Yang1,LIU Wenxia1,SUN Lijun2 et al (1.National Marine Products Quality Supervision & Inspection Center,Zhanjiang,Guangdong 524000;2.College of Food Science,Guangdong Ocean University,Zhanjiang,Guangdong 524000)
Abstract [Objective] The aim was to prepare Vibrio parahaemolyticus immunomagnetic beads (IMBVP) based on NHS group and evaluate the enrichment capacity.[Method] The best coupling conditions were decided by conjugate ratio,like conditions range from magnetic beads particle diameter,coupling time and the adding amount of antibody.The best enrichment conditions were decided by capture rates,like conditions range from pH,incubation time and the adding amount of IMBVP.The enrichment capacity of IMBVP was evaluated according to specificity,sensitivity,precision and stability.[Result] The IMBVP was prepared by chemical bond,which combined 0.1 mL of NHS bead with size N2 and 0.2 mL of Vibrio parahaemolyticus antiserum.IMBVP was placed into the bacterial suspension which pH was 7.0-7.4.Volume addition of was IMBVP 0.4 mL.They were incubation 2 h together.The method was involved in some advantages,high specificity,sensitivity and accuracy.The detection limit was 15 cfu/50 mL.The CVs of intra and inter assay were between 3% and 6%.The accuracy was greater than 91%.[Conclusion] The above results demonstrate that homemade IMBVP has good enrichment performance.Experiment results show that it is an effective method,convenience,low cost and quickness.
Key words NHS;Group Vibrio parahaemolyticus;Immunomagnetic beads;Enrichment
免疫磁珠分離技术是近年发展起来的一项新的免疫学技术[1]。根据免疫学原理,副溶血性弧菌抗体在适当的条件下与磁珠偶联后,可与副溶血性弧菌发生特异性结合,在外加磁场的作用下,达到快速分离和富集目标菌的效果。这种高特异性方法可以在较为复杂的环境中有效地收集、浓缩大量样品中的少量目标菌,从而提高检测效率。目前,已有学者对副溶血性弧菌免疫磁珠的制备方法进行了研究[2-4],但存在3个问题:一是采用国外磁珠Dynabeads效果较好,但是价格昂贵,超出国内磁珠价格10倍;二是常用磁珠类型为羧基磁珠或氨基磁珠,在连接抗体前需要对磁珠进行活化,并且磁珠与抗体偶联的时间较长,一般需要过夜,大大影响了免疫磁珠制备的效率;三是现有研究主要是对1 mL样品液进行富集,没有体现免疫磁珠应用优势。
基于以上问题,笔者选用NHS磁珠作为试验材料,与副溶血性弧菌抗血清偶联制备免疫磁珠(IMBVP),优化了免疫磁珠制备条件和孵育条件,确定了最佳制备和使用方案,并通过特异性、灵敏性和稳定性试验对副溶血弧菌免疫磁珠富集性能进行了评价,以期为构建副溶血弧菌高效快速的检测方法奠定基础。
1 材料与方法
1.1 材料 副溶血性弧菌(ATCC33847)、创伤弧菌(ATCC27562)、溶藻弧菌(ATCC 17749)、金黄色葡萄球菌(ATCC 25923)、单增李斯特菌(ATCC 19115)、铜绿假单胞菌(ATCC9027)、沙门氏菌(CMCC50094)、志贺氏菌(CMCC51572);NHS磁珠(HRCZ-03N300粒径为300 nm,以下缩写为“N1”、HRCZ-03N400粒径为1 μm,以下缩写为“N2”),洛阳惠尔纳米科技有限公司。
1.2 方法
1.2.1 免疫磁珠的制备。①取0.1 mL NHS磁珠,加入0.5 mL洗涤缓冲液(PBST:0.1 mol/L PBS溶液含0.05%吐温-20,pH 7.4)洗涤3次,置于磁分离器中,去上清;②取副溶血弧菌K Ⅱ 型抗血清(以下简称“抗血清”)稀释液,偶联缓冲液(MEST:15 mmol/L MES,含0.05%吐温-20,pH 6.0)调节体积至0.4 mL,混合液室温振荡反应后,置于磁分离器取上清,检测偶联率。洗涤缓冲液洗涤3次,置于磁分离器中,去上清。考马斯亮蓝测蛋白法测定上清液蛋白质含量,计算抗体蛋白与磁珠偶联率。③加入封阻缓冲液(PBST含 2% BSA)涡旋30 s,将离心管于室温下振荡反应2 h;④洗涤后将制备好的免疫磁珠(IMBVP)存放于保存缓冲液(PBST含0.02%NaN3、1%BSA)中,4 ℃保存待用。
偶联率=血清蛋白加入量-上清液蛋白剩余量血清蛋白加入量×100%
1.2.2 免疫磁珠对目标菌株的捕获。①将IMBVP去上清,加入1 mL副溶血性弧菌菌悬液,37 ℃振荡反应。②取0.1 mL上清液涂布弧菌显色培养基,去其他上清液。③取0.5 mL洗涤缓冲液洗涤IMBVP 3次,置于磁分离器中,去上清。④加入0.3 mL PBST混匀后,分别取0.1 mL混合液涂布3个弧菌显色培养基,37 ℃培养18~24 h计数,取3个板菌落数之和。计算原液菌落数和IMBVP捕获菌落数,计算捕获率。同时以无菌生理盐水代替菌悬液作为阴性对照。
捕获率(X)=富集到的菌落数(cfu/0.1 mL)原始菌落数(cfu/0.1 mL)×100%
1.2.3 磁珠制备条件的优化。
1.2.3.1 磁珠型号。比较N1和N2 2种型号磁珠偶联情况。
1.2.3.2 偶联时间。磁珠与抗血清偶联不同时间(1.0、1.5、2.0、2.5、3.0 h),比较偶联率,确定最佳偶联时间。
1.2.3.3 抗体加入量。分别比较不同含量抗血清(0.1、0.2、0.3、0.4 mL )与磁珠的偶联率,确定最佳血清加入量。
1.2.4 免疫磁珠捕获目标菌条件的优化。
1.2.4.1 捕获时间。比较免疫磁珠与目标菌在不同孵育时间情况下(0.5、1.0、1.5、2.0、3.0 h)对目标菌的捕获率,确定IMBVP捕获目标菌最佳时间。
1.2.4.2 孵育溶液pH。比较不同孵育环境中(pH分别为6.0、6.5、7.0、7.5、8.0)免疫磁珠对目标菌的捕获情况。
1.2.4.3 免疫磁珠使用量。比较不同含量IMBVP(0.10、0.15、0.20、0.25、0.30 mL)对等浓度目标菌的捕获率,确定最佳免疫磁珠使用量。
1.2.5 免疫磁珠捕获性能的测定。
1.2.5.1 特异性。采用IMBVP分别分离副溶血性弧菌、霍乱弧菌、溶藻弧菌、金黄色葡萄球菌、单增李斯特菌、铜绿假单胞菌、沙门氏菌、志贺氏菌,对于副溶血性弧菌疑似菌落进行生化鉴定试验,比较IMBVP对不同菌株的富集情况,评价其特异性。
1.2.5.2 灵敏性。将IMBVP分别加入到等浓度、不同体积的副溶血性弧菌菌悬液中(1、10、50 mL)进行富集检测。设置传统菌落计数法作为对照试验。计算捕捉率确定IMBVP检测副溶血性弧菌的最低检测限。
1.2.5.3 精确度。将IMBVP分别加入浓度范围为<30 cfu和30~300 cfu副溶血弧菌菌悬液中,最佳条件下进行批内重复和批间重复(n=5),以其批内变异系数表示批内误差,批间变异系数表示批间误差,系数范围在低浓度点时应<15%。2个变异系数表示方法的精确程度。
1.2.5.4 准确度。计算多次试验(n=15)结果准确度。准确度(%)=1-E%。其中E%表示测定结果的相对误差。
2 结果与分析
2.1 免疫磁珠制备最佳条件的确定
2.1.1 磁珠型号对磁珠偶联能力的影响。采用2个型号免疫磁珠加入到等浓度的副溶血弧菌菌悬液中,N1型和N2型免疫磁珠对副溶血弧菌的捕捉率为(50.27±2.39)%和(74.23±1.77)%。因此,确定N2型磁珠作为后续试验磁珠,由N2型磁珠制备的免疫磁珠为IMBVP。
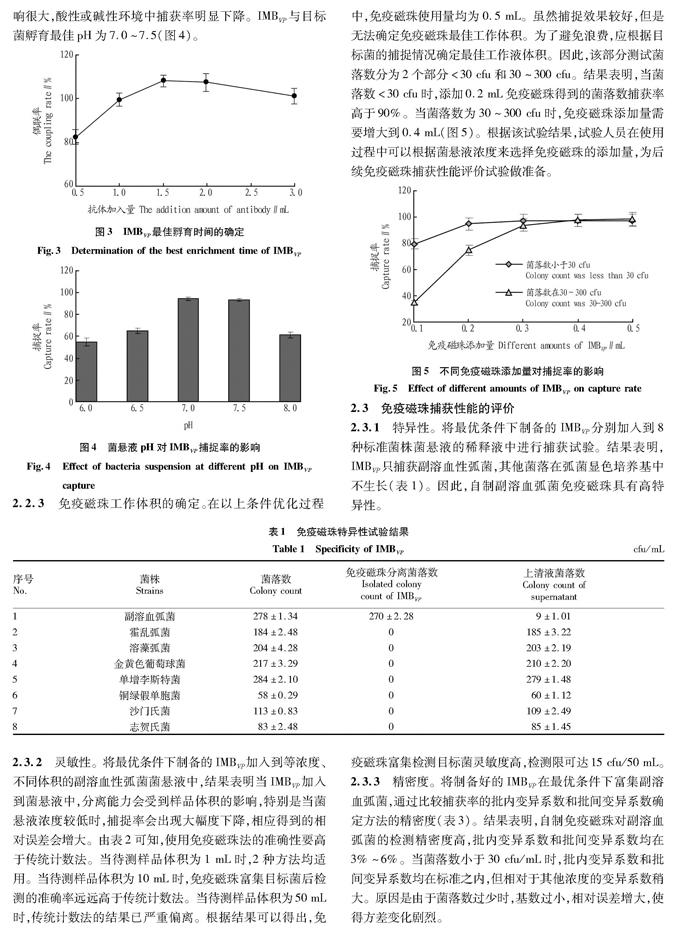
2.1.2 偶联时间对磁珠偶联能力的影响。结果表明,时间对偶联率的影响较大。随着磁珠与抗血清偶联时间的延长,磁珠结合抗血清的能力增强,偶联2 h后偶联率达到最大值(79.73±0.79)%(图1)。超过2 h后,磁珠与抗血清偶联率变化幅度较小,并有微弱的降低。这说明长时间的振荡会影响磁珠与抗血清的化学键结合。因此,选取2 h为磁珠与抗血清偶联最佳时间。
2.1.3 磁珠对抗血清承载量的确定。结果表明,磁珠对抗血清具有一定的承载能力。随着抗血清含量增加,与磁珠偶联趋于稳定,当抗血清添加量為0.2 mL时,偶联率最高可达(90.82±1.79)%(图2)。当超过磁珠承载量后,溶液中没有结合的血清含量增多,偶联率下降,浪费材料。因此,确定0.1 mL NHS磁珠可与0.2 mL抗血清进行偶联制备IMBVP。
2.2 免疫磁珠捕获目标菌株最佳条件的确定
2.2.1 捕获时间对IMBVP捕获能力的影响。结果表明,随着免疫磁珠与目标菌孵育时间的延长,捕获率明显提高。当孵育时间达到1.5 h时,捕捉率达到最高,为(88.22±2.68)%。时间延长至2.0 h,捕捉率基本稳定。但当孵育时间超过3.0 h时,捕捉率降低。根据原理,孵育时间过长会降低免疫磁珠的特异性,环境中的杂菌可能会与免疫磁珠相结合,导致捕捉率下降。因此,免疫磁珠与目标菌的孵育时间应在最佳时间范围内(图3)。
2.2.2 孵育液pH确定。将副溶血弧菌菌悬液加入到免疫磁珠工作液中,分别用无菌1 mol/L盐酸或氢氧化钠调节pH至6.0~8.0。结果表明,孵育环境对免疫磁珠的捕获能力影响很大,酸性或碱性环境中捕获率明显下降。IMBVP与目标菌孵育最佳pH为7.0~7.5(图4)。
2.2.3 免疫磁珠工作体积的确定。在以上条件优化过程中,免疫磁珠使用量均为0.5 mL。虽然捕捉效果较好,但是无法确定免疫磁珠最佳工作体积。为了避免浪费,应根据目标菌的捕捉情况确定最佳工作液体积。因此,该部分测试菌落数分为2个部分<30 cfu和30~300 cfu。结果表明,当菌落数<30 cfu时,添加0.2 mL免疫磁珠得到的菌落数捕获率高于90%。当菌落数为30~300 cfu时,免疫磁珠添加量需要增大到0.4 mL(图5)。根据该试验结果,试验人员在使用过程中可以根据菌悬液浓度来选择免疫磁珠的添加量,为后续免疫磁珠捕获性能评价试验做准备。
2.3 免疫磁珠捕获性能的评价
2.3.1 特异性。将最优条件下制备的IMBVP分别加入到8种标准菌株菌悬液的稀释液中进行捕获试验。结果表明,IMBVP只捕获副溶血性弧菌,其他菌落在弧菌显色培养基中不生长(表1)。因此,自制副溶血弧菌免疫磁珠具有高特异性。
2.3.2 灵敏性。将最优条件下制备的IMBVP加入到等浓度、不同体积的副溶血性弧菌菌悬液中,结果表明当IMBVP加入到菌悬液中,分离能力会受到样品体积的影响,特别是当菌悬液浓度较低时,捕捉率会出现大幅度下降,相应得到的相对误差会增大。由表2可知,使用免疫磁珠法的准确性要高于传统计数法。当待测样品体积为1 mL时,2种方法均适用。当待测样品体积为10 mL时,免疫磁珠富集目标菌后检测的准确率远远高于传统计数法。当待测样品体积为50 mL时,传统计数法的结果已严重偏离。根据结果可以得出,免疫磁珠富集检测目标菌灵敏度高,检测限可达15 cfu/50 mL。
2.3.3 精密度。将制备好的IMBVP在最优条件下富集副溶血弧菌,通过比较捕获率的批内变异系数和批间变异系数确定方法的精密度(表3)。结果表明,自制免疫磁珠对副溶血弧菌的检测精密度高,批内变异系数和批间变异系数均在3%~6%。当菌落数小于30 cfu/mL时,批内变异系数和批间变异系数均在标准之内,但相对于其他浓度的变异系数稍大。原因是由于菌落数过少时,基数过小,相对误差增大,使得方差变化剧烈。
2.3.4 准确性。将制备好的IMBVP在最优条件下富集副溶血弧菌,通过考察多次检测结果与真实值之间接近的程度来确定方法的准确性。结果表明,当副溶血弧菌菌悬液浓度在30~300 cfu/mL时,IMBVP检测准确度为(94.36±2.18)%;当浓度<30 cfu/mL时,IMBVP检测准确度为(91.45±4.38)%。综合来看,自制免疫磁珠对副溶血弧菌的检测有较好的准确性。
3 结论与讨论
免疫磁珠在制备过程中通常会受到磁珠类型[5-6]和制备条件[7-8]的影响。免疫磁珠的制备实质上是磁珠表面的活性基团与抗体外部基团的结合过程[9]。活性基团包括羧基、氨基、巯基、甲苯磺酸基和环氧基等[10]。为了降低非特异性结合,研究人员又研制了Protein A/G磁珠。但是Protein A/G磁珠在使用过程中会出现免疫反应,形成背景目标蛋白[11]。链霉亲和素磁珠也是目前常用磁珠之一[12]。但是链霉亲和素磁珠在使用前要将抗体进行生物素化。生物素化过程较为繁琐,素化后要对素化效果进行检测,过程繁琐,需要专业人员进行操作。NHS磁珠是近年来新开发的基于NHS基团磁珠,其磁核为纳米四氧化三铁,接有羧基磁珠壳层硅基,然后再连接羧基,最后NHS基团修饰。NHS基团与抗体可形成较为牢固的共价键连接,不易解离。这是该研究采用NHS磁珠作为基础材料的重要原因。
制备条件是成功制备免疫磁珠的重要因素。免疫磁珠的制备条件主要受到磁珠粒径大小[13]、温度[14]、活化剂、时间[15]、pH[16]、抗體添加量等因素的影响。笔者所在课题组自2011年开始对免疫磁珠的制备进行研究[17-20],根据团队研究成果,参考磁珠类型及成品磁珠说明书建议,该研究主要以磁珠型号、时间和添加量作为免疫磁珠制备的优化因素,经试验确定制备方案,即采用0.1 mL HRCZ-03N400型NHS磁珠与0.2 mL抗血清进行偶联2 h可制备副溶血弧菌免疫磁珠。免疫磁珠对副溶血弧菌富集条件的优化也是能够获得良好性能的重要保障。经研究,确定了最佳孵育条件,在pH 7.0~7.4菌悬液中添加0.4 mL免疫磁珠孵育2 h。
通过对免疫磁珠制备条件的优化和捕获目标菌株条件的优化,可获得高特异性免疫磁珠,其最低检测限已达15 cfu/50 mL,与团队前期研究成果相比提高了8倍[17],突破了传统计数法的局限,大大提高了检测方法的灵敏度、准确度和精密度。另外,该方法制备免疫磁珠的时间为4 h,与其他类型免疫磁珠制备方法相比,可减少23 h,大大提高效率。该制备方法成本较低,是国外产品价格的1/10。该研究自主制备的副溶血弧菌免疫磁珠已申请发明专利,并为免疫磁珠试剂盒的研制奠定了基础。
参考文献
[1] UGELSTAD J.Process for preparing an aqueous emulsion or dispersion of a partly watersoluble material,and optionally further conversion of the prepared dispersion or emulsion to a polymer dispersion when the partly watersoluble material is a polymerizable monomer:4,336,173[P].1982-06-22.
[2] 张凡非,杉山宽治,西尾智裕,等.环境样品中病原性副溶血性弧菌高效檢出法[J].中国卫生检验杂志,2002,12(3):272-274.
[3] 苏晨曦,孙晓红,卢瑛,等.副溶血性弧菌免疫磁珠的制备及其应用[J].食品工业科技,2012,33(17):313-316.
[4] 王报贵,武晓丽,董素琴,等.副溶血弧菌的磁珠捕获及检测[J].食品工业科技,2013,34(13):147-152.
[5] 梁冰,张雅洁,纪雪,等.肠出血性大肠埃希菌 O157 免疫磁珠的制备[J].中国生物制品学杂志,2017,30(3):278-282.
[6] 丁浩,苏战强,夏利宁,等.免疫磁珠富集法对牛源大肠杆菌 O157∶H7 分离鉴定的影响[J].中国畜牧兽医,2017,44(4):1189-1194.
[7] 张尔力.EDC/NHS 法制备免疫磁珠及其效果验证[J].化工管理,2016 (30):104-105.
[8] 陈伟,王国民.免疫磁珠分选前列腺肿瘤细胞的方法优化[J].泌尿外科杂志(电子版),2017(2):5-7.
[9] 闻一鸣,徐金亭,向军俭.免疫磁珠富集技术进展[J].中国免疫学杂志,2013,29(1):88-92.
[10] ERATHODIYIL N,YING J Y.Functionalization of inorganic nanoparticles for bioimaging applications[J].Acc Chem Res,2011,44(10):925-235.
[11] MUKTHAPURA A,SHIMOGGA A,VINODCHANDRAN K,et al.Oxidative products of proteins and antioxidant potential of thiols in gastric carcinoma patients[J].Journal of medical biochemistry,2010,29(2):102-106.
[12] 杨秋萍,何珊珊,王志民.生物素化 DNA 与链霉亲和素绑定初步研究[J].上海交通大学学报(农业科学版),2016,34(6):9-14.
[13] CHEN J,PARK B.Effect of immunomagnetic bead size on recovery of foodborne pathogenic bacteria[J].International journal of food microbiology,2018,267:1-8.
[14] 喻伟.免疫磁珠的制备及其初步应用[D].武汉:华中农业大学,2010.
[15] XING J,CHANG Y H,TANG X Q,et al.Separation of haemocyte subpopulations in shrimp Fenneropenaeus chinensis by immunomagnetic bead using monoclonal antibody against granulocytes[J].Fish & shellfish immunology,2017,60:114-118.
[16] 张凡非,杉山宽治,西尾智裕,等.利用免疫磁珠法分离环境及食品中产生 TDH 副溶血性弧菌的研究[J].中国卫生监督杂志,2004,11(1):7-9.
[17] 梁光明,刘阳,孙力军,等.利用人免疫球蛋白构建免疫磁珠富集金葡菌条件优化[J].食品与生物技术学报,2013,32(3):265-271.
[18] 胡连花.对虾中副溶血性弧菌产毒株的分离识别及抗菌肽的控制效应[D].湛江:广东海洋大学,2012.
[19] 刘阳.对虾中金葡菌及肠毒素 B 免疫磁快速检测法的建立与应用[D].大连:大连工业大学,2011.
[20] 黄韵仪,胡连花,孙力军,等.副溶血性弧菌免疫磁珠偶联条件优化及捕获性能评价[J].微生物学杂志,2012,32(6):7-11.安徽农业科学,J.Anhui Agric.Sci. 2018,46(6):33-36

