降雨量变化对入侵植物豚草植株生长的影响
全国明,刘莹莹,毛丹鹃,章家恩,*,谢俊芳
1.广州城市职业学院城市建设工程系,广州 510405
2.华南农业大学热带亚热带生态研究所/农业部华南热带农业环境重点实验室/广东省现代生态农业与循环农业工程技术研究中心,广州 510642
1 前言
豚草(Ambrosia artemisiifolia),又名艾叶破布草或豕草,菊科豚草属的一年生草本植物,原产美国西南部、墨西哥西北部的索诺兰地区,现广泛分布于美洲、亚洲、澳洲和大西洋群岛的许多国家和地区,是世界公认的广布型恶性入侵杂草[1]。豚草可能于20世纪30年代初传入我国,最早的标本于1935年采自杭州,现已蔓延到辽宁、北京、河南、湖北、江西、福建等21个省区,发生面积达0.0247亿 hm2[1–2]。豚草入侵后极易形成单优植物群落,排斥土著物种,降低当地的生物多样性并造成农、林、牧业大幅减产,而且花粉是人类过敏性反应“枯草热病”的主要致病原,严重威胁人体健康。1997年豚草被列入我国三类潜在危险性杂草;2003年被列入“中国第一批外来入侵物种名单”,排名第四[3–4]。
近年来,科学工作者在豚草的群落分布[2,5]、入侵机制[6–7]、生态危害[8–9]、防治控制[10–11]以及预测预报[12]等方面开展了大量的研究工作,发现豚草的繁殖传播能力强[13–14]、生长速度快且再生力强[15–16]、具有化感作用[17–18]、表型可塑性以及遗传多样性较高[19–20]等生物学特性与其强大入侵力紧密相联,并且豚草在野外能够通过改善入侵地的土壤营养循环、提高土壤肥力供应水平而促进自身持续入侵[21]。随着经济贸易、交通运输以及旅游业的快速发展,豚草在我国的入侵危害区域不断扩大,最近在广东西南部、新疆伊犁等地区相继发现豚草的入侵踪影[16,22]。另外,全球气候变化对豚草的蔓延扩散也产生重要影响,如温度上升能够提高豚草对新生境的适合度、延长豚草花粉的生长季节[23–24];CO2浓度升高能够增加豚草植株的地上部生物量以及花粉产量[25],这均有利于促进豚草的入侵生长和繁殖扩散。全球变暖亦在一定程度上加剧了生态系统的水循环,降雨的空间异质性与季节波动增大,降水格局发生明显变化[26]。这将直接改变土壤的含水量,进而影响土壤的温度、结构和养分含量,最终导致植物的形态、结构和生理生态特性发生变化[27]。但迄今为止,降雨量变化对豚草植株的入侵生长产生哪些影响作用?目前所开展的研究极为缺乏。本文采用温室盆栽试验方法,以野外自然群落中豚草的常见伴生土著植物肖梵天花(Urena lobata)作为对照物种,研究不同降雨量对豚草植株形态、生长、生物量积累与分配的影响效应,以探讨豚草在降水格局发生变化时的生态适应策略,旨在为科学预测豚草的入侵分布以及探索其入侵机制提供理论依据。
2 研究地区与研究方法
2.1 研究区概况
本试验在广东省广州市华南农业大学校内生态学农场(113°36′E,23°13′N)的玻璃温室进行。该地属南亚热带典型的季风海洋性气候,四季温暖、光热资源充足、雨量充沛,年平均气温21.5—22.2℃,年平均降雨量约1800 mm。
2.2 试验材料与设计
2009年10月在广东省韶关市郊外采摘豚草种子,11月在华南农业大学增城教学科研基地采摘肖梵天花种子,运回实验室后置于4℃冰箱冷藏备用。2010年6月28日挑选成熟、无病虫害的种子进行播种育苗,苗床基质为蘑菇渣,上盖一层遮阳网(透光率约75%);7月16日幼苗长至5—6 cm高时进行间苗。7月28日在苗床中选择生长健壮、株高约15 cm的豚草、肖梵天花幼苗进行移栽,花盆规格为20.0 cm(上口径)×16.0 cm(下口径)×19.0 cm(高), 每盆 1 株,栽培基质为旱地土,每盆装土5 kg,并且下面垫有一个配套的塑料底托。全部移栽上盆的幼苗置于温室内恢复生长,8月30日选择生长健壮、大小均匀、无病虫害的豚草和肖梵天花植株进行正式处理。试验共设置3个降雨水平,分别模拟年均降雨量为1800 mm(High precipitation treatment,HP)、1200 mm(Middle precipitation treatment,MP)和800 mm(Low precipitation treatment,LP)的高、中、低3种降水格局。用喷壶均匀喷洒自来水的方式模拟自然降雨,每天喷淋植株一次,喷淋量分别为5 mm、3.33 mm和2.22 mm。为保证水滴不落在花盆外,每次喷淋操作时均在植株外围沿花盆边缘用塑料薄膜围蔽,并引导水分回流至花盆内。每处理10个重复。9月15日按1 g·盆-1的规格施用复合肥(N:P:K=15:15:15,深圳市芭田生态工程股份有限公司),适时防治病虫害。10月8日结束试验,取样测定相关研究指标。
2.3 测定方法
试验结束后测定豚草、肖梵天花植株的形态和生长参数,包括株高、分枝数量、分枝长度、叶片数、叶面积与生物量等指标。每处理5个重复。采用Li-3000A型(Li-cor,USA)叶面积仪测定叶面积。生物量的测定先把植株的根、茎、叶等器官分离,装入纸袋后于85℃烘1周,待其达到恒重后进行称量。按Poorter[28]的方法计算各器官生物量比(根生物量比[Root mass fraction,RMF];茎生物量比[Stem mass fraction,SMF];叶生物量比[Leaf mass fraction,LMF];根冠比[Root mass/crown mass,R/C])、叶面积比(Leaf area ratio,LAR)、叶根比(Leaf area to root mass ratio,LARM)和比叶面积(Specific leaf area,SLA)等相关参数。按 Poorter[28]、Yamashita 等[29]的方法计算平均相对生长速率(Relative growth rate,RGR)与净同化速率(Net assimilation rate,NAR):
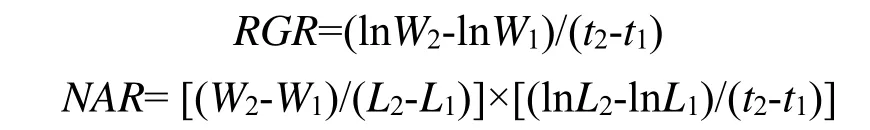
其中W1、L1分别表示开始处理时测定的豚草、肖梵天花植株总生物量(g)和总叶面积(cm2),共取5个重复的算术平均值,W2、L2分别表示收获时测定的豚草、肖梵天花单个重复的总生物量(g)和总叶面积(cm2)。(t2-t1)表示两次测定的时间间隔(d)。
2.4 数据处理
所有试验数据均在Microsoft Excel上完成处理,采用SPSS17.0进行双因素方差分析(ANOVA),其中同一物种的同一指标在不同降雨水平的差异采用Duncan新复极差法进行多重比较,不同物种的同一指标在同一降雨水平的差异采用独立样本t检验(Independent SampleT-test)进行分析。采用SigmaPlot 12.0绘制图表。
3 结果与分析
3.1 物种、降雨量对植株生长性状的影响
除总叶面积、总生物量和NAR外,植株的全部生长性状指标均受到物种类型的显著影响(表1)。降雨量对植株的结构特征、生物量积累、叶形态参数与生长特征的大部分指标作用显著,但对于植株的生物量分配参数,只有叶生物量比受到其显著影响。而分枝数量、叶片数、叶根比、RGR等指标以及全部生物量积累参数均受到物种×降雨量的显著交互作用。
3.2 降雨量变化对豚草植株结构特征的影响
两种植物的株高均随降雨量的上升显著增加,并在HP处理达到最大值(图1)。其中豚草株高分别比LP、MP处理增加36.07%和27.30%,差异均达显著水平;肖梵天花株高亦分别高于LP、MP处理45.69%和11.54%,但只与LP处理的差异显著;并且同一降雨水平下豚草植株均显著高于肖梵天花。两种植物的分枝数量、分枝长度对降雨量变化的响应规律不同(图1)。豚草的分枝数量在MP处理达到最大值(97.33),并显著高于LP、HP处理;肖梵天花的分枝数量随降雨量的上升而增加,其中HP处理显著高于LP、MP处理;但在三种降水格局下,豚草的分枝数量均显著高于肖梵天花,增幅达到0.87—6.49倍。对于分枝长度,豚草在HP处理的分枝最长,并显著高于LP、MP处理;而肖梵天花在不同降雨处理的分枝长度接近,差异不显著。豚草的叶片数、总叶面积均在MP处理获最大值,并显著高于LP、HP处理,而HP处理的总叶面积亦显著高于LP处理;肖梵天花的叶片数、总叶面积均随降雨量的上升持续增加,各处理间的差异显著;在MP处理,豚草的叶片数、总叶面积分别为肖梵天花的2.79倍、1.38倍,差异显著,但两种植物在HP处理的差异均不明显(图 1)。
3.3 降雨量变化对豚草植株生物量积累的影响
降雨量变化对豚草、肖梵天花两种植物的生物量积累影响不同(图2)。豚草植株各器官生物量(根、茎、叶)和总生物量均在MP处理获得最大值,并显著高于LP处理;HP处理的各个生物量积累指标亦显著高于LP处理,但与MP处理的差异不明显。肖梵天花的根、茎、叶等器官生物量以及总生物量随降雨量的上升而增加,除根生物量在LP、MP两个处理间的变化较小外,总生物量以及茎、叶生物量在各个降雨量梯度下的差异均达显著水平。另外,肖梵天花的根、叶器官生物量高于豚草,其中LP、
HP处理的差异显著;豚草的茎生物量、总生物量在MP处理均显著高于肖梵天花,但两植物的茎生物量在LP、HP处理的差异不显著,而总生物量则显著低于肖梵天花(图2)。

表1 植株生长性状的双因素方差分析结果Tab.1 Results of the two-wayANOVAS for growth traits of two weeds,according to the factors of species and precipitation.
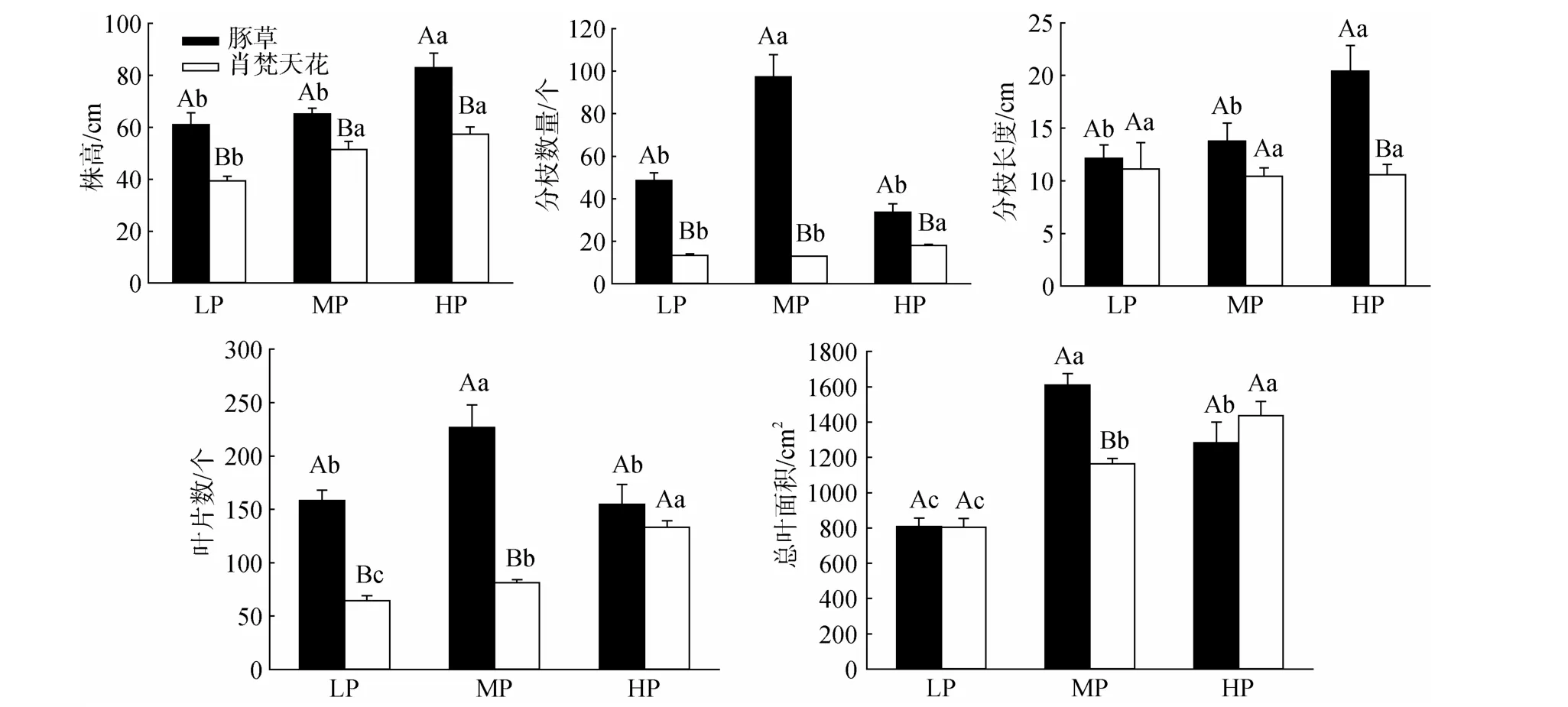
图1 降雨量变化对豚草植株结构特征的影响Fig.1 Effects of precipitation variation on plant structure traits of Ambrosia artemisiifolia
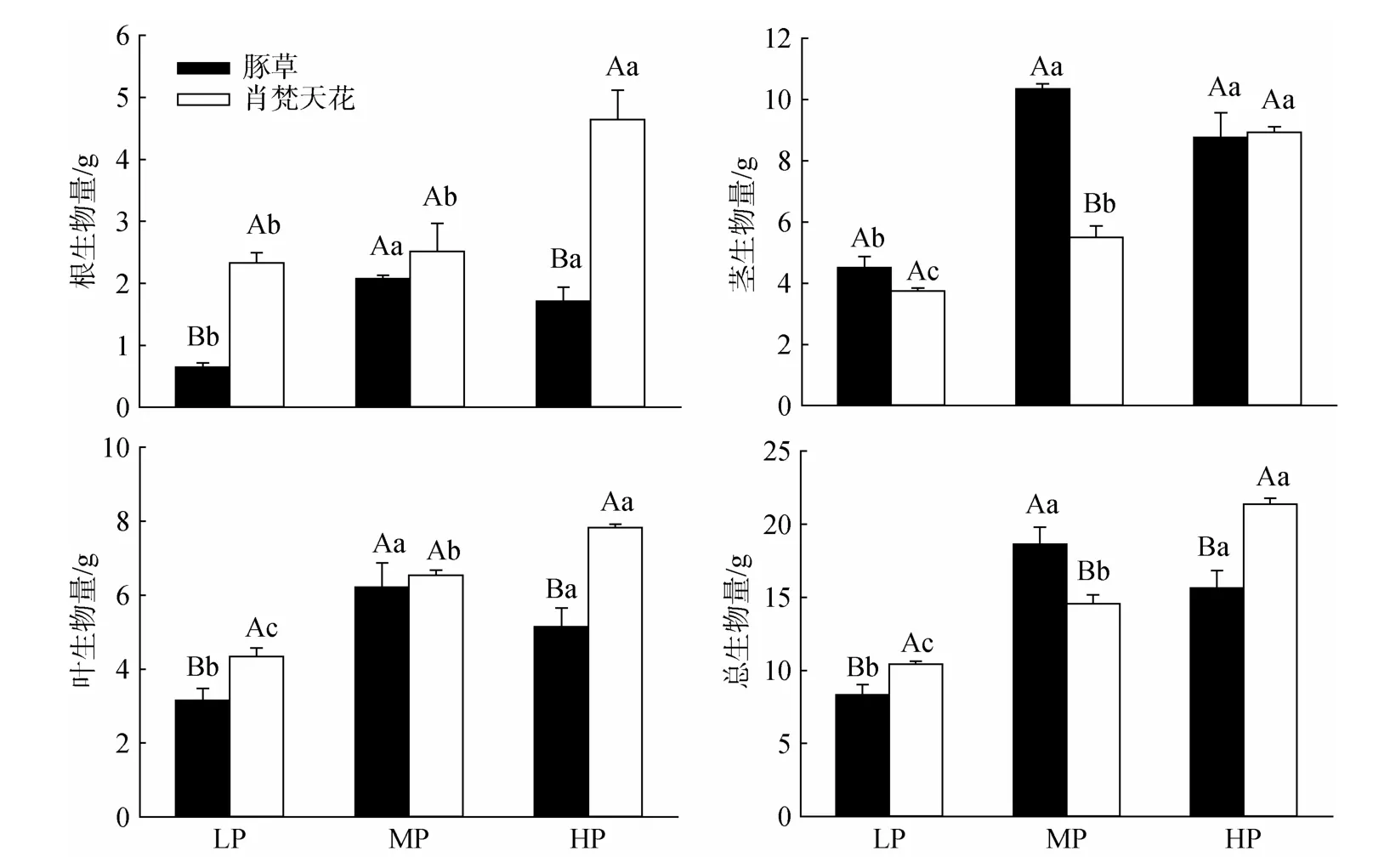
图2 降雨量变化对豚草植株生物量积累的影响Fig.2 Effects of precipitation variation on plant biomass accumulation of Ambrosia artemisiifolia
3.4 降雨量变化对豚草植株生物量分配的影响
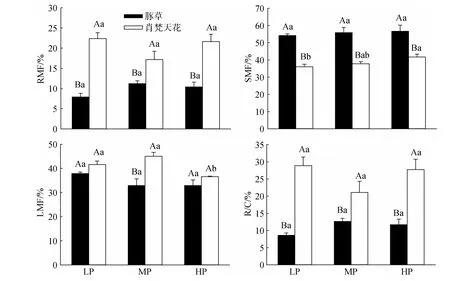
图3 降雨量变化对豚草植株生物量分配的影响Fig.3 Effects of precipitation variation on biomass allocation of Ambrosia artemisiifolia
豚草的RMF、SMF、R/C随降雨量上升略有增加,但各处理间的差异不显著;LMF则呈下降趋势,但差异亦不达显著水平(图3)。肖梵天花的RMF、R/C在MP处理最低,而LMF在此降雨水平达最大值并显著高于HP处理;SMF随降雨量上升不断提高,其中LP、HP两个处理的差异显著。在各个降雨水平下,豚草的RMF、R/C均显著低于肖梵天花,SMF则显著高于肖梵天花;LMF亦略低于肖梵天花,但只有MP处理的差异显著。
3.5 降雨量变化对豚草植株形态学参数与生长特征的影响
无论豚草或肖梵天花,降雨量变化对LAR、SLA影响均较小;在各个降雨水平下,豚草的LAR稍高于肖梵天花,但差异均不显著,而SLA则显著高于肖梵天花(图4)。豚草的LARM在LP处理最高且显著高于其它两个处理;肖梵天花的LARM在各处理间变化不大,差异均不显著;但在各个降雨水平下,豚草的LARM均显著高于肖梵天花,增幅达0.82—2.55倍。豚草的RGR、NAR随降雨量增加先升后降,在MP处理获最大值并显著高于LP处理,但与HP处理差异不显著;肖梵天花的RGR、NAR则随降雨量增加不断上升,其中RGR在各处理间的差异显著;豚草的RGR、NAR在MP处理均显著高于肖梵天花,但LP、HP处理下两种植物的差异不明显。
4 讨论
4.1 影响豚草入侵力的植株性状
无论降雨量的高低,豚草的株高、分枝数量、分枝长度、叶片数均高于伴生土著植物肖梵天花,其中两种植物的株高、分枝数量的差异均达显著水平(图1)。这将有利于豚草在入侵生长过程中占据群落的上层空间,并产生大量、较长的分枝来拓展其冠层结构,形成郁闭度更高的冠层来荫蔽、排斥群落中下层土著物种的正常生长,进而增强自己的竞争能力,成功入侵。类似的研究结果在三叶鬼针草(Bidens piolsa)、飞机草(Chromolaena odorata)等外来植物的相关研究中也曾有报道;如在三叶鬼针草的自然群落中,植株的分枝数量远高于伴生土著种鬼针草(Bidens bipinnata);而即使相对于原产地种群,飞机草的入侵种群也具有更高的株高与分枝数[30–31]。
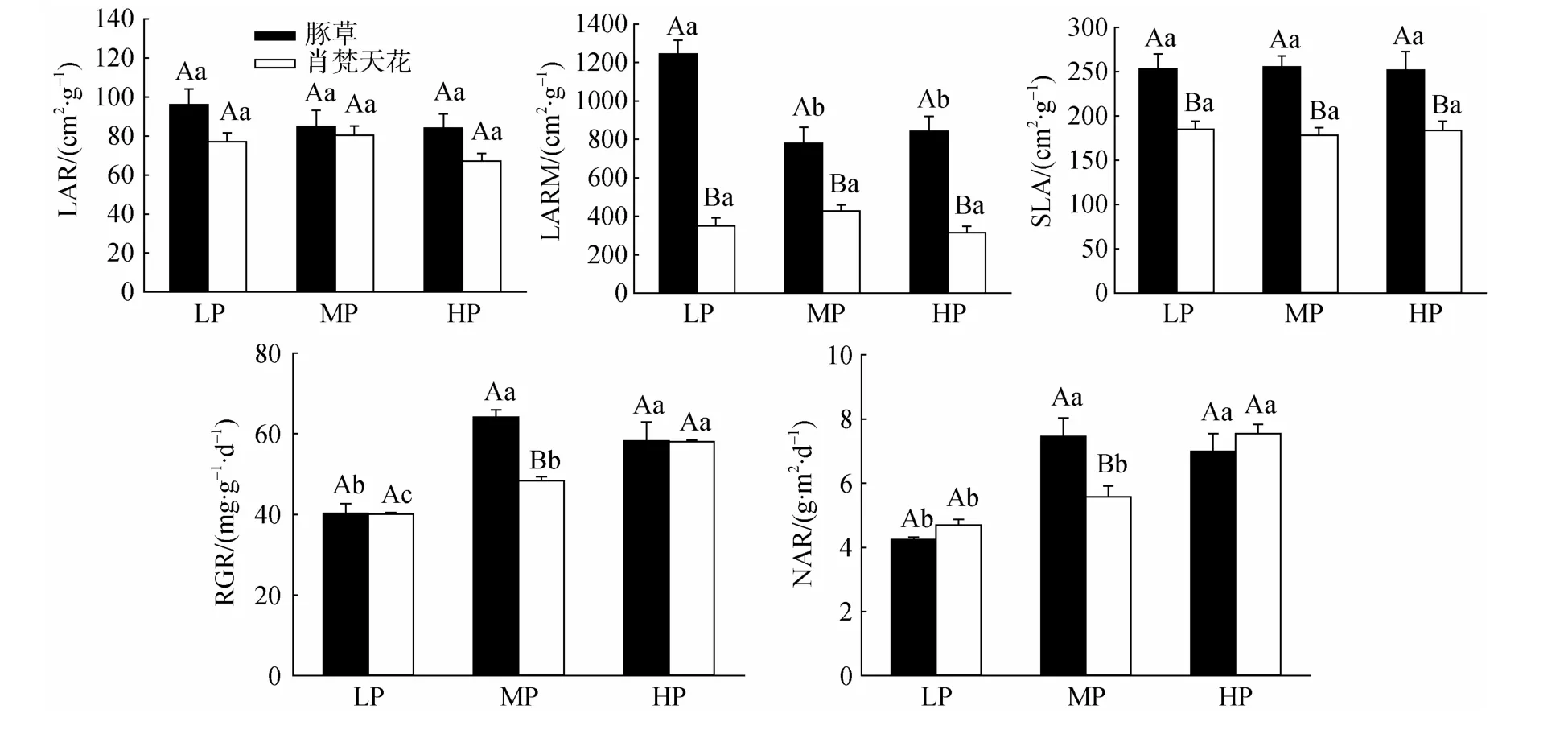
图4 降雨量变化对豚草形态学参数和生长特征的影响Fig.4 Effects of precipitation variation on morphology and growth traits of Ambrosia artemisiifolia
在植株生物量分配方面,入侵植物豚草的RMF、R/C在各个降雨量水平显著低于肖梵天花,SMF则显著高于肖梵天花(图3),这与紫茎泽兰(Eupatorium adenophorum)等入侵植物的生物量分配特征类似[32–33]。豚草减少对地下部根系的生物量投入,必然导致地上部器官尤其支持结构的生物量分配增加。高的SMF一方面有利于豚草植株形成更多的分枝和花序,释放更巨量的花粉,产生更多的种子来扩大自身种群,并且大量的花粉也会危害人畜健康,这些效应均有利于其入侵。据Bassett[34]等调查,一株较小的豚草植株即能产生超过30000粒种子,而高大植株所产生的种子数量甚至高达62000粒。另一方面有利于豚草形成更多的叶片并增加植株个体水平的光合能力。许多研究表明,除叶片能够进行光合作用外,植株的茎、花、果等非同化器官也能进行光合作用,并且其单位叶绿素的光合效率更高[35–36];如外来杂草薇甘菊(Mikania micrantha)在单位土地面积上植株非同化器官的光合碳积累占群体总光合能力的19%—49%,对入侵种群的蔓延扩散具有重要推动作用[37]。豚草地上部的大量分枝、花序使其可能通过非同化器官的光合途径增加碳的固定与积累,同时形成更致密的冠层结构来抑制土著植物的生长,不断提高自身的竞争优势与入侵能力。其次,低的RMF能够有效降低地下部根系的呼吸消耗,有利于植株生物量的积累[32]。但这并不影响豚草对环境资源的获取能力,豚草的LARM在各个降雨量水平均显著高于肖梵天花(图4),说明在投入相同根生物量的基础上,豚草能够形成更高数量的叶片面积,有利于捕获更多的光能和提高碳同化的能力。尽管豚草的LMF低于土著植物肖梵天花,但对植株总叶面积的形成并不产生制约作用,因为其具有更高的SLA(图4)。这与薇甘菊、五爪金龙(Ipomoea cairica)等外来植物类似,它们的SLA均显著高于伴生土著植物[38]。SLA是植物最重要的功能性状之一,反映植物在生长过程中对光的适应性以及碳同化的能力。较高的SLA表示单位质量叶片的面积更大,植物以较小的碳投入即可获得更高的光合能力[39]。豚草的高SLA意味着其资源利用效率和植株生产力较高,这将极有利于入侵种群的蔓延扩散。
4.2 降雨量变化对豚草入侵生长的影响
降水格局的变化能够影响入侵植物的生长发育与种群动态。在美国科罗拉多州的干旱草地(降雨量475 mm·a-1),冬、春季的降雨增加能够改变外来植物旱雀麦(Bromus tectorum)的生活史特点,显著提高种群的生长速率,促进入侵[40]。本试验结果则表明,豚草的分枝数量、叶片数、总叶面积以及根、茎、叶器官生物量和植株总生物量均在MP处理获得最大值,降雨量减少至800 mm·a-1时上述指标均显著下降;而降雨量增加至1800 mm·a-1时上述指标亦有所降低,其中分枝数量、叶片数与总叶面积的差异显著(图1,2)。说明豚草在野外更偏好入侵中等湿润程度的自然环境,过于干旱或潮湿均导致其入侵能力减弱。这与罗文启等[41]的研究结果类似,在海南岛开展的入侵植物野外分布调查中,他们发现降雨量相对较低的东北、西南部地区的入侵植物数量多,而降雨量较高(约2000 mm·a-1)的中部地区分布的入侵植物数量较少,相对干旱的环境更有利于草本入侵植物的蔓延扩散。土著植物肖梵天花的株高、分枝数量、叶片数、总叶面积、各器官生物量以及植株总生物量均随降雨量上升显著增加并在HP处理获得最大值,这表明降雨增加有利于促进肖梵天花的植株生长,能够形成更多的分枝、更大的光合作用吸收面积以及积累更高的光合产物,从而增强其野外竞争能力,抵御入侵。
降雨量变化对豚草的生物量分配特征影响不明显,但能够显著提高肖梵天花的茎生物量分配比例,有利于增加其分枝数量(图3)。两种植物的LAR、SLA均不随降雨量的变化而波动;但豚草的LARM在LP处理最高,表明尽管降雨量较少时豚草的入侵力下降,但其根系的资源利用效率迅速提高,有利于减轻这一不利影响(图4)。豚草的RGR、NAR均在MP处理获最大值,这将直接促进幼苗快速生长,积累更多的生物量,成株高大、枝叶繁茂,更容易抢夺光照、空间等环境资源而成功入侵,与植株的总叶面积、总生物量等指标变化一致。可见,中等湿润程度的自然环境更容易受到豚草的入侵危害。这也与豚草在我国的实际分布区域相吻合,南京、武汉、南昌-九江等长江中下游城市均属于豚草在我国的发生与扩散中心[1]。何云玲等[42]亦指出,降雨导致紫茎泽兰部分种子在成熟之前就脱离母体,种子变质快且难以有效随风扩散,对种群在长江流域的入侵蔓延起到抑制作用。据隋月等[43]报道,我国南方大多数地区的年降雨量为1311 mm,其中长江中下游地区的年降雨量约1200 mm,而华南大部分地区的年降雨量多在1600 mm以上。但近年来,豚草在我国的入侵扩散区域不断向南和西北方向移动,说明豚草对不良环境条件具有一定程度的耐受力和适应性,能够通过自身抗氧化酶系统的调节以及表型可塑性来适应光照、温度与水分等环境因子的制约作用[6,44]。例如在广东,除珠江三角洲地区之外,在粤北和粤东北部的野外地区均发现成片分布、密集的豚草单优群落[16]。
尽管本试验结果揭示了不同降雨水平对豚草入侵生长的影响规律,但需要指出的是本研究只考虑了总降雨量这一因素,实际上降雨分布情况还包括降雨频率或次数、平均降雨间隔时间以及平均单次降雨量等因素。许多研究指出,在总降雨量一定的情况下,降雨间隔时间、单次降雨量的变化均能影响植物种子的萌发率和幼苗生长状态[45–46]。本试验
为方便管理,把年降雨总量均分成为植株生长季内每一天的雨水喷淋量,可能与实际的降雨情况存在一定差异。另外,降雨量分布格局的变动亦只是全球变化的一个方面,其它全球变化过程如CO2浓度升高、气候变暖、氮/磷沉降等均能够单独或协同影响外来植物的入侵力。因此,为更好地预测豚草在我国入侵趋势的演变,还需要开展更加深入、系统的研究来探索多个全球变化因素之间的交互作用对豚草及其伴生土著植物的综合影响。
参考文献
[1]刘静玲,冯树丹,幕颖.豚草生态学特性及生防对策[J].东北师大学报(自然科学版),1997(3):61–67.
[2]周忠实,郭建英,李保平,等.豚草和空心莲子草分布与区域减灾策略[J].生物安全学报,2011(4):263–266.
[3]国家环保总局.中国第一批外来入侵种名单[EB].国务院公报,2003,23:40–46.
[4]郭琼霞,黄可辉,刘景苗.美洲豚草(Ambrosia artemisiifolia)风险分析[J].武夷科学,2004,20(1):115–121.
[5]黄宝华.豚草国内的分布及危害调查[J].植物检疫,1985(6):62-65.
[6]QIN Zhong,MAO Danjuan,QUAN Guoming,et al.Physiological and morphological responses of invasiveAmbrosia artemisiifolia(common ragweed)to different irradiances[J].Botany,2012,90(12):1284–1294.
[7]LEIBLEIN–WILD M C,KAVIANI R,TACKENBERG O.Germination and seedling frost tolerance differ between the native and invasive range in common ragweed[J].Oecologia,2014,174:739–750.
[8]田兴山,岳茂峰,冯莉,等.豚草对花生产量性状的影响及其经济阈值[J].中国油料作物学报,2012,34(3):300–304.
[9]SMITH M,CECCHI L,SKJØTH C A,et al.Common ragweed:A threat to environmental health in Europe[J].Environment International,2013,61:115–126.
[10]万方浩,马骏,郭建英,等.豚草卷蛾和苍耳螟对豚草的联合控制作用[J].昆虫学报,2003,46(4):473–478.
[11]陈红松,郭薇,李敏,等.广聚萤叶甲和豚草卷蛾联合控制外来入侵豚草的田间试验[J].中国生物防治学报,2013,29(3):362–369.
[12]陈浩,陈利军,ALBRIGHT T P.以豚草为例利用GIS和信息理论的方法预测外来入侵物种在中国的潜在分布[J].科学通报,2007,52(5):555–561.
[13]ŠIKOPARIJA B,SKJØTH C A,ALMKÜBLERD K,et al.A mechanism for long distance transport ofAmbrosiapollen from the Pannonian Plain[J].Agricultural and Forest Meteorology,2013,180:112–117.
[14]郝建华,金洁洁,陈国奇,等.恶性入侵植物豚草的繁育系统特性[J].生态学报,2015,35(8):2516–2520.
[15]PATRACCHINI C,VIDOTTO F,FERRERO A.Common Ragweed(Ambrosia artemisiifolia)growth as affected by plant density and clipping[J].Weed Technology,2011,25:268–276.
[16]冯莉,岳茂峰,田兴山,等.豚草在广东的分布及其生长发育特性[J].生物安全学报,2012,21(3):210–215.
[17]王大力,祝心如.豚草的化感作用研究[J].生态学报,1996,16(1):11–19.
[18]VIDOTTO F,TESIO F,FERRERO A.Allelopathic effects ofAmbrosia artemisiifoliaL.in the invasive process[J].Crop Protection,2013,54:161–167.
[19]GENTON B J,SHYKOFF J A,GIRAUD T.High genetic diversity in French invasive populations of common ragweed,Ambrosia artemisiifolia,as a result of multiple sourcesofintroduction[J].MolecularEcology,2005,14(14):4275–4285.
[20]LEIBLEIN–WILD M C,TACKENBERG O.Phenotypic variation of 38 EuropeanAmbrosiaartemisiifoliapopulations measured in a common garden experiment[J].Biological Invasions,2014,16:2003–2015.
[21]QIN Zhong,XIE Junfang,QUAN Guoming,et al.Impacts of the invasive annual herbAmbrosia artemisiifoliaL.on soil microbial carbon source utilization and enzymatic activities[J].European Journal of Soil Biology,2014,60:58–66.
[22]梁巧玲,陆平.新疆伊犁河谷发现外来杂草--三裂叶豚草和豚草[J].杂草科学,2014,32(2):38–40.
[23]VOGL G,SMOLIK M,STADLER L M.Modelling the spread of ragweed:effects of habitat,climate change and diffusion[J].The European Physical Journal Special Topics.2008,161:167–173.
[24]ZISKA L,KNOWLTON K,ROGERS C,et al.Recent warming by latitude associated with increased length of ragweed pollen season in centralNorth America[J].Proceedings of the National Academy of Sciences,2011,108:4248–4251.
[25]WAYNE P,FOSTER S,CONNOLLY J,et al.Production of allergenic pollen by ragweed(Ambrosia artemisiifoliaL.)is increased in CO2-enriched atmospheres[J].Annals of Allergy,Asthma and Immunology,2002,8:279–282.
[26]吴福婷,符淙斌.全球变暖背景下不同空间尺度降水谱的变化[J].科学通报,2013,58:664–673.
[27]WELTZIN J F,LOIK M E,SCHWINNING S,et al.Assessing the response of terrestrial ecosystems to potential changes in precipitation[J].BioScience,2003,53:941–952.
[28]POORTER L.Growth responses of 15 rain-forest tree species to a light gradient:the relative importance of morphologicaland physiologicaltraits[J].Functional Ecology,1999,13:396–410.
[29]YAMASHITA N,KOIKE N,ISHIDA A.Leaf ontogenetic dependence of light acclimation in invasive and native subtropical trees of different successional status[J].Plant,Cell and Environment,2002,25:1341–1356.
[30]严文斌,全国明,章家恩,等.环境因子对三叶鬼针草与鬼针草种子萌发的影响[J].生态环境学报,2013,22(7):1129–1135.
[31]李委涛,郑玉龙,冯玉龙.飞机草入侵种群与原产地种群生长性状的差异[J].生态学报,2014,34(23):6890–6897.
[32]ZHENG Yulong,FENG Yulong,LIUWanxue,et al.Growth, biomass allocation, morphology, and photosynthesis of invasiveEupatorium adenophorumand its native congeners grown at four irradiances[J].Plant Ecology,2009,203:263–271.
[33]柴伟玲,类延宝,李扬苹,等.外来入侵植物飞机草和本地植物异叶泽兰对大气CO2浓度升高的响应[J].生态学报,2014,34(13):3744–3751.
[34]BASSETT I J,CROMPTON C W.Thebiology of Canadian weeds:11.Ambrosia artemisiifoliaL.andA.psilostachyaDC[J].Canadian Journal of Plant Science,1975,55(2):463–476.
[35]ASCHAN G,PFANZ H.Non-foliarphotosynthesis-a strategy of additional carbon acquisition[J].Flora,2003,198:81–97.
[36]祖元刚,张衷华,王文杰,等.薇甘菊叶和茎的光合特性[J].植物生态学报,2006,30(6):998–1004.
[37]王文杰,张衷华,祖元刚,等.薇甘菊(Mikania micrantha)非同化器官光合特征及其生态学意义[J].生态学报,2009,29(1):28–36.
[38]宋莉英,彭长连,彭少麟.华南地区3种入侵植物与本地植物叶片建成成本的比较[J].生物多样性,2009,17(4):378–384.
[39]FENG Yulong,FU Gailan,ZHENG Yulong.Specific leaf area relates to the differences in leaf construction cost,photosynthesis,nitrogen allocation and use efficiencies between invasive and noninvasive alien congeners[J].Planta,2008,228:383–390.
[40]PREVÉY J S,SEASTEDT T R.Effects ofprecipitation change and neighboring plants on population dynamics ofBromus tectorum[J].Oecologia,2015,179(3):765–775.
[41]罗文启,符少怀,杨小波,等.海南岛入侵植物的分布特点及其对本地植物的影响[J].植物生态学报,2015,39(5):486–500.
[42]何云玲,张林艳,郭宗锋.降雨对长江廊道紫茎泽兰有性繁殖的影响[J].江苏农业科学,2011,39(5):145–148.
[43]隋月,黄晚华,杨晓光,等.气候变化背景下中国南方地区季节性干旱特征与适应I.降水资源演变特征[J].应用生态学报,2012,23(7):1875–1882.
[44]邓旭,王娟,谭济才.外来入侵种豚草对不同环境胁迫的生理响应[J].植物生理学通讯,2010,46(10):1013–1019.
[45]周双喜,吴冬秀,张琳,等.降雨格局变化对内蒙古典型草原优势种大针茅幼苗的影响[J].植物生态学报,2010,34(10):1155–1164.
[46]马赟花,张铜会,刘新平,等.春季小降雨事件对科尔沁沙地尖头叶藜萌发的影响[J].生态学报,2015,35(12):4063–4070.

