Cu/Ag掺杂TiO2包覆SiO2纳米复合材料的结构与光催化性能
官仁发,肖亚,刘启明,刘绍军
Cu/Ag掺杂TiO2包覆SiO2纳米复合材料的结构与光催化性能
官仁发1,肖亚2,刘启明1,刘绍军1
(1. 中南大学 粉末冶金研究院,长沙 410083;2. 湖南省文物考古研究所,长沙 410008)
采用溶胶−凝胶法制备包覆层厚度约为12 nm的高分散性TiO2包覆SiO2(TCS)复合粉末。在此基础上,合成光催化效率显著提高的Cu和Ag掺杂TCS光催化剂。利用X射线衍射仪、X射线光电子能谱仪、紫外−可见分光光度计和光催化降解甲基橙测试等,系统研究包覆和掺杂对TiO2结构及光催化活性的影响规律和相关作用机制。结果表明,TiO2与SiO2的界面可能以Ti—O—Si化学键联结,并通过影响TiO2的结晶过程而抑制TiO2晶粒的长大。通过控制实验条件得到了性能优异的Cu2O-TiO2-SiO2复合粉末,Cu掺杂的作用机制可理解为Cu2O半导体对TiO2的修饰,光催化活性的提高与氧空位和Cu2O有关。相比较,Ag掺杂对TiO2的禁带宽度影响不大,但吸光强度有较大提高。当Ag掺杂量为1.0%时,光催化降解甲基橙效率达到95.7%。
二氧化钛;二氧化硅;氧化亚铜;银;掺杂;光催化
纳米TiO2粉末因廉价、化学性质稳定及光催化活性高等特点而备受关注[1−4]。TiO2的光催化性能受微观形貌、相成分、晶粒尺寸和电子−空穴复合率等因素的综合影响[5−6]。纳米粉末易团聚的特点限制了TiO2的光催化活性,将TiO2负载在Al2O3、SnO2、SiO2和活性炭等表面能改善粉末的分散性,SiO2因制备简单、分散性好而得到广泛应用[7−9]。此外,较大禁带宽度和较高电子−空穴复合率也限制了TiO2光催化活性[10]而掺杂能改变TiO2的这些性质[11−15]。HOANG等[16]发现掺杂Ag后TiO2-SiO2粉末的杀菌性能得到提高,并归因于掺杂后吸收光谱的红移及颗粒细化。PINHO等[17]在SiO2上复合TiO2和Ag颗粒,发现Ag的掺入可增强催化剂对可见光的吸收并能增大比表面积。LI等[18]制备了Cu-TiO2-SiO2粉末,发现Cu的掺入可增强催化剂对可见光的吸收,但未研究Cu的化学环境。王贤亲等[19]用溶胶−凝胶法制备了Cu-TiO2-SiO2粉末,发现催化效率的提高与Cu(II)和SiO2有关。Cu和Ag掺杂提高TiO2的光催化活性,通常认为是Cu(II)或CuO、Ag颗粒对TiO2的作用[14, 19]。而ZELEKEW 等[20]合成了TiO2-CuO-SiO2复合粒子,发现复合粒子对硝基苯酚等的还原能力提高,并将这些归因于CuO/Ag2O与TiO2之间的p-n结。但该文献未区分Cu2O与CuO对TiO2-CuO-SiO2的作用,对此也少有其他相关的报道。本文采用液相法在SiO2表面原位同步合成TiO2和CuO/Ag,形成CuO-TiO2-SiO2和Ag-TiO2-SiO2结构,并通过控制条件得到含单相Cu2O的复合粉末。结合XRD、XPS、UV-vis和TEM等表征技术,着重分析掺杂离子在复合粉末中的存在形式,研究Cu和Ag掺杂对TiO2-SiO2复合粒子结构、光催化性能的影响规律和相关作用机制。
1 实验
采用分步法制备TiO2包覆SiO2(TCS)纳米复合粉末。第一步,以正硅酸乙酯(aladich,99.9%)为前驱体,采用溶胶−凝胶法制备出粒径可控、分散均匀的SiO2颗粒。第二步,将一定量的SiO2颗粒超声分散于乙醇和去离子水的混合溶液A中,用蠕动泵将钛酸四丁酯(aladich,99.9%)和乙醇的混合溶液B按一定速度滴入上述混合溶液A中,老化2 h并超声、离心洗涤多次,然后于真空干燥箱中80 ℃干燥24 h,经研磨即得TCS纳米复合粉末。当制备掺杂Cu、Ag的复合粉末时,先将一定量金属盐溶解于乙醇中,再加入钛酸四丁酯配制成混合溶液B,其它操作均相同,本文中Cu、Ag的掺杂范围为0.05%-3.0%(Cu、Ag与Ti的摩尔比)。粉末经800 ℃退火处理2 h后再用于表征实验。
采用日本理学的D/Max2500型X-ray衍射仪(XRD)进行物相与晶体结构分析,测量范围为10°~80°,扫描速度为4 (°)/min。拉曼光谱(Raman)由法国Horiba Jobin的S.A.S拉曼光谱仪测量,扫描范围为100~800 cm−1。X射线光电子能谱(XPS)由英国Thermo Fisher的K-Alpha 1063测得。采用美国FEI公司的TECNAI G2场发射电子显微镜观察粉末的显微形貌。紫外−可见吸收光谱(UV-vis)由上海菁华的723型UV-vis测得。
本文的紫外光降解甲基橙实验是以300 W的高压汞灯为紫外光源。实验中甲基橙的初始浓度为10 mg/L。实验中每隔10 min取样,用紫外−可见分光光度计测定样品的吸光度,利用朗伯−比尔定律计算甲基橙的浓度,最终绘制降解率曲线。
2 结果与讨论
2.1 TCS纳米复合粉末的表征
图1(a)和(b)分别为纯TiO2和TCS复合粉末的TEM图像。从图中可知,纯TiO2粉末颗粒间发生团聚,而SiO2基体可有效改善TiO2的分散性。图1(c)显示TiO2包覆层的厚度大约为12 nm。
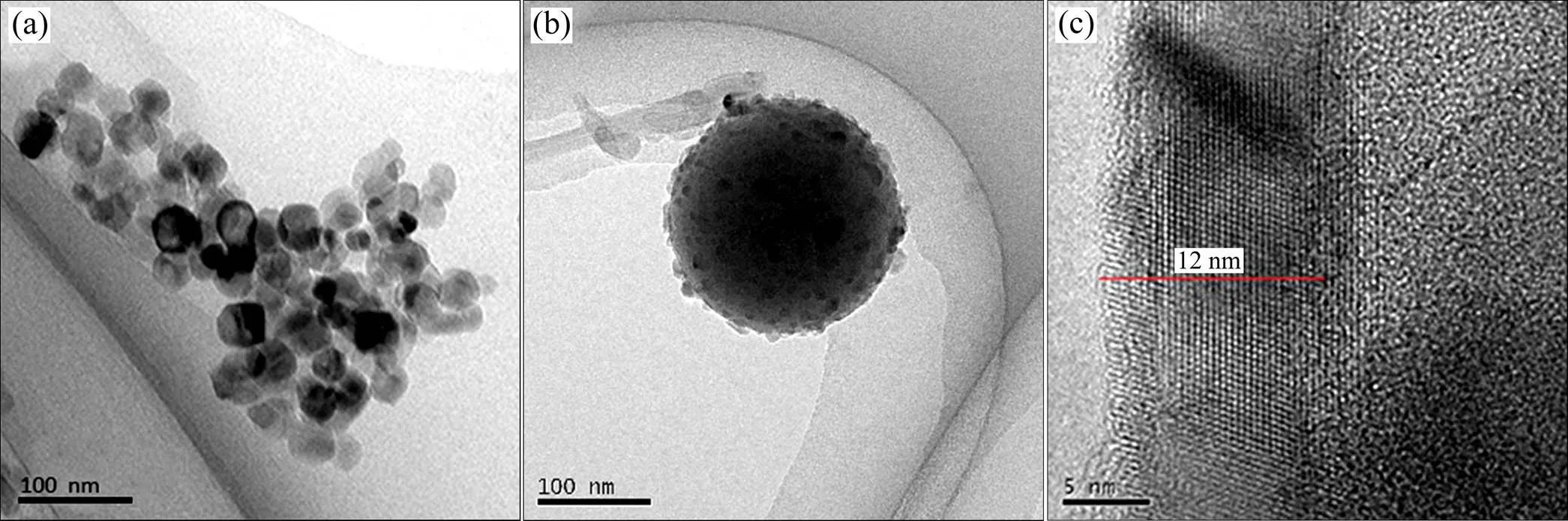
图1 纯TiO2和TCS纳米复合粉末的TEM图
表1所列为纯TiO2和TCS纳米复合粉末的部分性能参数,其中粒度是根据谢乐公式从XRD谱图中计算所得。谢乐公式对尺寸在1~100 nm范围内的球形颗粒适用,且得到的为颗粒平均尺寸。除了晶粒细化,晶体不完整也会引起衍射峰的宽化,因此通常需要结合TEM进行比较分析。由表可见,相对纯的TiO2粉末,TCS纳米复合粉末表现出更好的光催化活性,这可能与TCS纳米复合粉末更大的比表面积,更小的晶粒尺寸有关。粉末比表面积越大,越有利于在表面吸附降解物,增加催化反应的活化中心,进而提高光催化效率。另一方面,当晶粒尺寸小于10 nm时,会存在量子尺寸效应,颗粒的吸收带边发生蓝移,禁带宽度增加,TiO2的价带−导带的氧化−还原能力得到相应增强。

表1 纯TiO2和TCS纳米复合粉末的性能参数
图2所示为纯TiO2和TCS纳米复合粉末在800℃退火2 h后的XRD图谱。由图可见,两种粉末均以锐钛矿相(2=25.3°附近)为主,在2=22°附近出现的非晶峰对应于SiO2的非晶散射峰。经放大2=22.5°− 27.5°区间发现,相对TiO2粉的XRD峰,TCS纳米复合粉末的峰位发生了小角度偏移。此外,复合粉末的XRD峰出现一定程度的宽化,这与TiO2的晶粒细化有关。
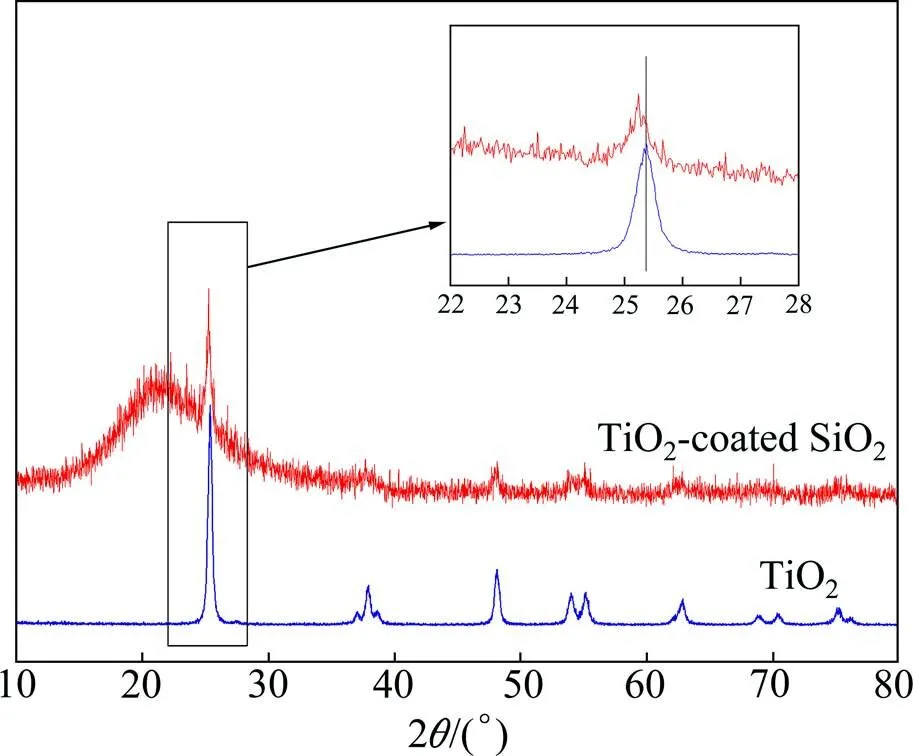
图2 纯TiO2和TCS纳米复合粉末在800 ℃退火2 h后的XRD图谱
2.2 XRD和Raman结果分析
图3(a)和(b)分别为掺杂不同含量Cu,Ag的复合粉末经800℃退火2 h后的XRD图谱。由图可见,复合粉分别经过Cu和Ag掺杂后,均只存在单一锐钛矿相(2=25.3°),但锐钛矿相的结晶性发生了变化。本文结晶度的计算是根据黄继武等[21]提供的结晶度分析方法,利用Jade软件对XRD图谱进行全谱拟合,并扣除SiO2基体的非晶峰,拟合出晶体峰和非晶峰的强度,即可得到TiO2结晶度及晶粒尺寸的分析报告,结果如表2所列,掺杂Cu和Ag后的复合粉末结晶度均得到提高,且随掺杂浓度增大结晶度提高。这可能与Cu和Ag掺杂引起的表面缺陷有关,表面缺陷可以作为锐钛矿的成核中心,有利于结晶化的进行[22]。当Cu掺杂浓度达到2.0%时,样品中出现了金红石相的峰。而Ag掺杂复合粉末中没有出现上述金红石相的峰。
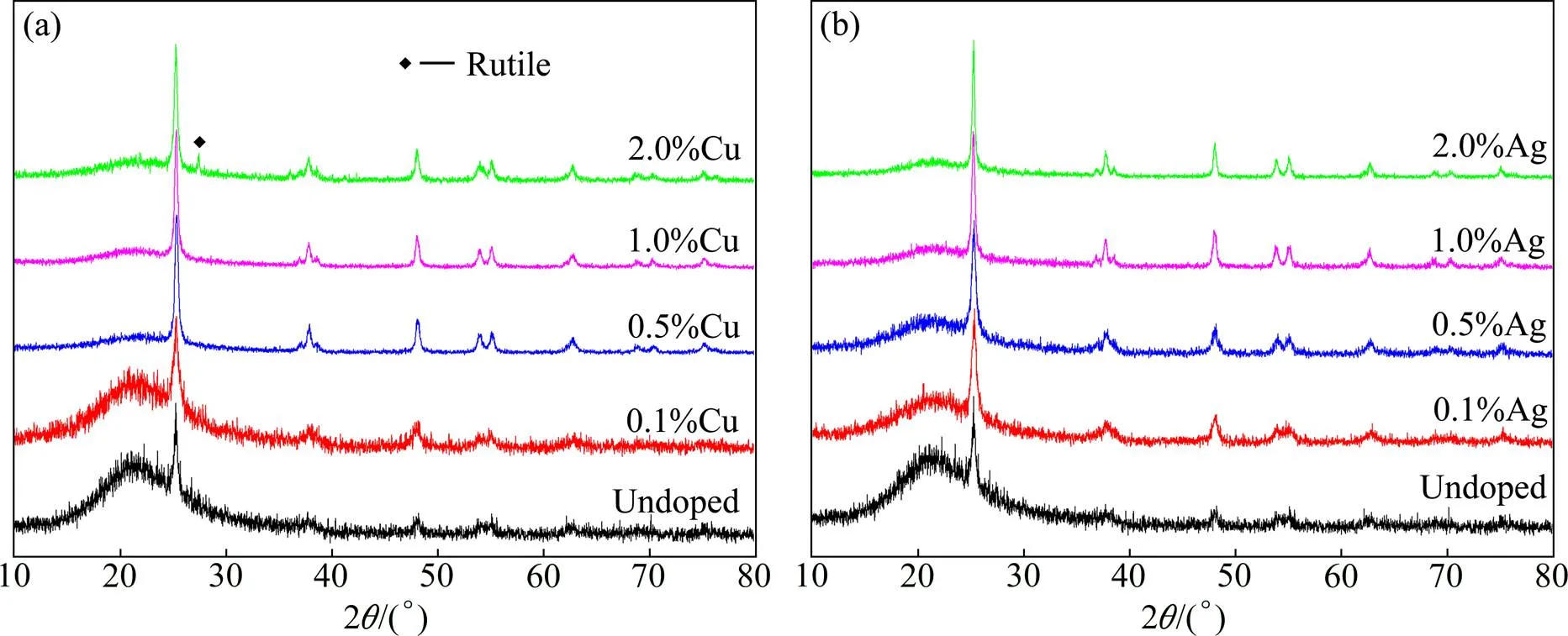
图3 Cu和Ag掺杂TCS纳米复合粉末的XRD图谱
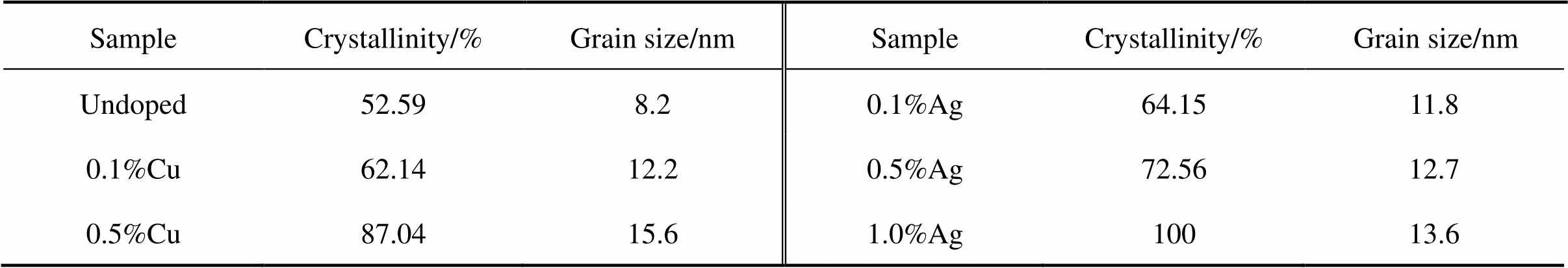
表2 Cu和Ag掺杂复合粉末性能参数
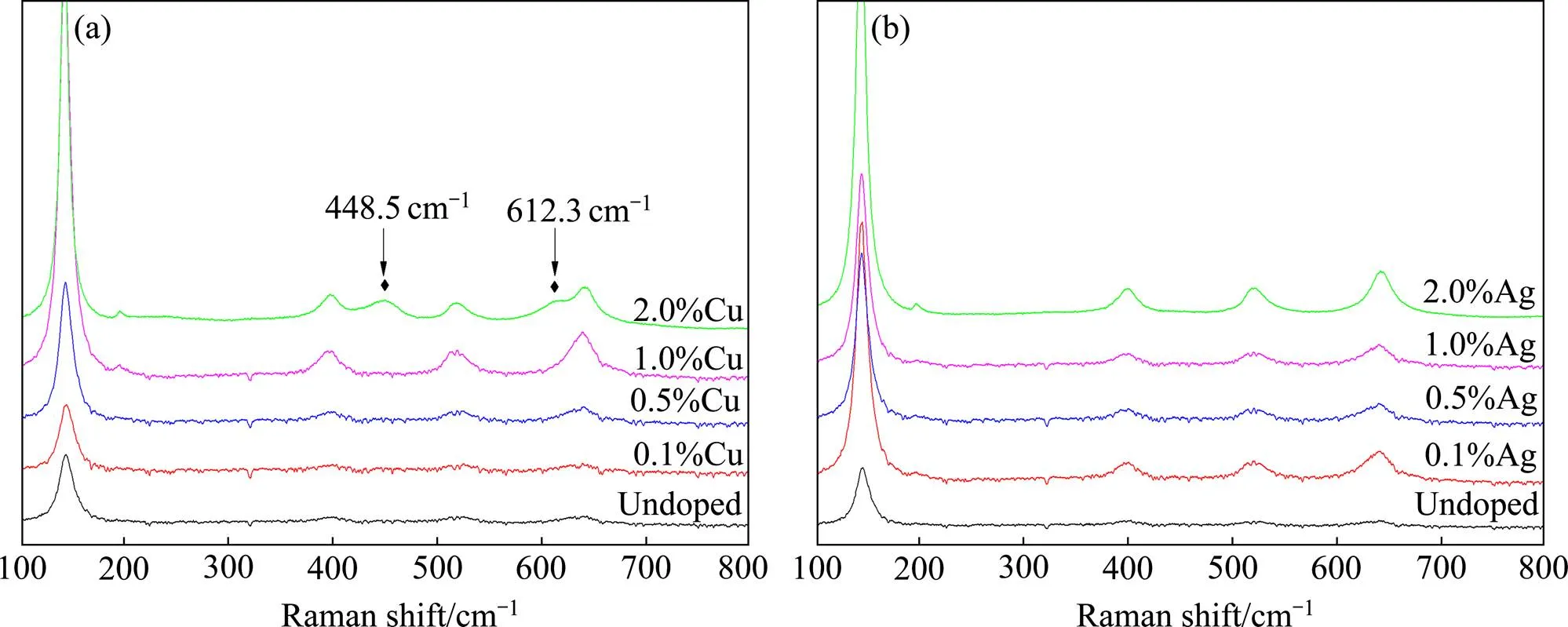
图4 Cu和Ag掺杂TCS纳米复合粉末的Raman图谱
图4为不同含量Cu和Ag掺杂的复合粉末的Raman图谱。如图所示,经800 ℃退火处理2 h后,TiO2仍以单一锐钛矿相存在。随Cu和Ag掺杂量增加,锐钛矿的振动峰增强,说明掺杂促进锐钛矿相的结晶过程。相比较,2.0%Cu掺杂复合粉末的Raman图谱出现了金红石相的特征振动峰[23],与上述XRD图谱的结果吻合。
2.3 XPS结果分析
图5(a)和(b)分别为掺杂0.5%Cu,1.0%Cu的复合粉末的Cu2p图谱。如图5(a)所示,Cu2p图谱经拟合后在结合能932.2和952.4 eV处存在两个谱峰,即分别对应于Cu(I)的Cu2p3/2和Cu2p1/2[24−25],表明当Cu掺杂浓度为0.5%时,Cu在掺杂粉末中以Cu2O的形式存在。如图5(b)所示,当掺杂浓度增加到1.0%时,Cu2p图谱中除在932.2和952.4 eV处出现谱峰外,还分别在934.3,954.3和942.7 eV结合能处出现谱峰,其中934.3和954.3 eV分别对应Cu(II)的Cu2p3/2和Cu2p1/2的谱峰[26−27]。这表明试样中同时存在Cu2O和CuO。Cu2p图谱在942.7 eV结合能处出现的峰则与CuO的震激伴峰有关,CuO的XPS图谱的明显特点是在Cu2p3/2谱峰高结合能处一侧约7~10 eV会出现非常明显的震激伴峰[28]。
图5(c)和(d)分别为掺杂0.5%Cu前后复合粒子Ti2p的XPS图谱,掺杂前后没有明显的变化。在Ti2p图谱中,经拟合后均出现三个谱峰,分别位于458.7,459.1和464.2 eV结合能处,其中458.7和464.2 eV分别对应于Ti2p3/2和Ti2p1/2峰,而459.1eV结合能处的峰则可能对应于Ti—O—Si键的特征XPS峰[29]。
图5(e)和(f)分别为掺杂0.5%Cu前后复合粉末O1s的XPS图谱,均在529.8和532.4 eV结合能处出现谱峰,其中532.4 eV对应于SiO2中的Si—O键,而529.8 eV则是对应复合粉末的Ti—O键的特征XPS峰[9]。而图(e)O1s的图谱在532.9eV处出现的特征谱则对应于吸附氧Os[30],这可能是因为Cu2O与TiO2的复合引起TiO2晶格氧空位的增加。
图6(a)和(b)分别为掺杂0.5%Ag复合粉末的Ag3d和O1s的XPS图谱。Ag3d图谱在368.0 和374.1 eV结合能处出现谱峰,其分别对应Ag3d5/2和Ag3d3/2[31],这表明Ag掺杂后是以Ag单质的形式存在样品中,并没有进入TiO2的晶格。O1s的XPS图谱则和掺杂前的图谱变化不大,没有出现吸附氧的特征谱峰。
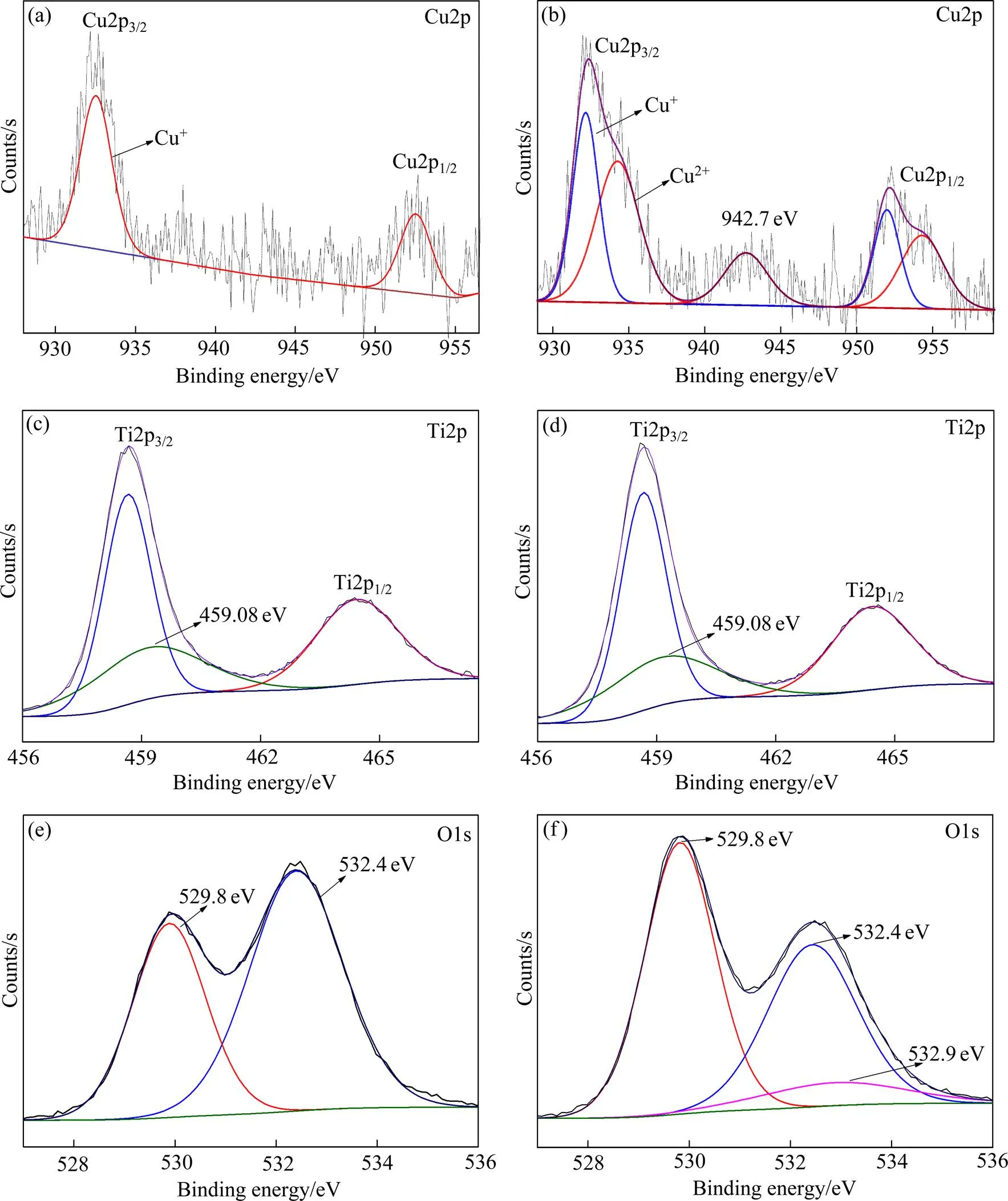
图5 Cu掺杂TCS纳米复合粉末的XPS图谱
(a) 0.5%Cu; (b) 1.0%Cu; (c), (e) Pure; (d), (f) 0.5%Cu
2.4 UV-vis光谱分析
图7为未掺杂和分别掺杂Cu、Ag复合粉末的UV- vis光谱图。与掺杂前的样品相比,Cu掺杂复合粉末的光谱发生了红移,且在400~600 nm及700~800 nm区间出现新的吸收带,从而有效地拓展了TiO2的响应范围。新的吸收带分别对应Cu2O(2.2 eV)和CuO(1.7 eV)的吸收带,而峰强度的变化也与XPS的分析结果相吻合。而Ag掺杂的复合粉末的吸收边较掺杂前的复合粉末变化不大,但在400~800 nm区间的吸光强度有较大的提高。当掺杂浓度为1.0%时,400~550 nm范围内出现明显的吸收峰,这主要与TiO2表面上分散的Ag颗粒有关[32]。这表明Ag掺杂没有明显改变TiO2的禁带宽度,只是提高了对可见光的吸收效率。
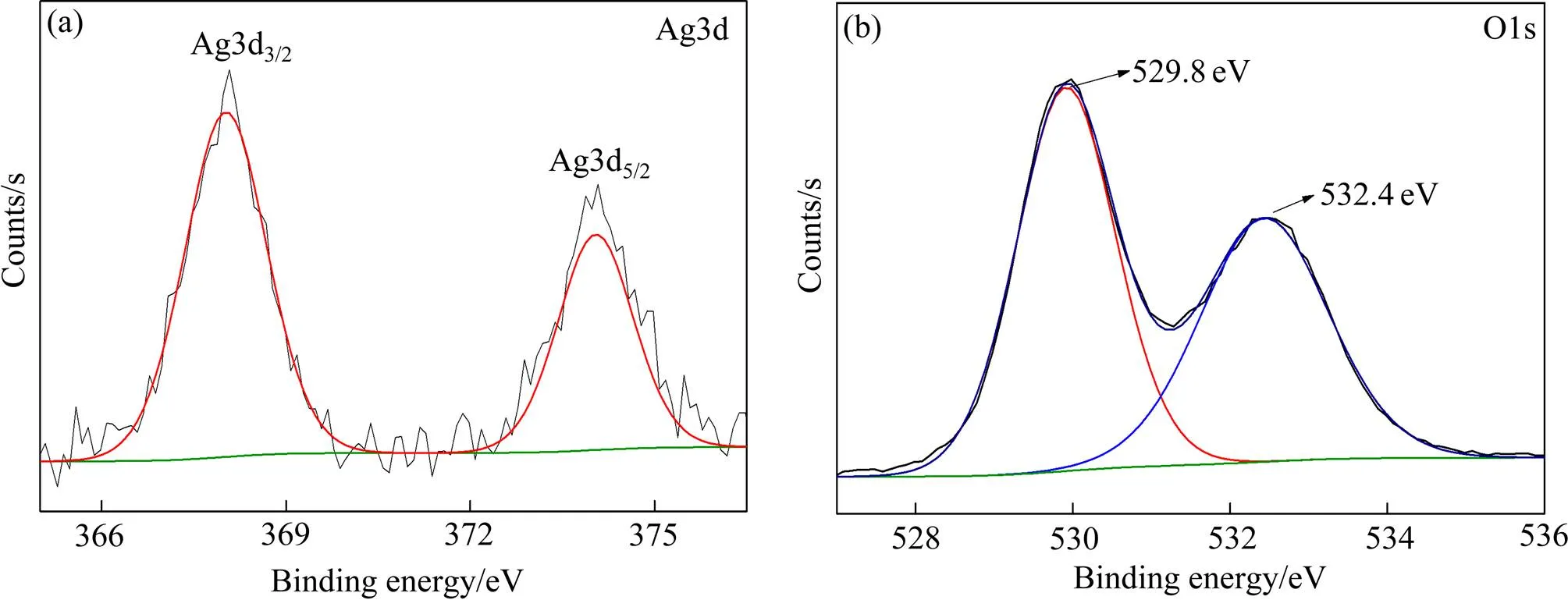
图6 0.5%Ag掺杂TCS纳米复合粉末的XPS图谱
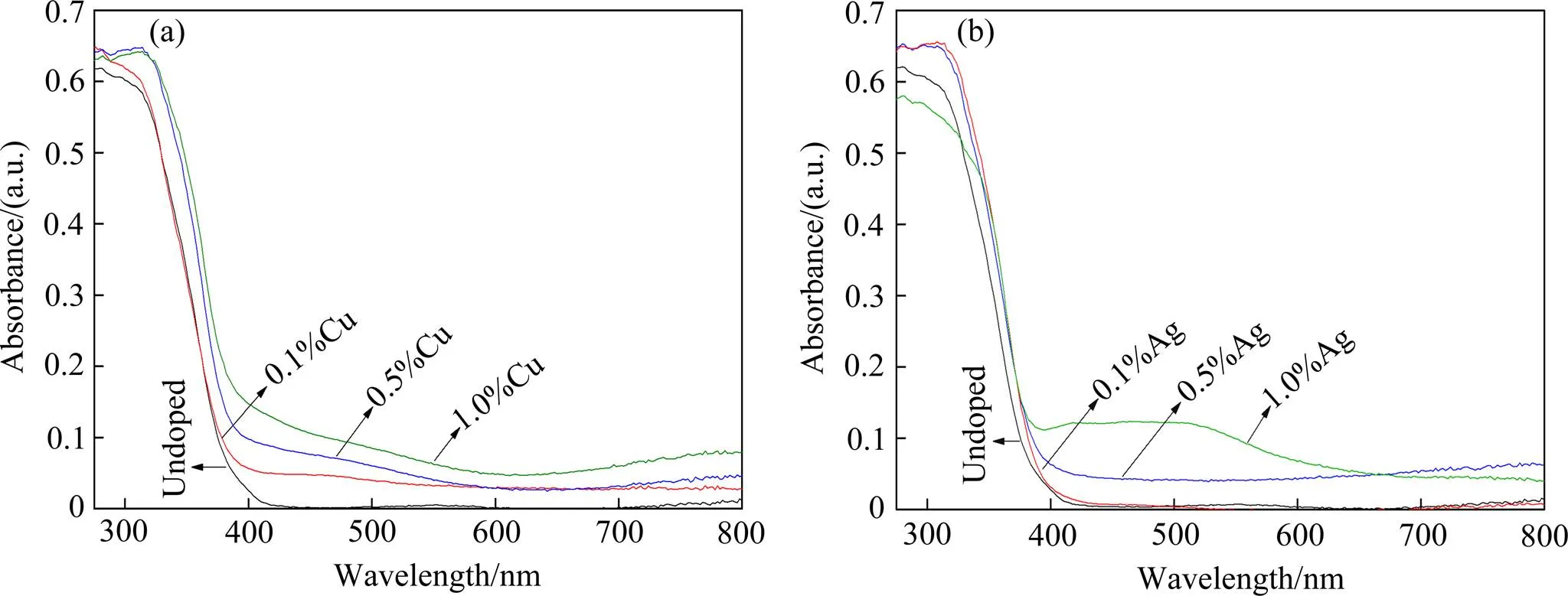
图7 Cu、Ag掺杂TCS纳米复合粉末的UV-vis光谱图
2.5 TEM及EDX结果
图8(a)、(b)和(c)、(d)分别为0.5%Ag,2%Ag掺杂复合粉末的TEM及EDX图。由图可见,掺杂适量Ag时,Ag颗粒均匀地分散在复合粉末表面。当Ag掺杂过量时,Ag颗粒在表面发生聚集。
2.6 光催化性能
图9为未掺杂和Cu、Ag掺杂复合粉末的光催化降解甲基橙的降解率图。由图可知,未掺杂复合粉末在紫外光照射1 h后,对甲基橙的降解率为75.6%。随掺杂浓度增大,复合粉末的降解率先增大后减小,其中Cu的最佳掺杂量为0.5%,此时甲基橙降解率达到90.3%。而Ag的最佳掺杂量为1.0%,此时降解率达到95.7%。
与降解率为38.5%的纯TiO2相比,未掺杂及分别掺杂Cu、Ag的复合粉末均可明显地改善TiO2的光催化降解甲基橙效率。对于TCS纳米复合粉末,SiO2基体的存在一方面可改善TiO2的分散性并增大比表面积(43.29 m2/g),这有利于TiO2表面吸附H2O和O2等。另一方面,SiO2与TiO2界面可能通过Ti—O—Si键联结,抑制晶粒长大,从而提高TiO2的光催化活性。
由XPS结果可知,当低浓度掺杂时,Cu在TiO2中主要以Cu2O形式存在。作为p型半导体,Cu2O的禁带宽度为2.2 eV,因此TCS复合粉末的Cu掺杂可理解为Cu2O半导体对TiO2的修饰,即半导体复合。这可以显著提高电子的传输效率,并有效地分离光生电子和空穴以及拓展光响应范围。同时Cu2O与TiO2的复合可能引起TiO2晶格氧空位的增加,有利于形成表面羟基。当掺杂浓度继续增大,样品中出现CuO,少量CuO也可提高光催化活性,但随着CuO含量增多,Cu(II)的电子构型为3d94s0,当捕获的电子填充到3d或4s中时易引起光生电子的深度捕获,成为电子−空穴对结合中心,从而降低量子效率和催化活性[33]。
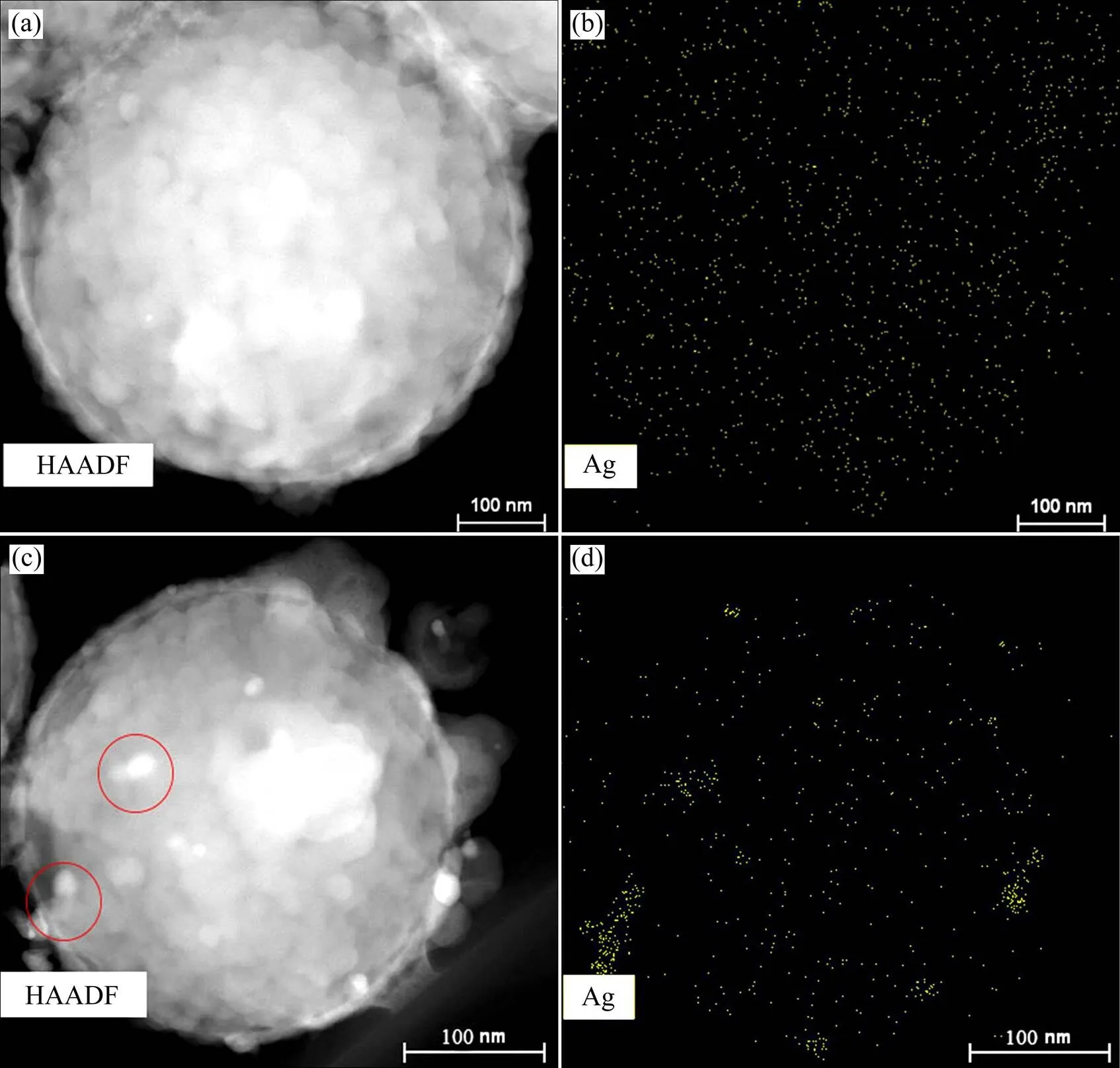
图8 不同Ag掺杂浓度的TCS纳米复合粉末TEM及EDX图
(a), (b) 0.5%Ag; (c), (d) 2.0%Ag
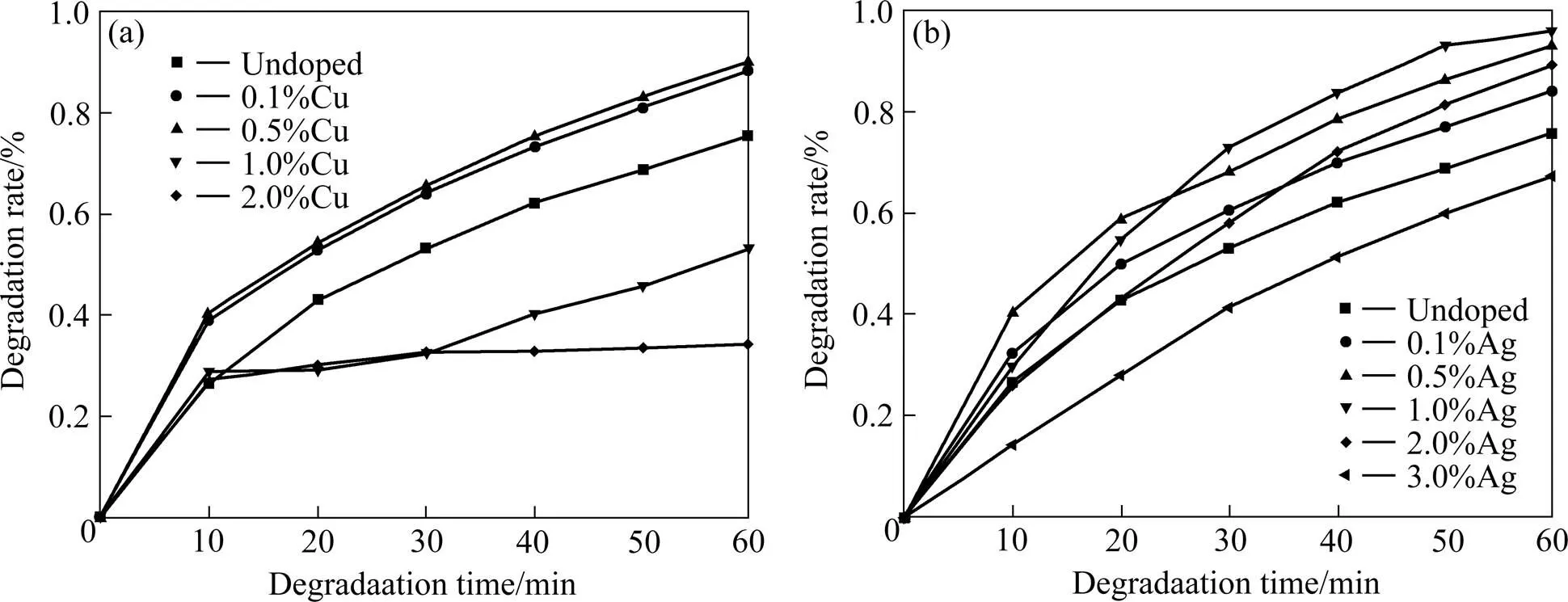
图9 Cu、Ag掺杂TCS纳米复合粉末的光催化降解效率图
(a) Cu; (b) Ag
对于Ag掺杂TCS复合粉末,Ag粒子可以提高对可见光的吸收效率。同时由于Ag的费米能级低于TiO2粒子,当受紫外光照射后,从TiO2粒子价带激发到导带的光生电子就容易转移到Ag粒子表面,从而有效地分离光生电子和空穴,提高光催化活性。当Ag掺杂量超过最佳浓度时,TiO2的表面出现Ag团簇,此时Ag粒子不仅不能有效分离光生电子和空穴,还增加了电子与空穴的相遇几率,成为光生电子和空穴新的复合点,从而降低光催化活性。
3 结论
1) 在TiO2包覆SiO2纳米粉末样品中,TiO2与SiO2界面可能通过Ti—O—Si键联结,抑制晶粒的长大,显著提高了复合粉末的光催化活性。
2) 通过控制实验条件可得到性能优异的Cu2O- TiO2-SiO2复合粉末,此时Cu掺杂的作用机制可理解为Cu2O半导体对TiO2的修饰,氧空位和Cu2O是提升光催化活性的主要原因。
3) Ag掺杂对TiO2的禁带宽度影响不大,但吸光强度有较大提高,当掺杂1.0%Ag时,光催化降解甲基橙效率达到95.7%。
[1] BEMS B, JENTOFT F C, SCHLÖGL R. Photoinduced decomposition of nitrate in drinking water in the presence of titania and humic acids[J]. Applied Catalysis B: Environmental, 1999, 20(2): 155−163.
[2] HERRMANN J M, GUILLARD C, DISDIER J, et al. New industrial titania photo catalysts for the solar detoxification of water containing various pollutants[J]. Applied Catalysis B: Environmental, 2002, 35(4): 281−294.
[3] DALTON J S, JANES P A, JONES N G, et al. Photo catalytic oxidation of NOgases using TiO2: A surface spectroscopic approach[J]. Environmental Pollution, 2002, 120(2): 415−422.
[4] CHEN X B, LIU L B, Huang F Q. Black titanium dioxide (TiO2) nanomaterials[J]. Chemical Society Reviews, 2015, 44(1): 1861−1885.
[5] ZLAMAL M, MACAK J M, SCHMUKI P, et al. Electrochemically assisted photo catalysis on self-organized TiO2nanotubes[J]. Electrochemistry Communications, 2007, 9(12): 2822−2826.
[6] WANG Y B, WU J, WANG H N, et al. Effective balance of antireflection and self-cleaning properties via hollow silica nanospheres-based surface coated with scattered titania nanoparticles[J]. Solar Energy, 2015, 122(1): 763−772.
[7] STANDRIGE S D, SCHATZ G C, JOSEPH T H, et al. Toward plasmonic solar cells: protection of silver nanoparticles via atomic layer deposition of TiO2[J]. Langmuir, 2009, 25(5): 2596−2600.
[8] GREELEY J, NØRSKOV J, MAVRIKAKIS M. Electronic structure and catalysis on metal surfaces[J]. Annual Review of Physical Chemistry, 2002, 53(1): 319−348.
[9] LEE J W, KONG S, KIM W S, et al. Preparation and characterization of SiO2/TiO2core-shell particles with controlled shell thickness[J]. Materials Chemistry and Physics, 2007, 106(1): 39–44.
[10] 马清. 纳米晶TiO2半导体材料的可控制备与光电化学性能研究[D]. 深圳: 哈尔滨工业大学深圳研究生院, 2012: 56−69. MA Qing. Controllable synthesis and photo-electrochemical property of nano-crystalline TiO2semiconductor[D]. Shenzhen: Shenzhen Graduate School of Harbin Institute of Technology, 2012: 56−69.
[11] WANG C M, HELLER A, GERISCHER H. Palladium catalysis of O2reduction by electrons accumulated on TiO2particles during photo assisted oxidation of organic compounds[J]. Journal of the American Chemical Society, 1992, 114(13): 5230−5234.
[12] AGUILAR T, NAVAS J, ALCÁNTARA R, et al. A route for the synthesis of Cu-doped TiO2nanoparticles with a very low band gap[J]. Chemical Physics Letters, 2013, 571(5): 49−53.
[13] CHOI W Y, TERMIN A, MICHAEL R, et al.The Role of metal ion dopants in quantum-sized TiO2: Correlation between photo reactivity and charge carrier recombination dynamics[J]. Journal of Physical Chemistry, 1994, 98(51): 13669−13679.
[14] DUNNILL C W, PAGE K, AIKEN Z A, et al. Nanoparticulate silver coated-titania thin films—Photo-oxidative destruction of stearic acid under different light sources and antimicrobial effects under hospital lighting conditions[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2011, 220(2−3): 113−123.
[15] LI F, CAO B, MA R, et al. Performance of Cu/TiO2-SiO2catalysts in hydrogenation of furfural to furfuryl alcohol[J]. Canadian Journal of Chemical Engineering, 2016, 94(7): 1368− 1374.
[16] HOANG T T, NGUYEN T V, SUC N V, et al. Bactericidal activities and synergistic effects of Ag-TiO2and Ag-TiO2-SiO2nanomaterials under UV-C and dark conditions[J]. International Journal of Nanotechnology, 2015, 12(5): 367−379.
[17] PINHO L, ROJAS M, MARIA J. Ag-SiO2-TiO2nanocomposite coatings with enhanced photo activity for self-cleaning application on building materials[J]. Applied Catalysis B: Environmental, 2015, 178(1): 144–154.
[18] LI J, ZHEN D, SUI G, et al. Nanocomposite of Cu-TiO2-SiO2with high photoactive performance for degradation of rhodamine B dye in aqueous wastewater[J]. Journal of Nanoscience & Nanotechnology, 2012, 12(8): 6265−6270.
[19] 王贤亲, 张国亮, 张凤宝. Cu2+/TiO2-SiO2催化剂的制备及其光催化降解气相间二甲苯的性能[J]. 石油化工, 2006, 35(3): 277−280. WANG Xianqin, ZHANG Guoliang, ZHANG Fengbao. Preparation of Cu2+/TiO2-SiO2catalyst and its photo catalytic activity for degradation of m-xylene in gaseous-phase[J]. Petrochemical Technology, 2006, 35(3): 277−280.
[20] ZELEKEW O A, KUO D H. Facile synthesis of SiO2@ CuO@TiO2hetero structures for catalytic reductions of 4-nitrophenol and 2-nitroaniline organic pollutants[J]. Applied Surface Science, 2017, 397(9): 110−118.
[21] 黄继武, 李周. 多晶材料X射线衍射[M]. 北京: 冶金工业出版社, 2012: 119−130. HUANG Jiwu, LI Zhou. X-ray Diffraction (XRD) of Polycrystalline Materials[M]. Beijing: Metallurgical Industry Press, 2012: 119−130.
[22] XIN B F, WANG P, DING D D, et al. Effect of surface species on Cu-TiO2photo catalytic activity[J]. Applied Surface Science, 2008, 254(9): 2569−2574.
[23] SWAMY V, KUZNETSOV A, DUBROVINSKY L S, et al. Finite-size and pressure effects on the Raman spectrum of nanocrystalline anatase TiO2[J]. Physical Review B, 2005, 71(18): 184302−184313.
[24] COLON G, MAICU M, HIDALGO M C, et al. Cu-doped TiO2systems with improved photo catalytic activity[J]. Applied Catalysis B: Environmental, 2006, 67(1−2): 41−51.
[25] GANESH I, KUMAR P P, ANNAPOORNA I. Preparation and characterization of Cu-doped TiO2materials for electrochemical, photo electrochemical, and photo catalytic applications[J]. Applied Surface Science, 2014, 293(1): 229−247.
[26] CORDOBA G, VINIEGRA M, FIERRO J L G, et al. TPR, ESR, and XPS Study of Cu2+Ions in Sol–Gel-Derived TiO2[J]. Journal of Solid State Chemistry, 1998, 138(1): 1−6.
[27] FU M, LI Y, WU S, et al. Sol-gel preparation and enhanced photo catalytic performance of Cu-doped ZnO nanoparticles[J]. Applied Surface Science, 2011, 258(4): 1587−1591.
[28] 曹立礼. 材料表面科学[M]. 北京: 清华大学出版社, 2007: 171−198. CAO Lili. Material Surface Science[M]. Beijing: Tsinghua University Press, 2007: 171−198.
[29] GOPEL W, ANDERSON J A, FRANKEL D, et al. Surface defects of TiO2(110): a combined XPS, XAES and ELS study[J]. Surface Science, 1984, 139(2/3): 333−346.
[30] POZNYSK S K, PERGUSHOV V I, KOKORIN A I, et al. Structure and electrochemical properties of species formed as a result of Cu(II) ion adsorption onto TiO2nanoparticles[J]. Journal of Physical Chemistry B, 1990, 30(8): 111−125.
[31] LIU Y, JORDAN R G, QIU S L. Electronic structrs of order Ag-Mg alloys[J]. Physical Review B, 1994, 49(7): 4478-4484.
[32] VAMATHEVAN V, TSE H, AMAL R. Effects of Fe3+and Ag+ions on the photo catalytic degradation of sucrose in water[J]. Catalysis Today, 2001, 68(1): 201−208.
[33] IRIE H, KAMIYA K, SHIBANUMA T, et al. Visible Light-Sensitive Cu(II)-Grafted TiO2Photo catalysts: Activities and X-ray absorption fine structure analyses[J]. Journal of Physical Chemistry C, 2009, 113(24): 10761−10766.
(编辑 高海燕)
Synthesis and photocatalytic property ofSiO2nanopowder coated by Cu/Ag-doped TiO2
GUAN Renfa1, XIAO Ya2, LIU Qiming1, LIU Shaojun1
(1. Powder Metallurgy Research Institute, Central South University, Changsha 410083, China;2. Hunan Provincial Institute of Cultural Relics and Archaeology, Changsha 410008, China)
The TiO2-coated SiO2(TCS) nanocatalysts with about 12 nm thickness coating and high dipersity were synthesized by the sol-gel method. Based on the previous experiment, the photocatalytic efficiency of TCS catalysts was enhanced notably by doping Cu and Ag. The effects of coating and doping on the structure and photocatalytic activity of TiO2and the relative mechanism were investigated by XRD, XPS, UV-vis and the photocatalytic degradation experiment of methyl orange. The results show that, the Ti—O—Si bonds between the interface of TiO2and SiO2have an impact on the crystallization process of TiO2and restrain the growth of the grains. Cu2O-TiO2-SiO2composite powder with excellent performance can be synthesized by controlling the experimental conditions. The reinforcement mechanism of doping Cu can be ascribed to the modification of Cu2O semiconductor to TiO2. The increasing of photocatalytic property is related to the oxygen vacancy and Cu2O particles. Doping Ag cannot change the width of the forbidden band but can improve the intensity of light absorption, and the photocatalytic degradation efficiency is 95.7% after doping 1.0%Ag.
TiO2; SiO2; Cu2O; Ag; doping; photocatalytic
TM23
A
1673-0224(2018)01-101-09
国家科学自然基金资助项目(21641013)
2017−04−07;
2017−06−23
刘绍军,研究员,博士。电话:13974953502:E-mail: liumatthew@csu.edu.cn

