咪唑啉衍生物缓蚀剂改性前后的缓蚀性能及成膜机理研究*
,,,,,
(1.辽宁石油化工大学石油化工学院,辽宁 抚顺 113001;2.广东石油化工学院 化学工程学院,广东 茂名 525000)
咪唑啉衍生物因其环结构中的N原子具有孤对电子,可以在金属表面发生吸附,而其非极性链多为烷基链,控制其油溶性,驱动其整个分子发生吸附,且阻碍金属表面与腐蚀介质的物质和能量交换,所以广泛应用于金属的防腐蚀[1]。咪唑啉衍生物作为缓蚀剂又因其低毒、高效和环保,在开发使用方面备受关注[2]。该文对曼尼希反应改性前后咪唑啉类缓蚀剂的缓蚀性能和缓蚀机理进行了研究。
1 试验部分
1.1 仪器与试剂
电热套、恒温磁力搅拌器、四口烧瓶、温度计、冷凝管、电子天平、电化学工作站、旋转腐蚀挂片仪和10号碳钢试片。
月桂酸、油酸、三乙烯四胺、二甲苯、亚磷酸、甲醛、盐酸、丙酮和无水乙醇。
1.2 缓蚀剂的制备
(1)取0.4 mol月桂酸加入到四口烧瓶中,将其放到控温电加热套上进行加热,待月桂酸完全熔化,升温至(160±5) ℃,在不断搅拌的状态下,以恒压滴液漏斗向烧瓶内缓慢滴加0.44 mol三乙烯四胺,再加入0.32 mol携水剂二甲苯。在此温度下搅拌回流加热3 h完成酰胺化反应。继续使温度升高,当温度为200~240 ℃时,随着反应的进行用分水器不断将生成水分离出,在此温度下搅拌回流加热4 h完成环化反应。最后在230 ℃回流加热,一定真空度下蒸馏出二甲苯得到中间体产物IMLT(一种咪唑啉衍生物)。式(1)为IMLT的合成反应。
(2)取0.038 4 mol中间体IMLT,8.2 mL H3PO3,12.8 mL盐酸和12.8 mL H2O加入到四口烧瓶中,温度100~110 ℃回流加热2 h,再以恒压漏斗向烧瓶内缓慢滴加13.4 mL甲醛,继续回流加热1 h停止加热,待其冷却到室温将产物取出并加一定量的饱和食盐水洗涤后分液,将得到的粗产物加一定量的乙酸乙酯再进行分液得到产物IMLTM(曼尼希反应后的咪唑啉衍生物)。式(2)为形成磷酸酯基团过程中电子运动情况;式(3)为IMLTM咪唑啉衍生物的合成反应。
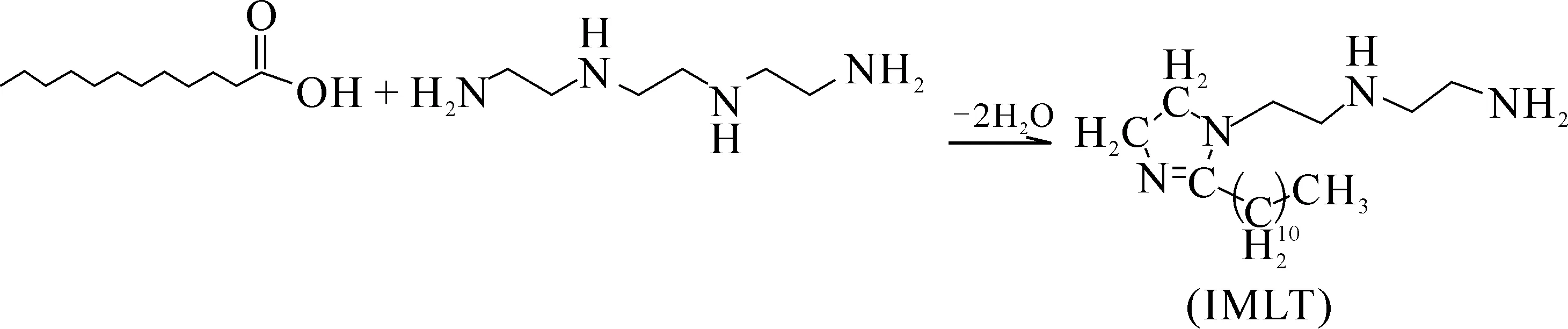
(1)
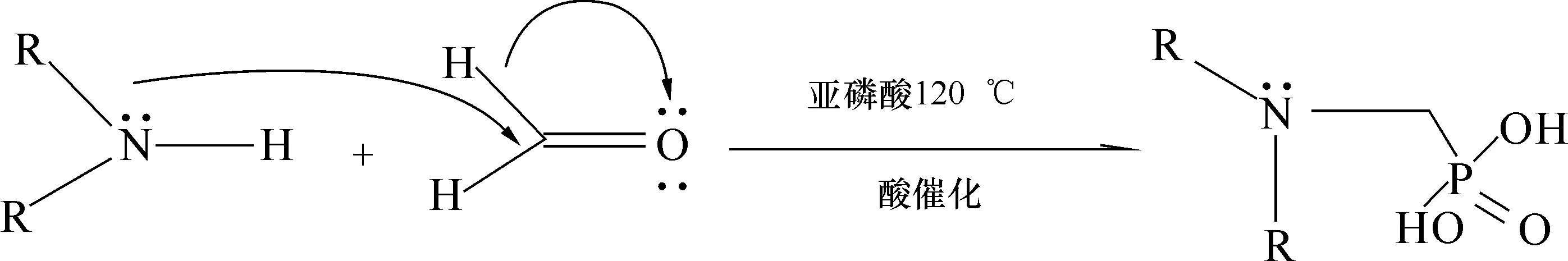
(2)

(3)
1.3 缓蚀剂性能测试
选用10号碳钢试片,用砂纸逐级打磨,再用丙酮、无水乙醇清洗,进行脱水脱脂并干燥处理。试验前,将干燥好的试片进行尺寸测量及称质量,并加以记录。配制1 mol/L盐酸的腐蚀试验介质,分别和不同缓蚀剂加入旋转挂片腐蚀实验仪的各容器中,水浴60 ℃加热。温度到达后,分别挂入试片,一定转速下进行试验4 h 。由质量损失数据,按式(4)计算单片腐蚀速率;按式(5)计算平均腐蚀速率;按式(6)计算缓蚀率。
(4)
式中:Vi为单片腐蚀速率,g/(m2·h);Δmi为试片腐蚀质量损失,g;Ai为试片表面积,mm2;Δt为反应时间,h。
V=(V1+V2+V3)/3
(5)
式中:V为平均腐蚀速率,g/(m2·h)。
(6)
式中:η1为缓蚀率,%;Δm0为未添加缓蚀剂试片的质量损失,g;Δm1为添加缓蚀剂试片的质量损失,g。
利用电化学工作站进行极化曲线与电化学交流阻抗谱测试。选用三电极体系,以铂电极为辅助电极,研究电极为10号碳钢,饱和甘汞电极(SCE) 为参比电极。试验溶液为1 mol/L盐酸溶液。极化曲线扫描幅度为±150 mV(相对于开路电位),扫描速度为0.05 mV/s。交流阻抗测试频率为0.01~100 000 Hz,交流激励信号为5 mV。按式(7)计算腐蚀速率,按式(8)计算缓蚀率。
腐蚀速率=3 270JcorrMρ-1n-1
(7)
式中:Jcorr为腐蚀电流密度,A/cm2;M为物质的量,g/mol;ρ为材料密度,g/cm3;n为电荷转移量。
(8)
利用扫描电子显微镜(SEM)和能谱分析仪(EDS)进行动态质量损失试验后的试片表面形貌观察与表面元素分析。
2 结果与讨论
2.1 红外光谱
图1是IMLTM和IMLT的红外光谱图。由图1(b)可知, IMLT咪唑啉环C=N的特征吸收峰出现在1 608.42 cm-1,表明咪唑啉中间体化合物成功制备;在IMLT中C-N的吸收峰出现在1 093.87 cm-1,N-H的伸缩振动吸收峰出现在3 375.98 cm-1;-CH2-的伸缩振动吸收峰位于2 925.28 cm-1。而由图1(a)可知,在IMLTM中,C=N的特征吸收峰出现在1 639.48 cm-1;N-H的伸缩振动吸收峰出现在3 410.30 cm-1;IMLTM中-CH2-的伸缩振动吸收峰位于2 928.34 cm-1。成功发生曼尼希反应的标志性特征是在IMLTM中的1 038.20 cm-1处有一强吸收峰,这是-PH2O3基团综合作用的结果。
2.2 动态质量损失
在60 ℃浸泡4 h后,含不同缓蚀剂(质量浓度3 g/L)的试验溶液中试样的平均腐蚀速率见图2。由图2可知,未加入缓蚀剂的情况下,试片的平均腐蚀速率可达19.26 g/(m2·h),当缓蚀剂添加量为3 g/L时,试片在IMLTM缓蚀剂中的平均腐蚀速率降至1.63 g/(m2·h),其缓蚀率已达到91.52%;试片在IMLT缓蚀剂中的平均腐蚀速率降至2.02 g/(m2·h),其缓蚀率已达到89.52%,同一浓度水平下IMLTM缓蚀性能好于IMLT。
2.3 极化曲线
图3是添加不同缓蚀剂的试验介质中试样的极化曲线,表1是极化曲线的相关电化学参数。
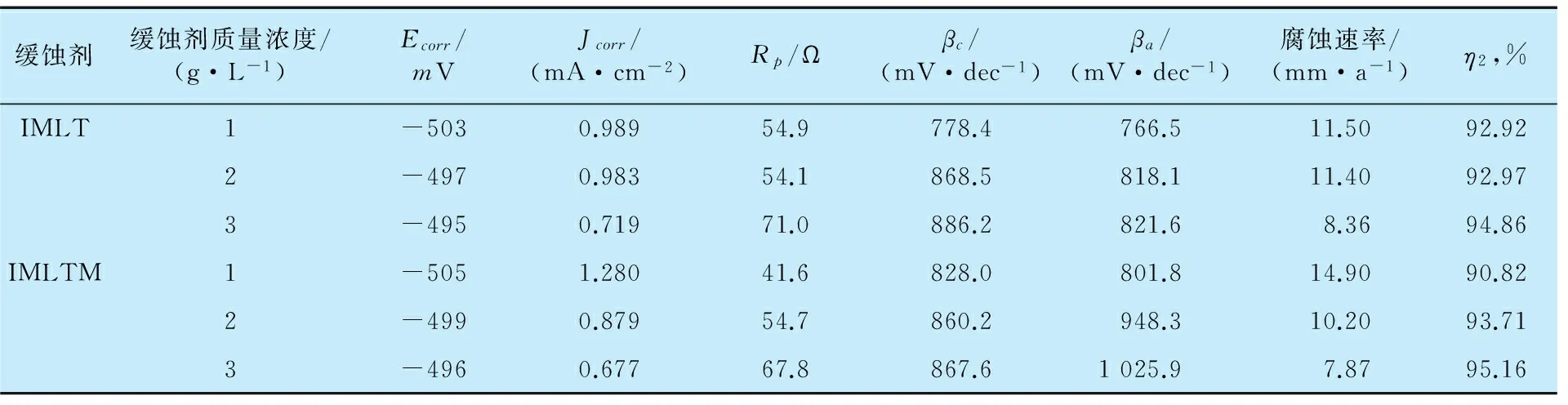
缓蚀剂缓蚀剂质量浓度/(g·L-1)Ecorr/mVJcorr/(mA·cm-2)Rp/Ωβc/(mV·dec-1)βa/(mV·dec-1)腐蚀速率/(mm·a-1)η2,%IMLT1-5030.98954.9778.4766.511.5092.922-4970.98354.1868.5818.111.4092.973-4950.71971.0886.2821.68.3694.86IMLTM1-5051.28041.6828.0801.814.9090.822-4990.87954.7860.2948.310.2093.713-4960.67767.8867.61025.97.8795.16
注:Rp为极化电阻,Ω;βa为阳极塔菲尔曲线的斜率;βc为阴极塔菲尔曲线的斜率;Jcorr为电流密度。
由图3和表1可见,与空白试验组相比,添加两种缓蚀剂后,腐蚀电流密度均减小,缓蚀率都有增加;虽然阴极和阳极腐蚀电流均减小,阴极析氢和阳极溶解的过程均受到抑制,但腐蚀电位Ecorr正移,阳极极化率增大,则说明它们对阳极反应有较强的抑制作用[3],所以IMLT和IMLTM均是抑制阳极为主的混合型缓蚀剂。此外,阴、阳极斜率βc和βa的变化幅度较小,可知缓蚀剂并没有改变腐蚀作用的反应机理,而仅是吸附成膜,遮蔽金属表面的反应活性位点。总体来说,IMLTM的缓蚀性能较IMLT更好,这是由于IMLTM具有与金属表面更多的结合位点,覆盖能力更强,稳定不易脱附;而IMLT所形成的保护膜不如IMLTM形成的保护膜致密和吸附力强,这与质量损失试验结果一致。
2.4 电化学阻抗谱
图4为研究电极在试验介质中的电化学阻抗谱等效电路图。其中,Rf为吸附电阻;Rct为电荷转移电阻;RS为溶液电阻;Cf为膜电容;Cdl为双电层电容。
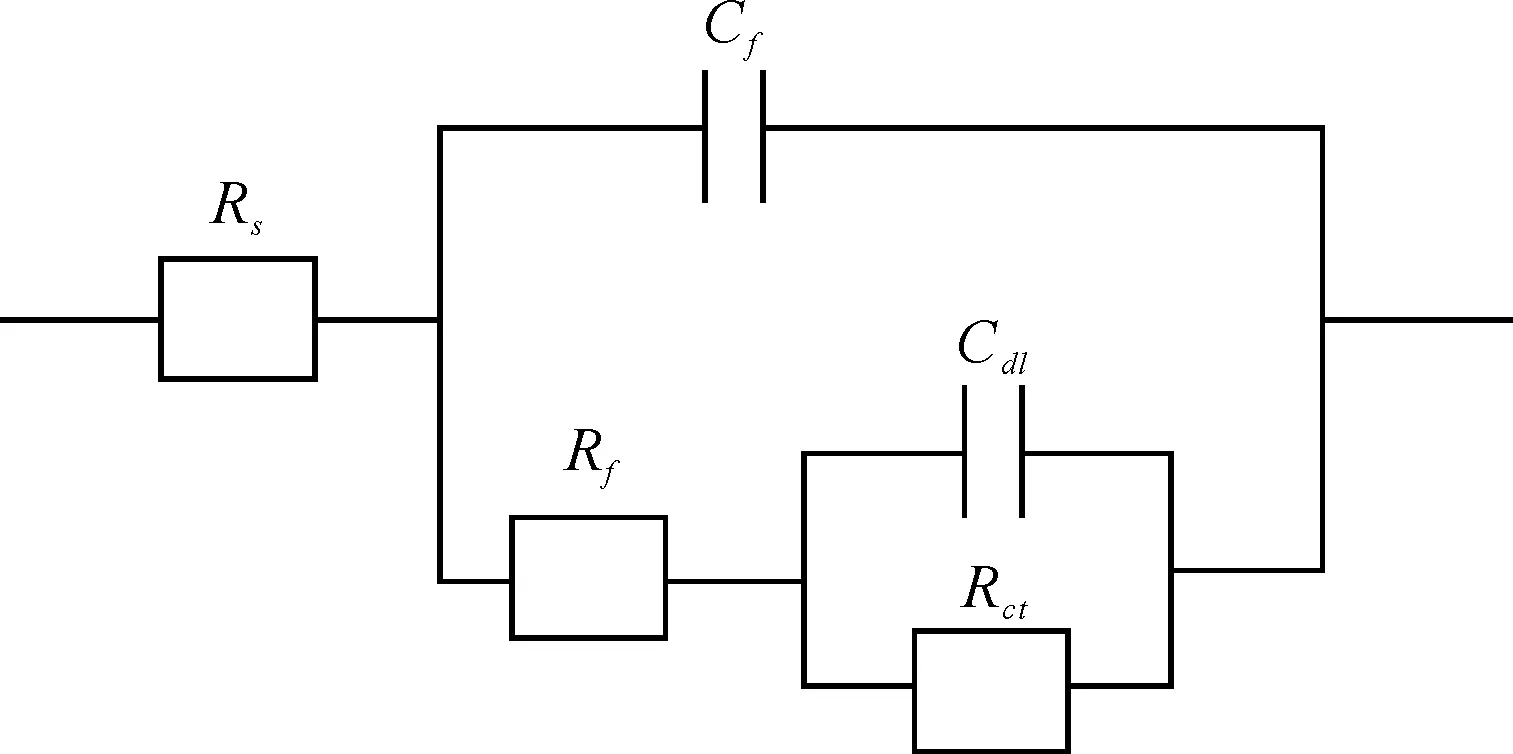
图4 电化学阻抗谱等效电路
图5是10号碳钢试片在60 ℃、含不同浓度IMLT和IMLTM的1 mol/L盐酸腐蚀介质中的电化学阻抗谱。由于谱图中低频区不存在延伸的45°直线部分,则电化学腐蚀过程不受传质控制,只受电荷传递过程控制,而电化学反应速率与电极有效面积有关[4-5]。添加缓蚀剂后,腐蚀体系的界面阻抗特征发生明显变化,随着缓蚀剂浓度的增大,容抗弧的半径增大,即电荷转移电阻Rct值增大,表明涉及电化学腐蚀反应过程中的电荷转移变慢,腐蚀反应明显受抑制;双电层电容Cdl值减小,这是由于缓蚀剂在金属表面形成吸附层,替代了介电常数不同的水,有效隔离了水和其他腐蚀物质的直接接触,双电层电容Cdl值逐渐降低。与相同条件下质量损失法的试验结论比较,两者具有相同趋势。
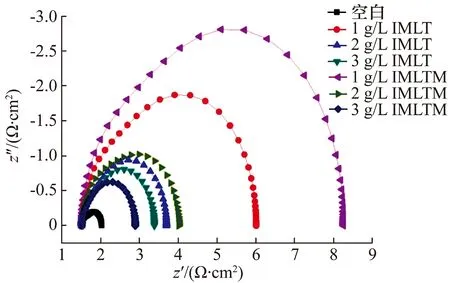
图5 试验溶液中的电化学阻抗谱
2.5 表面形貌
图6是在空白溶液、添加3 g/L的IMLT和添加3 g/L IMLTM缓蚀剂的试验溶液中,试片于60 ℃浸泡4 h后的SEM 形貌。
由图6可见,空白组的试片已经完全看不出金属打磨痕迹,表面存在一些酥松多孔的结构,说明试片均匀腐蚀的同时发生了点蚀。为尽量模拟真实操作条件,加入缓蚀剂的试验溶液中的试片未经过预膜处理,且腐蚀介质处于流动状态。在介质的冲击下,试验前期缓蚀剂很难在金属表面均匀成膜,金属表面首先受到酸的不均匀腐蚀,形成一些铁的氧化物,所以缓蚀剂先发生覆盖的位置腐蚀较轻,可以看到一些金属打磨痕迹,后覆盖的位置会看到疏松多孔结构。通过腐蚀情况的分析可推测出缓蚀剂以两种膜层进行缓蚀作用(见图7),一种是贴近金属的一层膜,是由缓蚀剂中含有较强电负性的原子及基团与Fe2+或Fe3+反应的产物沉积成膜;另一种是非极性烷基链与N,P和O等带孤对电子的原子吸附于金属表面活性位点覆盖成膜,而且沉积膜的化合键结合力强于覆盖膜的配位键[4]。

图6 试片于60 ℃浸泡4 h后的SEM 形貌
2.6 表面能谱分析
在60 ℃温度下4 h试验后,对试片表面吸附膜的能谱分析表明:相比于空白试验组,添加缓蚀剂后使膜中Fe和O比例上升,这充分说明SEM分析的成膜理论是成立的,即不同价态Fe的氧化腐蚀产物和缓蚀剂反应的生成物沉积于金属表面成膜,这类吸附的特点是单层致密吸附力强,属于化学吸附[5]。此外添加IMLTM缓蚀剂情况下,试片表面膜中出现P,则是由于曼尼希反应成功进行,产生-PH2O3基团并在金属表面发生吸附。
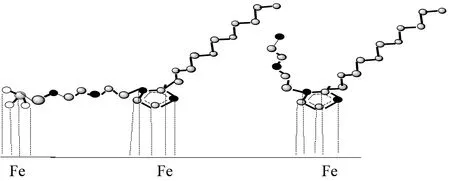
图7 缓蚀剂在碳钢表面吸附机理
2.7 吸附热力学
为探究曼尼希反应前后缓蚀剂在10号碳钢表面的吸附行为,利用质量损失法测得60 ℃时的质量损失数据分别代入各类等温方程,结果发现符合Langmuir等温吸附方程:
式中:C为缓蚀剂质量浓度;θ为缓蚀剂表面覆盖度;K为吸附平衡常数。
以C·θ-1对C作图,结果见图8。由图8可知,C·θ-1与C线性相关,相关系数r近似等于1,这表明它们在10号钢表面的吸附行为符合Langmuir等温吸附方程。由计算得出ΔG0为负,说明缓蚀剂在金属表面发生自发吸附,且存在物理化学混合吸附机制[6-8]。
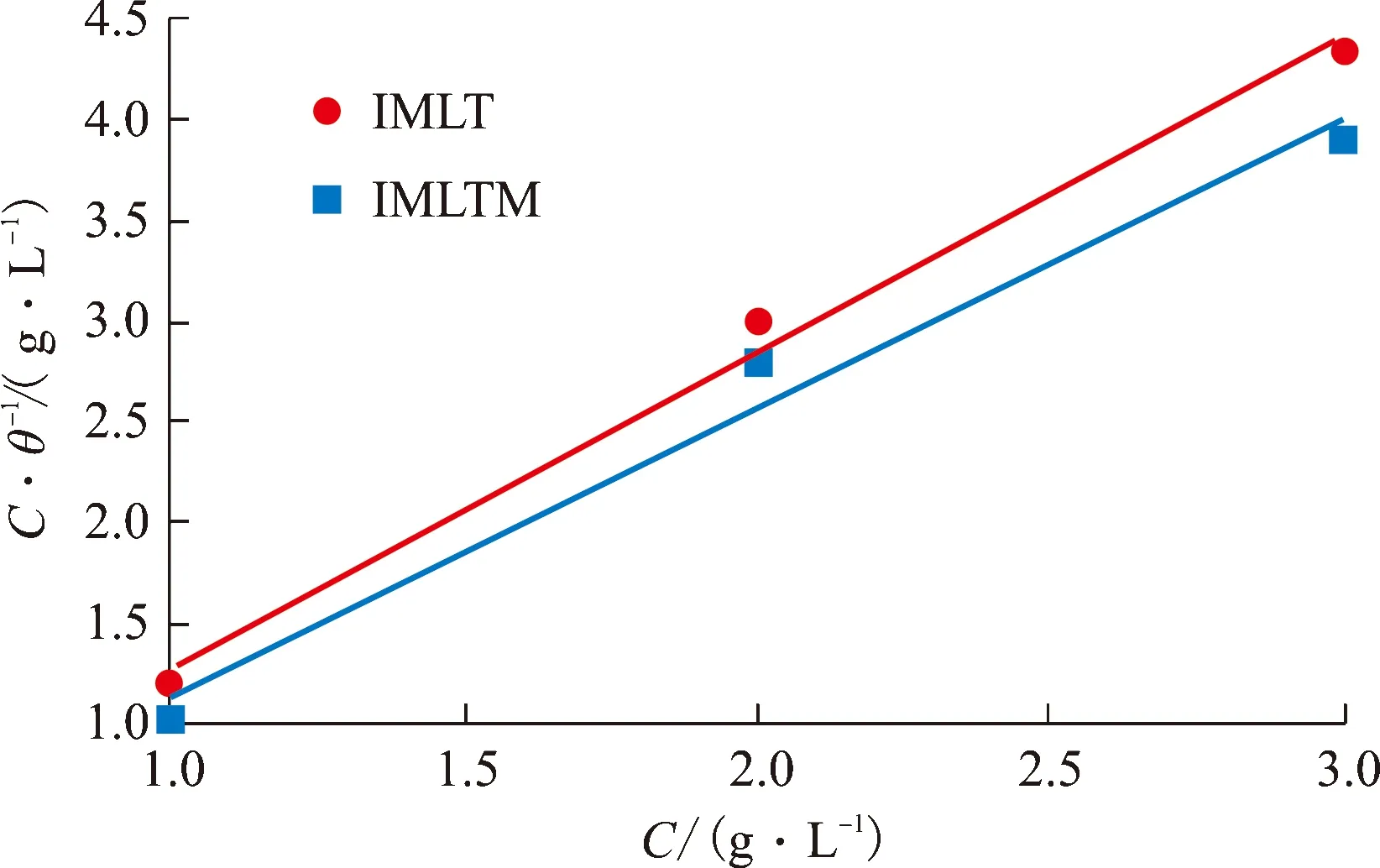
图8 试验溶液中C·θ-1与C 关系
3 结 论
(1)利用动态质量损失法、极化曲线法和交流阻抗法从不同角度研究了缓蚀剂的缓蚀效果和成膜机理。
(2)曼尼希反应前后缓蚀剂缓蚀效率都达到89%以上,尤其是曼尼希反应后缓蚀效果更好;它们均属于阳离子型缓蚀剂。
(3)曼尼希反应后的缓蚀剂活性吸附位点增多,覆盖力增强,分散性更好。
(4)通过扫描电镜观察、能谱分析和等温吸附曲线的分析,印证了缓蚀剂发生了化学吸附,一种是与铁盐反应沉积成膜,这是一种化学吸附层;另一种是缓蚀剂吸附覆盖成膜,吸附规律符合Langmuir等温吸附方程。
[1] EDWARDS A,OSBORNE C,WEBSTER S,et al.Mechanistic Studies of the Corrosion Inhibitor Oleic Imidazoline[J].Corrosion Science,1994,36(2):315-325.
[2] A Negm N,A Yousef M,M Tawfik S.Impact of Synthesized and Natural Compounds in Corrosion Inhibition of Carbon Steel and Aluminium in Acidic Media[J].Supportive & Palliative Care,2013,3(2):351-358.
[3] FANG Z,WU Y S,ZHANG L,et al.Application of the Modified Electrochemical Potentiodynamic Reactivation Method to Evaluate Intergranular Corrosion Susceptibility of Stainless Steels[J].Corrosion,1998,54(5):339-346.
[4]GULBRANDSEN E,NESIC S,HESJEVIK S M,et al.Effect of Precorrosion on the Performance of Inhibitors for CO2Corrosion of Carbon Steel[J].Corrosion Science,1998,26(3):215-225.
[5] FOUDA A S,ABDALLAH M,El-HOSEINY M.Acrylonitrile Derivatives as Corrosion Inhibitors for Cu10Ni Alloy in 0.5 M Hydrochloric Acid Solution[J].Journal of Taibah University for Science,2013,33(4):412-417.
[6] 江依义.酸化缓蚀剂的合成及其缓蚀性能研究[D].杭州:浙江大学,2013.
[7]ZENG C L,WANG W,WU W T.Electrochemical Impedance Models for Molten Salt Corrosion[J].Corrosion Science,2001,43(4):787-801.
[8] LI X,DENG S,XIE X.Experimental and Theoretical Study on Corrosion Inhibition of Oxime Compounds for Aluminium in HCl Solution[J].Corrosion Science,2014,81(4):162-175.

