长链非编码MALAT1在宫颈癌转移中的作用
张 蕾, 胡尔西旦·尼牙孜, 赵化荣, 忙尼沙·阿不都拉, 迪丽达尔·斯地克, 王 静,张 洋, 叶建蔚, 包永星
(新疆医科大学第一附属医院肿瘤中心一科, 乌鲁木齐 830054)
宫颈癌是女性生殖系统肿瘤常见的肿瘤之一。我国每年宫颈癌新发病例占世界新发病例总数的1/5左右[1]。因此,预测宫颈癌新的标志物,以及阐明宫颈癌发生及转移的分子水平机制,是提高宫颈癌患者生存率的首要问题,同时在治疗前通过对肿瘤放射敏感性的检测评估放疗疗效是及其重要的,为选择合理而有效的治疗提供有力的依据。因而与放疗疗效相关的分子标志物研究广受关注。长链非编码RNA(long non-coding RNA,lncRNA)是最近几年发现的一系列转录物,长链非编码RNA的长度一般都超过200 nt,虽然它们不具有编码蛋白质的具体功能,但调节mRNA的 剪切、降解以及翻译等过程发挥着其重要的作用[2]。lnc RNA 也逐渐被认为是肿瘤的相关分子,可以作为恶性肿瘤新的标志物来研究。肺癌转移相关转录本1 (metastasis-associated lung adenocarcinoma transcript1 MALAT1) 在人类非小细胞肺癌中被首次发现,也是最早被发现的lnc RNA 之一[3]。现将研究结果深入的进行下去,与近期的国际研究热点结合,了解长链非编码RNA与宫颈癌转移的相关性,着眼于提高宫颈癌综合治疗的疗效,同时寻找新疆宫颈癌的预后预测指标。本研究将miRNA- 143、MALAT1的慢病毒转载至HeLa细胞株上,通过逆转录-聚合酶链反应,细胞增殖试验(MTT)分析细胞的增殖,采用west blot来分析波形蛋白等方法,测定miRNA- 143和长链非编码RNA MALAT1是否促进细胞株的转移及侵袭,现报道如下。
1 材料与方法
1.1材料人类宫颈癌细胞系HeLa细胞由新疆医科大学实验室提供。Dulbecco的链霉素/青霉素,胎儿牛血清购买于美国沃尔瑟姆试剂公司。转录和反转录RNA引物由中国Sangon生物技术公司设计并合成。lipofectamine TM2000和Trizol试剂盒购买于中国Sangon有限公司。荧光实时定量PCR试剂盒购买于中国Sangon生物技术公司。Trans-well试剂、反单克隆抗体、兔抗人e-cadherin多克隆抗体、抗小鼠二级抗体结合碱性磷酸酶、小鼠抗人类β-actin抗体购自美国圣克鲁斯生物技术有限公司。
1.2分组方法HeLa细胞株被分为5组,即空白组、miRNA-143转染组、MALAT1转染组、miRNA-143抑制剂转染组和MALAT1抑制剂转染组。
1.3试验方法
1.3.1 HeLa细胞的培养方法 将HeLa细胞在Roswell Park Memorial Institute(RPMI)1640培养基中培养,37℃恒温培养箱中培养HeLa细胞。慢病毒载体转染:miRNA-143、MALAT1、miRNA-143抑制剂和MALAT1抑制剂的载体由Sangon生物科技有限公司合成引物,见表1。从琼脂糖凝胶中提取出线性化的载体片段含碱性磷酸酶,观察至提取生长发育阶段的细胞,植入96孔板中,分为miRNA-143转染组、MALAT1转染组、miRNA-143抑制剂转染组、MALAT1抑制剂转染组和对照组。逆转录定量PCR(RT- qPCR):使用Trizol试剂盒进行RNA提取,共使用了200个ng RNA作为合成cDNA的模板。采用cDNA作为模板和引物进行PCR扩增,测定在生长发育阶段的HeLa细胞数并接种在培养皿中生长。经慢病毒转染的细胞在含DMEM培养基中孵育2%胎牛血清24 h,然后在含有10% FBS的DMEM培养基中孵育,细胞中加入20 μL 细胞增殖液(5mg/mL) 保留4 h,分别孵化10 min与15 min,测定570 nm处的吸光度值。
1.3.2 Trans-well试验 基底膜基质添加trans-well室孵化24 h,然后在无血清培养基水化1 h。将Post-transfection细胞保留在反式培养基的上部培养1 h,下部灌注RPMI1640媒介,用Giemsa染色法进行显微观察其变化。
1.3.3 Western blotting试验 将Hela细胞在指数期为8%胶片上分离40 μg溶解产物,将e-cadherin蛋白质被转移到PVDF膜上(Thermo Fisher Scientific),在5% BSA(细胞信号技术)溶解1 h后,膜与原抗体(抗e-cadherin)孵育或波形蛋白结合,分别在1∶200和1∶500(β-actin)孵化30 min,用TBST(tris-缓冲生理盐水和Tween 20,pH 7.5)加入至缓冲器中冲洗,最后用次级抗体(1∶2 000稀释)孵育1 h,然后依次添加增色剂,用软件对光学密度进行分析。
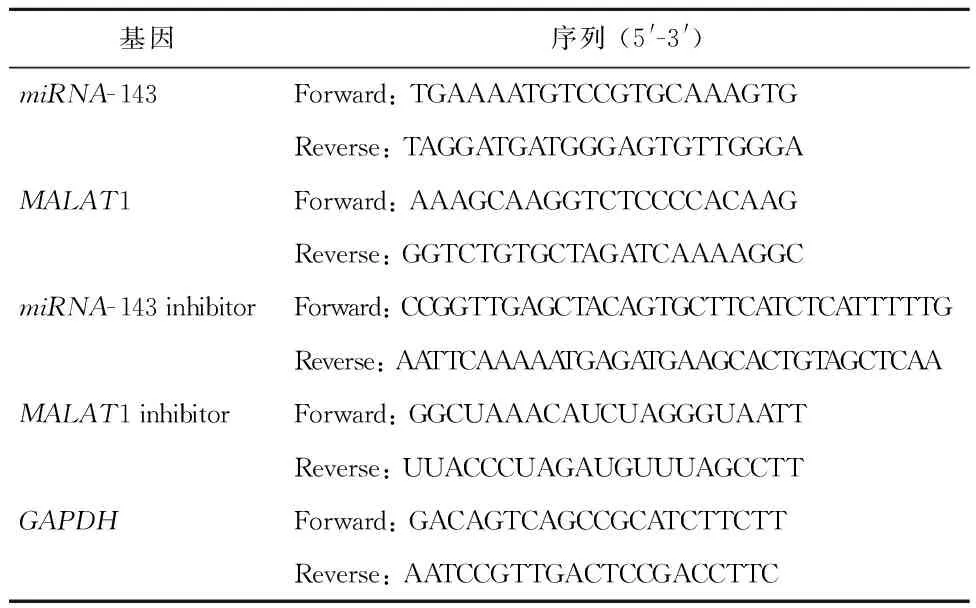
表1 慢病毒转载引物
2 结果
2.1经转染的HeLa细胞增殖情况与空白组比较,miRNA-143转染组和MALAT1转染转染组HeLa细胞增殖,差异有统计学意义(P<0.05),见表2。
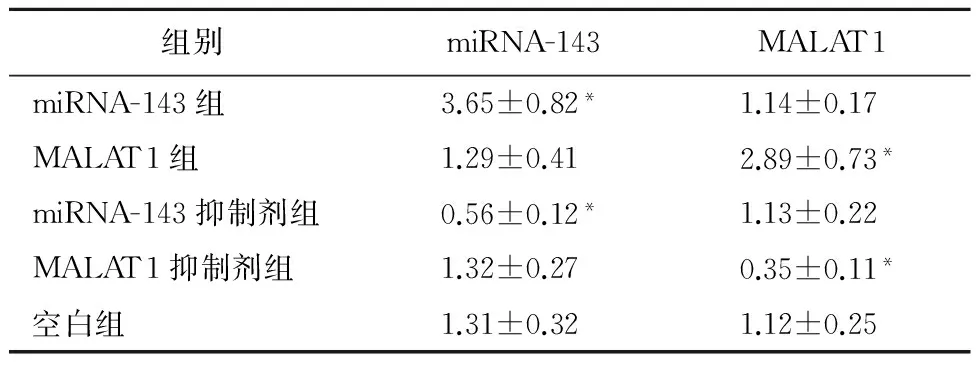
表2 HeLa细胞中miRNA-143与MALAT1的表达情况
注: 与空白组比较,*P<0.05。
2.2不同时间转染组HeLa细胞的侵袭情况不同转染条件下HeLa细胞的增殖中,与miRNA-143转染组比较,miRNA-143抑制剂转染组侵袭性更强,差异有统计学意义(P<0.05)。与MALAT1抑制剂转染组比较,MALAT1转染组侵袭性更强,差异有统计学意义(P<0.05),见表3。
2.3HeLa细胞在不同转染条件下细胞的入侵和迁移情况采用反式分析方法检测HeLa细胞的入侵和迁移,与miRNA-143转染组比较,miRNA-143抑制剂转染组HeLa细胞的入侵和迁移能力增加,差异有统计学意义(P<0.05) ,见图1-5。

表3 不同时间转染组HeLa细胞的侵袭情况
注: 0 h后与空白组对照比较,*P<0.05; 24 h后与空白组对照比较,#P<0.05; 48 h后与空白组对照比较,△P<0.05。


2.4miRNA-143转染HeLa细胞蛋白分析与miRNA-143转染组比较,miRNA-143抑制剂转染组e-cadherin水平降低,差异有统计学意义(P<0.05);与MALAT1抑制剂转染组比较,MALAT1转染组的vimentin水平升高,差异有统计学意义(P<0.05),见图6、表4。


组别E-cadherinVimentinmiRNA-143转染组3.57±1.63*0.86±0.08*MALAT1转染组1.06±0.11*2.15±1.05*miRNA-143抑制剂组1.02±0.12*2.34±1.16*MALAT1抑制剂组3.78±1.75*0.78±0.07*空白组1.38±0.221.26±0.18
注: 与空白组比较,*P<0.05。
3 讨论
随着宫颈癌筛查技术的发展,宫颈癌早期患者较前有所增加,但宫颈癌患者的发病率及死亡率未见明显下降。因此,了解宫颈癌的发生、发展和转移的机制是非常重要的。有学者的研究结果提示miRNA-143可能促进肿瘤细胞凋亡[4]。MALAT1是首先在非小细胞肺癌中发现[5],作为一种长链非编码RNA,它在各种肿瘤和组织中表达,可能影响肿瘤的增殖、凋亡、侵袭、转移[6]
本研究选择了人类宫颈癌细胞株,HeLa细胞株作为模型。经慢病毒转染,发现经转染的HeLa细胞增殖与空白组比较,结果提示miRNA-143和MALAT1的表达对肿瘤的侵袭和增殖有影响。miRNA-143在细胞增殖中的存在负调控机制[7]。MALAT1也已被证明可以调节肿瘤细胞的转移能力,促进细胞的增殖和迁移[8]。在上皮-间质转化(EMT)中,恶性肿瘤细胞获得成纤维细胞的形态特征[9]。EMT的显著特征是它下调不同信号转导的间充质,从而促进细胞外基质(ECM)降解[10]。钙粘蛋白是一个Ca2+依赖的细胞内跨膜糖蛋白粘附在上皮组织的分子,参与建立细胞连接。本研究发现了miRNA-143抑制剂转染过程中,e-cadherin水平降低,与MALAT1抑制剂转染组的水平相比,MALAT1转染组的vimentin水平升高。本研究结果与Ying等人[11]的结论一致,即MALAT1移植钙粘蛋白的表达和β-catenin,促进间充质转变上皮细胞,调控结直肠癌的增殖和转移。
尽管本研究揭示了一些问题,但在分子机制分析中使用的Giemsa染色方法不是最优的方法[12],因为它需要使用固定细胞,脱色和染色过程对基质细胞是有影响的。因此,在后续的研究中,我们将采用结晶紫染色法避免Giemsa染色可能出现的问题。此外,由于本研究中只使用了一个宫颈癌细胞系,再后续的实验中可以使用其它宫颈癌细胞系证实所发现的问题。总之,低水平的mirna-143和高水平的MALAT1可以增强宫颈癌细胞系HeLa细胞的增殖,因此,mirna-143与MALAT1可能是宫颈癌转移的新标记物,仍需要进一步的研究去探究其机制。
参考文献:
[1] AHMAD I, SINGH L B, YANG Z H, et al. Mir143 expression inversely correlates with nuclear ERK5 immunoreactivity in clinical prostate cancer[J]. Br J Cancer,2015,12(1) :149-154.
[2] BANNO K, IIDA M, YANOKEAN M,et al. MicroRNA in cervical cancer: OncomiRs and tumor suppressor miRs in diagnosis and treatment[J]. World Cancer,2014,22(1): 41-58.
[3] CALIN G A, SEVIGNANI C, DUMITRU C D, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers [J]. Proc Natl,2012,11(1): 136-139.
[4] CHEN X, GUO X, ZHANG H, et al. Role of miR-143 targeting KRAS in colorectal tumor genesis [J]. Oncogene, 2010,11(1): 33-35.
[5] FU J, QIN L, HE T, et al. The TWIST/Mi2/NuRD protein complex and its essential role in cancer metastasis [J]. Cell Res,2016, 16(2) :133-136.
[6] GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2015,13(1):233-237.
[7] GUTSCHNER T,DIEDERICH S.The hallmarks of cancer: a long non-coding RNA point of view[J]. RNA Biol,2013,23(1): 163-167.
[8] GUTSCHNER T, HAMMERLE M,DIEDERICHS S. MALAT1-a paradigm for long noncoding RNA function in cancer[J]. Mol Med, 2016,20(1): 63-68.
[9] HUANG J, LIU H, WANG J, et al. MicroRNA regulation and therapeutic targeting of survivin in cancer[J].Cancer Res,2015,10(1): 133-135.
[11] WANG J, SRIVASTAVA V, LIU S M, et al. MicroRNA machinery genes as novel biomarkers for cancer[J]. Frontiers in Oncology,2014,4(113):173-178.
[12] LAJER C B, GARNAS E, FRISS-HANSEN L, et al. The role of miRNAs in human papilloma virus (HPV)-associated cancers: bridging between HPV-related head and neck cancer and cervical cancer[J].Cancer, 2015,16(1) 23-29.

