间歇性低压低氧预处理对SD大鼠放射性肝损伤的保护作用
徐 丽, 叶 华, 邹 蕴, 李文军, 夏红娟, 袁 芳
(新疆军区总医院放疗科, 乌鲁木齐 830054)
放射治疗目前已成为肿瘤治疗重要的手段之一,射线造成危及器官损伤是制约放射治疗的主要因素,肝脏属于放射敏感器官[1],放射性肝损伤(radiation-induced liver injury,RILI)就是肝脏受到射线照射后,肝细胞产生的一系列生理、病理变化造成的肝组织损伤[2],是继发于腹部放射治疗最严重且制约着腹部肿瘤剂量递增的致死性并发症之一[3]。随着放射治疗设备的不断创新以及放射治疗技术的不断改进,肝癌放疗导致的胃肠道和消化道的并发症降低,但放射性肝损伤仍然有发生,严重制约着肿瘤放射治疗剂量的增加以及肝胆肿瘤的再程放疗[4]。间歇性低压低氧预处理(intermittent hypobaric hypoxia preconditioning,IHHP)是指间断模拟高海拔的低压低氧,在两次低压低氧之间恢复复常压常氧环境[5]。作为增强机体和组织缺氧耐受性的手段,低压低氧已被广泛使用。本研究将SD大鼠作为研究对象,间歇性模拟高原海拔环境,探讨低压低氧对大鼠肝脏的影响,并进一步探讨低压低氧对放射性肝损伤能否产生保护作用。
1 材料与方法
1.1动物来源及分组24只健康雄性SPF级SD大鼠购自新疆医科大学医学验动物中心[SCXK(新)2011-0004],体质量180~220 g/只,随机分为对照组(C组)、4 000 m低压低氧预处理组(IHHP组)、单纯照射组(R组)和低压低氧预处理联合照射组(IHHP+R组),每组6只,C组大鼠在常压常氧环境中饲养,低压低氧环境均在西北特殊环境人工实验舱(新疆军区总医院研制)中进行,IHHP组大鼠通过实验舱模拟海拔高度4 000 m的高原环境,每天进舱6 h,每日进1次,1 w进舱5次,每日进舱时间基本固定,出舱后在常压常氧环境中饲养。分组后大鼠标记编号,分笼饲养,3只/笼,标准啮齿类动物饲料常规饲养,饮水设施、整个实验过程对动物处置严格按照伦理学要求。实验开始前,所有大鼠在新疆军区总医院动物实验科动物饲养中心[SYXK(新)2011-0003]适应性饲养1 w。
1.2照射方法照射组大鼠照射前通过3%戊巴比妥钠腹腔注射(0.1 mL/100 g)麻醉,麻醉成功后将大鼠固定在木质的固定板上,选择右半肝照射,根据大鼠肝脏的位置及肝脏与邻近器官的关系确定好照射野,并在体表标记,照射野大小3 cm×2 cm×1.5 cm,内侧界:大鼠腹中线,外侧界:开放,上界:膈顶,下界:距上界2 cm。射线类型:6 MV X射线,源皮距(Source Skin Distance,SSD) =100 cm,照射深度(d)=1.5 cm,照射剂量率:600 cGy/min,照射总剂量(Total dose,DT)=60 Gy,2 Gy次/d,周一至周五照射,周末休息。整个实验过程每天测量体质量,详细记录所有大鼠的生物学行为,大鼠精神、活动状态、饮食、大小便情况,照射组大鼠照射野的皮肤、有无脱毛等情况。
1.3采血所有实验结束后6 h, 3%戊巴比妥钠腹腔注射麻醉大鼠,固定好大鼠打开腹腔,找到下腔静脉采血5 mL,检测肝功能,主要比较谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)的变化。完成采血后,完整的暴露肝脏并观察肝脏的大体形态:大小、 形状、质地、颜色。选择照射野内的肝脏组织,切取1 cm×1 cm×1 cm大小, 10%中性福尔马林溶液固定,石蜡包埋,5 μm连续切片, HE染色光镜下观察病理形态。

2 结果
2.1各组大鼠ALT、AST的比较与C组相比,R组ALT、AST均升高,IHHP+R组转氨酶AST值升高,差异有统计学意义(P<0.05),IHHP组大鼠经过低压低氧预处理后,转氨酶ALT、AST值降低,差异有统计学意义(P<0.05),IHHP+R组与R组比较,预处理后转氨酶值降低,差异有统计学意义(P<0.05)(表1)。

表1 照射与HHP预处理对大鼠转氨酶ALT、 AST的影响
注:与C组比较,*P<0.05;与 R组比较,ΔP<0.05。
2.2各组大鼠肝脏大体形态C组大鼠肝脏颜色鲜红,质地软(图1a),与C组大鼠肝脏比较,R组大鼠照射部位肝脏颜色变暗,其余无明显变化(图1b),IHHP组大鼠肝脏无明显变化(图1c),IHHP+R组大鼠肝脏有轻度充血,余无明显变化(图1d)。
2.3各组大鼠肝脏病理形态C组大鼠肝脏肝细胞排列整齐(图2a),R组大鼠肝脏中央静脉、肝窦扩张充血,肝细胞水肿,肝细胞出现空泡样变性(图2b),IHHP组大鼠肝脏病理心态与对照组大鼠类似(图2c),IHHP+R组大鼠肝脏中央静脉、肝窦扩张充血,肝细胞空泡样变性数量及程度较照射组明显减轻(图2d)。

a: C组大鼠肝脏

b: R组大鼠肝脏

c: IIHP组大鼠肝脏
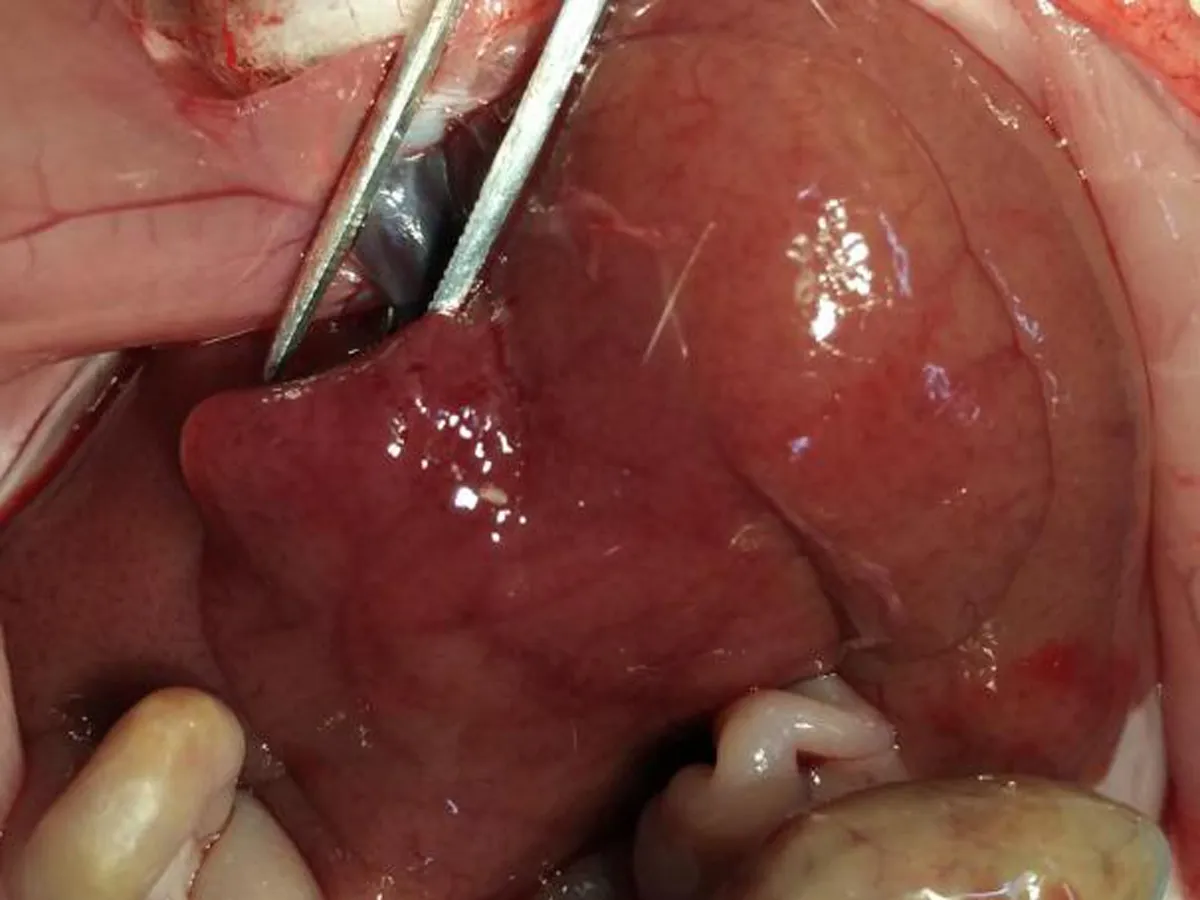
d: IHHP+R组大鼠肝脏
图1各组大鼠肝脏大体形态
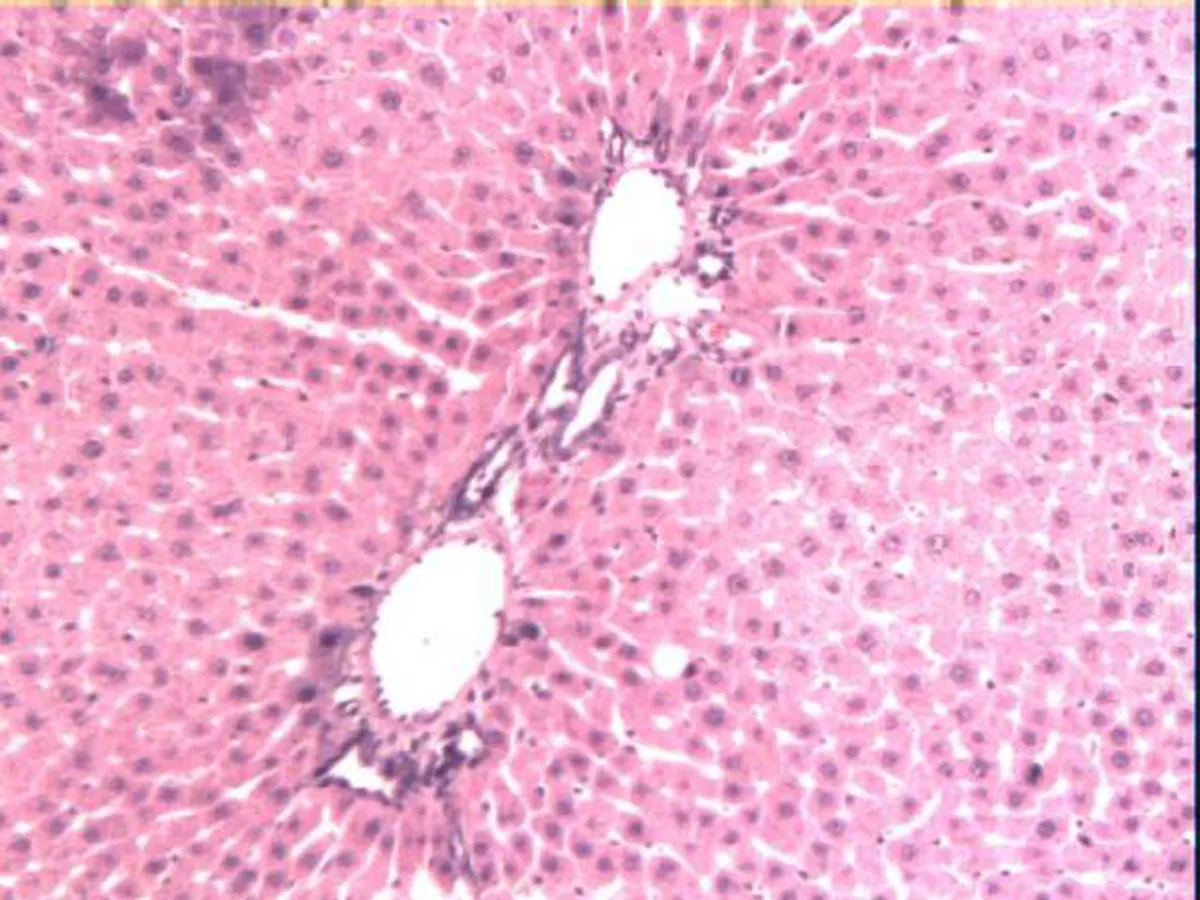
a: C组
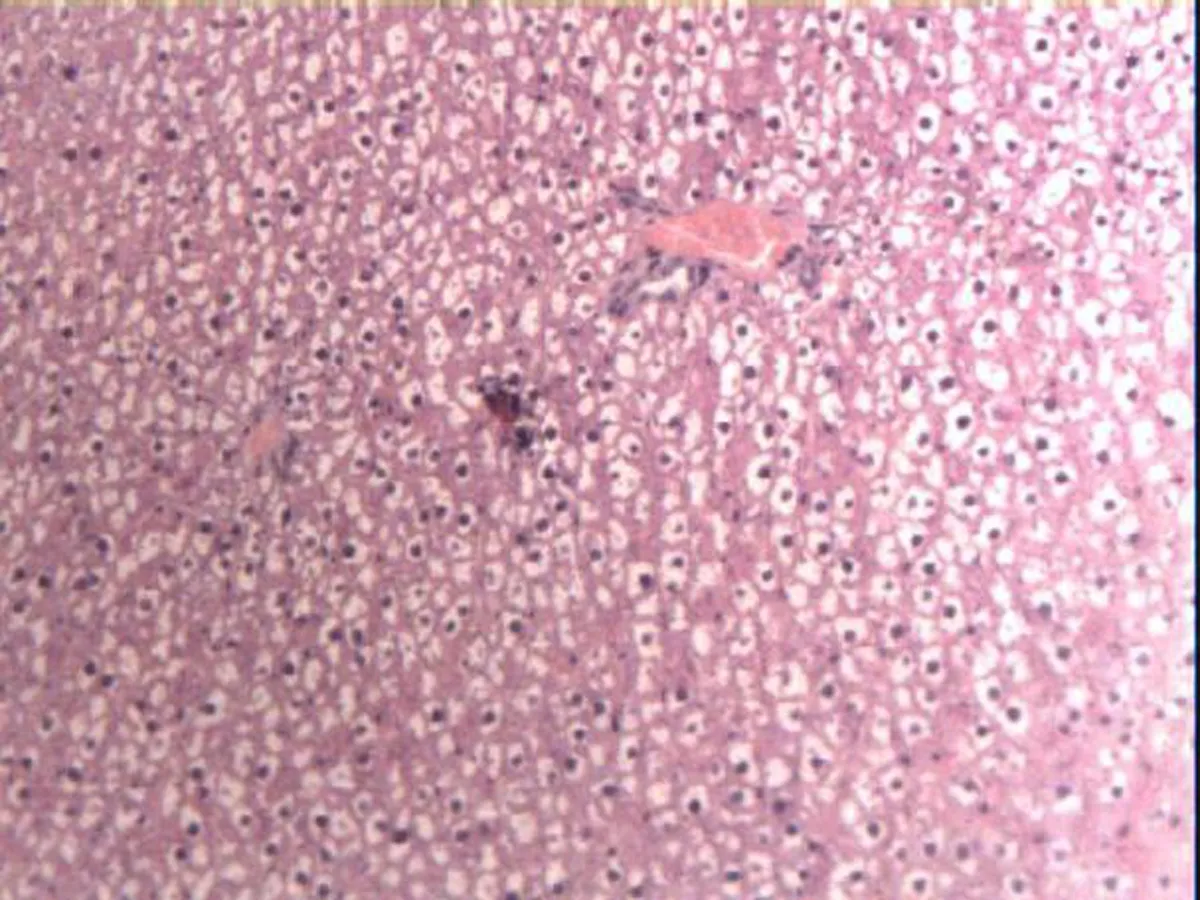
b: R组

c: IHHP组

d: IHHP+R组
图2各组大鼠肝组织HE染色观察(×100)
3 讨论
目前国内外在放射治疗中面临的一个突出问题仍然是如何在杀灭肿瘤的同时又能保护正常组织及重要器官。放射性肝损伤是放射治疗导致的亚急性、慢性肝脏损伤,是胸部以及上腹部肿瘤放疗和骨髓移植前预处理中最严重的并发症之一,极大影响胸腹部肿瘤尤其是肝癌放疗的疗效[6-7]。
肝脏照射后会引起肝功损伤,ALT、AST会有不同程度的升高,Cheng等[8]研究结果也表明放射性肝脏疾病(radiation-induced liver disease,RILD)大鼠肝功检测ALT、AST以及碱性磷酸酶(alkaline phosphatase, ALP)明显增加。本研究中将SD大鼠放进低压低氧舱模拟高海拔环境进行低压低氧预处理,处理后对大鼠进行右半肝照射,IHHP+R组与R组比较,预处理后ALT、AST值降低,差异有统计学意义(P<0.05)。照射后大鼠肝脏大体颜色变暗,与吴戈等[9]放射性肝损伤模型建立的研究中对大鼠肝脏大体形态的描述相似,照射后颜色由鲜红逐渐变为暗红,IHHP组大鼠肝脏大体变化不大,可能与低氧处理有关。Berthrong 等[10]认为肝脏急性损伤效应(又称急性放射性肝炎)的主要病理学特征表现为肝小叶中央静脉闭塞性损伤(venous occlusive disease, VOD)。照射后大鼠肝脏中央静脉、肝窦扩张充血,肝细胞水肿,肝细胞出现空泡样变性,经过预处理后的大鼠肝细胞水肿程度及中央静脉、肝窦淤血程度较R组大鼠减轻,表明IHHP可以减轻大鼠肝脏照射后引起的损伤。Yuan等[11]研究表明慢性间歇性低压低氧预处理可通过抑制内质网应激损伤减轻代谢综合征大鼠模型的肝损伤。Wang等[12]研究表明慢性间歇性低压低氧处理可以减轻放射性心脏功能损伤和纤维化,这种保护作用可能与低压低氧抑制氧化应激和内质网应激相关。
间歇性低压低氧预处理可以增强机体对缺血、缺氧的耐受性,对心脏、神经、肝脏等组织器官产生保护作用[13-14]。HHP通过上调组织热休克蛋白70来降低全身的炎症因分子和器官组织毒性损伤[15]。Yan等[16]研究表明低压低氧预处理可能通过增加自由基清除能力,减弱氧化应激反应及上调抗凋亡蛋白表达等方式减轻肾脏缺血再灌注损伤后所致的肝脏损伤。慢性间歇性低压低氧对大鼠心脏缺血再灌注损伤有保护作用,这种保护作用可能与蛋白激酶C的激活有关[17]。针对抑郁症动物模型,间歇性低氧预处理有类似于抗抑郁药治疗抑郁的潜能[18-19],或许可以成为治疗这类病理生理状态的一个选择。Xu等[20]结果说明心脏骤停后低氧处理能提供保护作用,通过增加缺氧诱导因子1α(HIF-1α)的表达。相关放疗防护方面的研究发现低氧放疗能提高结直肠癌患者的远期生存率[21]。孙衍伟等[22]关于中晚期胰腺癌低氧放疗的研究也表明低氧放疗能提高患者的远期生存率,降低胰腺癌患者的远处转移率,可能与低氧放疗保护了正常组织,改善了患者的免疫功能有关。本研究结果显示,大鼠经过间歇性低压低氧预处理后行右半肝照射,大鼠转氨酶下降,病理形态损伤减轻,说明低压低氧能降低放射性造成的肝脏损伤。
综上所述,低压低氧预处理后行半肝照射可以对肝脏产生一定的保护作用,这或许能为放射性肝损伤的防护提供一条新的思路,但预处理时间的长短是否合适、预处理高度是否合理等问题还需要进一步的探讨。
参考文献:
[1] 董天明, 安宁豫. 放射性肝损伤影像学研究现状[J]. 中国医学科学院学报, 2013, 35(6):694-697.
[2] 赵增虎, 刘俊堂, 范青建.放射性肝损伤研究及防治进展[J].现代肿瘤医学,2011, 19(10):2110-2113.
[3] KIM J, WANG S, HYUN J, et al. Hedgehog signaling is associated with liver response to fractionated irradiation in Mice[J]. Cell Physiol Biochem, 2016, 40(1/2):263-276.
[4] DOI H, SHIOMI H, MASAI H, et al. Threshould doses and prediction of visually apparent liver dysfunction after stereotactic body radiation therapy in cirrhotic and normal livers using magnetic resonance imaging[J]. J Radiat Res, 2016, 57(3):294-300.
[5] ZHANG Y, ZHOU Z N. Beneficial effects of intermittent hypobaric hypoxia on the body[J]. Chin J Appl Physiol, 2012, 28(6):504-509.
[6] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[7] 江林官, 孟鸿宇, 张火俊. 放射性肝损伤的研究进展[J]. 世界华人消化杂志, 2017, 25(20):1811-1818.
[8] CHENG W, XIAO L, AINIWAER M, et al. Molecular responses of radiation-induced liver damage in rats[J]. Mol Med Rep, 2015, 11(4):2592-2600.
[9] 吴戈,肖蕾,张瑞丽,等. 急性放射性肝损伤大鼠模型的建立与评价[J]. 中国实验动物学报,2015,23(2):178-181.
[10] BERTHRONG M, FAJARDO L F. Radiation injury in surgical pathology. part II. alimentary tract.[J]. Am J Surg Pathol, 1981, 5(2):153-78.
[11] YUAN F, TENG X, GUO Z, et al. Chronic intermittent hypobaric hypoxia ameliorates endoplasmic reticulum stress mediated liver damage induced by fructose in rats[J]. Life Sci, 2015(121):40-45.
[12] WANG J, WU Y, YUAN F, et al. Chronic intermittent hypobaric hypoxia attenuates radiation induced heart damage in rats[J]. Life Sci, 2016(160):57-63.
[13] BRENNAN S, JACKON R, PATEL M, et al. Early opening of sarcolemmal ATP-sensitive potassium channels is not a key step in PKC-mediated[J]. J Mol Cell Cardiol, 2015(79):42-53.
[14] ZHU X H, YAN H C, ZHANG J, et al. Interrmittent hypoxia promotes hippocompal neurogenesis and produces antidepressant-like effects in adult rats[J]. J Neurosci, 2010, 30(38):12653-12663.
[15] WANG C T, LIN H J, CHENG B C, et al. Attenuating systemic inflammatory markers in simulated high-altitude exposure by heat shock protein 70-mediated hypobaric hypoxia preconditioning in rats[J]. J Formos Med Assoc, 2015, 114(4):328-338.
观察组护士安全管理意识、安全防范完善性优于对照组,P<0.05,其中,观察组护士安全管理意识、安全防范完善性96.55±2.89分、98.62±1.78分优于对照组82.50±3.13分、82.67±2.27分,P<0.05。
[16] YAN N, FENG Z G, YAN G T, et al. Effect of repeated hypoxia preconditioning on renal ischemia-reperfusion-induced hepatic dysfunction in rats[J]. J South Med Univ, 2015, 35(1):149-153.
[17] MA H J, LI Q, MA H J, et al. Chronic intermittent hypobaric hypoxia ameliorates ischemia/reperfusion-induced calcium overload in heart via Na/Ca2+exchanger in developing rats[J]. Cell Physiol Biochem, 2014, 34(2):313-324.
[18] KANEKAR S, BODGANOVA O V, OLSON P R, et al. Hypobaric hypoxia induces depression-like behavior in female sprague-dawley rats, but not in males[J]. High Alt Med Biol, 2015, 16(1):52-60.
[19] KUSHWAH N, JAIN V, DEEP S, et al. Neuroprotective role of intermittent hypobaric hypoxia in unpredictable chronic mild stress induced derression in rats[J]. PLoS One, 2016, 11(2):e0149309.
[20] XU K, LAMANNA J C. Short-term hypoxic preconditioning improved survival following cardiac arrest and resuscitation in rats[J]. Adv Exp Med Biol, 2014(812):309-315.
[21] PRPROKOV V V, GOLDOBENKO G V, NIKOLAEV A V, et al. Long-term results of surgery and preoperative hypoxyradiotherapy for colorectal cancer[J]. Vopr Onkol, 2011(57):99-101.
[22] 孙衍伟,安永恒. 低氧放疗对中晚期胰腺癌的放射防护作用[J]. 中华胰腺病杂志,2013, 13(1):40-41.

