多孔明胶微球对大鼠脂肪干细胞的生物相容性实验
杨 轩,孟昊业,刘 伟,鲁长风,全 琦,孙 逊,卫光星,杜亚楠,彭 江,汪爱媛解放军总医院 骨科研究所/北京市再生医学重点实验室/全军战创伤重点实验室,北京 0085;清华大学,北京 0008;南开大学,天津 0007;部队,山西大同 07000
种子细胞和生物支架材料的选择是组织工程治疗的两大基本要素。脂肪间充质干细胞(adipose-derived stem cells,ADSCs)具有可控性高、潜在致瘤风险低、来源广泛、伦理争议少、低免疫原性、分离培养方法简单等优点,被广泛应用于组织工程治疗领域[1-7]。明胶是胶原部分水解而得到的一类蛋白质,是一种天然的高分子材料,其化学结构与胶原相似,其降解产物易被吸收而不易产生炎症反应,有利于细胞增殖和黏附,具有良好的生物相容性,是理想的生物组织工程材料[8-9]。最新研究表明,利用明胶制成的微球可以明显改善微环境氧浓度,为干细胞提供营养支持,增加细胞成活概率,提高细胞增殖能力[10-11]。本研究拟采用多孔明胶微球作为支架,选用脂肪间充质干细胞作为种子细胞,探讨两者之间生物相容性,为进一步治疗骨科损伤确定实验基础。
材料和方法
1 实验动物和材料 5只2 d龄雄性SD乳鼠均购自解放军军事医学科学院实验动物中心;DMEM培养基(Hyclone,美国);PBS缓冲液(Hyclone公司,美国);无水乙醇(分析纯AR,北京化工厂,中国);0.05%胰酶(Gibco,US);胎牛血清(Gibco,美国);Ⅱ型胶原酶(Sigma,美国);青/链霉素(双抗)混合液(Gibco,美国);LIVE/DEAD染色试剂盒(Invitrogen);MTT试剂(Amresco,美国);大鼠脂肪间充质成骨、成软骨和成脂诱导试剂盒(Cyagen,美国);多孔明胶微球由清华大学制备和提供。
2 扫描电镜观察多孔明胶微球 扫描电镜(Hitachi S-4800)观察多孔微球微观结构和孔径大小。
3 大鼠脂肪间充质干细胞的分离、培养和三系诱导 取SD雄性2 d大鼠3只,颈椎脱臼法处死后,75%乙醇浸泡消毒5 min后转移入超净台。无菌条件下取出腹股沟脂肪组织,用含5%双抗的PBS漂洗3遍。用已灭菌的眼科剪将脂肪组织剪成1 mm3的碎块,移入锥形瓶,加入10倍脂肪体积的含0.1%Ⅱ型胶原酶的DMEM,37℃恒温水浴中震荡消化20 min。收集消化液1 700 r/min离心5 min,弃上清。用间充质干细胞专用培养基重悬沉淀,接种于6 cm培养皿,置于37℃、5% CO2细胞培养箱中培养,48 h后首次换液。倒置显微镜下观察细胞形态及生长情况,细胞达80%左右融合时,用0.25%胰蛋白酶-EDTA进行消化,以1∶2传代。取P3代ADSCs,分别按照成脂、成软骨和成骨的相应说明书方法进行三系诱导分化。诱导结束后,分别进行油红O、阿尔新蓝、茜素红染色,倒置显微镜下观察、拍照。
4 ADSCs复合微球实验 采用60Co照射的方法灭菌微球。取P2代ADSCs,胰酶消化,制成细胞密度为107/ml的细胞悬液,吸取200μl滴加于20 mg经消毒的微球上,静置复合2 h后,转移至六孔板中,加入培养基,置入37℃、5% CO2细胞培养箱中培养。
5 细胞增殖实验 取上述复合有细胞的微球,置于96孔板中培养,加入100μl培养液,按上述微球复合细胞比例计算细胞数,使每孔初始细胞数约为2×103个,设5个复孔,此为微球复合细胞组。再取P2代ADSCs,胰酶消化,计数,置入96孔板培养,每孔初始细胞数为2×103个,设5个复孔,此为单纯细胞对照组。按照MTT试剂方法操作,酶标仪测定两组分别在1 d、3 d和5 d时490 nm波长下的OD值。
6 细胞毒性实验 用含10%胎牛血清和1%双抗的DMEM培养基按照ISO10993标准制备浸提液,无菌封装,4℃保存。取第3代ADSCs,胰酶消化,计数,接种于96孔板,每孔2×103/100μl,共10孔。然后移除上清,向其中5孔加入浸提液,每孔100μl,此为浸提液组(100% leach liquor)。另外5孔都加入正常的干细胞培养基,每孔100μl,作为阴性对照组(Negative control)。按照MTT试剂方法操作,酶标仪测定两组分别在1 d、3 d和5 d时490 nm波长下的OD值。
7 激光共聚焦显微镜观察细胞增殖活性 分别在微球复合细胞后第2天和5天,使用LIVE/DEAD试剂盒,按照说明书进行染色,采用激光共聚焦显微镜(Olympus FV1000)观察细胞在微球上的形态、死活及增殖情况。
8 统计学分析 运用SPSS17.0统计学软件进行分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
1 多孔明胶微球的微观结构 普通光学显微镜和扫描电镜结果显示多数微球直径为100 ~ 400μm,扫描电镜结果显示微球孔径为20 ~ 90μm,孔隙率约为93%(图1)。
2 ADSCs形态学观察 ADSCs在P0、P1、P2代都呈长梭形,少量细胞为多角形、圆形;细胞培养3 d后,细胞数量明显增多,融合率达到80% ~90%,细胞呈旋涡状生长,部分细胞集落间有融合现象 (图 2)。
3 ADSCs的三系分化诱导结果及鉴定 成脂诱导10 d后,大部分细胞内出现圆形脂滴,油红O染色后,脂滴呈红色;成软骨诱导3周后,细胞团聚集成小球,阿尔新蓝染色后成,基质呈浅蓝色;成骨诱导15 d后,细胞呈层状、结节状生长,可看到明显的钙沉积结节,茜素红染色呈红色(图3)。
4 细胞增殖实验和毒性实验 MTT实验显示,浸提液组与阴性对照组的OD值随着培养时间递增。浸提液组与阴性对照1 d、3 d、5 d的OD值无明显差异(P均>0.05)。同时,微球复合细胞组与单纯细胞组相比,微球复合细胞组3 d和5 d的OD值明显高于单纯细胞组,有统计学差异(P均<0.05),两组的OD值随着时间延长而增加(图4)。

图 1 多孔明胶微球的形态A: 普通光镜(×200); B: 扫描电镜Fig. 1 Morphology of gelatin porous microspheresA: Optical microscope (×100);B: Scanning electron microscope
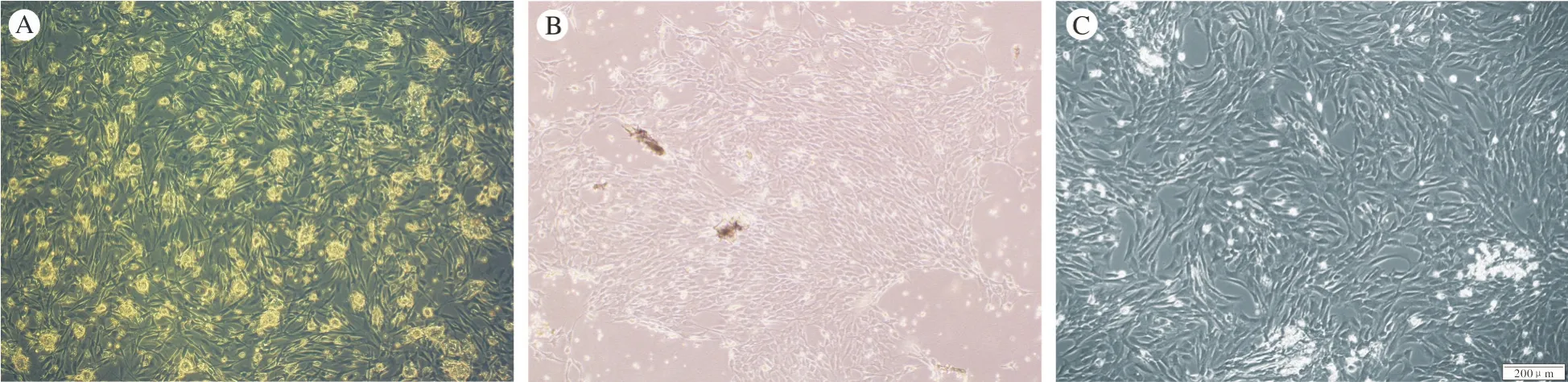
图 2 分离培养ADSCs的形态 A:原代细胞形态 (×100); B:第一代细胞形态 (×100); C:第二代细胞形态 (×100)Fig. 2 Morphology of cultured ADSCs A:Passage 0 (×100); B:Passage 1 (×100); C:Passage 2 (×100)

图 3 ADSCs的三系诱导与鉴定 A: 成脂油红O染色 (×100); B: 成软骨阿尔新蓝染色 (×200); C: 成骨茜素红染色 (×100)Fig. 3 Three lineages differentiation and corresponding identification of ADSCs A: oil red staining for adipogenic induction (×100);B: alcian blue staining for chondrogenic induction (×200); C: alizarin red staining for osteogenic induction (×100)
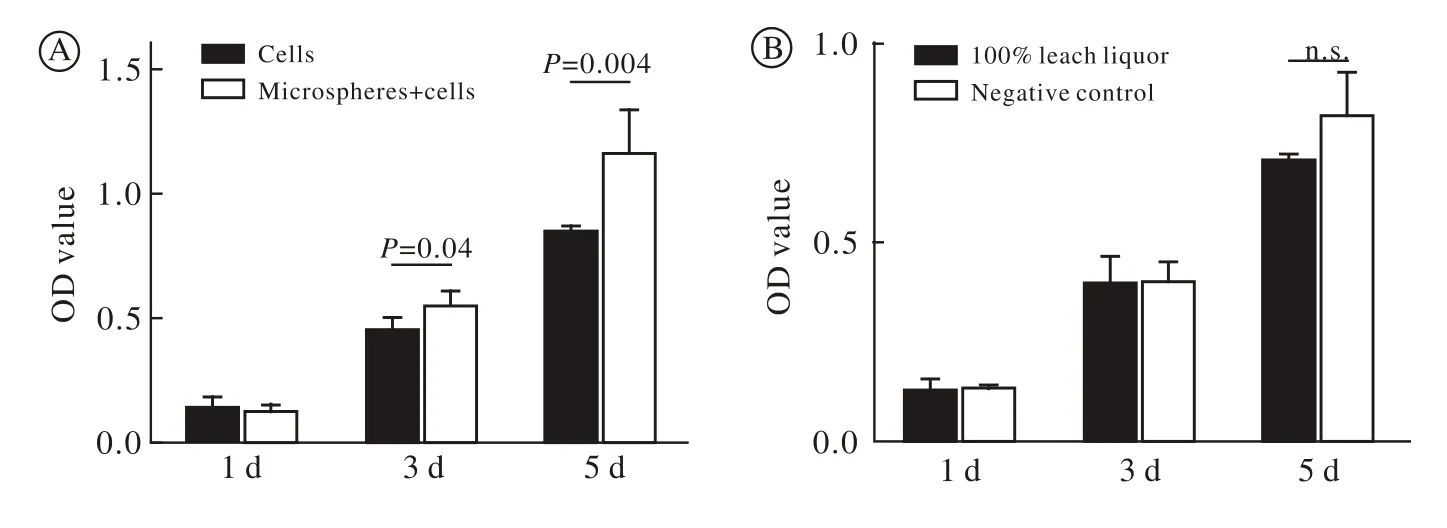
图 4 MTT检测显示细胞增殖实验(A)和毒性实验(B)(n.s.表示各个时间点,两组比较无统计学差异)Fig. 4 Cell proliferation (A) and toxicity detection (B) by MTT assay (n.s.:no significance)
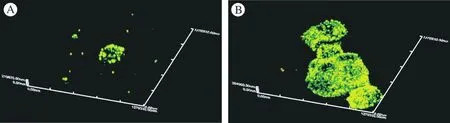
图 5 共聚焦观察细胞复合微球后增殖情况(绿色为活细胞)A:细胞复合微球2 d; B:细胞复合微球5 dFig. 5 Proliferation of cell on the microspheres observed with laser confocal. Green fluorescence indicated living cells A: cell incorporated into microspheres at 2 d; B: cell incorporated into microspheres at 5 d
5 ADSCs复合微球后增殖情况 激光共聚焦显微镜观察显示,绿色荧光为活细胞,微球复合细胞5 d时与2 d时相比,细胞数量明显增多,微球间有聚集现象,这可能与细胞外基质的大量沉积有关 (图 5)。
讨 论
目前,多选取3 ~ 4周龄SD大鼠的脂肪组织进行分离培养以获得ADSCs,所获得的ADSCs一般5 ~ 6 d传代1次,尚未见报道选用SD乳鼠[12]。本实验通过SD乳鼠所获得的细胞2 ~ 3 d就可传代1次,细胞形态以典型的长梭形为主,呈明显的漩涡状生长,符合干细胞的生长规律[13]。传代周期明显少于4周龄方法,细胞增殖明显较快,证实了所获干细胞活性较高,纯度较好。另外,SD大鼠腹股沟皮下脂肪组织位置表浅,容易分离,操作简单。周围血管筋膜较少,分离所得干细胞纯度较高,提高了脂肪组织利用率。然而,对比SD乳鼠与4周龄的大鼠脂腹股沟肪组织发现,SD乳鼠总体脂肪组织偏少,棕色脂肪所占比例较大,这是否为传代时间明显减少的原因需要进一步实验证实。是否具有多项分化潜能是鉴别间充质干细胞和普通细胞的基本共识。本实验取P3细胞分别进行了成脂、成骨、成软骨诱导,结果显示油红O、茜素红、阿尔新蓝染色均为阳性,与相关文献研究结果一致[14]。
本实验中MTT法检测显示细胞增殖结果中微球复合细胞组3 d和5 d的OD值明显高于单纯细胞组,说明多孔明胶微球可以明显提高细胞增殖能力。另外,两组都显示了良好的细胞增殖曲线。而在毒性实验中,浸提液组与阴性对照组各个时间点无显著差异,说明该材料不具有明显生物毒性。
设计生物支架的最初理念就是为细胞提供一个3D的适宜微环境,以利于细胞黏附,促进细胞增殖和细胞外基质沉淀[15]。新型的可注射微球结构可以填充任意形状的缺损从而避免了大开口外科修复移植,缩短了机体恢复时间[16]。有综述指出,细胞复合微球后所分泌形成的细胞外基质的一些特性与某些天然组织非常相似[17]。而生物材料的多孔性和大孔径不仅加快了营养物质交换,为细胞黏附增殖提供一个积极的生长微环境,而且增加了材料接触表面积,有利于生物材料降解[16-18]。Huang等[19]成功地通过明胶微球把间充质干细胞递送到皮肤伤口处,防止了细胞流失,促进了伤口愈合和瘢痕形成。在猪心梗模型中,刘琼等[20]将干细胞或微载体注射到梗死区,3周的实验结果表明,在明胶微球复合干细胞组中的毛细血管密度明显多于单纯细胞组,并且DAPI标记的干细胞明显更多。Li等[21]报道通过选取明胶多孔微球支架材料用以充当递送间充质干细胞的运输工具,不仅可以防止细胞流失,而且实现了细胞的大量扩增,同时保护干细胞分泌功能。本实验首次探讨了多孔明胶微球对大鼠脂肪干细胞的相容性。实验所用微球具有大孔径,高孔隙率的特性,保证了细胞生长微循环营养物质的及时流通和更新,提高了细胞增殖能力。共聚焦观察显示5 d时微球上的细胞数量明显多于2 d时。
综上所述,本实验选取ADSCs作为种子细胞,明胶多孔微球作为材料支架,初步验证了细胞与材料之间良好的生物相容性以及多孔微球对细胞黏附、增殖和分泌外基质的促进作用。为下一步的体内注射植入奠定了基础。
1 Piryaei A, Valojerdi MR, Shahsavani M, et al. Differentiation of bone marrow-derived mesenchymal stem cells into hepatocyte-like cells on nanofibers and their transplantation into a carbon tetrachlorideinduced liver fibrosis model[J]. Stem Cell Rev, 2011, 7(1):103-118.
2 Ma S, Xie N, Li W, et al. Immunobiology of mesenchymal stem cells[J]. Cell Death Differ, 2014, 21(2): 216-225.
3 Li KC, Chang YH, Hsu MN, et al. Baculovirus-Mediated miR-214 Knockdown Shifts Osteoporotic ASCs Differentiation and Improves Osteoporotic Bone Defects Repair[J]. Sci Rep, 2017, 7(1):16225.
4 Watanabe Y, Sasaki R, Matsumine H, et al. Undifferentiated and differentiated adipose-derived stem cells improve nerve regeneration in a rat model of facial nerve defect[J]. J Tissue Eng Regen Med,2017, 11(2): 362-374.
5 Pers YM, Rackwitz L, Ferreira R, et al. Adipose Mesenchymal Stromal Cell-Based Therapy for Severe Osteoarthritis of the Knee: A Phase I Dose-Escalation Trial[J]. Stem Cells Transl Med, 2016, 5(7): 847-856.
6 Deng D, Wang W, Wang B, et al. Repair of Achilles tendon defect with autologous ASCs engineered tendon in a rabbit model[J].Biomaterials, 2014, 35(31): 8801-8809.
7 张泽宇, 苗迎春, 张威, 等. 脂肪间充质干细胞移植对大鼠心肌缺血再灌注后炎症反应及心脏功能的影响[J]. 解放军医学院学报, 2016, 37(4): 381-385.
8 Kriebel A, Hodde D, Kuenzel T, et al. Cell-free artificial implants of electrospun fibres in a three-dimensional gelatin matrix support sciatic nerve regeneration in vivo[J]. J Tissue Eng Regen Med,2017, 11(12): 3289-3304.
9 Xue D, Zhang W, Chen E, et al. Local delivery of HMGB1 in gelatin sponge scaffolds combined with mesenchymal stem cell sheets to accelerate fracture healing[J]. Oncotarget, 2017, 8(26):42098-42115.
10 Hayashi K, Tabata Y. Preparation of stem cell aggregates with gelatin microspheres to enhance biological functions[J]. Acta Biomater,2011, 7(7): 2797-2803.
11 韩钊, 刘兴炎, 厉孟, 等. 载骨髓间充质干细胞明胶微球的制备[J]. 军医进修学院学报, 2012, 33(5): 512-515.
12 刘琴, 王丽平, 陈芳, 等. 悬浮组织块法分离培养SD大鼠脂肪干细胞的实验研究[J]. 中国免疫学杂志, 2017, 33(8): 1197-1200.
13 Cai YN, Yuan XD, Ou Y, et al. Apoptosis during β-mercaptoethanol-induced differentiation of adult adipose-derived stromal cells into neurons[J]. Neural Regen Res, 2011, 6(10):750-755.
14 Gomathysankar S, Halim AS, Yaacob NS, et al. Compatibility of Porous Chitosan Scaffold with the Attachment and Proliferation of human Adipose-Derived Stem Cells In Vitro[J]. J Stem Cells Regen Med, 2016, 12(2): 79-86.
15 Van Wezel AL. Growth of cell-strains and primary cells on microcarriers in homogeneous culture[J]. Nature, 1967, 216(5110):64-65.
16 Liu X, Jin X, Ma PX. Nanofibrous hollow microspheres selfassembled from star-shaped polymers as injectable cell carriers for knee repair[J]. Nat Mater, 2011, 10(5): 398-406.
17 Zhang Z, Eyster TW, Ma PX. Nanostructured injectable cell microcarriers for tissue regeneration[J]. Nanomedicine (Lond),2016, 11(12): 1611-1628.
18 Ma PX. Biomimetic materials for tissue engineering[J]. Adv Drug Deliv Rev, 2008, 60(2): 184-198.
19 Huang S, Wu Y, Gao D, et al. Paracrine action of mesenchymal stromal cells delivered by microspheres contributes to cutaneous wound healing and prevents scar formation in mice[J].Cytotherapy, 2015, 17(7): 922-931.
20 刘琼, 赵世华, 陆敏杰, 等. 细胞因子微球加强骨髓间充质干细胞移植对猪心肌梗死的疗效[J]. 中华心血管病杂志, 2009, 37(3): 233-239.
21 Li Y, Liu W, Liu F, et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia[J]. Proc Natl Acad Sci U S A, 2014, 111(37): 13511-13516.

