两种制备鸡肝癌细胞染色体方法的比较
汪伟伟,张文玲,王晓菲,张晨晰,张立文,田亚平
解放军总医院,北京 100853 1转化医学实验室;2临床检验科
禽类作为重要的经济动物和理想的生物反应器,具有广阔的应用前景[1-2]。以禽类模型建立相应的细胞系,可以用于多种病毒的增殖和纯化[3],还可以用来评价环境中化学物质的毒性作用[4]。与哺乳动物原代细胞相比,用细胞系生产制造疫苗具有更突出的优势[5]。特定的细胞系用于疫苗生产前,需按规定对其进行全面鉴定并建立细胞种子库[6],且传代细胞在一定代次后细胞的致瘤性会增强[7]。选择一种永生性细胞系代替原代细胞增殖病毒用于疫苗生产非常必要,而细胞核型反映物种的种质特性,是再现性很高的细胞遗传学信息,可以证明传代细胞的稳定性[8-12]。为了保证细胞系的纯净和安全性,确保细胞系有清楚的遗传背景,对细胞系进行染色体核型分析必不可少[5-6]。鸡肝癌细胞系(LMH)最早是由日本于1981年建立,目前常用于疫苗生产制造及药物筛选体外实验[13]。Kawaguchi等[14]通过对LMH细胞系第30代和第120代的细胞核型分析得到该细胞系的染色体数目为88 ~ 124条,并且都含有6条标记染色体。证明了该细胞系稳定性好,符合生产生物制品对细胞核型的要求。但Kawaguchi等制备的染色体短小,分散困难,显带后难分辨,且重复性较差,很难为LMH细胞系在生物领域的扩展应用奠定稳定基础。因此,我们总结了羊水细胞、人类淋巴系统肿瘤细胞以及鸡外周血细胞的染色体核型制备方法[15-17],建立了两种新的LMH细胞染色体制备方法,并对这两种方法进行了比较。
材料和方法
1 细胞及试剂 由北京市农林科学院畜牧兽医研究所提供的24瓶贴壁生长的鸡肝癌细胞。秋水仙素浓度为250μg/ml;固定液(甲醇∶冰乙酸=3∶1);低渗液:0.6%枸橼酸钠;缓冲液:磷酸氢二钾(1.79 g)和磷酸二氢钠(0.78 g),加入1 L超纯水配制而成;Giemsa染液;0.1%明胶;10%NaHCO3;0.5%的胰酶溶液。
2 分组 将24瓶细胞系分为两组,每组12瓶。一组在细胞传代前,先用0.1%明胶覆盖培养瓶底1 h;另一组直接接种细胞于培养瓶中。所有细胞传代后均培养72 h。明胶处理后的细胞采用原位法制备染色体,不作处理一组则采用滴片法制备染色体。
3 原位法制备染色体 向LMH细胞培养液中加入250μg/ml的秋水仙素150μl,轻轻混匀,放回37℃ CO2恒温箱中继续培养60 min。弃去培养液,加入37℃预温的0.6%枸橼酸钠9 ml;在37℃恒温环境中低渗处理40 min。每个培养瓶中加入2 ml新配制的固定液(甲醇∶冰乙酸=3∶1),静置2 min;吸取2 ml悬液后再加入2 ml固定液,静置2 min;重复以上步骤3次。弃去瓶中液体,加入9 ml固定液,放入4℃冰箱中低温固定50 min。弃去瓶中固定液,放入65℃烤箱中老化3 h,自然冷却待消化。取0.5%胰酶溶液1 ml和10% NaHCO31 ml,加入盛有50 ml 0.9%氯化钠注射液的染缸中混匀,置37℃预温。用吸管吸取5 ml的胰酶混合液迅速加入到培养瓶中,让混合液均匀铺在瓶底。消化50 s,倒掉瓶中的消化液,加入Giemsa染液染色18 min。
4 滴片法制备染色体 向LMH细胞培养液中加入250μg/ml的秋水仙素150μl,轻轻混匀,放回37℃ CO2恒温箱中继续培养60 min。弃去培养液,加入37℃预温的0.6%枸橼酸钠9 ml;在37℃恒温环境中低渗处理40 min。轻轻吹打细胞及瓶壁,将悬液倒入15 ml离心管中,加入1 ml新配制的固定液(甲醇:冰乙酸=3:1),轻轻吹打混匀,2 000 r/min离心10 min。弃上清,加入5 ml固定液,轻轻吹打混匀后,立即2 000 r/min离心10 min。重复以上步骤2次,弃上清,加入适量的固定液,制成悬液。吸取少量细胞悬液,滴3 ~ 4滴于冰水浸泡过的载玻片上,在酒精灯上来回过火数次,将玻片放入65℃烤箱中烤片3 h,自然冷却待消化。取0.5%胰酶溶液1 ml和10% NaHCO31 ml,加入盛有50 ml 0.9%氯化钠注射液的染缸中混匀,置37℃预温。将玻片放入胰酶混合液中消化10 s,用0.9%氯化钠注射液涮洗后,Giemsa染液染色5 min。
5 统计学分析 所有数据均使用SPSS21.0统计软件分析,组间核型数量及染色体相对长度比较采用t检验,染色体数目采用χ2检验,P<0.05为差异有统计学意义。
结 果
1 核型数量比较 在10倍物镜下对两种方法制备的染色体进行观察,发现原位法制备的染色体核型数量明显多于滴片法。在20倍物镜下,我们对两种方法制备的玻片各选取了10个视野,将每个视野中发现的核型数量进行统计,结果显示原位法制备的染色体核型数量远远高于滴片法(P<0.05),差异有统计学意义。见图1、表1。
2 染色体数目比较 两种方法制备的染色体均通过100倍物镜进行观察,镜下可见原位法制备的核型较为紧密,滴片法制备的核型较为分散。从两种方法制备的核型中各选取50个条带良好的核型,记录每个核型中染色体条数,将相同染色体条数的核型归为一种类型,统计不同染色体条数的出现频数。结果显示原位法制备的核型类型多于滴片法(P=0.123),但差异无统计学意义。见图2、图3、表2。
3 染色体形态比较 从两种方法制备的玻片中各选取10组条带清晰的细胞核型,根据染色体的条带和形态将染色体分别进行排列,观察比较两种方法制备的核型,均能发现6条标记染色体,8对大染色体和一对性染色体,其余为小染色体及微小染色体。排列好的核型列于图4中。
4 染色体相对长度比较 通过北昂分析软件测量两种方法制备的各条大染色体、性染色体和标记染色体的相对长度,以-x±s表示,两种方法获得的同组别染色体相对长度无统计学差异(P>0.05)。见表3。
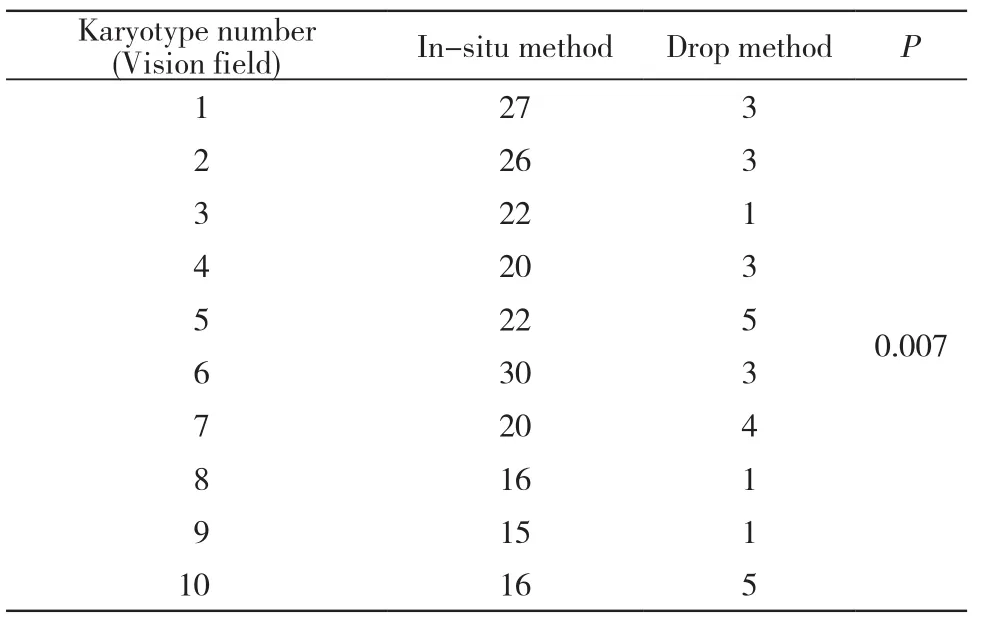
表1 两种方法在20倍物镜下染色体核型数目比较Tab. 1 Comparison of karyotype number between two methods under 20 times objective lens
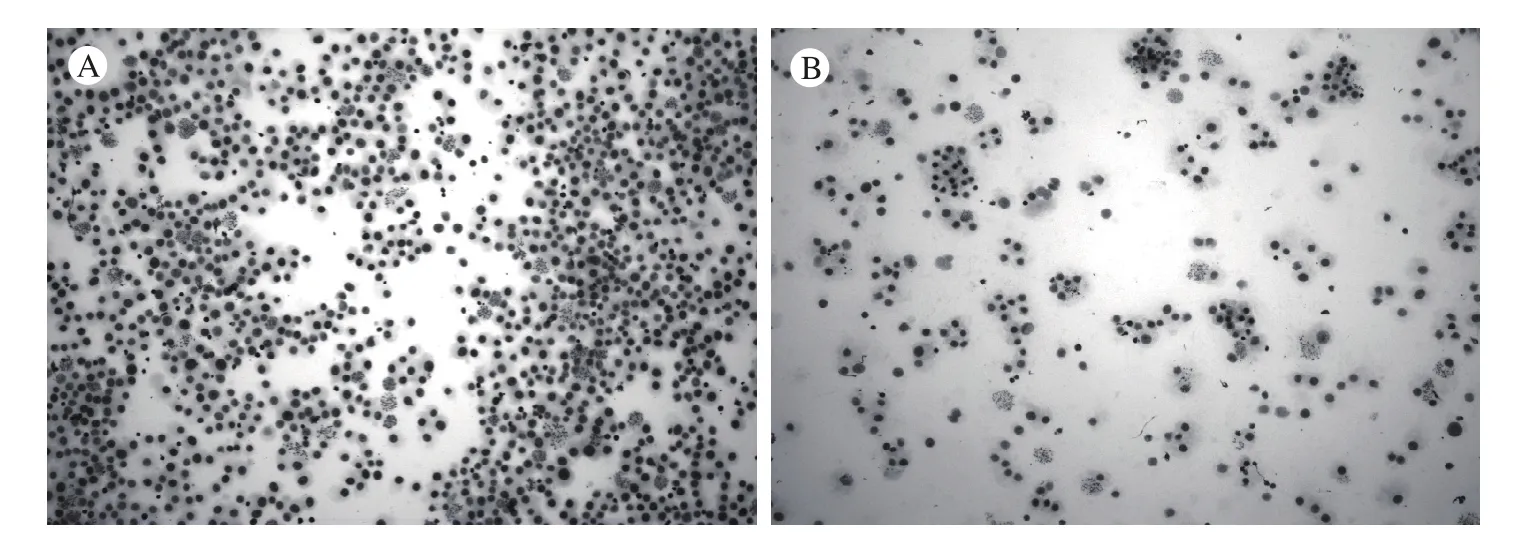
图 1 10倍物镜下两种方法制备的染色体核型数量比较A:原位法;B:滴片法Fig. 1 Comparison of karyotype number between two methods under 10 times objective lensA: in-situ method; B: dropmethod
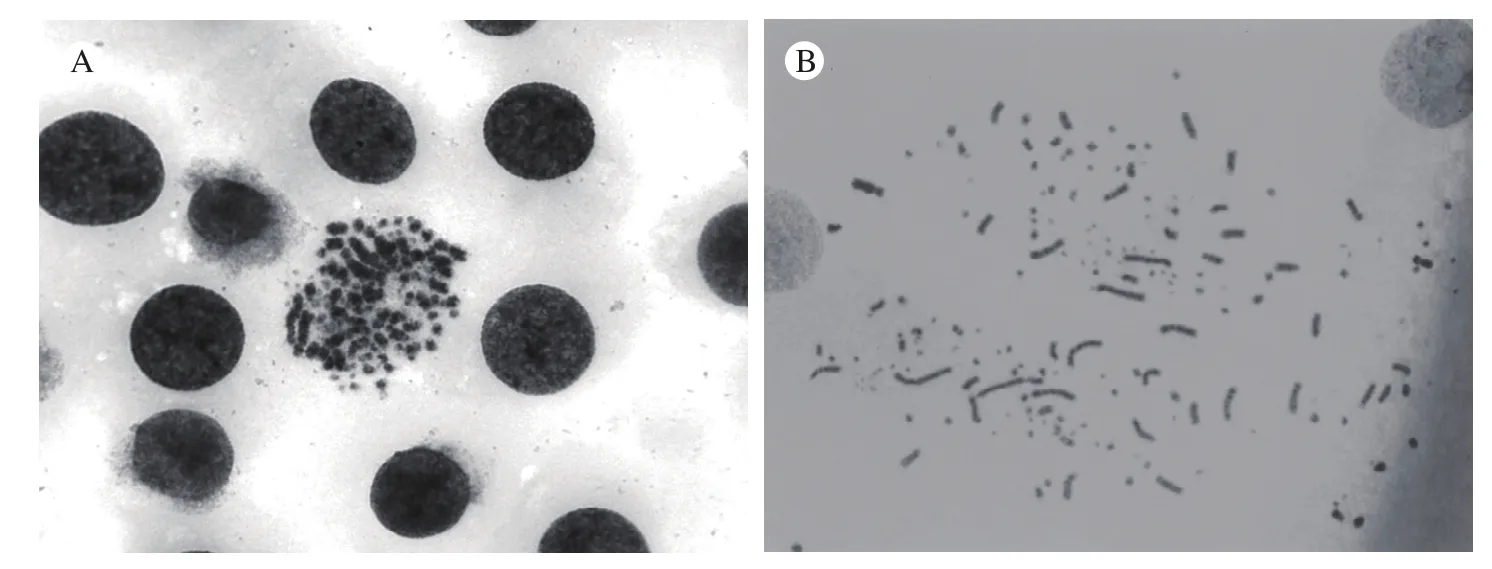
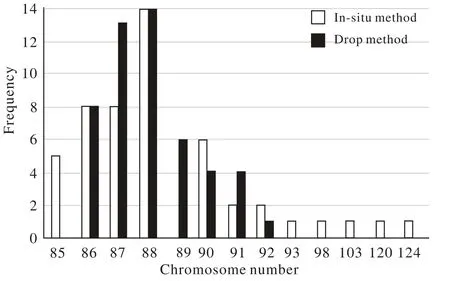
图 3 两种方法制备的所含不同染色体数目的核型分布Fig. 3 Comparison of karyotype distribution between two methods
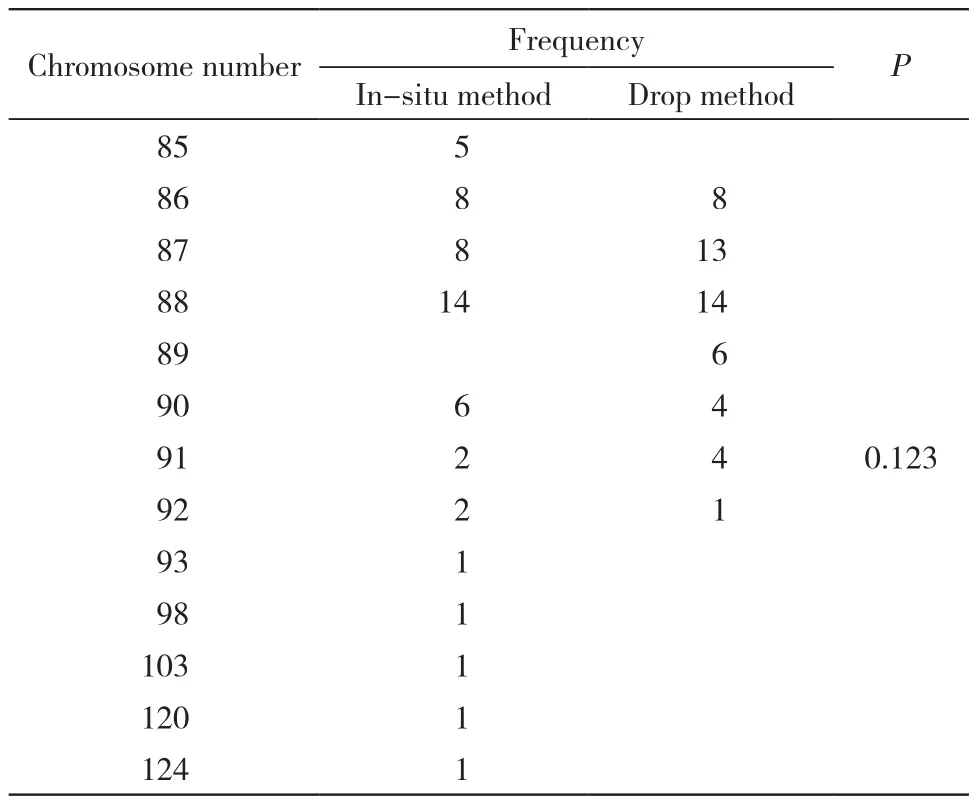
表2 两种方法制备的不同染色体条数的核型种类及出现频数Tab. 2 Types and occurrence frequency of karyotypes prepared by two methods

表3 两种方法制备的LMH细胞染色体相对长度比较Tab. 3 Comparison of average chromosome relative length with two methods (-x±s, %)
讨 论
染色体核型分析可以用于证明杂交次瘤细胞是两亲本细胞产物[18-19],可以排除细胞在培养过程中的污染和细胞株的错误鉴别[20-23]。在众多的细胞鉴别技术中,染色体可以通过倍型、带型检查是否有缺失和突变[24-25]。目前有关鸡的染色体制备及核型分析已有较多报道,但LMH细胞的染色体制备及核型分析罕见。
LMH细胞属于贴壁培养细胞,Kawaguchi等[14]采用0.2%胰酶将细胞从瓶壁上消化下来,但胰酶消化对温度、细胞集落大小、消化时间长短都要有所考虑,难以控制把握[15]。我们发现LMH细胞贴壁并不牢固,在低渗处理时细胞就已经从培养瓶上脱落,因此在低渗后只需要将脱落细胞转移至离心管中即可,并不需要胰酶处理。原位法为了让细胞贴壁牢固,增加细胞收获的可靠性,在细胞培养前就用0.1%明胶铺于培养瓶底。有文献指出转移贴壁细胞时,容易导致细胞的丢失、核型减少[26]。两种制备方法结果也显示原位法收获的核型数量大于滴片法,且存在显著差异。
秋水仙素和染色体长短有密切关系。秋水仙素加入过量或处理时间过长,可导致分裂细胞多,染色体凝集和收缩变小,或发生异常分裂现象,甚至染色体破碎,不宜用于染色体形态观察及计数;秋水仙素加入太少或处理时间偏短可导致染色体形态偏长或无中期分裂象[27]。我们参考相关文献[28-29],结合本实验室对人类外周血染色体核型的制备经验,将两种方法加入的秋水仙素浓度均定为250μg/ml,加入150μl作用60 min。
低渗处理主要用于诱导淋巴细胞膨胀,在后期滴片时有利于染色体从细胞中分散出来。有学者通过细胞膜功能对低渗液和固定液的作用进行了阐述[30]。为保证细胞不会因低渗时间过长而导致染色体分散过度,甚至细胞破碎溶解,本实验的两种方法均采用0.6%枸橼酸钠低渗40 min。
固定液是甲醇与冰醋酸的混合液,目的是维持染色体的形态。原位法采用2 ml固定液分3次将低渗液置换出来,然后用9 ml固定液直接作用50 min;滴片法则需要经过3次固定和离心的过程,较原位法烦琐。
滴片是滴片法中的一个很重要环节,Spurbeck等[31]首次提出了染色体分散动力学,对染色体分散过程做出了详细阐述。我们采用冷冻湿片,经过多次尝试找到最适高度和过火时间,使染色体铺展分散良好,但是这一过程很难控制,过于分散的核型不利于染色体计数。而原位法则省略了此步,分散更为稳定。
两种方法制备的核型结果与文献[14]基本相同,但不完全一致,这是由于微小染色体较多,部分染色体未显色,并且容易发生罗伯逊易位,滴片法中微小染色体又极易随液体漂流造成丢失,此外还容易将部分未溶解的染料颗粒及其他杂质误认为是微小染色体[17,32]。
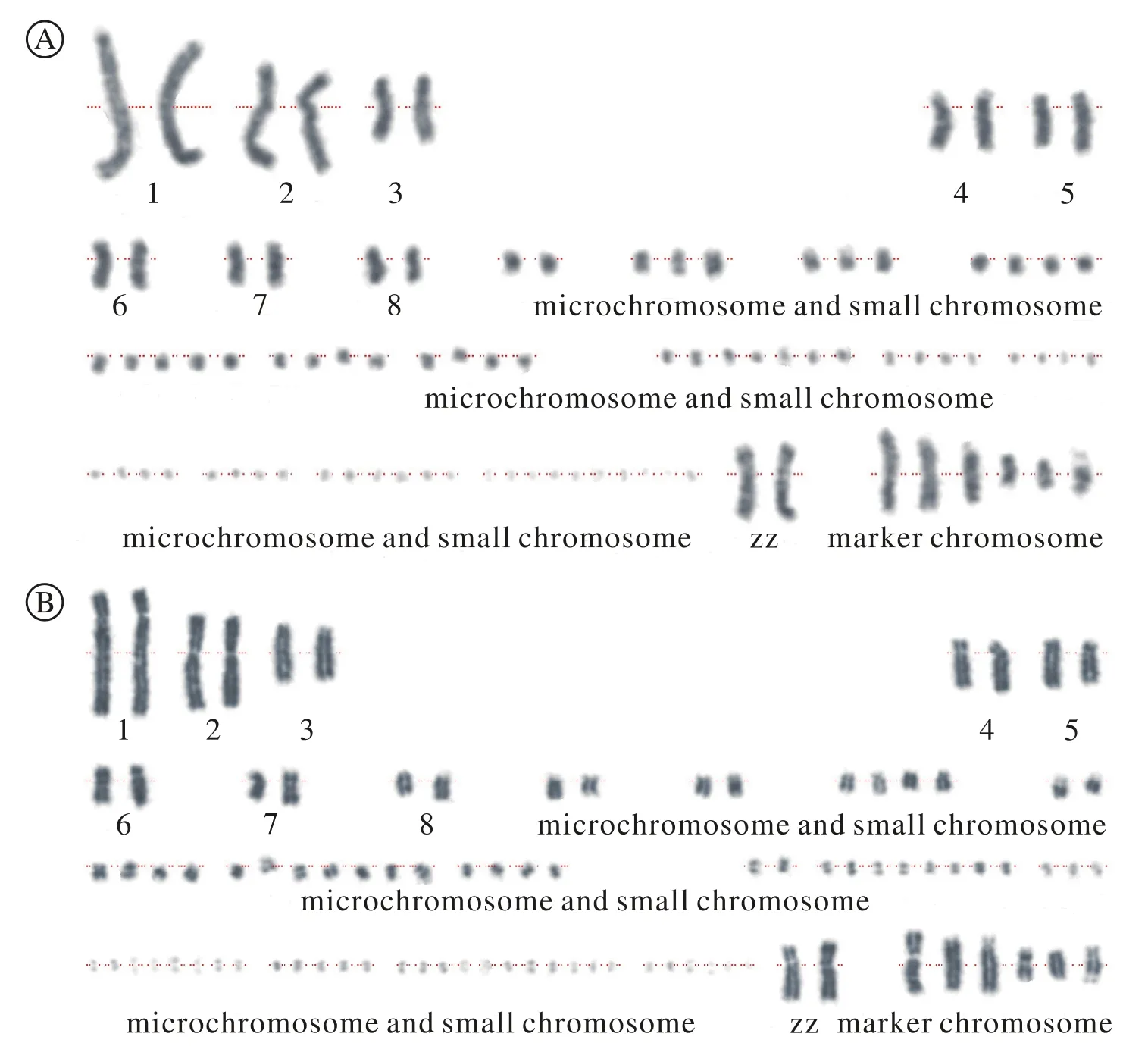
图 4 两种方法制备的核型图比较A:原位法; B:滴片法Fig. 4 Comparison of karyotypes of two methodsA: in-situ method; B: drop method
LMH细胞系来源于鸡的肝癌细胞,部分染色体保留了鸡类染色体的形态。不同的文献对鸡的染色体的描述并不相同。李军和赵金良[33]认为鸡的1号染色体为亚中央着丝粒染色体;部分文献指出2号染色体为亚中央着丝粒染色体[34-36];还有一部分文献则认为7号染色体为亚中央着丝粒染色体[36-38];徐琪等[39]则认为9号染色体为亚中央着丝粒染色体。两种方法制备的LMH细胞核型中,均可以看见8对大染色体和一对性染色体,大染色体中可见4对亚中央着丝粒染色体,与鸡的染色体核型相近,与文献[14]报道结果一致。
笔者通过反复实验,证明原位法较滴片法可收获更多的核型,便于染色体计数,提高了分析效率和准确性,因而优于滴片法,值得推广。
1 王令, 张涛, 尹亚军. 逆转录病毒载体介导的转基因鸡研究进展[J]. 中国家禽, 2015, 37(14): 44-48.
2 靳锴, 汪怡临, 左其生, 等. 睾丸注射Mx-NA双基因制备抗病转基因鸡的研究[J]. 中国家禽, 2014, 36(14): 8-12.
3 付智财, 王家敏, 令世鑫, 等. BHK-21细胞库的建立及其生物学特性鉴定[J]. 山西农业科学, 2013, 41(8): 808-812.
4 蒋鹏, 盛南, 王建设, 等. 五氯酚(PCP)对鸡肝癌细胞(LMH)毒性效应的机制研究[J]. 生态毒理学报, 2017(3): 373-381.
5 栾海萍, 杨素霞, 陈红岩. MDBK细胞传代中染色体畸变发生的研究[J]. 中国优生与遗传杂志, 2015, 23(6): 30-32.
6 令世鑫, 沈武玲, 徐水林, 等. Marc-145细胞库的建立及其生物学特性研究[J]. 西北民族大学学报:自然科学版, 2014, 35(1):69-74.
7 Wei BY, Tan TS, Hassan SS. Replication of a Malaysian Strain Avian Influenza A Virus H5N1 in Madin-Darby Canine Kidney and African Green Monkey Kidney Cells[J]. Sains Malaysiana, 2016, 45(5):787-793.
8 Glass RI, Bresee JS, Parashar U, et al. Rotavirus vaccines: past,present, and future[J]. Arch Pediatr, 2005, 12(6): 844-847.
9 刘学平, 魏至栋, 沈劲草, 等. 牛肾组织及其培养物的不同消化法效果评价[J]. 微生物学免疫学进展, 2010, 38(1): 26-31.
10 窦强, 魏至栋, 谢澎, 等. 牛肾细胞在两种不同载体中培养效果的比较[J]. 微生物学免疫学进展, 2012, 40(2): 19-22.
11 林杰, 窦强, 邢家强, 等. 牛肾细胞的冻存及复苏后连续传代的研究[J]. 中国新药杂志, 2014, 23(9): 1049-1052.
12 于漾, 毕志香, 揭鸿英, 等. DF-1细胞染色体制备及核型分析[J]. 中国家禽, 2014, 36(17): 44-46.
13 张晶晶, 陆小军, 叶奕菁, 等. Kras突变基因真核表达载体的构建及在不同肝细胞株中的表达[J]. 现代生物医学进展, 2014,14(1): 18-22.
14 Kawaguchi T, Nomura K, Hirayama Y, et al. Establishment and characterization of a chicken hepatocellular carcinoma cell line, LMH[J]. Cancer Res, 1987, 47(16): 4460-4464.
15 张玲莉, 陈小波, 严庆庆, 等. 羊水染色体制备技术改良的研究[J]. 中国优生与遗传杂志, 2014, 22(6): 41-42.
16 薛军. 造血和淋巴系统实体肿瘤染色体标本制作与分析[J].分子影像学杂志, 2016(4): 393-394.
17 李鹏姗, 雷雪芹, 徐廷生, 等. 转基因鸡的染色体核型分析[J].河南科技大学学报(自然科学版), 2016, 37(6): 77-81.
18 段舒怡, 姜平, 李玉峰, 等. O型口蹄疫病毒VP1蛋白单克隆抗体的制备与生物学特性鉴定[J]. 中国人兽共患病学报, 2007,23(3): 240-243.
19 李向茸, 冯若飞, 樊得英, 等. 脑心肌炎病毒单克隆抗体的制备与鉴定[J]. 中国兽医杂志, 2014, 50(12): 29-31.
20 钱兴丽, 宋彩花, 任芳芳, 等. 人用疫苗生产用工作细胞库Vero细胞的鉴别[J]. 中国生物制品学杂志, 2017, 30(10): 1022-1027.
21 Liu NN, Zhang SL, Chen W. The cross-contaminated cell lines of adenoid cystic carcinoma: A crucial concern[J/OL]. https://www.researchgate.net/publication/313833124_The_cross-contaminated_cell_lines_of_adenoid_cystic_carcinoma_A_crucial_concern.
22 Capes-Davis A, Theodosopoulos G, Atkin I, et al. Check your cultures! A list of cross-contaminated or misidentified cell lines[J].Int J Cancer, 2010, 127(1): 1-8.
23 Canny G. Cell line contamination and misidentification[J]. Biol Reprod, 2013, 89(3): 76.
24 谢忠平, 李琦涵, 孙茂盛. 生物制品检定手册[M]. 北京: 化学工业出版社, 2008.
25 苏强, 张晓延, 李娅亨, 等. 616名受试者染色体核型的分析[J].中国妇幼保健, 2016, 31(7): 1484-1486.
26 吴小青, 陈雪美, 谢晓蕊, 等. 原位培养载玻片法在流产绒毛染色体检测中的应用(附113例分析)[J]. 福建医药杂志, 2014,36(6): 88-90.
27 刘爱生,朱春燕. 外周血淋巴细胞培养及染色体高分辨标本制备方法[J]. 中国优生优育, 2013,19(2):82-85.
28 庄建龙, 王元白, 庄倩梅. 外周血染色体制备方法的探讨[J].国际检验医学杂志, 2015, 36(17): 2558-2560.
29 黄江玲, 林祥伟, 邱少雄, 等. 人外周血淋巴细胞培养及染色体制备的方法及成功率[J]. 中国校医, 2015, 29(7): 526-527.
30 张会勇, 王文锋. 用细胞膜知识探讨染色体制备过程中关键步骤的作用机理[J]. 生物技术世界, 2015(11): 256.
31 Spurbeck JL, Zinsmeister AR, Meyer KJ, et al. Dynamics of chromosome spreading[J]. Am J Med Genet, 1996, 61(4):387-393.
32 吴洪, 德吉巴卓, 商鹏, 等. 藏鸡的有丝分裂观察及染色体核型分析[J]. 中国畜牧兽医, 2014, 41(1): 174-177.
33 李军, 赵金良 . 麻雀核型研究的新发现[J]. 遗传, 1994, 16(2):20-24.
34 程光潮, 吴丽. 家鸡染色体的制备及其组型观察[J]. 遗传,1981, 3(1): 17-19.
35 刘蓓一, 李国祥, 秦枫, 等. 固始鸡核型、G带的研究[J]. 中国家禽, 2006, 28(6): 16-19.
36 曾养志. 家鸡 (Gallus domesticus) 和原鸡 (Gallus gallus) 的染色体及 G-带带型比较研究[J]. 云南农业大学学报, 1987, 2(2):57.
37 赵淑娟, 雷雪芹, 徐廷生, 等. 卢氏绿壳蛋鸡染色体核型与G带分析[J]. 西北农林科技大学学报(自然科学版), 2009, 37(12):34-38.
38 嵇宝华, 汤道玲, 卢克伦. 中国地方鸡种染色体研究进展[J].上海畜牧兽医通讯, 2004(5): 4-5.
39 徐琪, 谢芳, 李碧春. 禽类染色体制备及其在育种中应用[J].动物科学与动物医学, 2003, 20(2): 13-15.

