18F-AV-45和18F-FDG PET/CT联合脑显像在阿尔茨海默病中的诊断价值
常 燕, 秦永德, 张奇洲, 李毓斌, 阿米娜·依布拉音, 娜姿·伊力哈木
(新疆医科大学第一附属医院核医学科, 乌鲁木齐 830054)
阿尔茨海默病(Alzheimer disease,AD)是一种以认知功能障碍、日常生活能力下降及精神行为异常为特征的神经系统退行性疾病,是老年期痴呆中最常见的类型,大约占所有老年性痴呆患者的50%~70%。随着世界人口老龄化,AD的患病率显著增加。AD的病因至今未明,可能与衰老过程、代谢障碍、遗传、内分泌机能减退、机体解毒功能减弱等因素有关。AD的临床诊断主要依据临床病史、神经心理学、神经影像学、脑电图及脑脊液检查等,由于这些检查的灵敏度及准确率受限,AD公认的确诊依据为病理学活检,即尸检时发现老年斑(SP)、神经原纤维缠结(NFTs)和选择性神经元与突触丢失等进行诊断。其发病机理尚不明确,导致对AD的诊断严重滞后,特殊的治疗方法更是不可能的。目前,传统的成像技术,如X射线计算机断层扫描(CT)和磁共振成像(MRI)只能在脑萎缩和脑功能改变后的患者中检测到,主要用于排除其他潜在疾病和发现AD的特异性影像学表现,而单光子发射计算机断层扫描 (SPECT)及正电子发射断层显像(PET)等分子显像设备能够在活体内进行早期以及无创伤的特异性神经显像及量化分析[1],已成为AD早期诊断的重要辅助手段。新型分子诊断药物Florbetapir F-18(18F-AV-45)是用于PET成像脑组织中β-淀粉样斑块检测的放射性诊断药物,国外研究对18F-AV-45在AD的诊断及鉴别诊断的作用予以了一定肯定[2-4]。本研究首先对11例临床诊断为不同程度的AD患者及13例健康对照者分别行18F-FDG检查,随后随机各挑选8例行18F-AV-45 PET显像,观察AD患者FDG脑葡萄糖代谢与AV-45 β淀粉样蛋白PET显像的特点,初步探讨18F-FDG脑代谢联合18F-AV-45 PET双显像在AD临床诊断中的应用价值。
1 资料与方法
1.1研究对象选择新疆医科大学第一附属医院2015年12月-2017年2月神经内科门诊诊断阿尔茨海默病患者11例,均进行18F-FDG PET检查。所有受试者分为AD患者(AD组)和健康对照者(HC组),均在本院行头部MRI检查,用以排除其他中枢性神经系统疾病、脑血管病或其他部位肿瘤脑转移史。本研究经本院伦理委员会批准施行。行检查前对所有受试者均作解释说明,受试者或家属签署知情同意书。
1.1.1 AD组 患者11例,其中男性7例,女性4例,年龄(68.91±8.51)岁,受教育程度平均初中毕业及以上,简易智力状态检查表(MMSE)平均评分(16.00±6.90)分,(MMSE21~26分为轻度,10~20为中度,0~9为重度)。
1.1.2 HC组 来源于神经内科门诊及体检中心健康老年人,根据病例组年龄及性别要求进行筛选并对其进行MMSE评分检查,结果≥27分者入选。最终选择13例,男性4例,女性9例,年龄(65.15±5.80)岁,受教育程度均为初中毕业及以上。
1.2纳入标准根据美国国立神经病语言障碍卒中研究所和阿尔茨海默氏病及相关疾病协会(NIN-CDS-ADRDA)标准,美国国立神经病语言障碍卒中研究所和及相关疾病AD协会(NIN-CDS-ADRDA)对AD痴呆的诊断新标准于2011年5月重新修订[5]。
1.3排除标准(1)伴确凿的脑血管病,存在多发或广泛脑梗死;(2)其他类型的痴呆:帕金森病痴呆、血管性痴呆、额颞叶痴呆、路易体痴呆;(3)有同时发生的、活动期的神经系统疾病,或非神经系统的医学共病,或有对认知功能造成重大影响的药物应用的证据;(4)对酒精过敏者;(5)左利手者;(6)有幽闭恐惧症者或其他原因不能配合检查者。
1.4方法
1.4.118F-FDG和18F-AV-45的合成18F-FDG和18F-AV-45均为本科室采用GE回旋加速器和合成器自主合成,18F-FDG放射化学纯度>95%。18F-AV-45购于江苏省原子医学研究所,由相应前体制备,最终产品放射化学纯度>95%,内毒素及细菌检测均为阴性,符合放射性药品要求。
1.4.2 PET/CT扫描方法 显像设备为美国GE Dsiacovery VCT64 PET/CT扫描仪,13例健康对照者及11例AD患者在1 w内先后接受18F-FDG PET检查,随后随机挑选8例AD患者及8例健康对照者在1 w内先后接受18F-AV-45 PET检查。18F-FDG PET/CT成像方法:静脉注射18F-FDG(185~370 MBq)于安静及暗光条件下安静休息40 min,应用3D方式动态采集10 min。PET数据经低剂量CT进行衰减校正及迭代法重建后和CT图像一同传送到Xeleris工作站进行同机图像融合,进行横断面、冠状面及矢状面多幅图像显示。18F-AV-45 PET/CT成像方法:检查前受试者空腹6 h以上,同时要求血糖水平<11.1 mmol/L,经静脉注射18F-AV-45(185~370 MBq)后25 min行动态PET发射断层扫描。受试者平躺于扫描床上,采用3D模式连续采集10 min,经滤波反投影(FBP)重建得到34帧图像。
1.5图像处理及分析方法感兴趣(ROI)半定量分析方法18F-FDG PET/CT:由3名PET/CT专业医师盲法目测分析2组受试者18F-FDG结果,在水平横断图像的相同层面上对称性的划取左、右侧大脑额叶、顶叶、颞叶、枕叶、基底节、后扣带回、楔前叶及小脑的ROI,由计算机自动测得ROI单位体积平均放射性,每个解剖结构分布测3次,取其平均值,分布计算左、右侧大脑额叶、顶叶、颞叶、枕叶、基底节、后扣带回、楔前叶及小脑的比值SUVR,作为评价局部脑葡萄糖代谢率的半定量指标;18F-AV-45 PET/CT:采用感兴趣区(ROI)技术在水平横断图像的相同层面上勾画大脑额叶、顶叶、颞叶、枕叶、基底节、后扣带回、楔前叶及小脑的ROI,获得该区域放射性计数与小脑的比值SUVR作为半定量指标进行分析。
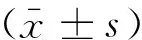
2 结果
2.12组一般资料及精神心理学检查结果比较24名受试者全部完成2种显像剂的注射、扫描及图像重建过程,并全部纳入最终分析。AD组患者MMSE评分,为(16.00±6.90)分,HC组为(28.69±1.18)分,AD组MMSE评分低于HC组,差异具有统计学意义(P<0.01)。AD组年龄及教育程度略高于HC组,但差异无统计学意义(P>0.05)。见表1。

表1 2组受试者一般资料及精神心理学检查结果比较
注:HC为健康老年志愿者;MMSE为简易智力状态检查表。
2.2HC组结果
2.2.118F-FDG PET显像结果 13例健康对照者18F-FDG PET显像表现为大脑形态如常,未见明显的脑萎缩征象,大脑皮层及两侧海马区放射性分布基本对称均匀;皮质下各神经核团(纹状体、丘脑)及脑桥显影清晰,放射性分布均匀对称;大脑各区未见明显放射性分布滞留,小脑及白质均未见异常放射性分布摄取(图1)。

图1 HC组18F-FDG PET显像图
2.2.218F-AV-45 PET显像结果 13例健康对照者18F-AV-45 PET显像表现为双侧大脑皮层各叶及皮质下结构放射性分布均匀对称,未见异常放射性滞留(图2)。

图2 HC组18F-AV-45 PET显像图
2.3AD组显像结果
2.3.118F-FDG PET显像结果 AD组与HC组比较,AD患者随着年龄增加,脑萎缩明显,主要表现为脑室系统扩大,脑裂增宽,皮质下各神经核团(纹状体、丘脑)及脑桥显影清晰,放射性分布均匀对称;小脑对称,白质未见异常放射性分布摄取。临床不同病情程度的AD患者FDG PET显像特点也不同(图3),轻度AD患者代谢减低区主要为双侧顶叶、颞叶及后扣带回,随着病情进一步进展,脑代谢减低区域逐渐扩大,楔前叶及部分额叶出现代谢减低,重度AD患者表现为全脑皮质代谢广泛减低,且以左侧为著,但小脑及基底节相对保持完好。
2.3.218F-AV-45 PET显像结果 AD 患者均显示出脑内特定区域AV-45不同程度的滞留,与FDG大脑减低区域具有较好的相关性,但是部分患者FDG分布减低区与AV-45滞留区不完全匹配,部分轻度患者额叶未见FDG摄取减低,但AV-45可见滞留。后扣带回及楔前叶出现轻度滞留(图4)。

a:患者女,68岁,MMSE评分25分,轻度AD痴呆18F-FDG PET主要表现为后扣带回及双侧顶叶的葡萄糖代谢减低。
b:患者女,60岁,MMSE评分17分,中度AD痴,呆18F-FDG PET主要表现为后扣带回及双侧颞顶叶的葡萄糖代谢显著减低

c:患者男 73岁 MMSE8分,重度AD痴呆18F-FDG PET主要表现为除了后带回、楔前叶及双侧顶叶的葡萄糖显著减低之外,双侧额叶的葡萄糖也显著减低,且以左侧尤著
图3轻、中、重度AD痴呆患者典型18F-FDGPET显像图

a: 患者女,68岁,MMSE评分25分,轻度AD痴呆18F- AV-45 PET主要表现为双侧顶叶明显滞留,双侧额叶轻度滞留,后扣带回未见明显滞留

b: 患者女,60岁,MMSE评分17分,中度AD痴,呆18F-AV-45 PET主要表现为双侧颞叶明显滞留,但扣带回未见明显滞留

c: 患者男 73岁 MMSE8分,重度AD痴呆18F-AV-45 PET主要表现为除了后带回及双侧顶叶滞留之外,双侧额叶明显滞留,且以左侧尤著
图4轻、中、重度AD痴呆患者典型18F-AV-45PET显像图
2.4定量分析结果AD组与 HC组 14 个大脑测试区域的SUVR见表2、3。AD组与HC 组比较,患者双侧额叶、顶叶、颞叶、后扣带回与楔前叶均出现葡萄糖代谢差异及一定程度的AV-45 滞留,差异具有显著性(P<0.01),而枕叶及基底节未见明显差异(P>0.05)。
3 讨论
目前,针对阿尔茨海默病的早期诊断仍存在一些困难,而存在的这些问题又难以进行定量分析,因此,对于是否一定要进行早期筛查存在很大争议[6]。据统计数据显示,截止到2030年,全世界范围内AD患者总计将到达6 300万人,且多发于发展中国家,其中中国AD患者约有800万[7]。阿尔茨海默病的主要神经病理学特征包括老年斑、神经元纤维缠结、神经元的减少颗粒空泡变性及淀粉样血管性病变。一项多中心大样本研究发现,AD患者18F-FDG PET显像的代谢减低区主要是双侧颞顶区、颞叶内侧、后扣带回、楔前叶,随着病情的进展,可逐渐累及额叶[8]。本研究结果显示,轻度AD患者的脑代谢减低区相对较局限,主要表现为双侧颞顶叶及后扣带回的FDG摄取减低,随着病情的进展,低代谢范围扩大,楔前叶及部分额叶出现代谢减低,重度AD患者表现为全脑皮质代谢广泛减低,且以左侧为著,但小脑及基底节相对保持完好,这与既往文献报道基本一致。近几年来,淀粉样蛋白显像研究成为热点,而淀粉样斑块显像主要被用于评价分子病理状态,同时也是评价β淀粉样蛋白在大脑沉积的重要方法之一[9], 既往的研究中应用最早且使用最多的β淀粉样代表沉积物为11C-PIB[10],但是由于其合成复杂且物理半衰期较短(20 min),很大程度上现在了临床应用,因此,通过修改其结构,研究人员研发出18F标记的类似物,18F-flutemetamol, 它们的共同点就是可以用于探测档案内淀粉样蛋白斑块的形成[11]。与11C-PIB比较,其具有合适的半衰期(110 min)便于药物的制备及适中的能量(510 MeV)是最理想的正电子显像药物, 而且与Aβ蛋白亲和性很高,特异性结合更好,更有助于评价Aβ蛋白的细微变化(如AD严重性的评估)[12]。18F-AV-45显像剂是小分子二苯乙烯类衍生物,18F-AV-45即18F-Florbetapir,它是全球首个通过美国食品药监局(FDA) 批准应用于18F标记的商品化正电子药物,在2012年4月,批准其上市,其商品名为Amyvid。研究表明[13]淀粉样PET显像阳性对于帮助诊断AD具有很高的灵敏度,Johnson等[14]对184名受试者进行18F-AV-45 PET显像,其中包括45例AD、60例MCI、79例正常对照组,研究结果显示,在AD患者中,表现为淀粉样斑块阳性的受试者约占76%,对于MCI患者而言,大约38%的患者脑内可见18F-AV 45滞留,而在正常对照组中也有14%出现了Aβ沉积,而且皮质Aβ沉积和年龄及apoE4基因之间具有明显的相关性。Chen等[15]的研究结果认为,如果将葡萄糖代谢及淀粉样蛋白斑块剂显像联合,可明显提高对AD的准确性,减低其临床漏诊及误诊的发生。在本研究中,AD患者双侧额叶、顶叶、颞叶及后扣带回均见淀粉样蛋白沉积,和健康对照组相比,半定量分析结果表明差异具有意义,但AV-45滞留区域较局限,主要是因为本研究采用采用感兴趣区(ROI)技术在水平横断图像的相同层面上勾画大脑额叶、顶叶、颞叶、枕叶、基底节、后扣带回、楔前叶及小脑的ROI,通过 SUVR作为半定量指标,未使用脑功能分析软件,没有对脑区进行细致划分,导致结果存在一定差别,同时也可能与本研究的病例数较少、纳入的患者痴呆程度不同有关。此外,本研究结果显示部分患者脑葡萄糖代谢减低区与淀粉样蛋白沉积部位不全一致,原因可能为两种显像剂示踪原理不同,氟代脱氧葡萄糖(FDG)是与葡萄糖结构类似物的放射性核素标记化合物,经静脉注射通过细胞膜上的葡萄糖转运蛋白进入细胞,再经己糖激酶磷酸化,生成6-PO-4-18F FDG,它不能通过磷酸激酶的识别,因此停止进一步的分解代谢,可在细胞中滞留几小时[16]。而AV-45可以和脑内Aβ特异性结合,故可作为Aβ特异性分子探针。

表2 2组受试者18F-FDG成像部分脑区SUVR比较
注:与HC组比较,*P<0.01。

表3 2组受试者18F-AV-45成像部分脑区SUVR比较
注:与HC组比较,*P<0.01。
尽管本研究纳入的样本数量有限,但研究结果表明,β淀粉样蛋白显像剂(AV-45)联合葡萄糖代谢显像(FDG)PET显像对AD疾病早期诊断具有一定的应用价值,但与同为淀粉样蛋白显像剂的11C-PIB相比,18F-AV-45滞留区域较局限,这可能会限制其作为斑块显像剂在临床的应用,同时本研究的不足之处在于纳入的AD样本量少,在以后的试验中将进一步扩大样本量,继续完善临床试验,客观评价18F-AV-45的在阿尔茨海默病中的临床应用价值。
参考文献:
[1] WOLK D A, KLUNK W. Update on Amyloid Imaging: From Healthy Aging to Alzheimer′s Disease[J]. Current Neurology & Neuroscience Reports, 2009, 9(5):345-352.
[2] GROTHE M J, BARTHEL H, SEPULCRE J, et al. In vivo staging of regional amyloid deposition[J]. Neurology, 2017, 89(20):2031-2038.
[3] TATENO A, SAKAYORI T, KAWASHIMA Y, et al. Comparison of imaging biomarkers for Alzheimer′s disease: amyloid imaging with [18 F] florbetapir positron emission tomography and magnetic resonance imaging voxel-based analysis for entorhinal cortex atrophy[J]. Int J Geriatr Psychiatry, 2015, 30(5):505-513.
[4] ZHU X C, WANG H F, JIANG T, et al. Effect of CR1 genetic variants on cerebrospinal fluid and neuroimaging biomarkers in healthy, mild cognitive impairment and Alzheimer′s disease cohorts.[J]. Mol Neurobiol, 2017, 54(1):551-562.
[5] WIMO A, WINBLAD B, Aguero-Torres H, et al. The magnitude of dementia occurrence in the world.[J]. Alzheimer Disease & Associated Disorders, 2003, 17(2):63.
[6] FOX C, LAFORTUNE L, BOUSTANI M, et al. Screening for dementia - is it a no brainer?[J]. Int J Clin Pract,2013, 67(11):1076-1080.
[7] HERHOLZ K, EBMEIER K. Clinical amyloid imaging in Alzheimer’s disease[J]. Lancet Neurol, 2011,10:667-670.
[8] CAROLI A, PRESTIA A, CHEN K, et al. Summary metrics to assess Alzheimer disease-related hypometabolic pattern with 18F-FDG PET: head-to-head comparison[J]. J Nucl Med,2012, 53(4):592.
[9] NASRALLAH I M, WOLK D A. multimodality imaging of Alzheimer disease and other neurodegenerative dementias[J]. J Nucl Med,2014, 55(12):2003.
[10] ZHANG S, SMAILAGIC N, Hyde C, et al. (11)C-PIB-PET for the early diagnosis of Alzheimer′s disease dementia and other dementias in people with mild cognitive impairment (MCI).[J]. Cochrane Database of Syst Rev, 2015, 1(7):CD010632.
[11] SPERLING R A, KARLAWISH J, JOHNSON K A. Preclinical Alzheimer disease the challenges ahead[J]. Nat Rev Neurol, 2013, 9(1):54-58.
[12] SAINT-AUBERT L, PAYOUX P, HANNEQUIN D, et al. MR, (18)F-FDG, and (18)F-AV-45 PET correlate with AD PSEN1 original phenotype[J]. Alz Dis Assoc Dis, 2013, 27(1):91-94.
[13] RIK V, KATARZYNA A, PATRICK D, et al. Amyloid PET in clinical practice: Its place in the multidimensional space of Alzheimer′s disease[J]. Neuroimage Clin, 2013, 2(1):497-511.
[14] JOHNSON K A, SPERLING R A, GIDICSIN C M, et al. Florbetapir (F18-AV-45) PET to assess amyloid burden in Alzheimer’s disease dementia, mild cognitive impairment, and normal aging[J]. Alzheimers Dement,2013, 9(5):S72-S83.
[15] CHEN X, ZHOU Y, WANG R, et al. potential clinical value of multiparametric pet in the prediction of Alzheimer’s disease progression[J]. PloS One, 2016, 11(5):e0154406.
[16] 李小东. 功能代谢闪烁显像靶向技术的优化及在某些难诊治疾病中的应用[D]. 天津大学, 2015.

