性别对肾血管性高血压大鼠血压及靶器官损伤的影响
邬利娅·伊明, 阿瓦古丽·达吾提, 帕提古丽·阿布拉, 阿迪力·阿不都热合曼, 刘 丹, 阿迪拉·迪里夏提, 周文婷, 艾尼瓦尔·吾买尔
(1新疆医科大学药学院药理学教研室, 乌鲁木齐 830011; 2新疆维吾尔医学专科学校, 新疆 和田 848000)
高血压是一种常见的心血管系统综合征,是多种心脑血管疾病发生发展的重要原因,约90%为原发性高血压,10%为继发性高血压。肾血管性高血压是一种单侧或双侧肾脏动脉狭窄使肾实质缺血所致的高血压,导致肾动脉狭窄的病因包括肾脏动脉粥样硬化、肾脏动脉的内膜纤维肌性增厚及多发性大动脉炎,80%患者为中青年女性[1]。二肾一夹(2K1C)肾血管性高血压大鼠是该疾病的动物模型,导致高血压形成的主要因素是肾素-血管紧张素系统(RAS)的过度激活[2-3]。已有研究发现:与同龄男性相比,绝经前女性的高血压及其他心血管系统疾病的发病率比较低,但绝经后雌激素水平降低时,高血压的发病率增加并且高于同龄男性,说明雌激素水平的变化可影响血压及心血管系统疾病[4]。至于雌激素与RAS之间的关系,不同实验室得出的研究结果有一定的差异[5-9]。本课题组前期研究结果发现,雌性原发性高血压大鼠血清雌二醇(E2)浓度与血浆血管紧张素Ⅱ(AngⅡ)的浓度呈正相关,提示在雌性大鼠中雌激素水平高时可促进AngⅡ的生成。
本研究选用10周龄Sprague-Dawley(SD)大鼠制备2K1C肾血管性高血压模型,研究肾血管性高血压形成的性别差异性;切除双侧卵巢造成雌激素水平低下,再制备2K1C肾血管性高血压模型,研究雌激素水平对肾血管性高血压形成的影响。
1 材料与方法
1.1实验动物160只10周龄健康无特定病原级(SPF)SD大鼠,雌雄各半,体质量(200±20)g,购自新疆医科大学实验动物中心。实验在新疆医科大学实验动物中心SPF级实验室进行,手术后的大鼠常规喂养。SD大鼠的使用得到新疆医科大学实验动物中心的同意,所有的操作符合动物伦理学的管理准则。
1.2实验仪器与试剂大鼠血压监测仪(上海奥尔科特生物技术有限公司),三通管及四通管(法国Plastimed公司),单通道转动器(美国Spalding Medical products),血压换能器(复旦大学电子工程系PT14M),A/D采样板(中科院声学所科声公司),JA2003型电子天平(上海天平仪器厂),超高速低温离心机(Eppendorf公司),UV-2802紫外可见分光光度计(上海尤尼柯仪器有限公司),戊巴比妥钠购自Sigma公司。大鼠AngⅡ、内皮素(ET-1)、白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的酶联免疫吸附试验(ELISA)试剂盒购自尚柏生物医学技术(北京)有限公司。
1.3实验方法
1.3.1 肾血管性高血压(2KIC)模型制备 取160只雌雄各半SPF级SD大鼠,随机分为雄性假手术(2K1C-male-sham)组、雄性手术(2K1C-male)组、雌性手术(2K1C-female)组和雌性去势手术(2K1C-VOX)组。大鼠适应性饲养1 w后,按文献[10]所述,腹腔注射戊巴比妥钠(45 mg/kg)麻醉,分离右侧肾动脉并套以U型银夹(内径为0.25 mm),完成一侧肾动脉狭窄手术,缝合切口完成肾动脉狭窄手术。假手术组所有的操作同手术组,分离肾动脉不套U型银夹,肌内注射青霉素(8万单位/只)预防感染。术后大鼠保温,清醒后每笼5只,置实验动物中心SPF级实验室常规喂养至实验结束。
1.3.2 双侧卵巢切除手术 40只雌性SD大鼠完成肾动脉狭窄手术后,按文献[11]所述,继续分离位于腰椎两侧肾脏下方的卵巢,结扎其血管及脂肪组织并切除。使腹腔脏器复位后,分层缝合腹膜组织及皮肤并消毒切口,肌肉注射青霉素(8万单位/只)预防感染。
1.3.3 大鼠血压的测定 常规喂养32 w后,大鼠用3%的戊巴比妥钠(45 mg/Kg)腹腔注射麻醉,准确称体质量,行股动脉插管,连接与大鼠血压监测系统测定血压,连续测定10 min,记录收缩压(SBP)和舒张压(DBP),高血压的成模标准为SBP>150 mmHg,戊巴比妥钠(45 mg/Kg)麻醉状态下, SBP被抑制10%[12],SBP>135 mmHg为成模标准,血压高于此标准大鼠入选,低者剔除,假手术者以SBP<126mmHg为筛选标准,高于此标准者剔除。
1.3.4 靶器官指数的测定 符合入选标准的大鼠麻醉后颈动脉插管取血制备血清和血浆,打开胸腔和腹腔,迅速取出心脏、主动脉和肾脏,用预冷的磷酸盐缓冲液(PBS)冲净血液,以滤纸吸干水分后称重。取心脏分离出左、右心室,分别称重,计算心室及左心室指数即心室重和体质量比(VW/BW)及左心室重和体质量比(LVW/BW)。取右肾吸干水分,称重计算肾指数即右肾重和体质量比(RKW/BW)。取胸主动脉,去除其粘附的脂肪组织和结缔组织,滤纸吸干水分并称重,用游标卡尺测量其长度,计算胸主动脉重和长度之比(AW/L),观察靶器官损伤程度。
1.3.5 血清及血浆的制备 经血压测定符合入选标准的2K1C大鼠,颈动脉插管取血2 mL注入试管中,室温放置1 h待凝固后分离血清,4℃ 3 000 rpm/min离心5 min,取上清液-20℃冻存;取血2 mL,注入放在冰水浴中含酶抑制剂(20 μL 3.0 mmol/L EDTA二钠,20 μL 3.4 mmol/L 8-轻基哇琳,10 μL 3.2 mmol/L二疏基丙醇)的小试管中,摇匀即刻再放回冰水中,4℃ 1 000 rpm/min离心15 min,分离血浆存放于-20℃供测定AngII;取血1 mL,迅速注入放在冰水冷却的含酶抑制剂15 μL 7.5%EDTA二钠,20 μL抑肽酶的小试管中,摇匀并迅速放回冰水中,4℃ 3 000 rpm/min离心10 min,分离血浆存放于-20℃供测定内皮素(ET-1)。
1.3.6 大鼠血清致炎因子和血浆AngII和ET-1的含量测定 ELISA法测定大鼠血清致炎因子和血浆AngII和ET的含量,按试剂盒的说明书操作。
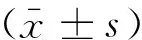
2 结果
2.1性别对2K1C大鼠血流动力学参数的影响手术后常规喂养32 w,用戊巴比妥钠麻醉行股动脉插管测定各组大鼠的血压, 2K1C组SBP、DBP高于2K1C-male-sham组(P<0.05),说明高血压模型制作成功。 2K1C-female组的SBP及DBP高于2K1C-male组和2K1C+OVX组(P<0.05),2K1C-male组和2K1C+OVX组血压差异无统计学意义,提示雌激素对肾性高血压的形成有促进作用,见表1。
2.22K1C大鼠靶器官损伤的性别差异2K1C组大鼠的VW/BW和LVW/BW高于2K1C-male-sham组(P<0.05),2K1C-female组的VW/BW和LVW/BW高于2K1C- male 和2K1C-OVX组(P<0.05),提示2K1C -female组的心肌肥厚程度最严重。2K1C- male组AW/L显著升高(P<0.05),提示2K1C- male组的血管增生最严重。2K1C组的RKW/BW高于2K1C-male-sham组(P<0.01),且在2K1C-female组增大最为明显,见表1。
2.2性别对2K1C大鼠血液中AngII、ET-1及炎症因子影响2K1C-male组血浆AngII高于2K1C-male-sham组(P<0.05),其他各组的变化差异均无统计学意义;2K1C组血浆ET-1高于2K1C-male-sham组(P<0.05),与2K1C-female组比较,2K1C-male组和2K1C-OVX组的血浆ET-1降低(P<0.05)。2K1C-OVX组血清IL-6的浓度也低于2K1C-female组和2K1C-female组(P<0.05),与2K1C-male-sham组比较,2K1C组血清TNF-α升高(P<0.05),2K1C-OVX组血清TNF-α升高作用最为明显(P<0.05),见表2。

表1 2K1C大鼠血压及靶器官损伤参数的性别差异
注:与2K1C-male -sham组比较,*P<0.05,**P<0.01; 与2K1C-male组比较,#P<0.05,##P<0.01;与2K1C-female组比较,▲▲P<0.01。

表2 2K1C大鼠血液AngII、ET-1和血清炎症因子的性别差异
注:与2K1C-sham-M组比较,**P<0.05,**P<0.01; 与2K1C-M组比较,#P<0.05,##P<0.01; 与2K1C-male组比较,▲▲P<0.01。
3 讨论
肾血管性高血压形成机制为一侧肾动脉狭窄后,肾血流量减少约30%,可刺激肾小球入球小动脉壁上的球旁细胞释放肾素,肾素可作用于血浆中由肝细胞生成的血管紧张素原,使其降解为无活性的AngⅠ[13],AngⅠ经循环到达肺脏时,经肺循环中内皮细胞表面的血管紧张素Ⅰ转化酶(ACE)[14]和局部组织中组织蛋白酶G、糜酶等AngⅡ生成酶等的作用下[15],在血循环系统和局部组织中生成AngⅡ,AngⅡ是一种活性极强的八肽,激活AngⅡ的1型受体(AT1)发挥多方面的作用,例如产生血管收缩作用,刺激肾上腺皮质释放醛固酮,激活交感神经系统,使血管平滑肌细胞及心肌细胞增生引起心血管组织重构[16]。此外,AngⅡ是一种强的致炎因子,参与炎症反应的所有过程[17]。炎症反应在高血压及其心血管并发症的发生发展过程中发挥关键的作用。
雌激素参与血压调节及炎症反应,至于雌激素和RAS之间的关系,不同的实验室得出的实验结果有一定差异[18-19]。本研究选用2K1C肾血管性高血压模型,狭窄一侧肾动脉时,对手术操作进行了一定的改进,不再将肾脏挤出切口,从肾脏侧分离肾动脉,改为不碰触肾脏,从腹主动脉侧分离肾动脉,使手术的成模率有了一定的提高。
本研究结果显示, 2K1C-female组大鼠的SBP和DBP均高于2K1C-male组和2K1C+VOX组(P<0.05),2K1C+VOX组大鼠的SBP、DBP与2K1C-male组差异无统计学意义,提示雌激素可加重肾血管性高血压大鼠的血压水平。靶器官损伤的大体观察结果显示,与2K1C-male -sham组比较,2K1C组VW/BW和LVW/BW和RKW/BW增加(P<0.05);2K1C-female组的VW/BW,LVW/BW和RKW/BW高于2K1C-male组和2K1C-OVX组(P<0.05),提示2K1C-female组的心肌肥厚程度和肾脏肿胀最为明显。代表血管肥厚的指标AW/L仅在2K1C-male组显著升高,提示雌激素可加重肾血管性高血压大鼠的靶器官损伤。
与2K1C-male-sham组相比,血清IL-6的浓度在2K1C-OVX组减少(P<0.05),在其他各组均无显著性变化;与2K1C-female组比较,2K1C-OVX组血清IL-6的浓度也减少(P<0.05)。2K1C手术可升高大鼠血清TNF-α的浓度(P<0.05); 2K1C-OVX组与其他各组相比,其血清TNF-α的浓度升高作用最为明显。
与2K1C-male-sham组比较,血浆AngⅡ浓度仅在2K1C- male组提高(P<0.05),2K1C-female组和2K1C-OVX组的变化差异无统计学意义,提示2K1C-male大鼠的血循环中的RAS激活程度高于雌性组。肾动脉狭窄早期,因肾血流量减少,RAS的激活可使血浆AngⅡ浓度应明显升高,而狭窄32 w后,主要影响因素不是循环中的AngⅡ,而是组织中的AngⅡ。2K1C组血浆ET-1的浓度明显升高,其中 2K1C-female组血浆ET-1的浓度明增加最明显。至于雌激素促进ET-1的释放的详细机制尚不确定。
综上所述,雌性2K1C大鼠的血压水平,心肌肥厚和肾脏损伤程度比2K1C雄性大鼠严重;切除雌性大鼠双侧卵巢致雌激素水平低下,肾血管性高血压的严重程度得以缓解。
参考文献:
[1] 张远慧. 肾血管性高血压[J]. 新医学, 2006, 37(5):287-289.
[2] GOLDBLATT H, LYNCH J, HANZAL R F, et al. Study on experimental hypertension: Production of persistent elevation of systolic pressure by means of renal ischemia [J]. J Exp Med, 1934, 59 (3):347-380.
[3] STOUT J M, GOUSSET M U, DRUMMOND H A, et al. Sex specific effects of heme oxygenase-2 deficienciy on renovascular hypertension[J]. J Am Soc Hyptens, 2013, 7(5):328-335.
[4] YANES L L, RECKELHOFF J F. Postmenopausal hypertension[J]. Am J Hypertens, 2011, 24(7):740-749.
[5] ALVAREZ A, HERMENEGILDO C, ISSEKUTZ A C, et al. Estrogens inhibit angiotensin II-induced leukocyteendothelial cell intER ctions in vivo via rapid endothelial nitric oxide synthase and cyclooxygenase activation[J]. Circ Res, 2002, 91 (12):1142- 1150.
[6] BEHL C, SKUTELLA T, LEZOUALC′H F, et al. Neuroprotection against oxidative stress by estrogens:structure-activity relationship[J]. Mol Pharmacol, 1997, 51 (4):535-541.
[7] SULLIVAN J C. Sex and the renin-angiotensin system:inequality between the sexes in response to RAS stimulation and inhibition[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 294 (4):R1220-R1226.
[8] RICCHIUTI V, LIAN C G, OESTREICHER E M, et al. Estradiol increases angiotensin II type 1 receptor in hearts of ovariectomized rats[J]. J Endocrinol, 2009, 200 (1):75-84.
[9] YAMALEYEVA L M, PENDERGRASS K D. Ovariectomy is protective against renal injury in the high-salt-fed older mRen2. Lewis rat[J]. Am J Physiol Heart Circ Physiol, 2007, 293(4):H2064-H2071.
[10] 古孜力努尔·依马木, 邬利娅·伊明, 依巴代提·托合提, 等. 罗勒提取物对肾性高血压大鼠的影响[J]. 新疆医科大学学报,2009,32(3): 259-264.
[11] 马虎, 阿迪力·阿不都热合曼, 秦浩, 等. 雌激素对肾血管性高血压大鼠心脏功能及氧化应激的影响[J]. 新疆医科大学学报, 2016, 39(4): 441-448.
[12] YI-MING W, SHU H, MIAO C Y, et al. Asynchronism of the recovery of baroreflex sensitivity, blood pressure, and consciousness from anesthesia in rats[J]. J Cardiovasc Pharmacol, 2004, 43(1): 1-7.
[13] POLDERMAN K H, STEHOUWER C D, VAN KAMP G J, et al. Influence of sex hormones on plasma endothelin levels[J]. Ann Int Med, 1993, 118 (6):429-432.
[14] LIN C L, DUMONT A S, WU S C, et al. 17beta-estradiol inhibits endothelin-1 production and attenuates cerebral vasospasm after experimental subarachnoid hemorrhage[J]. Exp Biol Med, 2006, 231(6):1054-1057.
[15] ROSANO G M, GEBARA O, SHEIBAN I, et al. Acute administration of 17beta-estradiol reduces endothelin-1 release during pacing-induced ischemia[J]. Int J Cardiol,2007, 116 (1):34-39.
[16] SIRAGY H M. The angiotensin Ⅱ type 2 receptor and the kidney[J]. J Renin Angiotensin Aldosterone Syst,2010, 11(1):33-36.
[17] OESTREICHER E M, GUO C, SEELY E W, et al. Estradiol increases proteinuria and angiotensin II type 1 receptor in kidneys of rats receiving L-NAME and angiotensin II[J]. Kidney Int, 2006, 70(10):1759-1768.
[18] AL-GBURI S, DEUSSEN A J, GALLI R, et al. Sex-specific differences in age-dependent progression of aortic dysfunction and related cardiac remodeling in spontaneously hypertensive rats[J]. Am J Physiol Regul Integr Comp Physiol, 2017 , 312(5):R835-R849.
[19] DADAM F M, CISTERNAS C D, MACCHIONE A F, et al. Sex chromosome complement involvement in angiotensin receptor sexual dimorphism[J]. Mol Cell Endocrinol, 2017, 447(15):98-105.

