光电化学传感器的研究进展
钟 立,魏小平,冯莎莎,李建平
(广西电磁化学功能物质重点实验室,广西高校食品安全与检测重点实验室,桂林理工大学 化学与生物工程学院,广西 桂林 541004)
1 光电化学传感器简介
光电化学传感器是将光电技术与传感器相结合而发展起来的一种进行光电分析的新型传感器。利用光激发光电材料表面的活性物质产生光电流或光电压,依据光电流或光电压的变化与待测物质的浓度关系进行检测[1-2]。光电化学传感器具有装置简便、操作方便、检出限低、灵敏度高、背景值低等优点[3-4],其灵敏度可与毛细管电泳、电化学发光、荧光光谱相媲美[5-6],受到广大科研人员的青睐。在当今光电子时代大背景下,随着新材料技术的进步,光电材料的重要性日益凸显,为光电化学传感器注入了新的力量。它的特殊性质(如比表面积大、活性好、独特的物理性质等)使其对温度、光强、湿度等环境因素非常敏感。当外界环境发生改变时,光电材料表面或界面的电子传递会发生改变,并对电阻值产生影响,根据这一特点制备的光电化学传感器具有良好的发展前景[7]。
2 光电材料的分类与制备
2.1 光电材料的分类
光电材料又称光电转换材料,是通过光伏效应将辐射能直接转换成电能的一类材料。光电化学传感器采用具有光电活性的光电材料作为敏感膜。常见的光电材料可分为以下3类[8]:(1)无机光电材料——是由无机化合物构成的半导体发光材料,这些无机化合物的阳离子大部分是元素周期表中的第Ⅲ~Ⅴ周期元素,比如Si[9]、TiO2[10]、ZnO[11]、GaN[12-13]等。(2)有机光电材料——是一类具有光电活性的有机材料,它们通常是具有大π共轭体系,富含碳、氮、硫等杂原子的芳香性有机分子,分为小分子和聚合物两类。由有机化合物构成的半导体光电材料,具有光电响应快且易加工等特性,有望在分子尺寸实现对电子运动的控制。常见的有机小分子光电材料包括酞菁及其衍生物[14-15]、卟啉及其衍生物[16]、聚苯胺[17]等。(3)复合型光电材料——主要是无机光电材料与有机光电材料的复合、无机光电材料之间的复合。通常情况下会利用无机光电材料之间的相互复合或者无机材料与有机材料之间的相互复合来构建光电化学传感器。两种不同材料之间会形成异质结,异质结常具有两种半导体各自均不能达到的优良光电特性,从而有效提高了光生电荷的分离,降低了光生空穴与光生电子的复合几率,增加了整个光谱的响应范围,同时也增大了半导体材料的比表面积,从而很大程度上改善了整个材料的光电化学性能,拓宽了半导体材料在光电化学领域的应用范畴。研究较多的是TiO2掺杂,如CdS-TiO2[18]、ZnO-TiO2[19]等。后来,研究者利用金纳米粒子或者碳纳米结构的导电性,发展了基于金纳米粒子或者碳纳米结构-半导体复合物以提高半导体光生电子的捕获和传输能力,比如碳纳米管/CdS、碳纳米管/CdSe、富勒烯/CdSe、卟啉/富勒烯/金纳米粒子、CdS/金纳米粒子等体系,皆具有较高的光电转换效率。
2.2 光电材料的制备方法
光电材料是光电化学传感器的重要组成部分。为扩宽光电材料在光电化学传感器领域的应用范围,需根据不同需求采用不同合成方法。常见光电材料的制备方法有激光加热蒸发法、化学气相沉积、超声空化法、电化学沉积法、水热合成法、球磨法、连续离子层吸附法、沉淀法等。
2.2.1激光加热蒸发法激光加热蒸发法以大功率激光束为快速加热源,使气相反应物分子内部快速地吸收和传递能量,在瞬间完成气相反应的成核、生长以及终止。该方法可迅速使反应物结晶,生成粒径小(<50 nm)且粒度均匀可控的纳米微粒。Bjelajac等[20]采用激光加热蒸发法在TiO2纳米管上修饰CdS量子点,修饰的CdS量子点的量取决于激光脉冲幅度和激光能量密度,用此方法制备的CdS-TiO2纳米管光电材料在检测中获得的电流密度高达0.042 mA/cm2,具有良好的光电转换性能。由于激光束能量高度集中,周围环境温度梯度大,有利于纳米粒子的快速凝聚,因此可制得粒径小且分布均匀的高品质纳米粒子。
2.2.2化学气相沉积化学气相沉积技术主要是利用含有薄膜元素的一种或几种气相单质或化合物在基质表面上进行化学反应生成薄膜的方法,是近几十年发展的制备无机光电材料的新技术,已广泛用于提纯物质、沉积各种单晶、多晶或玻璃态无机薄膜材料。这些材料可以是硫化物、氮化物、氧化物等,而且它们的物理性能可通过气相掺杂的沉积过程来精确控制。Ameen等[21]采用热丝化学气相法(Hot filament chemical vapor deposition,HFCVD)将石墨烯电沉积到掺杂氟的SnO2透明导电玻璃上,再在其表面修饰一层ZnO薄膜形成光电阳极,实验检测该材料具有较高的光电转换效率(2.5%)。
2.2.3超声空化法超声空化法利用的是超声空化效应,是指液体中的微小气泡在超声波作用下发生振荡、膨胀、收缩及内爆等一系列动力学过程,而微小气泡爆炸的瞬间气泡内能量快速释放,导致发光、高温、高压、放电及微射流等极端物理现象。这些极端条件极大地促进了非均相界面间扰动和相界面更新,进而改善界面间传质速率,促进了新相的生成,从而加速界面间传质[22]。还原氧化石墨烯通过化学方法将氧化石墨烯还原,目的是将氧化石墨烯上附带的氧化基团彻底除去,使其具有更稳定的结构,保证制得的产物不会因过于活泼而发生化学反应变质[23]。Luo等[24]通过在含有氧化石墨烯、Zn(CH3COO)2、二甲基亚砜和H2O的溶液中进行简单的超声处理来制备还原的氧化石墨烯-层状ZnO空球体复合物。在超声过程中,由纳米颗粒组成的ZnO空心球均匀分散在氧化石墨烯片的表面,通过化学方法将氧化石墨烯还原,形成还原氧化石墨烯-ZnO复合材料。检测发现,还原氧化石墨烯-ZnO复合材料的光电流和光降解效率分别提高了5倍和67%。Muscuso等[25]通过在异丙醇中利用超声空化法的剥落/碎裂过程来获得薄而小的MoS2纳米颗粒,实验发现该光电材料具有优良的光电转换特性。超声空化法制备光电材料工艺简单,实验条件易控制,且高效率、低成本、无污染,具有良好的应用前景。
2.2.4水热合成法水热合成法是一种常见的无机光电材料的合成方法,该法是将反应原料配制成溶液在水热釜中封装,使合成体系维持在一定的压力范围后加热至一定的温度。因反应在高温、高压的水热条件下进行,反应后可以直接制成晶型完好、原始粒度小、分布均匀、团聚少的纳米粉末。Xu等[26]在水热条件下,在含有疏水性的Fe3+溶液的存在下,制备了α-Fe2O3粉末。用制备好的α-Fe2O3粉末修饰FTO电极,通过光电流响应来测试它们的光电化学性质。实验表明,α-Fe2O3粉末/FTO电极的光电响应高且光电化学性质稳定。水热合成法制备工艺相对简单,无需焙烧处理,但设备较昂贵。
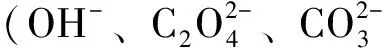
2.2.6电沉积法电沉积法是在水溶液、熔融盐和非水溶剂中通直流电,利用电化学还原法将金属离子沉积在阴极表面形成具有光电活性的纳米金属薄膜。该方法具有设备简单、产率高、成本低、过程易控制等优点,通常在常温常压下进行,适合大面积制造[29-30]。Zhang等[31]在FTO基底上修饰一层Cu2O薄膜后电沉积g-C3N4,形成Cu2O/g-C3N4异质结膜。实验表明:Cu2O/g-C3N4膜的光电化学性能优于纯g-C3N4和纯Cu2O膜。在-0.4 V外压和可见光照射下,优化的Cu2O/g-C3N4膜的光电流密度可达1.38 mA/cm2。Liu等[32]在FTO基质上通过电沉积制备三维分层ZnO纳米阵列,所制备的光电材料孔径小、厚度小。实验证实了ZnO纳米薄膜修饰的FTO表现出优异的光响应和光电化学性能。Wang等[33]研发了一种简单的无模板电沉积技术,用在导电基底上大规模制造垂直分布的银纳米棒(Ag NR)。Ag NR的直径、长度和表面覆盖度取决于电沉积时间和基材的选择。Ag NR具有大的比表面积、宽的光散射范围和光吸收可调性,可用作薄层光催化剂的理想衬底来增强光吸收和电荷收集。这种简单的NR制造方法已成功应用于制备FeNRs。但由于电沉积过程中金属离子浓度、沉积电位、电流密度等因素都处于动态变化中,导致薄膜重复性差。
2.2.7球磨法球磨法是一种简单的制备固相光电材料的方法,一般依靠研磨过程中的转动、振动将粉末进行研磨、搅拌达到机械混合的目的,或者在研磨混合过程中伴随某些化学反应的进行,再经过后续干燥或煅烧处理制得产品。Zhou等[34]通过简单的球磨法制备具有高度光催化性能的C3N4/TiO2混合光催化剂。机械化学过程可以促进C3N4在TiO2颗粒表面上的分散,形成单层混合结构和多层核-壳结构。C3N4/TiO2在可见光和紫外光照射下的光催化活性分别为纯C3N4和TiO2的3.0倍和1.3倍,光电流响应分别高达纯TiO2和C3N4的2.5倍和1.5倍。
2.2.8连续离子层吸附反应法连续离子层吸附法是一种较新的液相成膜制备光电材料的方法。与电沉积法成膜技术显著不同。该方法是通过离子在基质上的吸附而形成吸附离子单层,通过吸附离子与反离子间的沉淀反应或其水解过程而使吸附离子转化为固态膜层。因此可实现纳米尺寸的薄膜生长,具有良好的应用前景。Wang等[35]通过连续离子层吸附法在室温下将Bi2S3纳米颗粒以薄膜形式修饰在FTO玻璃基板上,无需退火,在可见光和近红外区域吸收系数达到1.0×106cm-1的数量级,最高达5.0×106cm-1。此外,在光照下4 000次测试期间,光电流几乎不降低。
3 光电化学传感器种类
根据测量参数的不同,光电化学传感器可分为电位型光电化学传感器和电流型光电化学传感器。

图1 LAPS的结构特征Fig.1 Architectural feature of LAPS
3.1 电位型光电化学传感器
电位型光电化学传感器通常指光寻址电位传感器(Light addressing potential sensor,LAPS),是一种基于半导体光电效应的化学传感器[36]。LAPS的基本结构有电解质/绝缘层/硅(Electrolyte/insulation/silicon,EIS)和金属/绝缘层/硅(Metal/insulation/silicon,MIS)两种。EIS结构和MIS结构的不同之处在于敏感层,EIS结构是离子敏的LAPS,一般用于液体的测量,而MIS结构是气敏的LAPS,一般用于气体的测量,LAPS的结构特征如图1所示。两者均可在硅基底上方便地实现光激发。对硅表面进行不同部位的照射,可选择性地激活LAPS的不同敏感部位,使LAPS成为一种结构简单(只需2根引线)且可实现多样品或多参数同时检测的传感器,从而达到传感器的微型化、阵列化、多功能化和智能化的要求。LAPS的基本原理是当半导体受到一定波长的光照射时,半导体吸收光子,发生禁带到导带的跃迁产生电子-空穴对。形成光电流,光电流随外加偏压的变化而变化,产生光电流-偏置电压曲线(即LAPS响应曲线)。当敏感膜表面吸附待测离了后,光电流-偏置电压曲线产生偏移,通过偏移量可检测待测离子浓度。在一般情况下,电子-空穴对很快复合,在外电路中测不到电流。如果在LAPS外加反向偏置电压时(N型硅加负压,P型硅加正压),半导体中产生耗尽层,此时靠近耗尽层的电子空穴对会被耗尽层拉开。采用强度可调制的光照射在LAPS的正面或背面,可在外电路中测量待测成分所对应的光电压和光电流,从而确定待测物的浓度。电流的大小还与光强、耗尽层的厚度(即外偏压)等有关[37]。
3.1.1电解质/绝缘层/硅结构的电位型光电化学传感器EIS结构的离子敏LAPS一般用于液体的测量。其制备方法以Si3N4/SiO2为光寻址电位传感器敏感膜为例:以硅片为衬底,在其一面生成一层SiO2层。再以Si3N4膜作为硅片保护层,并兼作H+敏感膜。然后去掉硅片衬底另一面的SiO2和Si3N4,引出引线,最后用环氧树脂和硅橡胶封装。采用直流稳压电源为EIS结构的传感器提供直流负偏压,使n型硅片表面进入多数载流子呈耗尽状态。当敏感膜与待测液接触时,根据能斯特方程测量待测液中H+活度aH+。
在直流偏压一定的情况下,交变光信号的大小与E有关。因此,通过测量光电压可以实现对待测液的pH值、溶液中离子浓度、细胞动作电位等各种参数的检测。EIS结构的离子敏LAPS是研究的热点。
3.1.2金属/绝缘层/硅结构的电位型光电化学传感器MIS结构的气敏LAPS一般用于气体的测量。由于LAPS是一种对偏压和光强具有一定分辨率的传感器,一切能影响偏压和入射光强变化的因素均可用LAPS测量。例如,吸附在LAPS表面的敏感膜与特定的气体发生作用会在LAPS表面产生一个偏压,利用这种现象选择不同的敏感膜可以测量不同物质。但是,MIS结构的LAPS仍有许多问题待解决,最关键的问题是光生载流子与硅、光强参数之间的关系。此种结构的LAPS在某些情况下,只能得到相对的光电流值,而且掺杂浓度和光强也会受到影响。
3.2 电流型光电化学传感器
电流型光电化学传感器是一种将光能转化为电能的装置,该装置主要由浸泡于电解液中的半导体阳极和金属阴极构成。当光照射光电材料时,光电活性物质受到激发吸收一个比带隙能级更高的光子时,光电活性物质处于激发态,其产生的电子(e)受激发从价带(VB)跃迁到导带(CB)或者其他具有较低能级水平的电极上,并在价带上留下空穴(H+),电子与空穴进行有效分离产生电子-空穴对,发生光电转换。待测物与光电材料相互作用后所产生的光电流的变化与待测物浓度之间的关系,是电流型光电化学传感器定量的基础[38]。以TiO2为例,它是一种常见的多晶型化合物n型半导体材料,禁带宽度是3.2 eV。TiO2在自然界中存在锐钛矿、金红石型和板钛矿型3种结晶形态,其中锐钛矿型和金红石型均具有光催化活性,而锐钛矿型的光催化活性更好。纳米TiO2及其复合材料除了具有一般纳米半导体材料的特性外,还具有无毒无害、易制备、化学性质稳定、价格低以及光电化学性能优异等优点,近年来被愈来愈多地用作光电化学反应体系的光阳极半导体材料,在光催化、染料敏化太阳能电池、光电化学传感等光电化学领域得到广泛应用。由于光电流由光激发产生,所以背景电流小,检测时可以获得很低的检出限。
4 光电化学传感器在分析检测中的应用
光电化学传感器(包括电流型和电位型)已成功应用于核酸[39]、蛋白质[40]、有机小分子[41]、无机小分子[42]、金属离子[43]等物质的检测,是近年来光电化学发展的一个重要领域。
4.1 电位型光电化学传感器的应用
LAPS具有封装要求低、制备工艺简单等优点,在稳定性、重现性、灵敏度、响应速度等方面均有优良的性能。Ha等[44]将硼掺杂到硅衬底上形成一层较厚的氧化物,然后在相应的敏感区域制备可响应各种阳离子(Pb2+、Cb2+、Zn2+)的聚氯乙烯膜阵列,用于同时测定重金属离子。该阵列型LAPS具有较高的重现性和良好的选择性。Fang等[45]提出了基于氧化石墨烯(GO)的LAPS(GO-LAPS)。结合不同链长度(分别为30、 21和14碱基对)的ssDNA后,可将GO-LAPS应用于单链DNA(ssDNA)检测。实验证明,目标ssDNA检测浓度范围为1.0×10-12~1.0×10-8mol/L。Gu等[46]设计出一种基于小鼠的抗人上皮细胞粘附因子固定在有羧基修饰的石墨烯氧化物表面(GO-COOH)的LAPS,并应用于前列腺癌中循环肿瘤细胞(CTC)的无标记检测。结果证实,LAPS的电压随着磷酸盐缓冲液(PBS)和血液中CTCs浓度的增加而降低,在1 mL血液中可以检测到10个以下的CTCs,表明所制备的传感器灵敏度高。以其对健康血液样本进行分析时电信号未变化,从而证实了传感器的特异性。Wang等[47]采用光电转换效率高的硫化铋通过恒电位沉积修饰纳米铟锡金属氧化物(Indium Tin Oxides,ITO)电极,在可见光区域,用金纳米粒子对其进一步修饰,并将不同感知区用绝缘漆分开,将甲胎蛋白(AFP)、癌胚抗原(CEA)和癌抗原19-9(CA19-9) 3种肿瘤标志物的抗体通过吸附固定在电极的不同感知区,建立了光寻址电位型传感器。此外,LAPS还可用于图像测量。激光束照射后,所激发的电子-空穴对只能在光照点周围的有限区域内产生,这就是LAPS的分辨力产生的原因[48]。若光在LAPS上做连续扫描,记录下每个扫描位置的光电流,然后将信号合成处理,即可表征待测物的二维图像[49]。
4.2 电流型光电化学传感器的应用

图2 检测Ni2+的分子印迹光电流型电化学传感器原理图[54]Fig.2 Schematic diagram of molecularly imprinted amperometric photoelectrochemical sensor for detection of Ni2+[54]
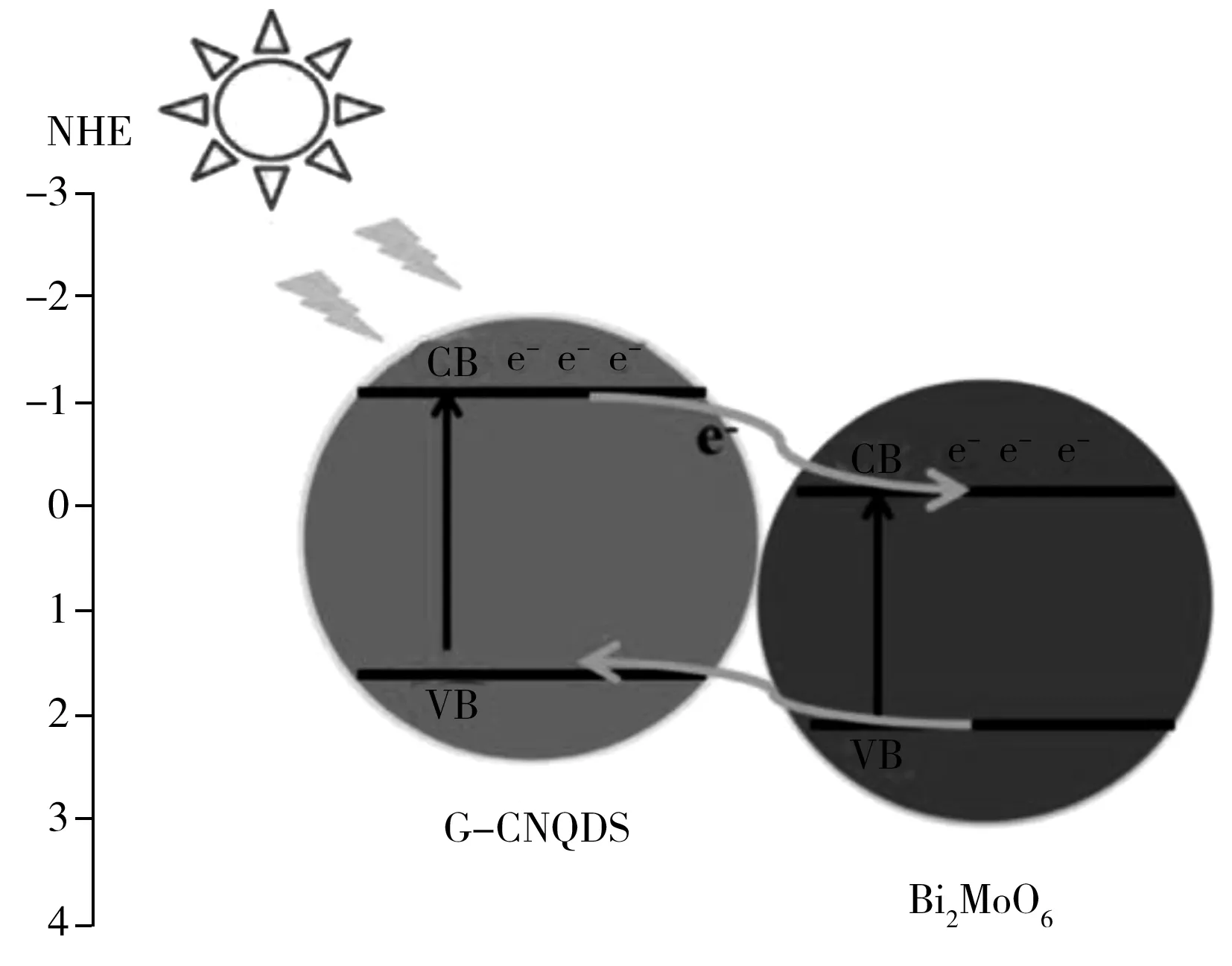
图3 g-CNQD和Bi2MoO6纳米复合材料的能带结构和电荷转移形成机理[55]Fig.3 Band structure and charge transfer formation mechanism for g-CNQD and Bi2MoO6 nanocomposites[55]
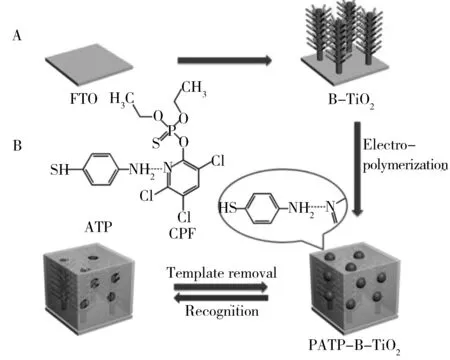
图4 电流型光电化学传感器的制备过程(A)以及ATP和CPF之间氢键相互作用的示意图(B)[63]Fig.4 Amperometric photoelectrochemical sensor preparation process(A) and schematic of hydrogen bond interaction between ATP and CPF(B)[63]
4.2.1电流型光电化学传感器在金属离子检测中的应用电流型光电化学传感器是根据被测物质与处于激发态的光电材料之间发生电子传递而引起光电流变化或者根据被测物质本身的光电流变化的原理而研发的一类分析检测装置。因此,可以根据光电流的变化达到检测金属离子的目的[50]。目前电流型光电化学传感器可以检测的金属离子主要有Cr3+、Cd2+、Hg2+、Cu2+等[51-53]。本课题组[54]制备了一种基于光电流检测的分子印迹传感器用于测定Ni2+。该传感器将CdTe量子点修饰到导电玻璃表面(CdTe量子点/ITO)作为光电材料,然后在CdTe量子点/ITO表面以光聚合法修饰镍-1-(2-吡啶偶氮)-2-萘酚(PAN)分子印迹膜。以365 nm紫外光作为激发光源,量子点在光照下生成电子-空穴对,以电子与电子受体-抗坏血酸作用形成的光电流作为检测信号,根据“门效应”对Ni2+检测(如图2)。结果表明,Ni2+浓度在5.0×10-11~5.0×10-8mol/L范围内与光电流的大小呈线性关系,检出限为8.3×10-12mol/L。该传感器已用于水样中Ni2+的分析。Chen等[55]通过偶联石墨烯氮化碳量子点(Graphitic carbon nitride quantum dots,g-CNQD)和Bi2MoO6纳米颗粒(NPs)制备纳米复合材料。所制备的纳米复合材料的光电流强度比纯g-CNQD高近3倍,比纯Bi2MoO6NPs 高6倍。这种改进归因于当g-CNQD受到光激发时,导带上的电荷能够快速转移到Bi2MoO6NPs(如图3)。基于其优异的光电化学性能,该纳米复合材料已成功用于构建检测Cu2+的电流型光电化学传感器。Zhang等[56]采用TiO2纳米薄片与Au@Ag纳米棒自组装的电流型光电化学传感器检测Hg2+,该传感器的线性范围为1.0×10-11~1.0×10-8mol/L,检出限为2.5×10-12mol/L,对人体血清中的检测可行性进行了评估,结果满意。这种方法将为临床诊断中Hg2+的检测提供参考。Moakhar等[57]以金纳米颗粒修饰的单晶金红石二氧化钛纳米棒为光电材料研发了一种具有高灵敏度和高选择性等优点的电流型光电化学传感器,用于检测和还原铬(Ⅵ)。在模拟太阳光源下测定时灵敏度达1.394×10-2A/(mol·L-1),检出限为6.0×10-9mol/L(S/N=3),线性范围为1.0×10-8~5.0×10-5mol/L。对实验室自来水和河水等样品进行测量表现出优异的抗干扰能力。
4.2.2电流型光电化学传感器在小分子有机物检测中的应用光电流法作为一种高效的检测手段已成为研究热门,众多研究人员设计了不同的电流型光电化学传感器来检测环境中的各种有机污染物甚至对人体有害的微量有机物质。虽然有些有机物含量很低,但因为结构、种类复杂,所以对环境和人体的影响较大。光电流法检测这些物质发挥了光电化学传感器的高灵敏性、低检出限等优点[58]。Dai等[59]构建了一种基于交织的钛酸盐纳米管和碳纳米角共轭作为复合光电材料用于测定叶酸的电流型光电化学传感器。具有网状结构的钛酸盐纳米管因具有良好的光催化活性并可快速促进长距离电子传输,因而用于作为光电子元件。分层结构的碳纳米角因具有突出的导电性和大的表面可用于作为电子传输介质的主体,将从激发的钛酸盐纳米管捕获的电子传输到传感基质,以此增强传感器的光电流响应。在最佳实验条件下,线性范围为1.0×10-10~5.0×10-5mol/L,检出限为(2.5±0.005)×10-11mol/L。该传感器的设计为其他同类待测物质的评估检测提供了有益的参考。Xu等[60]以石墨烯氮化碳/碘氧化铋(g-CN/BiOI)异质结为复合光电材料,制备了用于双酚A检测的电流型光电化学传感器。由于在异质结界面处形成的内部电场促进了电子-空穴对的分离,因此,g-CN/BiOI与纯的BiOI相比,光电流密度提高了2倍。除此类传感器外,科研人员将电流型光电化学传感器与分子印迹技术相结合,制备了检测各种有机物的分子印迹电流型光电化学传感器[61],相比一般的光电化学传感器,此类传感器的光电性能更高,选择性更好。本课题组[62]利用TiO2膜制备了一种分子印迹电流型光电化学传感器用来测定克百威。研究了掺杂改性对TiO2光催化效率的影响,结果表明掺杂Au的TiO2分子印迹膜对克百威有较好的光催化降解作用。在最佳实验条件下,克百威浓度在1.0×10-9~2.2×10-7mol/L范围内与光电流呈良好的线性关系,检出限为1.1×10-10mol/L(S/N=3)。该分子印迹光电化学传感器有较好的灵敏度、选择性和稳定性。Sun等[63]构建了基于分子印迹聚合物(MIP)修饰的层分化TiO2纳米棒(B-TiO2NR)的分子印迹光电化学传感器,用于毒死蜱(CPF)的检测。B-TiO2NRs通过水热法直接在FTO上生长形成B-TiO2NRs/FTO。在MIP制备过程中,氨基苯硫酚(ATP)和CPF通过电聚合形成氢键组装修饰在B-TiO2NRs/FTO的表面(图4)。因为MIP为绝缘层,阻碍光和电子之间的传递,所以,随着CPF浓度的增加,光电流减小。此外,该分子印迹光电化学传感器由于存在印迹孔穴对CPF的检测还具有特异性识别能力。Yang等[64]在电纺模板上制备了分子印迹型的纳米纤维修饰的BiOI纳米片(BiOINF)作为电极来检测磷酸三苯酯(TPhP),构建的分子印迹电流型光电化学传感器具有响应快速、灵敏度高、选择性好的特点。
4.2.3电流型光电化学传感器在生物检测中的应用核酸、蛋白质是构成生物体的重要物质。疾病会导致人体某种蛋白质含量的变化,因此检测人体中某些蛋白质的含量可以预测疾病的严重程度。而核酸的检测除了在处理犯罪证据方面提供理论依据,还对人类基因研究方面有着重要的意义[65]。目前检测核酸、蛋白质的各种电流型光电化学传感器已有较多报道。Wang等[66]在ITO电极上修饰PbS量子点作为光电敏感层,捕获DNA嫁接在量子点上,接有G-四链体的铂纳米粒子和捕获DNA与目标DNA结合后,在光照作用下,G-四链体催化H2O2产生电子促进光电流的产生,以此达到检测目标DNA的目的。Tu等[67]采用金纳米颗粒(Au NPs)修饰ZnSe-COOH纳米片(NFs)作为光电材料,使用microRNA(miRNA)-122a作为模板分子,研发了一种在405 nm光照射下检测miRNA-122a的超灵敏的电流型光电化学生物传感器,线性范围为3.5×10-13~5.0×10-9mol/L,检出限为1.53×10-13mol/L。该传感器已成功应用于人体宫颈癌细胞中miRNA-122a的分析检测,为肿瘤的早期诊断开辟了广阔的应用前景。Wang等[68]采用g-C3N4/CdS异质结作为光敏材料,抗N-6甲基腺苷作为识别单元,磷标记生物素作为链接单元,抗生物素蛋白功能化的CuO作为光电化学信号指示剂,构建了用于检测N-6甲基腺苷的电流型光电化学免疫传感器(图5)。在最佳检测条件下,该传感器的线性范围为1.0×10-11~1.0×10-8mol/L,检出限为3.53×10-12mol/L。此外,提出的方法也可用于乳腺癌患者血清样品中N-6甲基腺苷甲基化的RNA的检测。Zhang等[69]在ITO表面修饰一层金纳米粒子,在金纳米粒子上接一段Ru(bpy)2(dcbpy)2+的发卡DNA。当目标DNA加入后,发卡结构打开,光照后由于光敏剂Ru(bpy)2(dcbpy)2+距离电极较远导致光电流降低。加入起循环放大作用的引物和聚合酶后,可使检出限提高3~4个数量级。
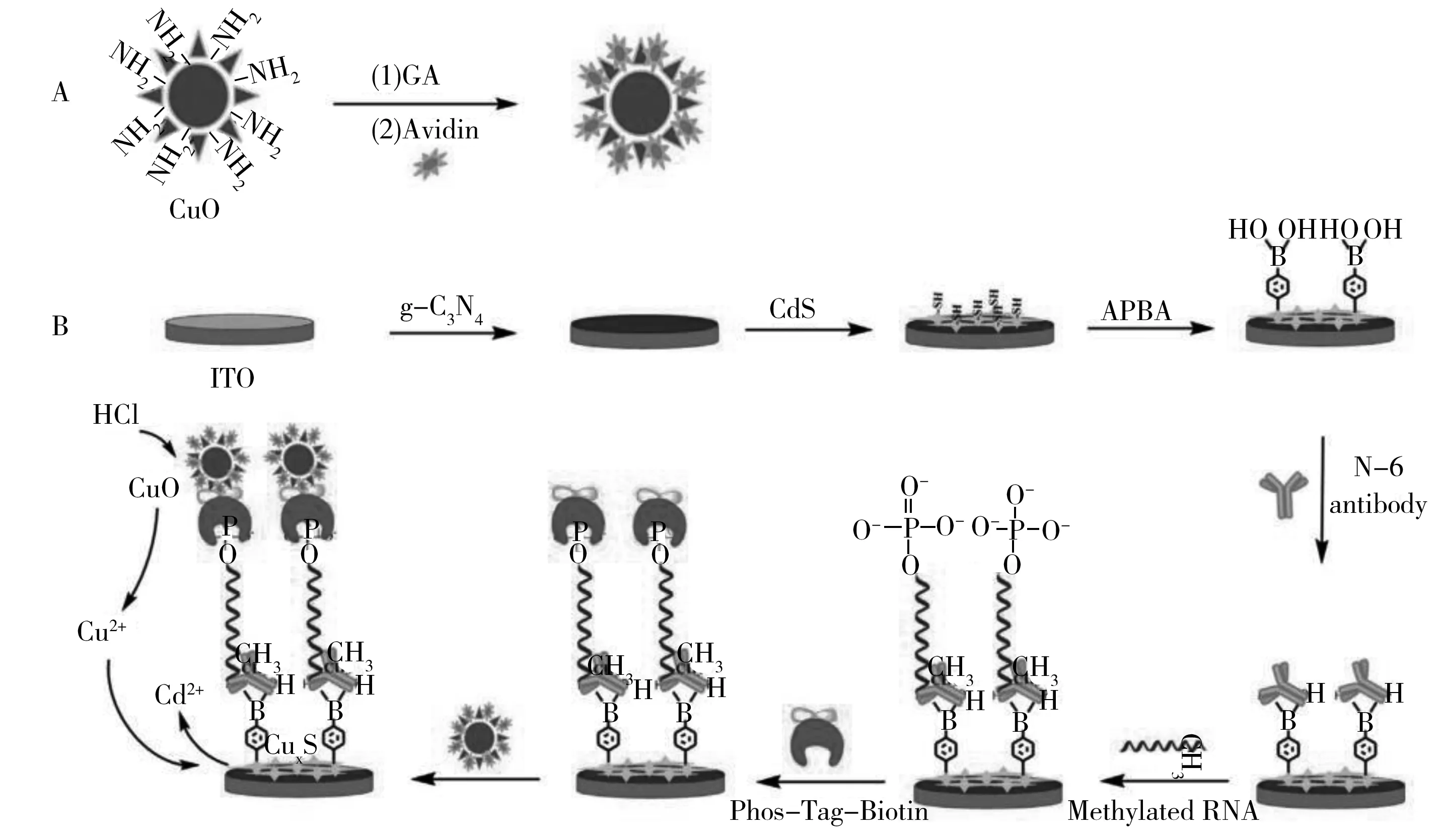
图5 用于检测N-6甲基腺苷的电流型光电化学免疫传感器的原理图Fig.5 Schematic diagram of amperometric photoelectrochemical sensor for detecting N-6 methyladenosine
蛋白质是一种生物大分子,常规检测方法难以达到相关要求,但光电流法在检测蛋白质时具有检出限低、稳定性好、抗干扰能力强、生物分子的特异识别能力好等优点,为生物传感器的发展提供一个良好的方向。Li等[70]将基于碳点(CDs)的电流型光电化学传感器用于谷胱甘肽(GSH)检测。在构建传感器的过程中,引入银纳米粒子(Ag NPs)、氧化石墨烯(GO)和介孔二氧化硅(MS)来提高该传感器的光电性能和催化性能。实验证实:GSH的检出限为6.2×10-9mol/L,线性范围为2.0×10-8~4.0×10-6mol/L。此外,该传感器对于GSH甚至其他生物硫醇和氨基酸也显示出高选择性。Fan等[71]利用具有可见光光电活性的BiOBr/Ag2S复合光电材料制备了一种超灵敏的电流型光电化学免疫传感器用以检测胰岛素。BiOBr经巯基乙酸修饰后,Ag2S纳米颗粒在BiOBr微球的表面上生长形成新型BiOBr/Ag2S复合材料,在BiOBr/Ag2S电极上通过聚合形成聚多巴胺(PDA)膜来固定胰岛素抗体。此外,PDA膜可以进一步提升BiOBr/Ag2S对可见光的吸收。Liu等[72]用二氧化钛与多壁碳纳米管组装合成纳米复合结构(TiO2@CNTs)并用分子印迹膜进一步修饰,构建了一种简单且灵敏度高的电流型光电化学传感器检测微囊藻毒素。该纳米复合材料的制备将溶胶-凝胶法与原位表面分子印迹技术(MIT)相结合,形成可控的核-壳结构。因为TiO2@CNTs异质结结构具有大的表面积、优异的光电活性以及分子印迹表面的丰富活性识别位点等优势,所以该传感器在灵敏度和选择性上有一定优势。Fan等[73]使用信号放大技术制备了一种新型的灵敏度高的夹心型光电化学传感器,用于定量检测前列腺特异性抗原(PSA),如图6所示。

图6 夹层式光电化学生物传感器的制备[73]Fig.6 Preparation of sandwich photoelectrochemical biosensor[73]
光电流法检测细胞含量是近几年发现的一种新方法,该方法因检出限低、灵敏度高、无毒、制备简单等优点受到广大科研人员的青睐[74]。Zhang等[75]在ITO电极上修饰一层SnO2和一层Ag2S量子点,然后在量子点上修饰3-氨基苯酚硼酸,并加入乳腺癌细胞(MCF-7)与3-氨基苯酚硼酸特异性结合,使得电子供体抗坏血酸进入电极的阻力增大,从而降低光电流值,该传感器检测癌细胞的检出限可达98 cell/mL。Wang等[76]研发了一种检测乳腺癌细胞MCF-7的电流型光电化学传感器。将增频转换纳米粒子和TiO2/CdTe异质结构结合制备膜电极,并将高亲和性适体AS1411修饰到电极上以识别MCF-7细胞。测定时,由于细胞覆盖在电极表面阻挡了激发光的传递从而引起光电流降低。利用光电流强度与细胞数量的反比关系实现对MCF-7细胞的检测(如图7)。结果表明,MCF-7细胞的检测浓度范围为1.0×103~1.0×105cell/mL,该传感器具有良好的灵敏度和特异性。
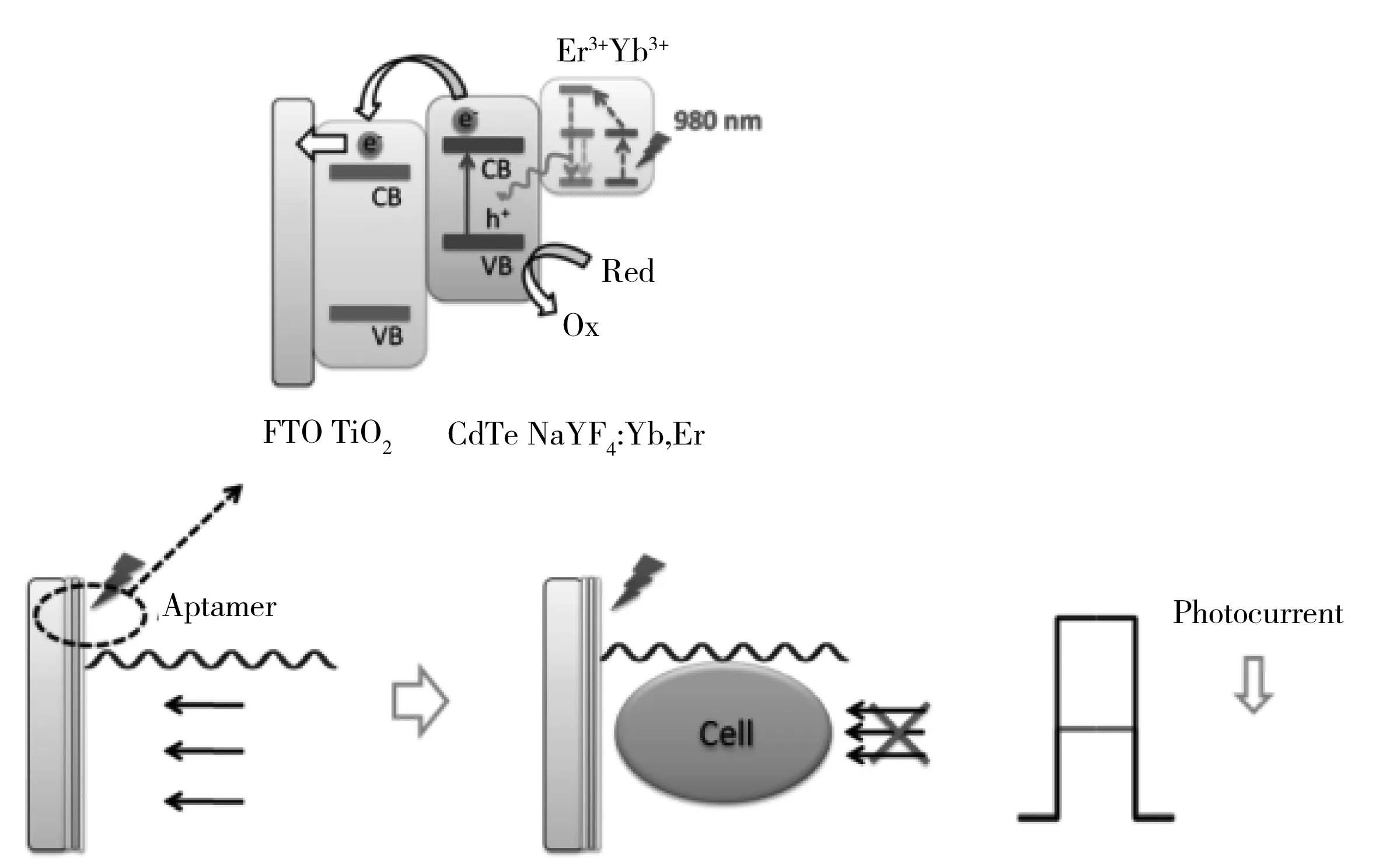
图7 受近红外光激发的光电化学传感器界面和MCF-7细胞检测原理图[76]Fig.7 Photoelectrochemical sensor interface with near-infrared light excitation and the schematic of MCF-7 cell detection[76]
Li等[77]通过使用HepG2细胞作为模型,研发了检测细胞的双信号放大电流型光电化学生物传感器。传感器的构建过程以及用于细胞释放H2O2的检测原理见图8。氮化碳(C3N4)纳米片和PbS量子点(QDs)之间的协同效应使之与单独C3N4相比,光电流强度增加了近9倍。在优化条件下,制备的传感器的线性范围为1.0×10-5~7.0×10-3mol/L,检出限为1.05×10-6mol/L。此外,该传感器还对其他具有还原性生物物种表现出良好的选择性,已成功应用于活细胞中H2O2释放的检测,在临床检测中具有广阔的应用前景。
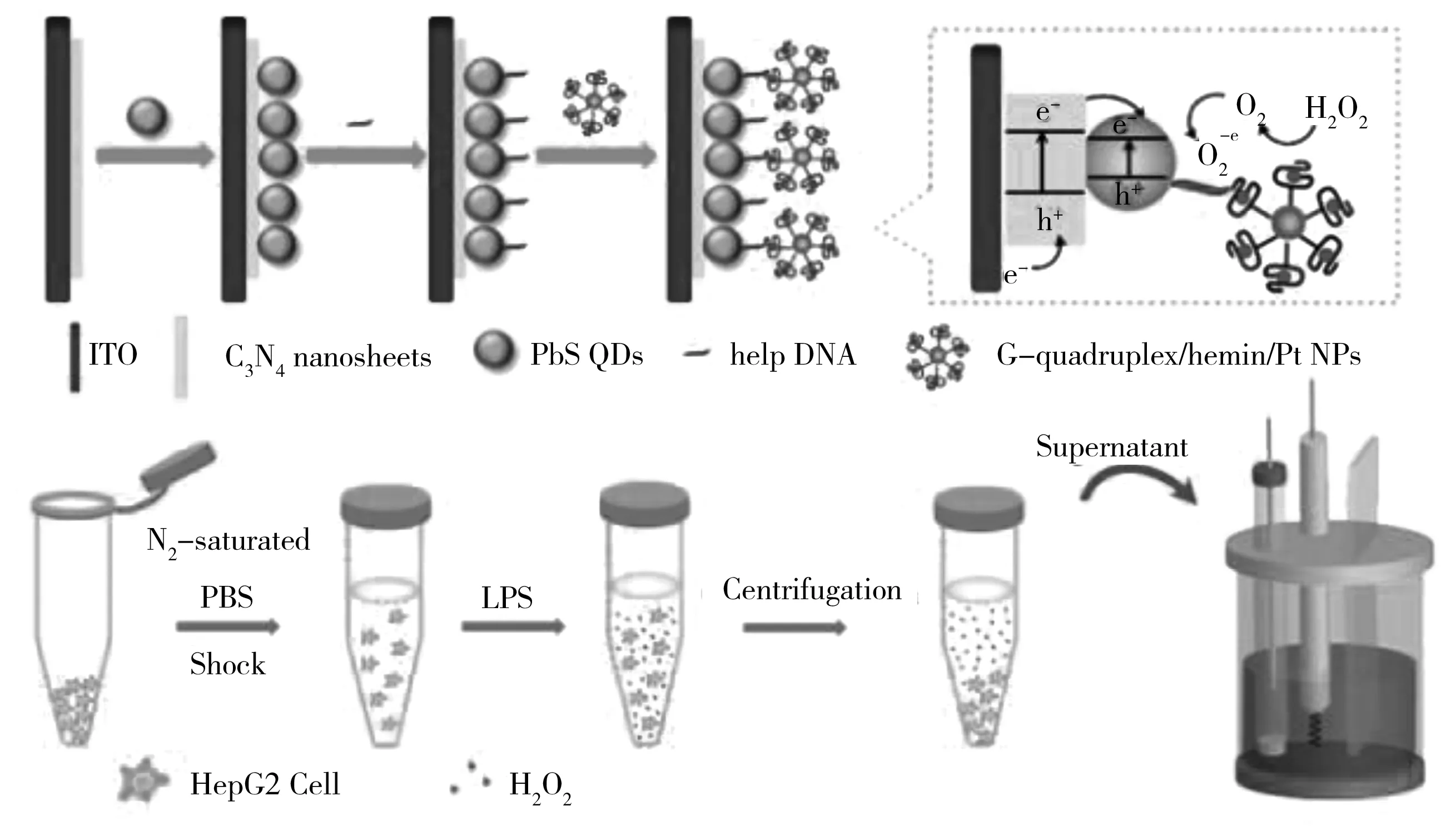
图8 光电化学传感器的制备过程及用于细胞释放H2O2的检测原理[77]Fig.8 The preparation process of photoelectrochemical sensors and the detection principle of H2O2 for cell chemical release[77]

图9 BiVO4修饰到FTO上用于光电化学检测H2O2的实验原理图[79]Fig.9 Experimental schematic for BiVO4 modification to FTO for photoelectrochemical detection of H2O2[79]
4.2.4电流型光电化学传感器的其它分析应用电流型光电化学传感器在检测无机小分子或者离子方面尚处于起步阶段,主要用于检测H2O2、S2-等。Li等[78]在n-n+-Si电极上修饰Pt和NiOOH测定H2O2,光照下NiOOH被激发能够催化H2O2产生光电流,H2O2的浓度越大,光电流越强。此传感器对H2O2的检出限为2.2×10-6mol/L。Zhao等[79]制备了由金纳米团簇和氧化石墨烯(Au NCs/GO)合成的纳米复合材料,并用于设计一种检测H2O2的新型光电化学传感器,检出限低至2.0×10-6mol/L,线性范围为3.0×10-4~5.0×10-3mol/L。Yu等[80]将BiVO4微棒经水热法合成后沉积在FTO基底上,制备了一种用于H2O2检测的光电化学传感器,实验原理如图9,在可见光照射下,BiVO4微棒从H2O2捕获电子,形成电子-空穴对,产生光电流。在最佳实验条件下,随着H2O2浓度的增加,光电流增加,检出限为8.5×10-6mol/L。该方法也适用于加标无菌奶样中H2O2的测定,并取得满意结果。Ding等[81]将CdS纳米粒子原位嫁接到TiO2纳米管上作为光电材料制备光电化学传感器,用于测定H2S。而在氧化钛纳米管的表面引入硫醇基可使Cd2+吸附固定,经H2S处理后,在TiO2纳米管上形成CdS纳米颗粒。利用CdS纳米颗粒的光电特性来检测癌细胞释放的H2S。检出限低至7×10-10mol/L。
5 光电化学传感器的发展展望
光电化学传感器的发展历史较短,但因其具有低背景值使得检出限非常低,因此光电化学传感器的灵敏度通常优于其他微量分析方法,如溶出伏安法、石墨炉原子吸收光谱法等。加上光电化学传感器仪器简单、操作简便,因而,较多地应用于水质分析、生物体中微量元素检测,以及食品添加剂和医疗辅助分析测定等领域。然而,光电化学传感器的研究和应用尚处于初步阶段,一是发光材料的种类较少,二是其制备技术不成熟,大规模生产受到限制。此外,现有的光电材料光电转换效率有待进一步提高。因此,新型光电材料的研究开发与应用可能成为本领域未来的热点之一,同时也将大大拓展光电化学传感器分析应用的范围。
参考文献:
[1] Sun B,Ai S Y.Prog.Chem.(孙兵,艾仕云.化学进展),2014,26(5):834-845.
[2] Zang Y,Lei J P,Ju H X.Biosens.Bioelectron.,2017,96:8-16.
[3] Yan Y Y,Liu Q,Du X J,Qian J,Mao H,Wang K.Anal.Chim.Acta,2015,53:258-264.
[4] Moakhar R S,Goh G K L,Dolati A.Appl.Catal.B,2017,201:411-418.
[5] Zhang X R,Guo Y S,Liu M S,Zhang S S.RSC.Advances,2013,3:2846-2857.
[6] Kang Q,Chen Y F,Li C C,Cai Q Y,Yao S Z,Grimes C A.Chem.Commun.,2011,47:12509-12511.
[7] Zhang Z X,Zhao C Z.Chin.J.Anal.Chem.(张兆霞,赵常志.分析化学),2013,41(3):436-444.
[8] Wang G L,Xu J J,Chen H Y.Chem.Sci.Chin.(王光丽,徐静娟,陈洪渊.中国科学),2009,39(11):1336-1347.
[9] Yu J,Yang Y L,Fan R Q,Li L,Huang J D.J.Phys.Chem.C,2014,118:8795-8802.
[10] Yen Y C,Chen J A,Ou S,Chen Y S,Lin K J.Sci.Rep.,2017,7:42524-42531.
[11] Lu Y J,Liu C F,Hu C C,Kuo J H,Boddula R.Mater.Chem.Phys.,2017,189:56-63.
[12] Zhang X L,Liu Q Y,Liu B D,Yang W J,Li J,Niu P J,Jiang X.J.Mater.Chem.,2017,5:4319-4326.
[13] Zhang M R,Qin S J,Peng H D,Pan G B.Mater.Lett.,2016,182:363-366.
[14] Guo Y Y,Song S S,Zheng Y,Li R J,Peng T Y.Dalton.T,2016,45:14071-14079.
[15] Spoerke E D,Small L J,Foster M E,Wheeler J,Ullman A M,Stavila V,Rodriguez M,Allendorf M D.J.Phys.Chem.C,2017,121:4816-4824.
[16] Yang X G,Liu Y,Lei H X,Li B J.Nanoscale,2016,8:15529-15537.
[17] Elmas S,Beelders W,Nash J,Macdonald T J,Jasieniak M,Griesser H J,Nan T.RSC.Adv.,2016,6:70691-70699.
[18] Fujishima M,Nakabayashi Y,Takayama K,Kobayashi H,Tada H.J.Phys.Chem.C,2016,120:17365-17371.
[19] Kwiatkowski M,Chassagnon R,Heintz O.Appl.Catal.BEnviron.,2017,204:200-208.
[20] Bjelajac A,Petrovic R,Socol G,Mihailescu I N,Enculescu M,Valentina G,Pavlovic V,Janackovic D.Ceram.Int.,2016,42:9011-9017.
[21] Ameen S,Akhtar M S,Song M,Shin S.ACSAppl.Mater.Int.,2012,4:4405-4412.
[22] Liu L Y,Yang Y,Liu P H,Tan W.Ultrason.Sonochem.,2014,21:566-571.
[23] Eda G,Fanchini G,Chhowalla M.NatureNanotechnol.,2008,3(5):270-274.
[24] Luo Q P,Yu X Y,Lei B X,Chen H Y,Kuang D B,Su C Y.J.Phys.Chem.C,2012,116(14):8111-8117.
[25] Muscuso L,Cravanzola S,Cesano F,Scarano D,Zecchina A.J.Phys.Chem.C,2015,19(7):3791-3801.
[26] Xu L,Xia J X,Wang L G,Qian J,Li J,Li H M,Wang K,Sun K Y,He M Q.Chem.Eur.J.,2014,20:2244-2253.
[27] Wang J,Liu S R,Mu Y N,Liu L,A R N,Su P Y,Yang J D,Zhu G J.J.ColloidInterfaceSci.,2017,55:59-66.
[28] Senthilkumar S,Hariharan R,Suganthi A,Ashokkumar M,Rajarajan M,Pitchumani K.Powder.Technol.,2013,237:497-505.
[29] Yang L X,Luo S L,Liu R H,Cai Q Y,Xiao Y,Liu S H,Su F,Wen L F.J.Phys.Chem.C,2010,114:4783-4789.
[30] Kang Q,Yang L X,Chen Y F,Luo S L,Wen L F.Anal.Chem.,2010,82:9749-9754.
[31] Zhang S S,Yan J,Yang S Y,Xu Y H,Cai X,Zhang X C,Peng F,Fang Y P.Chin.J.Catal.,2017,38(6):365-371.
[32] Liu C H,Qiu Y Y,Wang F,Li L Z,Liang Q,Chen Z D.Ceram.Int.,2017,43:5329-5333.
[33] Wang J,Gupta A,Pan S L.Int.J.Hydrogen.Energ.,2017,42:8462-8474.
[34] Zhou J W,Zhang M,Zhu Y F.Phys.Chem.Chem.Phys.,2015,7:3647-3652.
[35] Wang Y,Chen J Y,Jiang L X,Sun K,Liu F Y,Lai Y Q.J.AlloysCompd.,2016,686:684-692.
[36] Kloock J P,Moreno L,Bratov A,Huachupoma S,Xu J,Wagner T,Yoshinobu T,Ermolenko Y,Vlasov Y G,Schöning M.Sens.ActuatorB,2006,118:149-155.
[37] Yoshinobu T,Miyamoto K,Wagner T,Schöning M J.Sens.ActuatorB,2015,7:926-932.
[38] Zhang X R,Guo Y S,Liu M S,Zhang S S.RSC.Adv.,2013,3:2846-2857.
[39] Riedel M,Hölzel S,Hille P,Schörmann J,Eickhoff M,Lisdat F.Biosens.Bioelectron.,2017,94:298-304.
[40] Hun X,Wang S S,Wang S Y,Zhao J K,Luo X L.Sens.ActuatorsB,2017,249:83-89.
[41] Wang Y H,Ge S G,Zhang L N,Yu J H,Yan M,Huang J D.Biosens.Bioelectron.,2017,89:859-865.
[42] Yu Z Z,Lv S Z,Ren R R,Tang D P.Microchim.Acta,2017,184:799-806.
[43] Shen Q M,Zhao X M,Zhou S W,Hou W H,Zhu J J.J.Phys.Chem.C,2011,115(36):17958-17964.
[44] Ha D,Hu N,Wu C X,Kirsanov D,Legin A,Khaydukova M,Wang P.Sens.ActuatorB,2012,174:59-64.
[45] Fang J Y,Xue B Y,Zhang J,Zhou S,Song M,Xing K L.Analyst,2012,137:5866-5873.
[46] Gu Y J,Ju C,Li Y J,Shang Z Q,Wu Y D,Jia Y F,Niu Y J.Biosens.Bioelectron.,2015,6:24-31.
[47] Wang J,Long J,Liu Z H,Wu W Z,Hu C G.Biosens.Bioelectron.,2017,91:53-59.
[48] Das A,Chen T C,Yang C M,Lai C S.Sens.ActuatorB,2014,198:224-232.
[49] Zhang D W,Wu F,Wang J,Watkinson M,Krause S.Electrochem.Commun.,2016,72:41-45.
[50] Yue Z,Lisdat F,Parak W J,Hickey S G,Tu L P,Sabir N,Dorfs D,Bigall N C.ACS.Appl.Mater.Interfaces,2013,5:2800-2814.
[51] Xu H,Huang D D,Wu Y,Di J W.Sens.ActuatorB,2016,235:432-438.
[52] Ibrahim I,Lim H N,Abou-Zied O K,Huang N M,Estrela P,Pandikumar A.J.Phys.Chem.C,2016,120:22202-22214.
[53] Wang Y,Wang P P,Wu Y,Di J W.Sens.ActuatorB,2018,254:910-915.
[54] Wei X P,Liang S C,Huang W G,Li J P.Chin.J.Anal.Chem.(魏小平,梁顺超,黄文刚,李建平.分析化学),2016,44(3):348-354.
[55] Chen S B,Hao N,Jiang D,Zhang X,Zhou Z,Zhang Y,Wang K.J.Electroanal.Chem.,2017,787:66-71.
[56] Zhang Y,Shoaib A,Li J J,Ji M W,Liu J J,Xu M,Tong B,Zhang J T,Wei Q.Biosens.Bioelectron.,2016,79:866-873.
[57] Moakhar R S,Goh G K L,Dolati A,Ghorbani M.Appl.Catal.B,2017,201:411-418.
[58] Qin Q,Bai X,Hua Z.J.Electrochem.Soc.,2017,164(4):H241-H249.
[59] Dai H,Li Y L,Zhang S P,Gong L S,Li X H,Lin Y Y.Sens.ActuatorB,2016,222:120-126.
[60] Xu L,Yan P C,Li H N,Ling S Y,Xia J X,Xu Q,Qiu J X,Li H M.RSC.Adv.,2017,7:7929-7935.
[61] Neto S Y,Luz R C S,Damos F S.Electrochem.Commun.,2016,62:1-4.
[62] Feng S S,Liang C F,Liang S C,Wei X P,Li J P.J.Instrum.Anal.(冯莎莎,梁春凤,梁顺超,魏小平,李建平.分析测试学报),2017,36(5):684-688.
[63] Sun X,Gao C,Zhang L N,Yan M,Yu J H,Ge S G.Sens.ActuatorB,2017,251:1-8.
[64] Yang X M,Li X,Zhang L Z,Gong J M.Biosens.Bioelectron.,2017,92:61-67.
[65] Zhao W W,Xu J J,Chen H Y.Chem.Rev.,2014,114:7421-7441.
[66] Wang G L,Liu K L,Shu J X,Gu T T,Wu X M,Dong Y M,Li Z J.Biosens.Bioelectron.,2015,9:106-112.
[67] Tu W W,Cao H J,Zhang L,Bao J C,Liu X H,Dai Z H.Anal.Chem.,2016,88:10459-10465.
[68] Wang H Y,Zhang Q H,Yin H S,Wang M H,Jiang W J,Ai S Y.Biosens.Bioelectron.,2017,95:124-130.
[69] Zhang X R,Xu Y P,Zhao Y Q,Song L,Li X H,Lin Y Y.Biosens.Bioelectron.,2013,39:338-341.
[70] Li Z P,Zhang J,Li Y X,Zhao S,Zhang P X,Zhang Y,Bi J S,Liu G H,Yue Z.Biosens.Bioelectron.,2018,99:251-258.
[71] Fan D W,Wang H Y,Khan M S,Bao C Z,Wang H,Wu D,Wei Q,Du B.Biosens.Bioelectron.,2017,97:253-259.
[72] Liu M C,Ding X,Yang Q W,Wang Yu,Zhao G H,Yang N J.J.Hazard.Mater.,2017,331:309-320.
[73] Fan D W,Ren X,Wang H Y,Wu D,Zhao D,Chen Y C,Wei Q,Du B.Biosens.Bioelectron.,2017,87:593-599.
[74] Liu F,Zhang Y,Yu J H,Wang S W,Ge S G,Song X R.Biosens.Bioelectron.,2014,51:413-420.
[75] Zhang X R,Liu M S,Liu H X,Zhang S S.Biosens.Bioelectron.,2014,56:307-312.
[76] Wang K W,Zhang R H,Sun N,Li X P,Wang J,Cao Y,Pei R J.ACS.Appl.Mater.Interfaces,2016,8:25834-25839.
[77] Li R Y,Zhang Y,Tu W W,Dai Z H.ACS.Appl.Mater.Interfaces,2017,9:22289-22297.
[78] Li H X,Hao W L,Hu J C,Wu H Y.Biosens.Bioelectron.,2013,47:225-230.
[79] Zhao S,Zhang J,Li Z P,Zhang P X,Li Y X,Liu G H,Wang Y,Yue Z.Microchim.Acta,2016,3:677-686.
[80] Yu Z Z,Lv S Z,Ren R R,Cai G N,Tang D P.Microchim.Acta,2017,3:799-806.
[81] Ding L H,Ma C,Li L,Zhang L N,Yu J H.J.Electroanal.Chem.,2016,783:176-181.

