超高效液相色谱-三重四极杆质谱法测定保健食品中30种非法添加壮阳类化合物
孙 健,胡 青,张 甦,冯 睿,于 泓,张静娴,诸艳蓉,毛秀红,季 申
(上海市食品药品检验所,上海 201203)
随着生活水平的提高,我国抗疲劳类保健食品市场销量与日俱增。但少数违法分子为了突出功效、吸引消费者,牟取暴利,在产品中非法添加短期内见效快、成本相对低廉的壮阳类化学药物。非法添加的壮阳类药物主要是以西地那非等为代表的磷酸二酯酶5(PDE-5)抑制剂类化合物。目前上市的PDE-5抑制剂主要有西地那非、伐地那非、他达拉非、阿伐那非、乌地那非、米罗那非、欧迪那非[1]。
非法添加该类化合物将给消费者带来严重的健康威胁,其不良反应主要表现在中枢神经、循环和视觉系统,较为严重不良反应为心律失常、心肌梗死、心脏猝死、脑血管出血、高血压等[2]。
该类化合物的检测多采用高效液相色谱法[3-5]、液相色谱-质谱联用法等,质谱可采用三重四极杆[6-7]、飞行时间[8-10]、静电场轨道阱[11]、原位电离[12-14]等技术。其中,飞行时间质谱和静电场轨道阱质谱为高分辨质谱,可进行定性筛查和未知物结构确证;原位电离技术主要用于快速筛查;三重四极杆质谱定量相对准确,操作简便,适合基层检测机构使用。另外,采用近红外光谱[15]、拉曼光谱[16]、核磁共振法[17]、离子迁移谱法[18]检测西地那非等1~7种常见壮阳类化合物的研究亦有报道。
目前,我国有4项相关检测标准。国家药品补充检验方法和检验项目批准件2009030、食药监食监三[2016]28号文附件7和国家食品补充检验方法BJS201601[19]均采用液质联用技术测定了11个化合物(西地那非、他达拉非、伐地那非、红地那非、那红地那非、羟基豪莫西地那非、豪莫西地那非、氨基他达拉非、硫代艾地那非、伪伐地那非、那莫西地那非)。由本研究团队牵头起草的国家食品补充检验方法BJS 201704补充检测了去甲基他达拉非、硫代西地那非[20-21]。但随着新型衍生物的不断出现,如近年来国内报道的化合物丙氧基苯基西地那非(Propoxyphenyl sildenafil)[22]、丙氧基苯基艾地那非(Propoxyphenyl aildenafil)[23]、丙氧基苯基硫代艾地那非(Propoxyphenyl thioaildenafil)、艾地那非、羟基硫代豪莫西地那非[24]、甲羟基豪莫西地那非[25]、2-羟乙基去甲他达拉菲(2-Hydroxyethylnortadalafil)[26]等。因此,上述标准已不能有效打击此类新型衍生物的违法添加行为,且衍生物多缺乏系统全面的药理毒理学以及临床研究,其滥用可能会带来更严重的后果。
多数文献方法检测的化合物较少,一般测定10种以下。仅文献[7]同时测定了17种壮阳类化合物,但化合物种类仍不够全面,且回收率等方法学验证未严格按照GB/T27404-2008[27]进行。其他检测20种以上化合物的方法[8,10]均采用高分辨质谱,侧重于定性筛查。本文选择日常监测中发现的易被添加的30种化合物作为检测指标,建立了超高效液相色谱-三重四极杆质谱法进行测定,该方法定性定量准确,操作简便,适用于基层检测机构,可为国家标准的建立提供参考。
1 实验部分
1.1 仪器与试剂
Agilent 1290/6495超高效液相色谱-串联三重四极杆质谱仪;Waters CORTECS T3色谱柱(100 mm×2.1 mm,2.7 μm)。30种对照品的来源及相关信息见表1;乙腈、甲酸(色谱纯,Merck公司);甲醇(分析纯,上海凌峰化学试剂有限公司)。
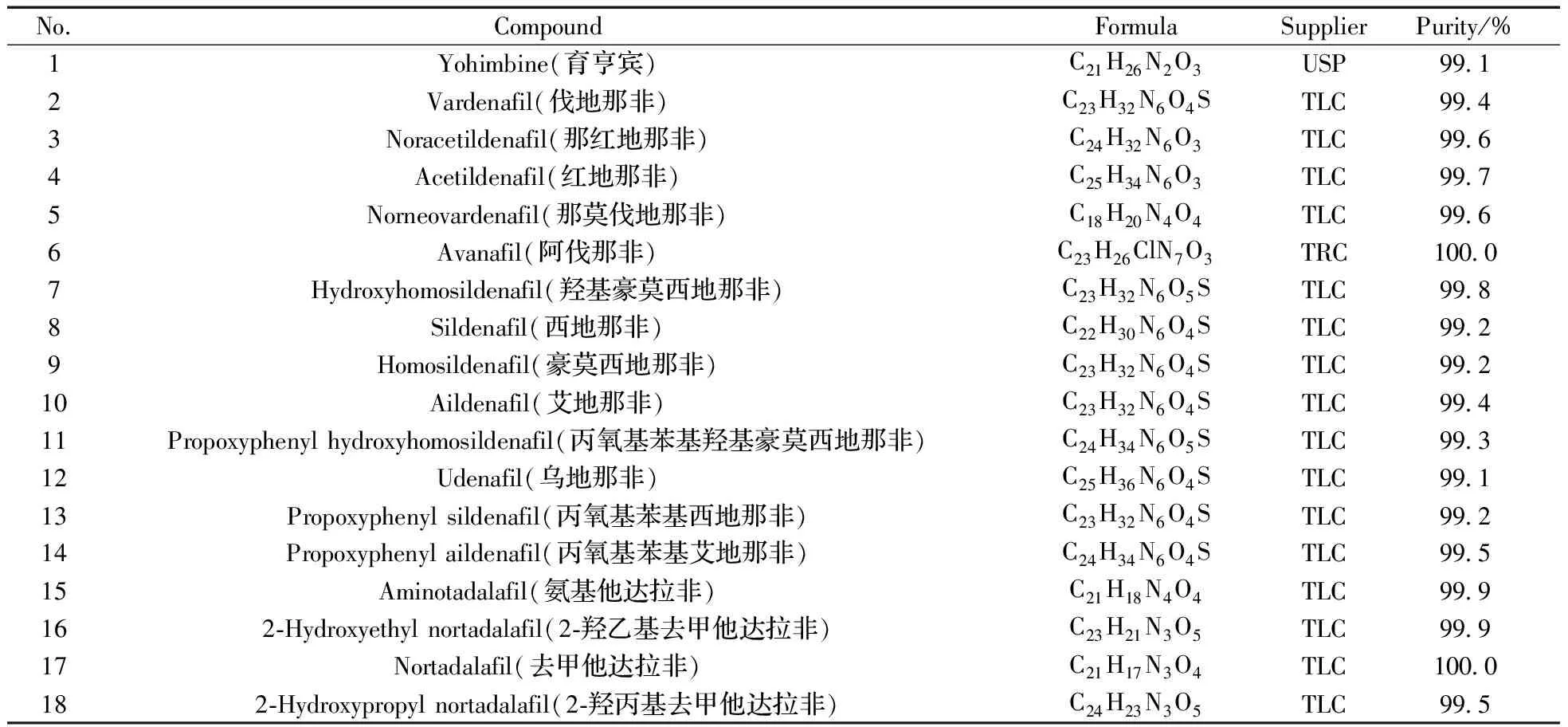
表1 30种化合物的对照品信息Table 1 Information of the 30 reference compounds

(续表1)
1.2 分析条件
色谱柱:Waters CORTECS T3色谱柱(100 mm×2.1 mm,2.7 μm);柱温:30 ℃;流动相:A为0.1%甲酸溶液,B为含0.1%甲酸的乙腈溶液;梯度洗脱程序:0~15 min,95%~2%A;15~18 min,2%A;流速:0.3 mL/min,进样量:1 μL。
离子源:电喷雾离子(ESI)源,正离子模式;离子源温度:200 ℃;毛细管电压:4 000 V;干燥气流量:12 L/min;雾化气压力:25 psi;鞘气温度:250 ℃;鞘气流量:10 L/min;喷嘴电压:500 V;采用多反应监测(MRM)方式检测。30种化合物的母离子、子离子和碰撞能量(CE)见表2。

表2 30种化合物的母离子、子离子、碰撞能量和线性关系Table 2 Precursor ions,product ions,collision energies(CEs) and linearationship of 30 compounds
*quantitative ion
1.3 对照品溶液的制备
分别取30种对照品适量,精密称定,用甲醇或空白基质提取液溶解并配制成质量浓度分别为10、20、50、100、200 μg/L的系列混合对照品溶液。
1.4 供试品溶液的制备
1.4.1固体样品取适量固体样品,混匀,研细,准确称取1.0 g粉末,置于具塞试管中,加入10 mL甲醇,密塞,称重,超声提取10 min,放冷至室温后,再次称重,用甲醇补足减失的重量,摇匀,离心,取上清液,根据实际浓度适当稀释至线性范围内,作为供试品溶液。
1.4.2液体样品取适量液体样品,混匀,准确量取1.0 mL,置于具塞试管中,加入9 mL甲醇,密塞,称重,超声提取10 min,放冷至室温后,再次称重,用甲醇补足减失的重量,摇匀,离心,取上清液,根据实际浓度适当稀释至线性范围内,作为供试品溶液。
2 结果与讨论
2.1 色谱条件的优化
因本方法中待测化合物均为正离子模式采集,故在流动相中添加0.1%甲酸,以增加正离子的响应信号。采用梯度洗脱,流动相条件优化后可将豪莫西地那非、艾地那非、丙氧基苯基西地那非和硫代豪莫西地那非、硫代艾地那非两组同分异构体有效分离。
比较了Waters CORTECS T3(2.1 mm×100 mm,2.7 μm)、Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱对待测化合物的分离效果及回收率,结果均可满足分析仪器的要求。考虑到保健食品的基质均较复杂,对色谱柱的使用寿命有一定要求,而后者进行复杂基质检测时,色谱柱寿命不如前者,故最终选择Waters CORTECS T3(2.1 mm×100 mm,2.7 μm)色谱柱对待测化合物进行分离。另外,考虑到保健品基质复杂,强保留成分多,因此待所有组分全部出峰后,采用高比例有机相充分清洗色谱柱,以避免残留基质对后续样品的影响。
2.2 质谱条件的优化
30种化合物的电喷雾离子化效果均较好,故采用电喷雾离子化源进行分析。分别用甲醇溶解30种化合物,配制质量浓度为0.5 mg/L的对照品溶液,采用Agilent MassHunter Optimizer软件自动优化质谱条件,使用单针自动进样分析目标化合物,在正离子模式下进行全扫描,确定30种化合物的分子离子,将分子离子作为母离子,施加一定的碰撞能量,全扫描二级离子,选取丰度较高的2个子离子分别作为定量和定性离子,以MRM模式优化碰撞能量(V)、碎裂电压(V)等质谱参数。优化条件下,30种化合物的MRM色谱图见图1。

图1 30种化合物的MRM色谱图Fig.1 MRM chromatogram of 30 compouds
2.3 供试品溶液的制备考察
对比了甲醇和乙腈作为提取溶剂时对30种化合物的提取效果,结果表明乙腈与甲醇的提取结果基本一致,但30种化合物在甲醇中的溶解性较好,综合考虑成本、试剂毒性等因素,最终确定甲醇为提取试剂。
以保健酒为例对前处理进行研究,比较了Waters Prime HLB固相萃取柱净化方法(图2中Method 1)和甲醇直接超声提取(图2中Method 2)的实验效果。结果显示,HLB固相萃取柱净化方法的回收率与甲醇直接超声提取相差不大。因甲醇超声提取操作简便,最终确定其为前处理方法。
2.4 基质效应的考察
以保健酒为例考察基质效应,研究显示,采用溶剂甲醇配制标准曲线时,8种化合物的回收率低于80%,偏差较大,基质效应严重。故采用空白基质提取液,配制基质对照品溶液(图2中Method 3)。结果表明,以空白基质配制标准曲线可使多数化合物的回收率得到明显改善,仅那红地那非和红地那非的回收率低于80%。

图2 样品前处理和基质效应的考察Fig.2 Study of sample preparation and matrix effectthe numbers denoted were the same as those in Table 1
2.5 方法学验证
2.5.1线性关系在上述优化条件下,对系列混合对照品溶液进样分析,以化合物的峰面积(y)为纵坐标,对应的质量浓度(x,μg/L)为横坐标进行线性回归,结果见表2。结果表明,30种化合物在10~200 μg/L范围内线性关系良好,相关系数(r)均大于0.99。
2.5.2专属性选择牡蛎片和保健酒2种基质作为固态和液态保健食品的代表基质。取牡蛎片和保健酒2种空白基质,按供试品溶液制备方法配制空白溶液,进样分析,结果均未检出该30种化合物。
2.5.3加标回收率及精密度取上述2种基质,分别添加低(0.1 mg/kg)、中(0.2 mg/kg)、高(1.0 mg/kg) 3个水平的对照品溶液,每个水平做6个平行样,按上述供试品溶液制备方法和色谱-质谱条件进行分析,计算加标回收率和相对标准偏差(见表3)。30种化合物的平均加标回收率为62.8%~135.2%,RSD均不大于14%。液体基质中仅那红地那非和红地那非的回收率低于80%;固体基质中仅氨基他达拉非的回收率低于80%,硫代艾地那非的回收率大于120%;其余26种化合物的回收率及精密度均符合GB/T 27404-2008(实验室质量控制规范 食品理化检测)要求。
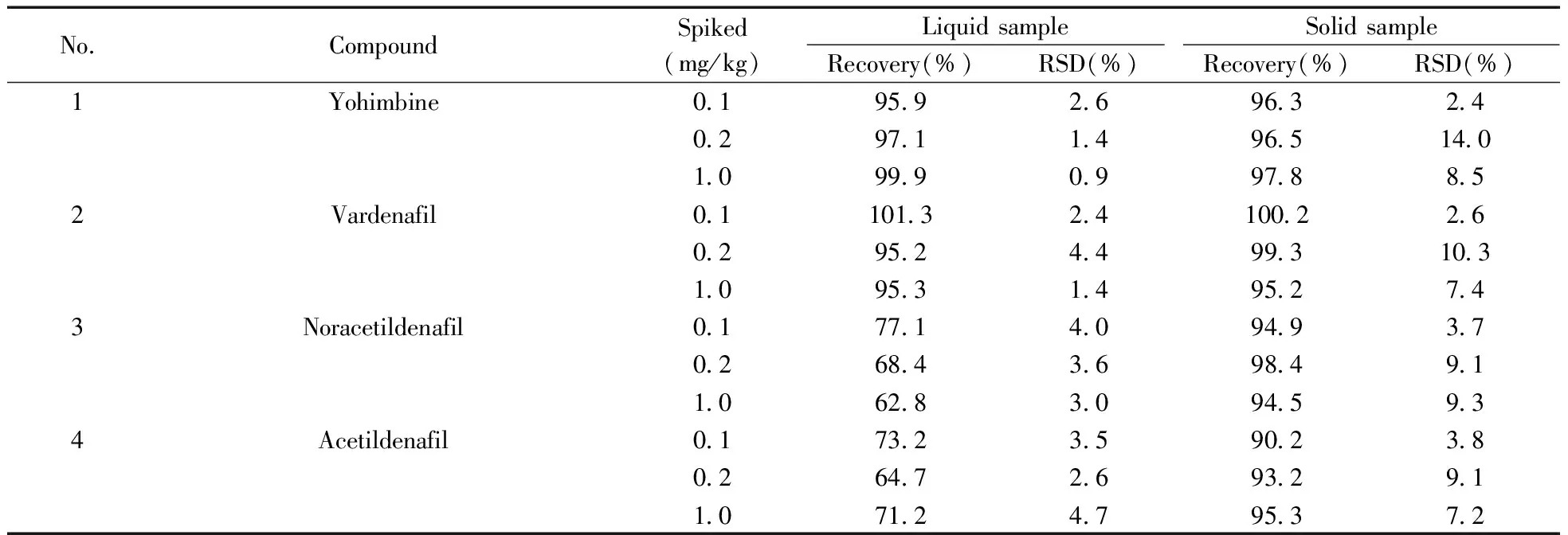
表3 30种化合物的加标回收率及相对标准偏差(n=6)Table 3 Recoveries and RSDs of 30 compounds(n=6)

(续表3)
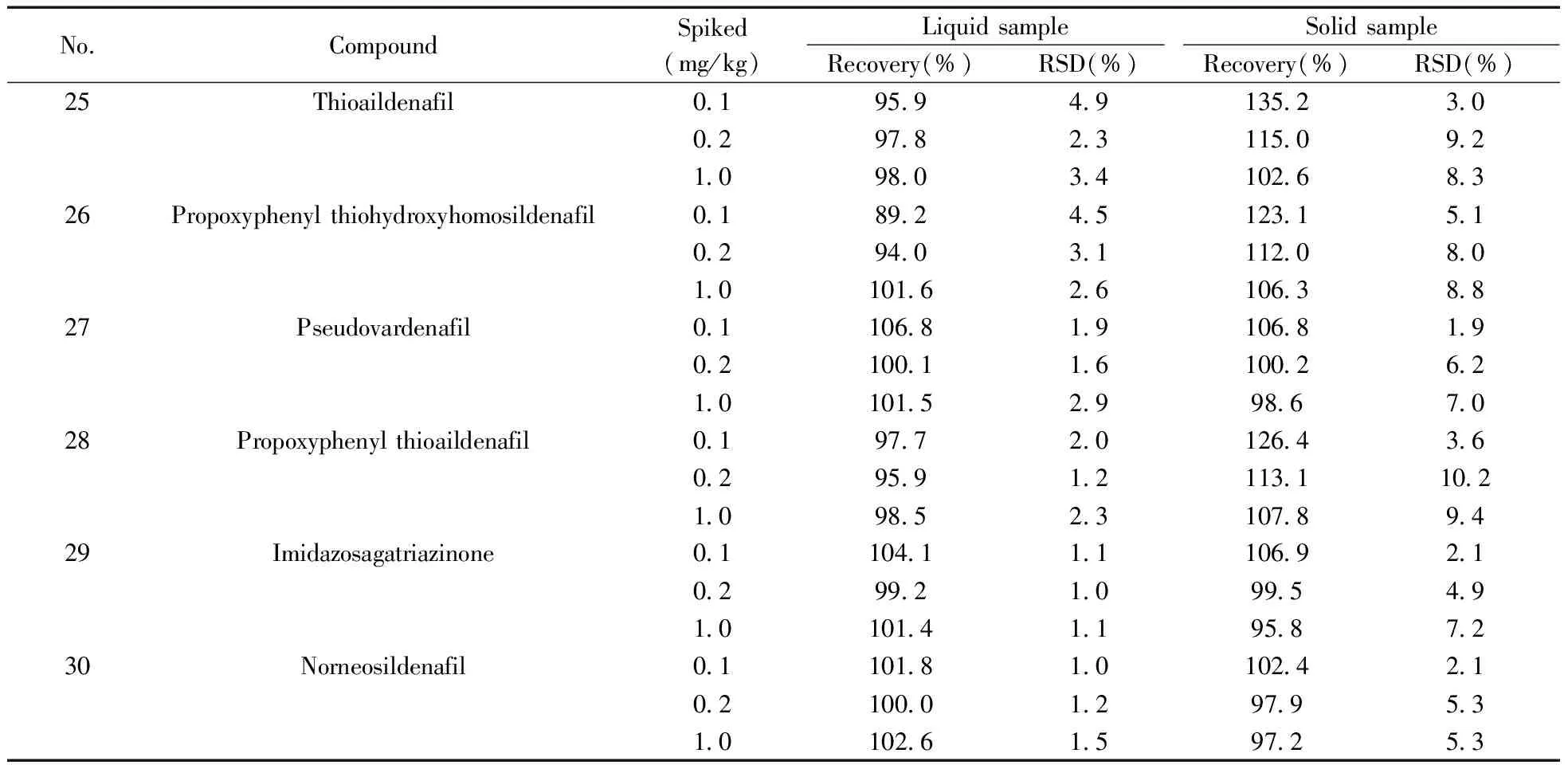
(续表3)
2.5.4检出限与定量下限向基质中添加0.05 mg/kg的30种化合物,以能实际检出的最低含量作为检出限(LOD),以回收率符合要求的最低含量作为定量下限(LOQ)。结果表明,30种化合物的LOD为0.05 mg/kg(固体)或0.05 mg/L(液体),LOQ为0.1 mg/kg(固体)或0.1 mg/L(液体)。
他达拉非、西地那非的临床用量分别为10 mg/次和50 mg/次。以每次服用保健食品1 g计,起效非法添加的含量分别为10 mg/g和50 mg/g,本方法的检出限和定量下限可满足日常非法添加剂量检测的监管需求。
2.6 定性判断方法
保健食品中添加的化学药品为禁用物质,测定方法应首先确保定性准确。本课题组已建立了31种壮阳类化合物的Q-TOF高分辨质谱筛查方法[8],但受限于基层实验室仪器、人员等因素,方法推广不易,且监管方时常需要定量结果。故本研究采用易于标准化操作的三重四极杆质谱建立测定方法,同时兼顾定性定量的准确性。
根据欧盟SANCO/12571/2013的规定,三重四极杆方法确证化合物至少需要两个子离子,且浓度相当的供试品溶液和标准溶液相对离子丰度一致(相对比例>50%,允许±20%偏差;相对比例>20%~50%,允许±25%偏差;相对比例>10%~20%,允许±30%偏差;相对比例≤10%,允许±50%偏差)。
2.7 实际样品的测定

表4 实际样品的检测结果Table 4 Detection results of real samples
表4列出了保健食品中非法添加化学药品实际检测工作中两百余批涉案专项阳性样品的检测结果。结果表明,添加化合物主要为西地那非和他达拉非,亦存在同时添加多种化合物的现象,且含量差异较大,安全风险高。
3 结 论
本研究建立了超高效液相色谱-三重四极杆质谱测定30种壮阳类化合物的分析方法,增加了现有国家标准中检测化合物的种类,定性定量准确,操作简便,已应用于实际样品检测,可为国家标准的建立提供参考。
参考文献:
[1] Feng J,Zhu S X,Xu S W,Shi Y.Chin.J.Pharm.(冯金,朱少璇,许淑文,石瑛.中国医药工业杂志),2016,47(8):1085-1092.
[2] Yu Q B,Xu L,Xiao Z M.HeraldofMedicine(余庆斌,徐玲,肖志梅.医药导报),2012,31(7):959-961.
[3] Xing J B,Cao H,Zhang J,Shan T T,Shui C H,Chen Y M,Hu D.LishizhenMed.Mater.Med.Res.(邢俊波,曹红,张炯,单婷婷,水彩红,陈玉梅,胡丹.时珍国医国药),2014,25(2):451-453.
[4] Lei Y,Huang Y T,Chen L,Zhang R.Phys.Test.Chem.Anal.:Chem.Anal.(雷毅,黄艳婷,陈林,张荣.理化检验:化学分册),2016,52(3):249-254.
[5] Lei Y,Huang Y T,Luo Z Y.Phys.Test.Chem.Anal.:Chem.Anal.(雷毅,黄艳婷,罗卓雅.理化检验:化学分册),2014,50(5):530-535.
[6] Zhang J,Ding T,Liu Y,Lü C,Fei X Q,Shen C Y,Wu B,Zhang R,Guo L,Ji M Q,Wang X L,Huang Z Q.Environ.Chem.(张健,丁涛,刘芸,吕辰,费晓庆,沈崇钰,吴斌,张睿,郭玲,季美泉,王栩璐,黄志强.环境化学),2016,35(2):415-418.
[7] Huang F,Wu H Q,Huang X L,Luo H T,Zhu Z X,Lin X S,Ma L G,Jiang Y L.Chin.J.Chromatogr.(黄芳,吴惠勤,黄晓兰,罗辉泰,朱志鑫,林晓珊,马立果,蒋娅兰.色谱),2016,34(3):270-278.
[8] Yu H,Hu Q,Zhang S,Sun J,Feng R,Ji S.Chin.Pharm.J.(于泓,胡青,张甦,孙健,冯睿,季申.中国药学杂志),2013,48(15):1312-1318.
[9] Hu T T,Qu X Y,Kang M Q,Song Q L,Yang L,Zhao Y H,Zhang D H.Chin.J.Chromatogr.( 胡婷婷,曲晓宇,康明芹,宋清莲,杨璐,赵韫慧,张代辉.色谱),2015,33(8):897-901.
[10] Wang M L,Zeng L,Yan H F,Li Y J,Dai H.J.Instrum.Anal.(王美玲,曾乐,颜鸿飞,李拥军,戴华.分析测试学报),2014,33(3):239-247.
[11] Liu Y,Ding T,Liao X Q,Shen C Y,Jiang S,Lü C,Gui Q W,Liu H,Fei X Q,Wu B,Zhang R,Wang Y,Ji M Q,Wang X L,Huang Z Q.Chin.J.Anal.Chem.(刘芸,丁涛,廖雪晴,沈崇钰,姜珊,吕辰,桂茜雯,柳菡,费晓庆,吴斌,张睿,王艳,季美泉,王栩璐,黄志强.分析化学),2016,44(3):423-429.
[12] Cheng X L,Li W J,Li W J,Wei F,Xiao X Y,Lin R C.Chin.J.Pharm.Anal.(程显隆,李文杰,李卫健,魏锋,肖新月,林瑞超.药物分析杂志),2011,31(3):438-442.
[13] Wu S,Wang H,Zhu H G,Zhao Y,Tian Q Q,Sun W J,Ding L,Chen B.Chin.J.Anal.Chem.(吴双,王华,朱慧果,赵勇,田清青,孙文剑,丁力,陈波.分析化学),2012,40(7):1081-1085.
[14] Wan P,Lu Y H,Chen B.Chin.J.FoodHyg.(万萍,卢岳华,陈波.中国食品卫生杂志),2017,29(4):459-463.
[15] Wang X L,Feng Y C,Hu C Q.Chin.J.Anal.Chem.(王学良,冯艳春,胡昌勤.分析化学),2009,37(12):1825-1828.
[16] Wang Y,Cao L,Luo J N.Chin.Pharm.J.(王玉,曹玲,罗疆南.中国药学杂志),2011,46(10):789-793.
[17] Zhang Z Q,Wang L J,An D G,Tu G Z,Zhao Y.J.Instrum.Anal.(张志强,王丽娟,安东各,涂光忠,赵阳.分析测试学报),2017,36(2):257-261.
[18] Feng X,Yin L H,Jin S H,Zhu L.Chin.J.Pharm.Anal.(冯雪,尹利辉,金少鸿,朱俐.药物分析杂志),2016,36(2):313-320.
[19] China Food and Drug Administration.No.196 Bulletin of the China Food and Drug Administration.2016(国家食品药品监督管理总局.总局公告2016年第196号).[2016-12-26].http://www.sda.gov.cn/WS01/CL1830/167963.html.
[20] China Food and Drug Administration.No.48 Bulletin of the China Food and Drug Administration.2017(国家食品药品监督管理总局.总局公告2017年第48号).[2017-05-05].http://www.sda.gov.cn/WS01/CL1830/172345.html.
[21] Jin S M,Gao W C,Ning X,Cao J,Ding H.J.FoodSaf.Qual.(金绍明,高文超,宁霄,曹进,丁宏.食品安全质量检测学报),2017,8(7):2448-2452.
[22] Sun J,Yu H,Hu Q,Feng R,Zhang S,Ji S.ActaPharm.Sin.(孙健,于泓,胡青,冯睿,张甦,季申.药学学报),2014,49(4):513-516.
[23] Zhou J L,Zhou Z,Chen B L,Ma L K.J.Chin.MassSpectrom.Soc.(周建良,周哲,陈碧莲,马临科.质谱学报),2016,37(5):422-430.
[24] Duan Q,Ma C Y,Feng S H.Chin.J.Pharm.Anal.(段琼,马春艳,封淑华.药物分析杂志),2017,37(2):277-282.
[25] Huang C H,Cai D D,Chen Z Y.Chin.J.Pharm.Anal.(黄朝辉,蔡丹丹,陈仲益.药物分析杂志),2015,35(4):694-698.
[26] Feng R,Yu H,Sun J,Hu Q,Zhang S,Mao X H,Ji S.J.FoodSaf.Qual.(冯睿,于泓,孙健,胡青,张甦,毛秀红,季申.食品安全质量检测学报),2016,7(7):2710-2714.
[27] GB/T 27404-2008.Criterion on Quality Control of Laboratories——Chemical Testing of Food.National Standards of the People′s Republic of China(实验室质量控制规范 食品理化检测.中华人民共和国国家标准).

