糖尿病前期与高血压发病风险的相关性研究
史 荣
(贵州省遵义市第一人民医院内分泌科 563000)
糖尿病前期是指血糖处于正常范围到糖尿病诊断界值之间的过渡水平,包括两类人群:空腹葡萄糖调节受损(impaired fasting glucose,IFG)和糖耐量受损(impaired glucose tolerance,IGT)。IGT与IFG通常同时存在,并与2型糖尿病以及动脉硬化相关性心血管疾病发生风险升高相关[1-4]。随着现代社会工业化、城市化不断加深,人类的饮食结构及生活习惯等也发生着相应改变,高血压作为当今社会最常见的心血管疾病之一,在世界范围内的流行程度也处于不断攀升的状态[5]。
既往研究表明,高血压患者中糖尿病前期的患病率较血压正常人群显著升高[6-7]。2016年来自于湖北省的一项横断面研究显示,与糖代谢正常人群相比,糖尿病患者的高血压患病风险显著升高(OR=3.87,95%CI:3.30~4.52)[8]。值得注意的是,同为代谢综合征的重要组分,血糖调节异常与高血压具有共同的危险因素,互相影响,互相促进[9]。2016年发表在《BMC Endocr Disord》杂志的一项横断面研究表明,在中国大于或等于65岁的老年人群中,IFG与高血压患病风险升高显著相关[10]。另外一项来自伊朗的随访研究同样表明,基线水平处于糖尿病前期的患者不论血压处于正常水平还是处于高血压前期水平,未来高血压的发生风险均显著升高[11]。因此,本研究旨在通过临床随访队列人群探讨糖尿病前期状态与新发高血压风险的相关性。
1 资料与方法
1.1一般资料 在2010年2月至2011年4月在本院内分泌科门诊及病房就诊患者以及来院体检者中,根据75 g口服葡萄糖耐量测试(oral glucose tolerance test,OGTT)结果,分别收集既往无高血压病史、目前血压正常且无降压药服用史的糖耐量正常者以及糖尿病前期患者(包括IFG和/或IGT患者)各200例。既往有肾脏疾病(包括急慢性肾炎、肾衰竭)、肝功能异常[血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)或者谷氨酰转肽酶(gamma-glutamyltransferase,GGT)升高大于正常值3倍]、肾功能异常(血肌酐大于或等于 134 μmol/L)以及有恶性肿瘤病史的患者不纳入到本研究当中。2014年3月至2015年5月对研究对象进行随访调查,糖尿病前期组共随访到146例研究对象,其中69例仍处于糖尿病前期的研究对象被纳入到本研究的分析当中。糖耐量正常组共随访到140例研究对象,其中102例研究对象仍处于糖耐量正常状态被纳入到本研究的分析当中。
1.2方法 问卷调查:本研究对每一位入组的研究对象通过问卷调查形式进行信息采集,收集研究对象的性别、出生日期、联系方式等基本信息以及基本临床信息,包括家族史、既往病史、用药史、生活方式(主要包括吸烟饮酒情况、体育活动情况等)。
人口学指标:研究对象接受常规体格检查,包括腰围、臀围、身高、体质量、静息状态血压等。
实验室检查:本研究于入组时及随访时分别对每位研究对象进行2次75 g OGTT检测,要求研究对象于夜间空腹至少10 h后进行。并对研究对象的空腹血糖,OGTT 2 h血糖、空腹胰岛素、OGTT 2 h胰岛素、糖化血红蛋白、三酰甘油、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇等生化指标进行了测定。胰岛素敏感性的评估采用的是胰岛素抵抗指数稳态模型评估法(homeostasis model of assessment for insulin resistence index,HOMA-IR),计算公式为:HOMA-IR=空腹血糖×空腹胰岛素/22.5。
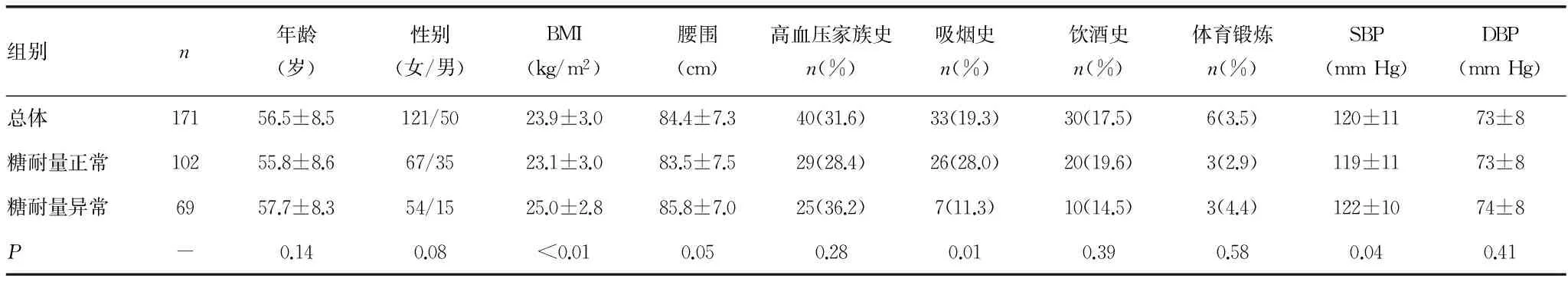
表1 基线临床指标比较

续表1 基线临床指标比较
1.3诊断标准 糖尿病前期根据世界卫生组织1999年发布的诊断标准[12]:6.1 mmol/L≤空腹血糖<7.0 mmol/L和/或7.8 mmol/L≤OGTT 2 h血糖<11.1 mmol/L,且既往无糖尿病病史,无口服降糖药或胰岛素使用史。高血压是根据国际联合委员会发布的第7版指南(Joint national committee,JNC7)进行诊断:收缩压(SBP)≥140 mm Hg和/或舒张压(DBP)≥90 mm Hg。新诊断高血压定义为随访调查时血压测量结果符合上述任一指标或者随访期间有降压药用药史。胰岛素抵抗定义为HOMA-IR≥2.5[13]。

2 结 果
2.1基线临床指标比较 本研究共纳入171例研究对象,平均随访时间为3.76年,其中102例研究对象随访期间处于糖耐量正常水平,69例研究对象随访期间处于糖尿病前期状态。研究对象平均年龄为(56.5±8.5)岁,男50例(29.2%),女121例(70.8%)。两组人群年龄、性别构成差异无统计学意义。通过对两组研究对象的基本临床特征及生化指标比较,结果显示,持续处于糖尿病前期状态的人群具有更高的体质量指数(body mass index,BMI)、SBP水平、空腹及OGTT 2 h血糖、空腹及OGTT 2 h胰岛素水平、糖化血红蛋白水平、三酰甘油、总胆固醇水平以及胰岛素抵抗患病率(P<0.05)。另外,与糖耐量正常组相比,糖尿病前期人群吸烟者比例较低(P<0.05),见表1。
2.2糖尿病前期状态与新发高血压风险的相关性 随访结果表明,持续处于糖尿病前期组高血压发病率为30.4%,显著高于糖耐量正常组的12.8%(P<0.05),见表2。在新发高血压人群中,糖尿病前期以及胰岛素抵抗的患病率(分别为61.76%和29.41%)均显著高于未发生高血压人群(分别为35.04%和9.49%,P<0.05)。Logistic回归模型分析表明,持续处于糖尿病前期状态可以显著增加高血压发病风险,OR(95%CI):2.99(1.38~6.51)。在矫正年龄、性别、BMI、腰围、高血压家族史、吸烟饮酒状态、体育活动、总胆固醇、三酰甘油水平等混杂因素后,结果保持显著:OR(95%CI):2.76(1.08~7.03),见表2。
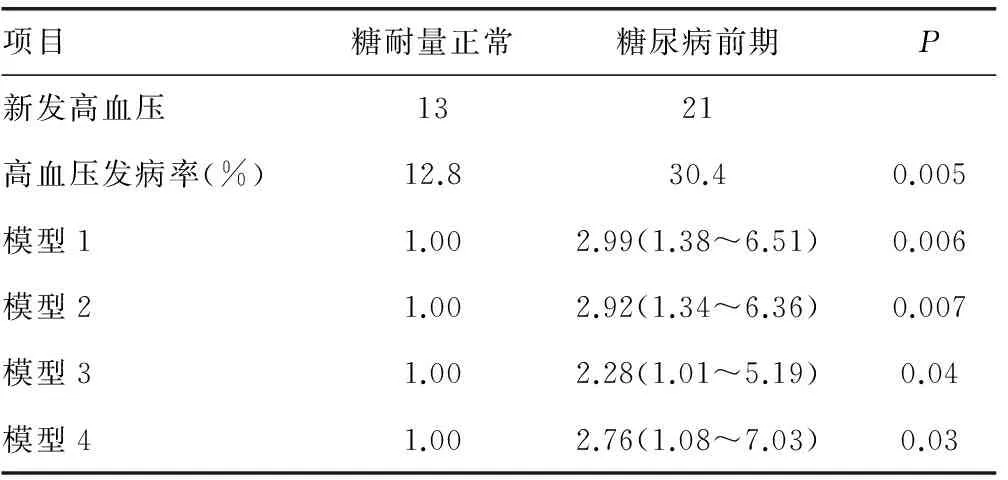
表2 Logistic回归分析糖尿病前期与新发高血压发生风险相关性
模型1:未校正;模型 2:矫正了基线年龄;模型3:在模型2的基础上校正了基线性别,体质量指数,腰围;模型4:进一步校正了高血压家族史、吸烟、饮酒状态,体育活动,总胆固醇,三酰甘油
3 讨 论
本研究通过对临床病例的收集和随访,发现糖尿病前期状态与高血压发生风险升高显著相关。与此同时,本研究还发现新发高血压患者中糖尿病前期及胰岛素抵抗的患病率均显著高于未发生高血压的人群。既往有关持续处于糖尿病前期与高血压发生风险相关性的研究尚少,本研究结果提示,即便未达到糖尿病诊断标准,长期处于糖尿病前期状态仍是高血压发病的重要危险因素,与持续处于血糖正常者相比,糖尿病前期状态及其伴随的胰岛素抵抗状态均与高血压发病风险升高相关。
糖尿病前期是机体对胰岛素利用率下降的临床表现之一,其中IFG主要与肝脏胰岛素抵抗有关,而糖耐量减低主要与肌肉组织胰岛素抵抗有关。上述复杂的病理生理机制可能参与到糖尿病前期增加高血压发生风险的作用当中。FAGOT等[14]的一项研究表明,高胰岛素血症以及血糖调节异常均是高血压发病的危险因素。另外一项来自日本的前瞻性研究也发现IFG是高血压发病的危险因素[15]。然而,中国香港一项评估心血管疾病危险因素的人群队列研究则发现IFG与高血压发病风险无显著相关性[16]。VACCARO等[17]对IGT与高血压发病风险相关性进行了分析,结果也提示,IGT在基线横断面水平与血压升高相关,但并不能预告高血压发病风险。上述既往研究结论尚具争议,本研究通过临床随访观察,排除随访期间糖耐量状态的变化,有针对性地将持续处于糖尿病前期状态的患者与随访期间糖耐量正常者进行比较,探讨两种糖代谢状态与高血压发病风险的相关性,为进一步人群调查研究及机制研究提供参考。
本研究发现,新发高血压人群胰岛素抵抗的患病率显著高于血压正常人群,且糖尿病前期患者胰岛素抵抗患病率也显著高于糖耐量正常人群。越来越多的研究提示,胰岛素抵抗对肾脏及水钠代谢平衡的不良影响在高血压发病的病理过程中扮演重要角色。胰岛素可以加强远曲小管对钠的重吸收,主要是通过提高钠转运通道的表达,并降低钠的排出[18]。水钠潴留是高血压发病的病理过程中的重要环节,高胰岛素血症还可以通过对近端小管钠-氢交换作用的加强促进水钠潴留的发生和发展,并最终导致高血压的发生[18]。与此同时,尿酸与钠在肾脏代谢途径类似,水钠潴留同样导致尿酸排泄降低,而高尿酸血症在高血压患者中十分常见,进一步成为高血压发病过程中的促进因素之一[19]。另外,高胰岛素血症所致的氧化应激状态对高血压的发生也产生一定促进作用[20]。主要是通过使机体对血管收缩及加压物质如血管紧张素Ⅱ等反应增强从而促进收缩压的升高[21-22]。血管内皮细胞如上皮细胞、平滑肌细胞等可以通过作用于黄嘌呤氧化酶及一氧化氮合酶,产生不同种类的过氧化物,这些物质可以通过直接组织损伤、降低具有生物活性一氧化氮水平及其相关的血管舒张功能等途径对血管内皮功能造成损伤[23]。而慢性炎症状态及氧化应激可以促进脂肪组织中血管紧张素原及血管紧张素Ⅱ的释放,从而激活体内ROS系统,最终导致血压升高[24]。
本研究也有一些不足:研究对象为院内收集病例,主要为中老年人群,故尚不能代表普通人群。本研究人群以女性为主,可能与男性和女性在社会参与度及配合度方面存在差异所致,但在本研究中,NGR及IGR人群无性别比例差异(P>0.05)。另外,本研究随访率相对偏低,可能是由于研究对象为中老年人群,依从性不高所致。综上所述,本研究可为糖尿病前期人群高血压的防治策略提供一定参考,但仍需长期随访的大样本随机抽样队列研究进一步探讨。有关糖尿病前期与高血压发生风险升高的内在机制仍有待进一步研究。
高血压是心血管疾病以及慢性肾病的重要危险因素之一,如同时伴有糖尿病则其升高心血管疾病风险的作用尤为加强,给社会和家庭带来沉重的医疗负担[25]。众所周知,糖尿病前期是糖尿病发生风险升高的重要预告因子,本研究发现,持续处于糖尿病前期的患者较糖耐量正常者高血压发生风险显著升高。因此,虽然未达到糖尿病诊断标准,医生在临床工作中仍应提高对糖尿病前期患者的重视,加强其血糖的监测及控制力度,积极采取饮食、锻炼等方式改善糖代谢状态,降低其糖尿病及高血压等心血管系统疾病的发生风险,提高患者的长期生活质量。
[1]VEGT F,DEKKER J M,JAGER A,et al.Relation of impaired fasting and postload glucose with incident type 2 diabetes in a Dutch population:The Hoorn Study[J].Jama,2001,285(16):2109-2113.
[2]FERRANNINI E,NANNIPIERI M,WILLIAMS K,et al.Mode of onset of type 2 diabetes from normal or impaired glucose tolerance[J].Diabetes, 2004, 53(1):160-165.
[3]BARR E L,BOYO E J,ZIMMET P Z,et al.Continuous relationships between non-diabetic hyperglycaemia and both cardiovascular disease and all-cause mortality:the Australian Diabetes,Obesity,and Lifestyle (AusDiab) study[J].Diabetologia,2009,52(3):415-424.
[4]NAKAGAMI T,GROUP D S.Hyperglycaemia and mortality from all causes and from cardiovascular disease in five populations of Asian origin[J].Diabetologia,2004,47(3):385-394.
[5]YACH D,HAWKES C,GOULD C L,et al.The global burden of chronic diseases:overcoming impediments to prevention and control[J].Jama,2004,291(21):2616-2622.
[6]CARNEVALE G P,FRA G P.Impaired glucose metabolism in hypertensive patients with/without the metabolic syndrome[J].Europ J Int Med,2014,25(5):477-481.
[7]MOZAFFARIAN D,MARFISI R,LEVANTESI G,et al.Incidence of new-onset diabetes and impaired fasting glucose in patients with recent myocardial infarction and the effect of clinical and lifestyle risk factors[J].Lancet,2007,370(9588):667-675.
[8]潘琦,郭立新,刘薇,等.湖北省15岁以上居民高血压患病状况分析[J].重庆医学,2016,45(18):2532-2534.
[9]丁贤彬,冯连贵,王豫林,等.重庆市部分农村居民高血压与糖尿病患病率及影响因素分析[J].重庆医学,2015,44(35):5112-5115.
[10]YAN Q,SUN D,LI X,et al.Association of blood glucose level and hypertension in Elderly Chinese Subjects:a community based study[J].BMC Endocr Disord,2016,16(1):40.
[11]DERAKHSHAN A,BAGHERZADEH KF,ARSHI B,et al.Different combinations of glucose tolerance and blood pressure status and incident diabetes,hypertension,and chronic kidney disease[J].J Am Heart Assoc,2016,5(8):e003917.
[12]GABIR M M,HANSON R L,DABELEA D,et al.The 1997 American Diabetes Association and 1999 World Health Organization criteria for hyperglycemia in the diagnosis and prediction of diabetes[J].Diabet Care,2000,23(8):1108-1112.
[13]YAMADA C,MITSUHASHI T,HIRATSUKA N,et al.Optimal reference interval for homeostasis model assessment of insulin resistance in a Japanese population[J].J Diabet Investig,2011,2(5):373-376.
[14]FAGOT C A,BALKAU B,SIMON D,et al.Is insulin an independent risk factor for hypertension? The Paris prospective study[J].Int J Epidemiol,1997,26(3):542-550.
[15]SUEMATSU C,HAYASHI T,FUJII S,et al.Impaired fasting glucose and the risk of hypertension in Japanese men between the 1980s and the 1990s[J].Diabet Care,1999,22(2):228-232.
[16]CHEUNG B M,WAT N M,MAN Y B,et al.Relationship between the metabolic syndrome and the development of hypertension in the Hong Kong Cardiovascular Risk Factor Prevalence Study-2 (CRISPS2)[J].Am J Hypertens,2008,21(1):17-22.
[17]VACCARO O,IMPERATORE G,IOVINO V,et al.Does impaired glucose tolerance predict hypertension? A prospective analysis[J].Diabetologia,1996,39(1):70-76.
[18]SONG J,HU X,RIAZI S,et al.Regulation of blood pressure,the epithelial sodium channel (ENaC),and other key renal sodium transporters by chronic insulin infusion in rats[J].Am J Physiol Renal Physiol,2006,290(5):1055-1064.
[19]MUSCELLI E,NATALI A,BIANCHI S,et al.Effect of insulin on renal sodium and uric acid handling in essential hypertension[J].Am J Hypertens,1996,9(8):746-752.
[20]COOPER S A,WHALEY-CONNELL A,HABIBI J,et al.Renin-angiotensin-aldosterone system and oxidative stress in cardiovascular insulin resistance[J].Am J Physiol Heart Circ Physiol,2007,293(4):2009-2023.
[21]JIA G,DEMARCO V G,SOWERS J R.Insulin resistance and hyperinsulinaemia in diabetic cardiomyopathy[J].Nat Rev Endocrinol,2016,12(3):144-153.
[22]ZHOU M S,LIU C,TIAN R,et al.Skeletal muscle insulin resistance in salt-sensitive hypertension:role of angiotensin II activation of NFkappaB[J].Cardiovasc Diabetol,2015,14:45.
[23]TANIYAMA Y,GRIENDLING K K.Reactive oxygen species in the vasculature:molecular and cellular mechanisms[J].Hypertension,2003,42(6):1075-1081.
[24]MASSIERA F,BLOCH-FAURE M,CEILER D,et al.Adipose angiotensinogen is involved in adipose tissue growth and blood pressure regulation[J].FASEB J,2001,15(14):2727-2729.
[25]EADDY M T,SHAH M,LUNACSEK O,et al.The burden of illness of hypertension and comorbid diabetes[J].Curr Med Res Opin,2008,24(9):2501-2507.

