血清MCP-1和CRP水平与老年冠心病的相关性研究
刘 丹,徐 敏,李 杰,颜 彦
(贵州省遵义市第一人民医院心血管内科 563000)
冠心病(coronary heart disease,CHD)是最常见的心脏病之一,患病率为0.15%,易感人群为45岁以上的男性和55岁以上或者绝经期的妇女,近年来,中老年人罹患CHD的概率越来越高[1-2]。CHD是由外界环境和炎症因子等遗传因素相互作用而引起的慢性炎症疾病[3]。各种炎症反应在多种急慢性炎症疾病的发生发展中起着重要作用,单核细胞趋化蛋白-1(MCP-1)和C反应蛋白(CRP)是非常关键的两个炎症因子,MCP-1促进慢性炎症反应,CRP促进急性炎症反应,在CHD的发生发展过程中至关重要[4-7]。MCP-1是一种单核细胞趋化蛋白,属于β亚家族趋化因子,在内皮细胞、平滑肌细胞和心肌细胞上高表达,在急性炎症条件下能够促使血液中的单核-巨噬细胞聚集到损伤的内皮下间隙并活化成巨噬细胞,刺激巨噬细胞不断吞噬类脂质并分化为形成富含胆固醇酯的泡沫细胞,MCP-1可促进多种炎症因子的产生并形成级联炎症反应,使内皮从抗凝-抗黏附状态转化为促凝-易黏附状态,促进动脉粥样硬化的发生发展,使CHD恶化[5];CRP是一种由肝脏合成的非特异性急性期炎症反应标志物,可激活经典的补体途径,增强白细胞的吞噬作用,调节淋巴细胞或单核-巨噬系统功能,促进巨噬细胞组织因子的生成[8]。目前,血清MCP-1和CRP浓度与CHD临床症状的相关性还有待进一步研究,本研究的目的在于探讨血清MCP-1和CRP于CHD临床症状的相关性。
1 资料与方法
1.1一般资料 2014年1月至2016年1月,收集本院共200例老年CHD患者作为观察组,其中,男120例,女80例,平均(65.10±8.75)岁;纳入标准:年龄大于60岁;有典型的心绞痛症状且经冠状动脉造影确诊为CHD;既往无经皮冠状动脉介入治疗(PCI)和冠状动脉搭桥手术史;心功能为KILLIP分级1~2级;愿意参加本研究,签署知情同意书。排除标准:合并其他心脏病患者,如先天性心脏病、严重瓣膜病、扩张型心肌病、肥厚性心脏病、风湿性心脏病等; 合并严重的器官衰竭性疾病,比如肾衰竭(血肌酐大于或等于25 mg/L)、严重心功能不全(左心室射血分数小于30%)、器官功能下降性疾病、严重钙化疾病等;合并脑血管疾病或其他神经系统疾病者; 合并甲状腺功能亢进及严重结缔组织病者; 合并感染、肿瘤、血液系统或免疫系统疾病者; 存在影响hs-CRP水平的其他疾病或因素的患者;近期手术、创伤者。对照组为200例冠状动脉造影正常的健康老人,男110例,女90例,平均(66.52±7.55)岁。观察组和对照组老人的基本临床特征比较,差异无统计学意义(P>0.05),具有可比性。本研究通过本院伦理委员会审批,所有患者或其家属均签署知情同意书。
1.2方法
1.2.1采集血清样本 冠状动脉造影术后,空腹时,采用乙二胺四乙酸(EDTA)抗凝管采集所有老年CHD患者和健康老人的肘静脉血,共收集8 mL,4 ℃保存待测。
1.2.2血清MCP-1和CRP水平的测定 取已收集的4 mL外周血,2 000 r/min离心20 min分离血清,-80 ℃冰箱保存待测。采用MCP-1双抗体夹心法ELISA试剂盒(美国R&D公司)检测,采用CRP双抗体夹心法ELISA试剂盒(美国R&D公司)检测,操作方法严格按照试剂盒说明书进行,光密度值由DG5033A酶联免疫检测仪测定,根据标准曲线计算血清中MCP-1和CRP的水平。
1.2.3分离外周血单核细胞 取4 mL外周血,密度梯度离心分离单核细胞,细胞计数统计细胞数量。
1.2.4RT-PCR检测 以人MCP-1、CRP序列为模板,使用Primer Premier 5.0设计引物,并由上海生物工程技术服务有限公司合成。使用Trizol提取单核细胞总RNA,RT-PCR检测MCP-1和CRP的mRNA表达浓度。MCP上下游引物序列如下,PF:CCT TCT GTG CCT GCT GCT CA,PR:TCT TCG GAG TTT GGG TTT GC;CRP上下游引物序列如下,PF:ATT ACG CTA TCT AGC ATC TA,PR:CAT GAT GCA TGA CTA CTA CA。

2 结 果
2.1两组对象CHD危险因素比较 对照组和观察组年龄、性别和舒张压(DBP)比较差异无统计学意义(P>0.05);但是两组在体质量指数(BMI)、收缩压(SBP)、三酰甘油(TG)、总胆固醇(TC)、血浆纤维蛋白原(FBG)和吸烟史上差异有统计学意义(P<0.05),见表1。
2.2两组对象血清MCP-1、CRP检测结果比较 观察组患者血清MCP-1和CRP的水平明显高于对照组,差异有统计学意义(P<0.05),见表2。
2.3两组对象外周血单核细胞中MCP-1和CRP mRNA水平比较 观察组患者单核细胞内MCP-1和CRP mRNA水平高于对照组,差异有统计学差异意义(P<0.05),见表3。
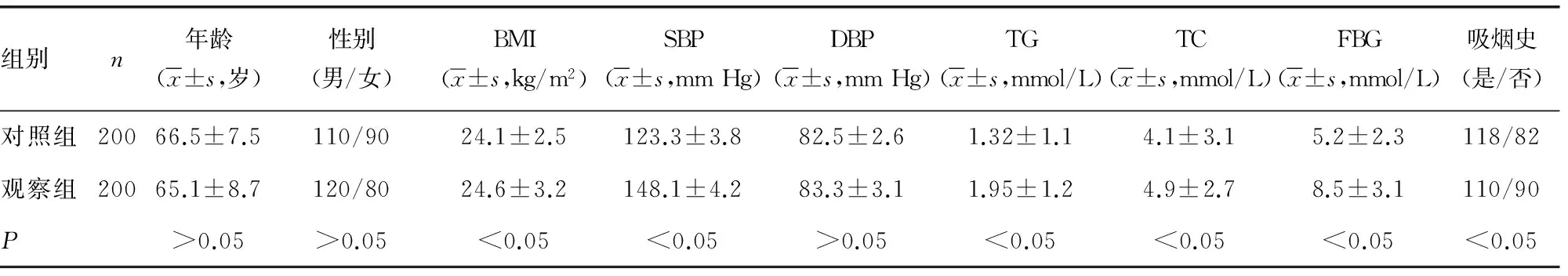
表1 两组对象CHD危险因素比较
2.4CHD患者单核细胞内MCP-1和CRP mRNA 与血清MCP-1和CRP水平的相关性 CHD患者单核细胞内MCP-1 mRNA水平与血清中MCP-1水平呈正相关(r=0.810,P<0.05)。患者单核细胞内CRP mRNA水平与血清中CRP水平呈正相关(r=0.791,P<0.05)。
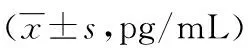
表2 两组对象血清MCP-1、CRP水平比较
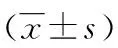
表3 两组对象单核细胞内MCP-1和CRP mRNA水平比较
2.5CHD危险因素与血清MCP-1和CRP水平的相关性分析 CHD患者的TG(r=0.760,P<0.05)和TC(r=0.793,P<0.05)与血清中MCP-1水平呈正相关。CHD患者的TG(r=0.781,P<0.05)和TC(r=0.839,P<0.05)与血清中CRP水平呈正相关。
3 讨 论
CHD是冠状动脉血管发生动脉粥样硬化病变而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病,致死率很高且大多数是40岁以上的中老年人,已引起全世界的关注[8-9]。动脉粥样硬化是CHD最主要致病因素,“内皮损伤反应学说”是公认的CHD发病机制。由于机体脂质(TG和TC等)代谢异常,血液中的脂质黏附在动脉内膜上,形成动脉粥样硬化斑块,随着炎症反应加剧,这些斑块逐渐增多,动脉管腔越来越狭窄,血流受阻,导致心脏缺血,从而产生CHD[10-11]。目前认为,动脉粥样硬化是一种慢性炎症性疾病,由于炎症反应伴随动脉粥样硬化乃至CHD的整个发生发展过程,炎症等级越高,动脉粥样硬化程度越重,心血管病病死率越高,因此,血液中炎症因子的浓度是诊断CHD及预测预后的临床分子标志物。
MCP-1和CRP是体内重要的促炎因子,研究显示,MCP-1和CRP等炎症因子的增加,以及持续的炎症反应可诱发动脉粥样硬化、血管狭窄和血流减少,这些症状会进一步加重炎症反应,从而形成恶性循环,最终导致CHD[12]。本研究结果显示,老年CHD患者血清MCP-1和CRP的水平均明显高于对照组,表明促炎症因子MCP-1和CRP水平与CHD的发生发展密切相关。单核细胞是血清MCP-1和CRP的主要来源之一,进一步分析也显示,CHD患者单核细胞内MCP-1和CRP mRNA水平均明显高于对照组,而且,CHD患者单核细胞内MCP-1 mRNA水平与血清中MCP-1水平呈正相关,而且单核细胞内CRP mRNA水平与血清中CRP水平呈正相关,也证实了这一点。
进一步,本研究分析了CHD的危险因素。相关性分析结果显示CHD患者的TG和TC均与血清中MCP-1和CRP水平均呈正相关。既往研究显示,MCP-1通过与CCR2(MCP-1受体)/PKC信号通路,一方面促进内皮细胞增殖并修复损伤的血管内膜[13],另一方面,过度的增殖引起动脉硬化和血管重塑,同时不断摄取脂质形成脂质池,促进脂质代谢异常,加重动脉粥样硬化和纤维化。另外,MCP-1还可刺激单核巨噬细胞合成IL-6和基质金属蛋白酶等细胞因子,使斑块不稳定甚至破裂[14]。而CRP可促进巨噬细胞摄取低密度脂蛋白并转化为泡沫细胞,从而形成动脉粥样硬化斑块,在斑块中也可检测到CRP[15]。本研究和既往研究结果说明炎症反应能够促进脂质代谢异常,而脂质代谢异常又可进一步加重炎症反应,二者间相互作用,相互调节共同促进进而促进动脉粥样硬化的发生发展。
综上所述,血清MCP-1和CRP与老年CHD紧密相关,这两种炎症因子引起的炎症反应是触发动脉粥样硬化的根本原因,可以作为检测CHD心肌缺血损伤程度的炎症标志物。
[1]MENAA F,MENAA A,TRETON J,et al.Technological approaches to minimize industrial trans fatty acids in foods[J].J Food Sci,2013,78(3):377-386.
[2]BELLO A E,HOLT R J.Cardiovascular risk with non-steroidal anti-inflammatory drugs:clinical implications[J].Drug Safety,2014,37(11):897-902.
[3]HUO Q P,LIANG F,LI J P,et al.Effects of wenxiao decoction on the expression of interleukin-6,intercellular adhesion molecular-1,and monocyte chemoattractant protein-1 in experiment[J].Chin J Integ Med,2014,20(6):445-449.
[4]TANG W,PANKOW J S,CARR J J,et al.Association of sICAM-1 and MCP-1 with coronary artery calcification in families enriched for coronary heart disease or hypertension:the NHLBI Family Heart Study[J].BMC Cardiovasc Disord,2007,7(1):1-11.
[5]CHANG C R,PAN Y P,ZHONG H M.Effect of non-surgical periodontal therapy on the level of serum IL-6 and hs-CRP in coronary heart disease patients with chronic periodontitis[J].J Oral Sci Res,2013,29(3):244-247.
[6]GUANG F W,YONG Q Z,JUN L A,et al.Application study of joint detection of Hcy,hs-CRP,LP(a)and DD in the course of coronary heart disease(CHD)[J].Modern Prev Med,2014,9(12):166-169.
[7]SHI Y J,ZHANG J,TAN C,et al.Genetic association studies reporting on variants in the C-reactive protein gene and coronary artery disease a Meta-Analysis[J].Medicine,2015,94(32):191-193.
[8]MEGA J L,STITZIEL N O,SMITH J G,et al.Genetic risk,coronary heart disease events,and the clinical benefit of statin therapy:an analysis of primary and secondary prevention trials[J].Lancet,2015,385(9984):2264-2271.
[9]IMAMURA T,DOI Y,NINOMIYA T,et al.Non-high-density lipoprotein cholesterol and the development of coronary heart disease and stroke subtypes in a general Japanese population:the Hisayama Study[J].Atherosclerosis,2014,233(2):343-348.
[10]AULCHENKO Y S,RIPATTI S,LINDQVIST I,et al.Loci influencing lipid levels and coronary heart disease risk in 16 European population cohorts[J].Nat Genet,2009,41(1):47-55.
[11]GUARDAMAGNA O,ABELLO F,ANFOSSI G A.Lipoprotein(a) and family history of cardiovascular disease in children with familial dyslipidemias[J].J Pediatr,2011,159(2):314-319.
[12]ZHU H J,LU S,SU W,et al.Effect of liandouqingmai recipe on life quality and vascular endothelial injury in patients with coronary heart disease[J].J Tradit Chin Med,2012,32(4):529-533.
[13]KALLEL A,ABDESSALEM S,SEDIRI Y,et al.Polymorphisms in the CC-chemokine receptor-2(CCR2) and-5(CCR5) genes and risk of myocardial infarction among Tunisian male patients[J].Clin Biochem,2012,45(6):420-424.
[14]LI M,CAI R L,SUN X,et al.Effects of electroacupuncture intervention on blood lipid levels and expression of CD 40 L and MMP-9 in the coronary artery tissue in coronary heart disease rats[J].Acupunct Res,2013,38(1):123-128.
[15]MÜLLER I I,MÜLLER K A,KARATHANOS A,et al.Impact of counterbalance between macrophage migration inhibitory factor and its inhibitor Gremlin-1 in patients with coronary artery disease[J].Atherosclerosis,2014,237(2):426-432.

