IL-17A启动子基因多态性与冠心病患者血脂和炎症因子的关联性研究*
张倩辉,谢悦陶,党 懿,苑可心,刘月欣,李树仁
(河北省人民医院心血管内科,石家庄 050000)
冠心病是受到环境因素和遗传因素互相作用的发病机制十分复杂的多基因疾病。近年来,遗传学研究认为不同个体对环境的反应存在差异,这种差异与单核苷酸多态性(single nucleotide polymorphisms,SNPs)有关,造成疾病易感性在个体分布存在差异[1-2]。白细胞介素-17(interleukin-17,IL-17)是主要由 Th17 细胞分泌的炎症因子,作为强效促炎因子,与受体结合后,通过参与变态反应达到调节组织局部炎性反应,如诱导促炎因子[白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子(TNF)及基质金属蛋白酶-3 (MMP-3)]等促进组织炎症发生。IL-17家族包括 IL-17A、IL-17B和IL-17C等6个亚型,其中IL-17A最具代表性。研究发现冠心病患者外周血IL-17A水平高于健康人,且与血脂代谢及动脉粥样硬化形成密切相关[3-4]。已有大量研究发现IL-17A基因多态性与多种炎性疾病相关,如炎症性肠病[5]、类风湿性关节炎[6]和病毒性细支气管炎[7],但IL-17A基因多态性与冠心病及血脂、炎症因子的相关性研究较少。本研究通过观察IL-17A rs8193036位点基因多态性与冠心病患者的血脂和炎症因子的关联,以期为开展特定人群疾病的预防及个体化治疗、预防冠心病的发生、发展提供参考。
1 资料与方法
1.1一般资料 共纳入2013年4月至2016年12月在本院就诊的冠心病患者241例为冠心病组,入选标准[8]:(1)冠状动脉造影检查提示心、外膜主要血管(左冠状动脉主干、右冠状动脉、左前降支、回旋支)中有任意一支直径狭窄程度大于50%;(2)运动负荷试验提示ST段压低大于或等于1 mm,持续时间超过2 min;(3)典型心肌梗死症状+心电图变化+心肌损伤标志物升高或既往有心肌梗死病史、接受过血运重建治疗;(4)核素负荷试验提示阳性或者负荷超声心动图提示阳性。冠心病组中男136例,女105例;年龄65~73岁,平均(68.2±3.9)岁;体质量指数(22.6±2.1)kg/m2;高中以下学历101例,高中或高中以上学历140例;未婚或丧偶56例,已婚 185例;单支血管病变96例,2支血管病变81例,3支及以上血管病变64例;急性冠状动脉综合征76例,慢性心血管疾病98例,冠心病高危人群67例;左心室射血分数(EF)≥40% 102例,EF<40% 139例。另取本院同期健康体检者68例为对照组,其中男39例,女29例;年龄67~72岁,平均(67.9±2.7)岁;体质量指数(23.0±0.9)kg/m2;高中以下学历30例,高中或高中以上学历38例;未婚或丧偶15例,已婚53例。两组受试者的性别、年龄、体质量指数、受教育程度及婚姻状况等基线资料差异均无统计学意义(P>0.05),具有可比性。本课题经本院伦理委员会同意,所有受试者均签署知情同意书。
1.2排除标准 合并糖尿病、甲状腺疾病、家族性高胆固醇血症、肾脏疾病、肝脏疾病者;合并严重的脑、肝、肺和肾功能障碍者;存在血缘关系者。
1.3检测指标
1.3.1IL-17基因启动子rs8193036基因型 收集所有受试者的空腹外周血5 mL,抗凝、离心分离血浆,用全血基因组DNA抽提试剂盒(上海生工生物工程有限公司)提取全血基因组DNA,用PCR-RFLP检测IL-17A基因启动子rs8193036位点多态性,引物序列上游5′-CGC TAA CTCCTT CTC TCT TTC C-3′,下游 5′-CTG CAT GCT ACCAAG CAA CT-3′。参考 Takara 高保真性PCR扩增基因组DNA,PCR反应体系:10×缓冲液5 μL,12.5 mmol/L dNTP 4 μL,引物20 pmol,模板DNA 0.2 g,耐热DNA聚合酶4 μL,去离子水加至50 μL。扩增反应循环参数:94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,34个循环,72 ℃延伸7 min,4 ℃保存,采用DNA测序仪检测。
1.3.2血脂 采用酶法和乳胶比浊法检测外周血血清总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)。检测仪器为日立7080全自动生化分析仪,血脂测定试剂盒由利德曼公司提供。
1.3.3炎症因子 采用酶联免疫吸附试验(ELISA)法检测IL-17、IL-6和TNF-α,IL-17A试剂盒购于Santa Cruz公司,其余试剂盒购于南京森贝伽生物科技有限公司,严格根据说明书要求操作,采用BIOBASE-EL10A酶标仪检测(山东博科)。

2 结 果
2.1IL-17A启动子rs8193036位点的基因型与等位基因频率分布 与对照组相比,冠心病组IL-17A启动子rs8193036 位点基因型 CC、CT和TT 分布差异有统计学意义(P<0.05),冠心病组 C 等位基因频率显著高于对照组(P<0.05),见表1。

表1 IL-17A启动子rs8193036位点的基因型与等位基因频率分布[n(%)]

表2 冠心病组IL-17各基因型间血脂水平的比较
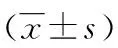
表3 冠心病组IL-17各基因型间炎症因子水平的比较
2.2冠心病组IL-17各基因型间血脂水平的比较 与冠心病组的CT+TT基因型比,冠心病组CC基因型的TG水平显著增高(P<0.05),HDL-C水平显著降低(P<0.05),TC和LDL-C水平差异无统计学意义(P>0.05),见表2。
2.3冠心病组IL-17各基因型间炎症因子水平的比较 与冠心病组CT+TT基因型比较,冠心病组CC基因型的IL-17A、IL-6、IL-8和TNF-α水平显著升高(P<0.05),见表3。
3 讨 论
冠心病是由多种因素和多个基因共同作用,以炎性反应损伤为主要特征的血管性疾病。除了年龄、吸烟、高血压、血脂异常等冠心病危险因素外,基因多态性在冠心病的发生和发展中的作用开始受到关注。本研究结果显示,对照组和冠心病组均存在3种IL-17A基因启动子rs8193036位点的基因型,即CC、CT和TT,但与对照组比较,冠心病组的上述3个基因型分布存在差异,C等位基因携带者发生冠心病的概率约为普通人的2.315倍。本文结果与国内外相关研究结果一致,提示IL-17启动子rs8193036基因多态性可能与冠状动脉粥样硬化形成相关[9-10],但其与动脉粥样硬化形成的具体机制仍不清楚。
血管内皮损伤和炎性反应在冠心病的发生、发展中起着重要作用。炎症可导致血管内皮损伤、影响脂质代谢、促进脂质沉积,血管局部长期的慢性炎症是动脉粥样硬化形成的主要原因。CC基因型冠心病患者血清IL-17A的水平显著高于CT+TT基因型,同时伴随TG水平升高及HDL-C水平降低,IL-6、IL-8和TNF-α等促炎因子水平升高,该结果进一步验证了前文提到的IL-17具有调节或诱导组织局部炎性反应,参与促进动脉粥样硬化的发生和发展的作用。既往研究发现IL-17A可通过核因子-κB(NF-κB)和p38/ERK MAKP信号通路上调脂肪酸结合蛋白aP2,进而促进动脉粥样硬化的进展[11]。以上结果进一步提示IL-17A启动子rs8193036位点改变对冠心病事件发生可能存在预测价值,因为既往研究[12]显示外源性IL-17A的干预导致斑块脂质含量增加、坏死核心占斑块面积增加;此外血脂水平异常及炎症因子增高均可通过影响斑块的不稳定性,从而影响冠心病的发生、发展及预后。
冠心病是复杂的多基因遗传疾病,其发生和发展是基因之间及基因环境之间的合力结果。不同区域、种族人群的遗传特征可能也存在差异。如本课题纳入的病例均为本省常住居民,IL-17A(rs2275913)基因多态性不能肯定地作为冠心病的分子遗传学标志,如BAO等[13]开展的Meta分析未得到IL-17A基因启动子rs8193036基因多态性与亚洲冠心病人群的易感关系,因此仍有必要扩大样本进行验证。IL-17A既然与冠心病的关系非常紧密,某些功能区域如启动子区、编码区、5′非翻译区(5′UTR)和3′非翻译区(3′UTR)等如果存在多态位点,都可影响基因结构,改变基因表达及功能[14],因此IL-17A(rs2275913)的研究仅是IL-17A基因多态性与冠心病关联的冰山一角,进一步的研究将分析IL-17A更多位点。
综上所述,IL-17A基因启动子rs8193036多态性与冠心病的发病有相关性,其中C等位基因是冠心病重要的遗传标记,IL-17A基因启动子rs8193036多态性可能通过影响血脂及炎症因子水平而影响冠心病的发生和发展。
[1]LI M P,HU X L,YANG Y L,et al.Basigin rs8259 polymorphism confers decreased risk of chronic heart failure in a Chinese population[J].Int J Environ Res Public Health,2017,14(2):E211.
[2]BARZISA,GHADERIANSM,NOORMOHAMMADIZ.Amolecularcase-controlstudyofassociationofHNF1Agenepolymorphisms(rs2259816
and rs7310409) with risk ofcoronaryarterydiseasein Iranian patients[J].Hum Antibodies,2017,25(1/2):65-70.
[3]TALEB S,TEDGUI A,MALLAT Z. IL-17 and Th17 cells in atherosclerosis:subtle and contextual roles[J]. Arterioscler Thromb Vasc Biol,2015,35(2):258-264.
[4]YU X H,JIANG N,ZHENG X L,et al.Interleukin-17A in lipid metabolismand atherosclerosis[J]. Clin Chim Acta,2014,431(3):33-39.
[5]ZHANG X,YU P,WANG Y,et al.Genetic polymorphisms of interleukin17A and interleukin 17F and their association with inflammatorybowel disease in a Chinese Han population[J]. Inflamm Res,2013,62(8):743-750.
[6]LEE Y H,BAE S C.Associations between circulating IL-17 levels and rheumatoid arthritis and between IL-17 gene polymorphisms and disease susceptibility:a meta-analysis[J].Postgrad Med J,2017,93(102):2016.
[7]PINTO L A,AZEREDO L A,MOCELLIN M,et al.IL-8/IL-17 gene variations and the susceptibility to severe viral bronchiolitis[J].Epidemiol Infect,2017,145(4):642-646.
[8]卫生部医疗服务标准委员会.冠状动脉粥样硬化性心脏病诊断标准[M].北京:中国标准出版社,2010.
[9]VARGAS-ALARCN G,ANGELES-MARTNEZ J,VILLARREAL-MOLINA T,et al.Interleukin-17Agene haplotypes are associated with risk of prematurecoronaryarterydiseasein Mexican patients from the Genetics of Atherosclerotic Disease(GEA) study[J].PLoS One,2015,10(1):e0114943.
[10]李万静,普彦淞,段宗明,等.IL-17A 基因启动子多态性与西北地区汉族人群冠心病的相关性研究[J].中国临床研究,2016,29(12):1654-1656.
[11]高琦.Th17细胞及效应分子IL-17A在动脉粥样硬化发生过程中的作用及机制研究[D].济南:山东大学,2012.
[12]王晓丹,韩荣旗,王玉慧,等.IL-17与动脉粥样硬化的研究进展[J].世界临床药物,2015,36(6):414-417.
[13]BAO M H,LUO H Q,XIANG J.Meta-analysis for the association between polymorphisms in interleukin-17A and risk of coronary artery disease[J].Int J Environ Res Public Health,2016,13(7):E660.
[14]张效林,韩雅玲,裴芳,等.IL-17A基因-121G/A多态性与中国北方汉族人群早发冠心病的关系[J].山东医药,2010,50(33):1-3.

